Композиция днк для вызова иммунного ответа против опухолеассоциированных макрофагов
Иллюстрации
Показать всеИзобретение относится к медицине и касается фармацевтической композиции для вызова иммунного ответа против опухолеассоциированных макрофагов, содержащей минигенную конструкцию ДНК, которая кодирует полипептид, в фармацевтически приемлемом носителе, где полипептид содержит три иммуногенных фрагмента легумаина, связанных вместе линкерными пептидами, и где каждый линкерный пептид состоит из последовательности ААА или AAY. Изобретение обеспечивает эффективность в борьбе с карциномой молочной железы, немелкоклеточным раком легкого и карциномой толстой кишки. 7 з.п. ф-лы, 26 ил., 2 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
В настоящей заявке испрашивается приоритет предварительной заявки на патент США №60/849927, поданной 6 октября 2006 года, содержание которой включено в настоящее описание в качестве ссылки.
ПРАВА ПРАВИТЕЛЬСТВА
Это изобретение было сделано при поддержке правительства Соединенных Штатов, гранты № DAMD17-02-0137 и DAMD17-02-0562 от Министерства Обороны и гранты № W81XWH-05-1-0091 и W81XWH-05-1-0318, контролируемые конгрессом программы медицинских исследований (Congressionally Directed Medical Research Program). Правительство имеет определенные права на данное изобретение.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к композициям дезоксирибонуклеиновых кислот (ДНК), кодирующим пригодные молекулы, эффективные для вызова иммунного ответа против опухолеассоциированных макрофагов. Более конкретно, настоящее изобретение относится к композициям ДНК, кодирующим, по меньшей мере, один эпитоп эндопептидазы, такой как легумаин (legumain), который экспрессируется в опухолеассоциированной клетке, такой как опухолеассоциированный макрофаг. Настоящее изобретение также относится к способам использования композиции ДНК для ингибирования опухолевого роста и опухолевых метастазов.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Опухолеассоциированные макрофаги (TAM) связаны с развитием опухоли и метастазированием. Новая противоопухолевая стратегия состоит в иммунизации против молекул, сверхэкспрессируемых ТАМ, и, посредством этого, в изменении окружающей микросреды опухоли, которая привлекает эти макрофаги и опосредует их функцию (см. Oosterling et al. 2005 J. Pathol. 207:147-155; Emens et al. 2005 Endocr. Relat Cancer 12:1-17). ТАМ состоят предпочтительно из популяции поляризованных макрофагов М2 (CD206+, F4/80+) с низкой цитотоксичностью по отношению к опухолевым клеткам из-за ограниченного продуцирования ими оксида азота и провоспалительных цитокинов (см. Mills et al. 2000 J. Immunol. 164:6166-6173).
ТАМ также обладают низкой антиген-презентирующей способностью и эффективно подавляют активацию Т-клеток. Фактически, эти макрофаги фенотипа М2 действительно способствуют пролиферации опухолевых клеток и метастазированию, секретируя широкий спектр факторов роста и про-ангиогенных факторов, а также металлопротеиназ, с вовлечением в сигнальную циркуляцию, что регулирует функцию фибробластов опухолевой стромы (Mantovani et al. 2004, Novartis. Found. Symp. 256:137-145).
В настоящее время анти-ТАМ эффекты, вызываемые низкомолекулярными ингибиторами, по сообщениям, способствуют подавлению опухоли (см. Lewis et al. 2005 Am. J. Pathol. 167:627-635; и Mantovani et al. 2004, Eur. J. Cancer 40:1660-1667). Например, «yondelis», антинеопластический агент, оказывает избирательный цитотоксический эффект на ТАМ, тем самым значительно снижая продуцирование ими IL6 и CCL2, что способствует угнетению роста опухолей человека, связанных с воспалением (см. Allavena et al. 2005, Cancer Res. 65:2964-2971). Другой подобный пример иллюстрируется бифосфонатным соединением, золедроновой кислотой, которая подавляет секрецию MMP9 ТАМ, тем самым ингибируя опухолевую металлопротеиназную активность и уменьшая связывание VEGF c его тирозинкиназными рецепторами на пролиферирующих эндотелиальных клетках (см. Giraudo et al. 2004, J. Clin. Invest. 114:623-633).
Как было показано в различных экспериментальных моделях, хемокин CCL5 очень важен в пополнении ТАМ. Антагонист этого хемокина уменьшал опухолевый инфильтрат и замедлял рост опухоли (см. Robinson et al. 2003, Cancer Res. 63:8360-8365). Следовательно, хотя терапевтическое нацеливание на ТАМ все еще довольно новый подход, начальные клинические результаты обнадеживают, так как они позволяют предположить, что нацеливание на ТАМ может дополнить более традиционные противораковые терапевтические схемы.
Легумаин - это абсолютно новое эволюционное ответвление семейства С13 цистеиновых протеаз (см. Ishii 1994, Methods Enzymol. 244:604-615),и он хорошо сохранился у растений и у млекопитающих, включая человека. Впервые легумаин был выявлен в растениях как фермент процессинга запасных белков во время прорастания семян и впоследствии обнаружен у паразитов, а затем у млекопитающих. Легумаин - это кислотоустойчивая цистеиновая эндопиптедаза с необычайно узкой специфичностью, обязательно требующая наличия аспарагина в сайте P1 субстратной последовательности (см. Chen et al. 1997, J. Biol. Chem. 272:8090-8098).
В настоящей заявке выбор легумаина в качестве мишени для противоопухолевой терапии основан на том факте, что ген, кодирующий эту эндопептидазу, как выяснилось, высоко активен во многих мышиных и человеческих опухолевых тканях, но отсутствует или представлен на очень низких уровнях во всех нормальных тканях, из которых эти опухоли развились. Важно, что сверхэкспрессия легумаина возникает в таких стрессовых условиях, как опухолевая гипоксия, которая ведет к усиленному росту опухоли, ангиогенезу и метастазированию.
Легумаин представляет собой особенно предпочтительную целевую эндопептидазу для композиций и способов по настоящему изобретению благодаря наблюдению, что легумаин интенсивно сверхэкспрессируется ТАМ в опухолевых тканях молочных желез у мышей, что подтверждается анализом экспрессии гена и иммуногистохимическими исследованиями. ТАМ имеют чрезвычайно высокую экспрессию легумаина в строме опухоли. В противоположность, классические макрофаги фенотипа М1, которые выполняют важные функции иммунного надзора и презентирования антигена, не экспрессируют легумаин. Следовательно, нацеливание на ТАМ, которые сверхэкспрессируют легумаин, не мешает биологическим функциям макрофагов М1, включая цитотоксичность и презентирование антигена. Настоящее изобретение представляет композиции ДНК для индуцирования иммунного ответа против ТАМ, сверхэкспрессирующих легумаин или другие эндопептидазы, также сверхэкспрессируемые в ТАМ, и которые пригодны для лечения опухолей и опухолевых метастазов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Композиция ДНК по настоящему изобретению содержит конструкцию ДНК, которая кодирует полипептид, включающий, по меньшей мере, иммуногенный фрагмент цистеиновой эндопептидазы, сверхэкспрессируемой в опухолеассоциированных клетках (например, опухолеассоциированных макрофагах). Конструкция ДНК включает структурные элементы, которые способствуют экспрессии полипептида в иммунных клетках субъекта, которому ввели конструкцию ДНК. Предпочтительно, эндопептидаза включает легумаин или, по меньшей мере, один его иммуногенный фрагмент (например, эпитоп). Конструкция ДНК заключена в фармацевтически приемлемый носитель, чтобы она могла быть введена пациенту. Композиция может кодировать единственный иммуногенный фрагмент эндопептидазы (например, эпитоп легумаина), полипептид, включающий два или более иммуногенных фрагментов эндопептидазы (т.е. иммуногенный полипептид), целый белок эндопептидазы или любую его часть, которая будет вызывать иммунный ответ у субъекта. Предпочтительно, чтобы конструкция ДНК кодировала человеческий легумаин, имеющий последовательность аминокислотных остатков, состоящих из SEQ ID NO: 2, белок, имеющий по меньшей мере 80% идентичность последовательности с SEQ ID NO: 2 (например, человеческий легумаин, свиной легумаин или мышиный легумаин), или его иммуногенный фрагмент, экспрессируемый в иммуногенных клетках субъекта, которому введена конструкция ДНК. Конструкции ДНК по настоящему изобретению пригодны для ингибирования роста опухоли и опухолевых метастазов.
Конструкция ДНК может быть «оголенной», предпочтительно в форме плазмиды. Такие «оголенные» конструкции ДНК могут быть заключены в липосомный носитель, полимерный носитель или вводиться посредством электропорации, генной пушки и тому подобных, при желании. В некоторых предпочтительных вариантах конструкция ДНК встроена в аттенуированный вирусный вектор или аттенуированный бактериальный вектор.
В предпочтительном варианте осуществления конструкция ДНК встроена в аттенуированный бактериальный вектор, такой как аттенуированная Salmonella typhimurium, например дважды аттенуированный (AroA-, dam-) штамм Salmonella typhimurium.
Необязательно, композиция ДНК может также включать конструкцию ДНК, кодирующую иммунный эффекторный белок, такой как цитокин. Предпочтительные цитокины включают CCL21, IL-2 и CD40LT.
В особенно предпочтительном варианте осуществления композиция ДНК по изобретению включает минигенную конструкцию ДНК, которая кодирует иммуногенный полипептид, включающий множество иммуногенных фрагментов (например, эпитопов) цистеиновой эндопептидазы (например, легумаина), который активно экспрессируется в опухолеассоциированных клетках. Иммуногенный полипептид, способный вызывать иммунный ответ против опухолеассоциированных клеток, экспрессируется в иммунных клетках и заключен в фармацевтически приемлемый носитель. Иммуногенные фрагменты соединены вместе последовательно пептидом-линкером с каждым последующим фрагментом в полипептиде. Пептиды-линкеры, в основном, длиной по меньшей мере три аминокислотных остатка и, предпочтительно, включают аминокислотную последовательность ААА или AAY. Использующийся в настоящем описании термин «пептид-линкер» относится к последовательности по меньшей мере из двух аминокислотных остатков, предпочтительно, по меньшей мере трех аминокислотных остатков, которые образуют последовательность аминокислотных остатков, связанную с иммуногенными фрагментами эндопептидазы и отличающуюся от природной эндопептидазы. Типично, комбинация пептидов-линкеров и иммуногенных фрагментов эндопептидазы будет включать полипептид длиной меньше чем приблизительно 100 аминокислотных остатков, более предпочтительно, длиной, приблизительно, от 19 до 62 аминокислот (например, от двух до, приблизительно, пяти иммуногенных фрагментов по 8-10 аминокислот каждый, объединенных вместе одним-четырьмя пептидами-линкерами по три аминокислоты каждый). Предпочтительно, минигенная конструкция ДНК кодирует иммуногенные фрагменты легумаина человека (SEQ ID NO: 2).
Композиции ДНК по настоящему изобретению могут действовать как вакцины, нацеленные на опухолеассоциированные макрофаги, которые экспрессируют цистеиновую эндопептидазу, такую как легумаин, обеспечивая высоко селективную цель для Т-клеточно-опосредованной противораковой иммунотерапии. Подход нацеливания на эндопептидазу, такую как легумаин, экспрессируемую опухолеассоциированными макрофагами, имеет несколько преимуществ над способами лечения, направленными против антигенов, которые экспрессируются исключительно самими опухолевыми клетками. Так, например, легумаин сверхэкспрессируется в ТАМ и, следовательно, не повреждается подавляемой экспрессией МНС-антигена, как зачастую случается в опухолевых клетках. Кроме того, опухолевые клетки часто становятся повышенно устойчивыми к опосредованному Т-клетками уничтожению из-за дефектов в апоптозных сигнальных путях, повышенной регуляции антиапоптозных белков или иммуносуппрессивных воздействий на цитотоксические Т-лимфоциты (CTL). Нацеливание на ТАМ, экспрессирующие легумаин, позволяет терапевтической композиции лечить ряд различных злокачественных образований, в противоположность способам лечения, вовлекающим антигены, экспрессирующиеся исключительно специфичными типами опухолей.
В одном предпочтительном варианте осуществления композиции ДНК по настоящему изобретению нарушают периферическую Т-клеточную устойчивость к аутоантигену легумаина, передавая свои кДНК ДНК, кодирующей один или более их иммуногенных фрагментов, как пероральная композиция ДНК с атеннуированным бактериальным вектором доставки (например, аттенуированный штамм Salmonella typhimurium). В таких вариантах осуществления композиция ДНК контактировала с антигенпрезентирующими клетками (APC) во вторичном лимфоидном органе, т.е. Пейеровых бляшках тонкой кишки. С профилактической целью, Т-клеточно-опосредованный противоопухолевый иммунный ответ, индуцированный вакцинацией композицией ДНК по изобретению, ингибировал рост опухоли в многочисленных мышиных опухолевых моделях. Настоящие композиции ДНК также значительно подавляют диссеминацию установленных легочных метастазов в терапевтической модели карциномы толстой кишки CT26.
Предпочтительная композиция ДНК включает аттенуированный носитель Salmonella, такой как дважды аттенуированный штамм S. typhimurium, например штамм, называемый RE 88, который включает dam- и AroA- мутации и поставляется Remedyne Corporation (Goleta, CA). В настоящем изобретении аттенуированный носитель Salmonella трансфицирован так, что он включает конструкцию ДНК, кодирующую эндопептидазу (например, легумаин) или полипептид, содержащий ее иммуногенный фрагмент. Эндопептидаза или полипептид экспрессируются в иммунных клетках млекопитающих, которым они вводятся. Сама бактерия не экспрессирует легумаин или полипептид, а только доставляет ДНК в такие иммунные клетки, как макрофаги или дендритные клетки (DC), которые в свою очередь экспрессируют эндопептидазу или полипептид, включающий ее иммуногенный фрагмент. Такие композиции могут обеспечить пролонгированные противоопухолевые эффекты в мышиных моделях. К тому же, эксперименты in vivo по истощению Т-клеток показали вовлечение CD8+, а не CD4+ Т-клеток в иммунный ответ, ассоциированный с композициями, кодирующими легумаин и полипептиды, включающие иммуногенные фрагменты легумаина. Наблюдавшийся цитотоксический эффект, опосредованный CD8+ Т-клетками in vitro, был специфически направлен против ТАМ-мишеней, которые сверхэкспрессируют антиген легумаина.
Композиции ДНК по настоящему изобретению также могут включать конструкции ДНК, которые кодируют иммунные эффекторные молекулы как адъюванты для композиции. Такие иммунные эффекторные молекулы включают, например, IL-2, индуктор пролиферации Т-клеток, CCL21, хемокин, который химически притягивают зрелые дендритные клетки, и наивные Т-клетки, а также CD40LT, известный индуктор созревания дендритных клеток. Нуклеиновые кислоты, кодирующие иммунные эффекторные белки, предпочтительно встроены в плазмиду. Конструкции ДНК легумаина и иммунного эффекторного белка могут быть встроены в одну и ту же плазмиду или в две отдельные плазмиды. CTL-ответ, индуцируемый против ТАМ, может замедлять рост ряда опухолей и не специфичен по отношению к конкретному типу опухолей.
Настоящее изобретение также предоставляет способ ингибирования опухолевого роста и опухолевых метастазов у млекопитающих, включая введение млекопитающему композиции ДНК по изобретению в количестве, достаточном для вызова иммунного ответа против ТАМ, экспрессирующих легумаин.
Еще один аспект настоящего изобретения - это эффективная комбинация схемы лечения, которая объединяет химиотерапию и терапию композицией ДНК по изобретению. В этом способе осуществления настоящего изобретения различные химиотерапевтические агенты, такие как доксорубицин, паклитаксел и/или циклофосфамид, которые не вызывают угнетения костного мозга при введении в максимальной допустимой дозе (МДД/MTD), вводились пациенту в сочетании с композицией ДНК по изобретению, содержащей конструкцию ДНК, кодирующую ТАМ-экспрессируемую эндопептидазу, такую как легумаин или полипептид, кодирующий ее иммуногенную часть, предпочтительно содержащую минигенную конструкцию, которая включает, по меньшей мере, два иммуногенных фрагмента эндопептидазы, последовательно соединенных вместе пептидами-линкерами между каждыми из последовательных иммуногенных фрагментов в полипептиде.
Другим предпочтительным способом осуществления является способ ингибирования роста опухоли или опухолевых метастазов у млекопитающих (например, человека), включающий стадии введения млекопитающим композиции ДНК по изобретению в количестве, достаточном, чтобы вызвать у них иммунный ответ против ТАМ, сверхэкспрессирущих эндопептидазу, такую как легумаин, с последующим введением млекопитающим эффективного противоопухолевого количества противоопухолевого химиотерапевтического средства.
Предпочтительно, чтобы млекопитающим, подвергшимся лечению способами по настоящему изобретению, являлся человек.
В способе осуществления настоящего изобретения, композиции ДНК могут вводиться энтерально посредством перорального введения или парентерально посредством инъекции или внутривенной инфузии. Предпочтительным является пероральное введение композиций. Композиции могут быть упакованы в герметичные контейнеры и снабжены информацией для клиницистов по эффективному введению композиции.
Композиции ДНК по настоящему изобретению являются пригодными для лечения и профилактики ряда болезненных состояний. Например, больной, страдающий колоректальным раком, раком молочной железы, раком легких и тому подобное, может получить пользу от иммунизации композициями по настоящему изобретению. Композиции по настоящему изобретению также полезны для исследования роли легумаина в различных формах рака.
Краткое описание чертежей
ФИГ.1. Легумаин экспрессируется в высокой степени на опухолеассоциированных макрофагах в строме опухоли. (А) Экспрессия легумаина в ТАМ была явно выражена, как показано на панели А. Макрофаги, инфильтрирующие опухоль, были визуализированы с помощью Г/Э окрашивания, как показано стрелками. Экспрессия легумаина выявлена двойным окрашиванием антилегумаиновых антител в сочетании с анти-CD68 антителами. (Увеличение ×35) (B) Повышенная экспрессия легумаина на ТАМ была подтверждена проточными цитометрическими анализами дважды положительных популяций CD206+/F4/80+ макрофагов M2, которые были выделены из свежей опухолевой ткани. (С) Многоцветовая проточная цитометрия продемонстрировала повышающую регуляцию маркера CD206 макрофага M2 на RAW-клетках после их культивирования с IL-4, IL-10 и IL-13 (10 нг/мл). Было показано, что легумаин активно экспрессируется на F4/80+/CD206+ положительных RAW клетках, культивировавшихся с IL-4, IL-10 и IL-13, как показано на верхнем фото, тогда как сравниваемые с диким типом RAW клетки изображены на нижнем фото. (D) Подтверждение экспрессии легумаина на RAW клетках с помощью вестерн-блоттинга, следующей за стимуляцией с IL-4, IL-13 и IL-10, отдельно или комбинированно.
ФИГ.2. Выделение легумаинэкспрессирующих клеток ведет к подавлению роста опухоли. (А) Схема композиции ДНК по изобретению, построенная с pCMV/myc/cyto векторным остовом, где ген легумаина был присоединен к C-концу мутантного полиубиквитина. Был включен целый фрагмент, и экспрессия белка была продемонстрирована вестерн-блоттингом. (В) Профилактическая модель: график вакцинации был рассчитан на три иммунизации с однонедельными интервалами, следуемыми за внутривенными введениями приблизительно 2×105 клеток немелкоклеточного рака легкого D121, приблизительно 50×104 клеток рака толстой кишки CT26, и инъекцией приблизительно 7×103 клеток рака молочной железы 4Т1 в жировую ткань молочной железы. Массы легких были измерены через 24 дня (D121 или CT-26) или через 30 дней (4Т1) после введения опухолевых клеток и проанализированы в каждой группе. Разница между двумя контрольными группами (PBS и/или пустой вектор) и лечебной группой была статистически значимой **P<0,005. Нормальный вес легкого = 0,2 г. (С) Терапевтическая модель: группам мышей BALB/c (n=8) в жировую ткань молочной железы изначально ввели приблизительно 7×103 клеток рака молочной железы 4T1 и в дальнейшем вакцинировали три раза на 3, 7 и 11 дни PBS, пустым вектором или pLegumain композицией ДНК, соответственно, и первичную опухоль удаляли на 12 день. Графики выживания отображают результаты для лечебной и контрольных групп по 8 мышей в каждой. Разница между контрольной группой пустого вектора и лечебной группой была статистически значима **P<0,005.
ФИГ.3. Популяция ТАМ в опухолевой строме сократилась благодаря специфическими CD8+ CTL, индуцированными композицией ДНК, основанной на легумаине. (А) RAW макрофаговые клетки активно экспрессируют легумаин после культивирования с IL-4, IL-10, IL-13 10 нг/мл и служат клетками-мишенями в 4-часовом анализе высвобождения 51Cr. Спленоциты, выделенные у мышей, иммунизированных pLegumain вакциной, эффективно уничтожали RAW клетки, обработанные in vitro этими цитокинами в различных соотношениях клеток эффектор-мишень, но не были способны вызвать цитотоксическое уничтожение нестимулированных RAW клеток, лишенных экспрессии легумаина. **P<0,005 по сравнению с контрольными группами. (В) Проточная цитометрия детектирует процент популяций ТАМ со специфическими макрофаговыми маркерами (CD206 и F4/80) в опухолевой ткани после вакцинации. Было показано снижение процентного соотношения популяций ТАМ среди клеток опухолевой ткани, выделенной у мышей, пролеченных композицией ДНК по изобретению. Не было уменьшения популяций ТАМ, выделенных у мышей, пролеченных либо пустым вектором, либо pLegumain вслед за истощением CD8+ Т-клеток (**P<0,005). (С) Результаты проточной цитометрии были подтверждены иммуногистохимическим окрашиванием, оцененным конфокальной микроскопией. Популяция ТАМ в опухолевой строме значительно сократилась после вакцинации. Увеличение ×5 (Г/Э), ×35 (Контроль, Пустой Вектор и pLegumain).
ФИГ.4. Ответ специфичных CD8+ Т-клеток, рестриктированных по МНС-антигенам первого класса против клеток, экспрессирующих легумаин. (А) Графики FACS показывают, что ДНК терапия увеличивает экспрессию ко-стимулирующих молекул благодаря DC. Лимфоциты из Пейеровых бляшек, полученные спустя 3 дня после вакцинации, были окрашены меченым FITC антителом к CD11c в комбинации с PE конъюгированным антителом к CD80, анти-MHC первого класса или анти-CD40 антителами. (*P<0,05, в сравнении с контрольными группами). (В) Внутриплазматическое высвобождение INF-гамма CD8+ Т-клетками было оценено FACS анализом. **P<0,005 по сравнению с контрольными группами. (С) Продуцирование специфического INF-гамма контролировалось на уровне отдельных клеток с помощью ELISPOT. Отображено количество иммунных пятен на лунку для лимфоцитов из иммунизированных мышей, рестимулированных либо legumain+ клетками опухолевой ткани 4T1, либо legumain- клетками 4T1. **P<0,005 по сравнению с лечебной группой без стимуляции. ##P<0,005 по сравнению с контрольными группами. (D) Спленоциты, выделенные из пролеченных мышей, эффективно уничтожали ТАМ, как показало применение теста с высвобождением 51Cr (*P<0,01 по сравнению с контрольными группами). Ингибирующие эксперименты с антителами против MHC-антигенов первого класса H2Kd/H-2Dd показали, что T-клетка, опосредовавшая лизис опухолевой клетки, была рестриктирована по MHC антигену первого класса. Истощение in vivo Т-клеток CD4+ или CD8+ показало, что лимфоциты, выделенные у вакцинированных мышей, у которых были истощены Т-клетки CD8+, не смогли вызвать цитотоксический лизис клеток-мишеней, истощение Т-клеток CD4+ не подавляло цитотоксический лизис этих клеток-мишеней. *P<0,01 по сравнению с группой PBS или пустого вектора.
ФИГ.5. Нейтрализация ТАМ ведет к уменьшению высвобождения факторов роста, миграции опухолевых клеток и метастазов. (А) Композиция ДНК по изобретению уменьшает высвобождение факторов роста ТАМ. Ткань опухоли молочной железы 4Т1 и мышиная сыворотка были собраны через 12 дней после вакцинаций и введения опухолевых клеток. После 24 часов или 48 часов культивирования супернатанты клеток опухолевых тканей были собраны, и концентрации TGF-бета, TNF-альфа и VEGF сыворотки или супернатантов были измерены с помощью ELISA. Разницы между лечебной и контрольной группами были значительными. *Р<0,01, **Р<0,005. (В) Было проведено иммуногистохимическое окрашивание, с целью обнаружить экспрессию этих факторов роста в микросреде опухоли. Вакцинированные лечебные группы показали, что после сокращения ТАМ уменьшилось высвобождение VEGF, TGF-бета и ММР-9, по сравнению с группами пустого вектора. (С) Был проведен трансвелл-анализ миграции (transwell migration assay), с целью определить миграцию опухолевых клеток после вакцинации. Число мигрирующих клеток явно уменьшилось после вакцинации. ***Р<0,001 по сравнению с группой пустого вектора. (D) Были проведены эксперименты in vivo, чтобы определить возможность формирования опухолевых метастазов у мышей. Мыши были пролечены вакциной по терапевтической схеме, как описано выше. Показатели опухолевого метастазирования и массы легких измерялись через 25 дней после эксцизии первичной опухоли. Показатель метастазирования выражался как % легочной поверхности, покрытой слившимися метастатическими очагами: 0 = отсутствовали; 1 = <5%, 2 = от 5% до 50% и 3 = >50%. Разницы в массе легких между группой мышей, пролеченной вакциной, и всеми контрольными группами были статистически значимыми (**Р<0,005).
ФИГ.6. Элиминация ТАМ приводит к снижению опухолевого ангиогенеза. Суппрессия VEGF-индуцированного ангиогенеза: мыши BALB/с были вакцинированы S.typhimurium, трансфицированной либо пустым вектором, либо pLegumain, либо pLegumain после элиминации либо CD8+, либо CD4+ Т-клеток in vivo, соответственно. Спустя неделю после последней вакцинации подкожно в среднюю линию живота мышам был введен Матригель (Matrigel). Васкуляризация была индуцирована VEGF или bFGF. (А) Изображения были сделаны с помощью цифровой камеры спустя 6 дней после имплантации пробки Матригеля. Кроме того, срез пробок Матригеля, окрашенных трихромом по Массону, показывает увеличение кровеносных сосудов в пробках Матригеля, как выделено стрелками (увеличение ×5). (В) Количественный анализ сосудистого роста был выполнен после окрашивания эндотелия in vivo FITC-меченным изолектином В4 и оценки с помощью флуорометрии. Уменьшение VEGF-индуцированной неоваскуляризации происходило только после вакцинации вектором, кодирующим легумаин, но не после вакцинации пустым вектором или pLegumain после истощения CD8+ Т-клеток. **Р<0,005, *P<0,01 по сравнению с легумаиновой лечебной группой. (С) Иммуногистохимическое окрашивание было выполнено и исследовано с помощью конфокальной микроскопии. Поперечные срезы пробок Матригеля были окрашены для определения типа клеток, проросших или мигрировавших в эти пробки. Изображения показывают, что эндотелиальные клетки с маркером CD31 или макрофаги с маркером CD68 проросли или мигрировали в пробки Матригеля, как показано стрелками (увеличение ×35). Контролем служило Г/Э окрашивание (увеличение ×5).
ФИГ.7. Клеточная линия 4Т1 была устойчиво трансфицирована ретровирусом, содержащим легумаиновую плазмиду, а затем использована в качестве клеток-мишеней для спленоцитов из иммунизированных мышей (Панель А, левое фото имеет 5× увеличение; правое фото имеет 35× увеличение), изображения были сделаны спустя 2 дня после трансфекции, и положительные клетки помечены стрелками. Данные анализа высвобождения 51Cr показаны на Части В. Спленоциты, выделенные из мышей, иммунизированных pLegumain композицией ДНК, эффективно уничтожали 4Т1 клетки, трансфицированные легумаином (*P<0,01 по сравнению с группами пустого вектора). Опухолеассоциированное опосредованное Т-клетками уничтожение было специфично для легумаина, поскольку нормальные 4Т1 клетки без легумаиновой экспрессии не были лизированы.
ФИГ.8 показывает нуклеотидную последовательность нуклеиновой кислоты, кодирующей легумаин человека (SEQ ID NO: 1).
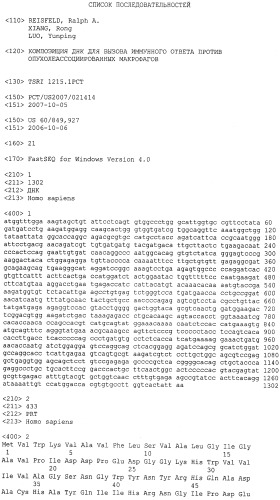
ФИГ.9 показывает последовательность аминокислотных остатков (SEQ ID NO: 2) легумаина человека.
ФИГ.10 показывает нуклеотидную последовательность (SEQ ID NO: 3) нуклеиновой кислоты, кодирующей легумаин мыши.
ФИГ.11 показывает последовательность аминокислотных остатков (SEQ ID NO: 4) легумаина мыши.
ФИГ.12 показывает нуклеотидную последовательность (SEQ ID NO: 3) нуклеиновой кислоты, кодирующей IL-2 человека.
ФИГ.13 показывает последовательность аминокислотных остатков IL-2 человека (SEQ ID NO: 6).
ФИГ.14 показывает нуклеотидную последовательность (SEQ ID NO: 7) нуклеиновой кислоты, кодирующей CCL21 человека.
ФИГ.15 показывает последовательность аминокислотных остатков CCL21 человека (SEQ ID NO: 8).
ФИГ.16 показывает нуклеотидную последовательность (SEQ ID NO: 9) нуклеиновой кислоты, кодирующей CD40L человека.
ФИГ.17 показывает последовательность аминокислотных остатков CD40L человека (SEQ ID NO: 10).
ФИГ.18 показывает нуклеотидную последовательность убиквитинилированного легумаина мыши (SEQ ID NO: 11).
ФИГ.19 показывает последовательность аминокислотных остатков убиквитинилированного легумаина мыши (SEQ ID NO: 12).
ФИГ.20 показывает последовательность аминокислотных остатков эпитопных последовательностей мышиного легумаина.
ФИГ.21 показывает схематичное изображение плазмидных кодирующих легумаин минигенов, содержащих иммуногенные фрагменты легумаина.
ФИГ.22 показывает, что pCMV-Kb/Kd минигенная композиция защищает мышей от заражения клетками D2F2 карциномы молочной железы. Группы мышей BALB/c (n=8) были иммунизированы три раза с недельным интервалом дважды аттенуированной Salmonella typhimurium RE-88, несущей указанные векторы. Спустя одну неделю после последней иммунизации мышей заразили с помощью в/в инъекции клетками карциномы молочной железы D2F2 в количестве 2×105. А. Схема протокола эксперимента. В. Значение объема опухоли мышей спустя 5-25 дней после заражения опухолевыми клетками. С. Вес опухоли мышей спустя 25 дней после заражения, *P<0,05 по сравнению с контрольной группой пустого вектора.
ФИГ.23 показывает, что pKd минигенная вакцина предотвращает метастазирование карциномы молочной железы D2F2 у изогенных мышей BALB/c. Группы мышей (n=8) были иммунизированы 3 раза с 1-недельными интервалами с помощью принудительного кормления аттенуированной Salmonella typhimurium RE-88, несущей указанные векторы. Спустя 2 недели после последней иммунизации мышей заразили с помощью в/в инъекции клетками карциномы молочной железы D2F2 в количестве 1×105. А. Схема протокола эксперимента. В. Средний показатель мышиного легочного метастазирования каждой экспериментальной группы спустя 25 дней после заражения опухолевыми клетками. Показатели легочного опухолевого метастазирования устанавливали, определяя % покрытой метастазами площади поверхности: 0, метастазы отсутствовали, 1, <20%, 2, от 20 до 50% и 3, >50% представляли индивидуальными символами для каждой лечебной группы. *P<0,05 по сравнению с контрольной группой пустого вектора.
ФИГ.24 иллюстрирует высвобождение IFN-гамма в легумаин-специфических Т-клетках, вызванное pCMV-Kb/Kd минигенной композицией. А. Экспрессия легумаина свежеполученными из опухолевых тканей 4Т1 клетками, использованными в качестве клеток-стимуляторов. С целью показать степень экспрессии легумаина на этих клетках была проведена проточная цитометрия. В. Продуцирование IFN-гамма контролировалось с помощью ELISPOT на уровне отдельных клеток, таких как лимфоциты из иммунизированных мышей, рестимулированных или legumain+ 4Т1 опухолевыми клетками, свежеполученными из опухолевой ткани, или legumain- 4Т1 культуральными клетками. Высвобождение INF-гамма показано количеством иммунных пятен на лунку. *P<0,05 по сравнению с группами мышей, чьи лимфоциты не были стимулированы legumain+ опухолевых клеток. #P<0,05 по сравнению с контрольными группами.
ФИГ.25 иллюстрирует специфическое CTL уничтожение легумаин положительных макрофаговых клеток, вызванное применением pCMV-Kb/Kd минигенной композиции. А. Показана экспрессия легумаина макрофаговыми клетками RAW линии после культивирования с IL-4, IL-10 и IL-13. С целью показать экспрессию легумаина на этих клетках был проведен Вестерн-блотт анализ. В. Спустя 2 недели после последней иммунизации были умерщвлены группы мышей BALB/c (n=4), а извлеченные у них спленоциты были стимулированы облучаемыми в течении 5 дней 4Т1 legumain+ клетками. После этого был проведен цитотоксический анализ либо с диким типом RAW legumain- клеток (нижняя панель), либо с RAW legumain+ клетками в качестве клеток-мишеней (нижняя панель). *<0,05 по сравнению с группой пустого вектора, где в качестве мишени использовались RAW legumain+ клетки.
ФИГ.26 иллюстрирует подавление ангиогенеза у изогенных мышей BALB/c, вызванное pCMV-Kb/Kd минигенной композицией. А. Результат матригельного анализа. Матригель был имплантирован мышам, вакцинированным либо пустым вектором, либо pCMV-Db/Dd, либо pCMV-Kb/Kd вакцинами. Измерение концентрации гемоглобина (Hb) в матригелевых пробках производилось для измерения роста кровеносных сосудов. Средняя концентрация Hb матригелевых пробок в каждой группе мышей отображена на гистограмме (n=4; среднее + стандартное отклонение). *P<0,05 по сравнению с контрольной группой пустого вектора. В. Окрашивание трихромом по Масону участка Матригеля проводили спустя 7 дней после имплантации матригелевой пробки. Стрелки показывают кровеносные сосуды в матригелевой пробке.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Настоящее изобретение предоставляет композицию ДНК, которая нацелена на опухолеассоциированные клетки, такие как опухолеассоциированные макрофаги (ТАМ). Композиция ДНК включает заключенную в фармацевтически приемлемый носитель конструкцию ДНК, кодирующую цистеиновую эндопептидазу, которая сверхэкспрессируется в опухолеассоциированных клетках, или по меньшей мере, один ее иммуногенный фрагмент, способный вызвать иммунный ответ против опухолеассоциированных клеток. Предпочтительно, чтобы композиция ДНК включала минигенную конструкцию ДНК, кодирующую экспрессируемый в иммунных клетках иммуногенный полипептид, включающий множество иммуногенных фрагментов цистеиновой эндопептидазы (например, легумаина), которая интенсивно экспрессируется в опухолеассоциированных клетках, где полипептид способен вызывать иммунный ответ против опухолеассоциированных клеток. Минигенный вариант осуществления - множество иммуногенных фрагментов эндопептидазы, объединенных вместе последовательно пептидами-линкерами между каждыми из последовательных фрагментов в полипептиде.
Предпочтительно, цистеиновая эндопептидаза - легумаин (например, легумаин человека; SEQ ID NO: 2). Конструкция ДНК может кодировать одиночный иммуногенный фрагмент цистеиновой эндопептидазы (например, эпитоп), но предпочтительно кодирует полипептидное включение двух или более иммуногенных фрагментов эндопептидазы.
Термин «конструкция ДНК», используемый в настоящем описании и в приложенной формуле изобретения, относится к структуре ДНК, которая кодирует представляющий интерес белок или полипептид, такой как легумаин или иммуногенный фрагмент легумаина (эпитоп), обобщенно называемой «ДНК легумаина», а также белки, такие как IL-2, CCL21, CD40L и им подобные. Предпочтительно, чтобы каждый иммуногенный фрагмент включал приблизительно 8-10 аминокислотных остатков в длину. Конструкции ДНК включают любую ДНК, которая может быть перенесена в меченые клетки, включая линейную ДНК и плазмидную ДНК, так же как ДНК, которая была включена в генетический материал клетки или вируса. Предпочтительно, конструкция ДНК - это ДНК, которая была включена в вирусный или бактериальный вектор доставки, например непатогенный аттенуированный вирусный или бактериальный вектор. В процессе лечения субъекта композицией по изобретению, ДНК легумаина доставляется в иммунные клетки (например, макрофаги и дендрические клетки), которые затем экспрессируют белок или пептид, включая в его иммуногенный фрагмент. Вирусный или бактериальный носители ДНК легумаина сами не экспрессируют легумаин.
В некоторых предпочтительных вариантах осуществления конструкция ДНК - это минигенная конструкция, которая кодирует иммуногенный полипептид, включающий множество (например, 2-5) иммуногенных фрагментов эндопептидазы, которая активно экспрессируется в ТАМ (например, легумаин). Используемый в настоящем описании термин «миниген» относится к конструкциям ДНК, кодирующим множество частей (фрагментов) интересующего протеина, которые связаны вместе, предпочтительно небольшими пептидами по меньшей мере из трех аминокислот. Такие минигены кодируют полипептиды, включающие иммуногенные фрагменты представляющего интерес белка, но не кодируют целый представляющий интерес белок. Предпочтительно, чтобы минигенная конструкция кодировала полипептид, включающий приблизительно 2-5 иммуногенных фрагментов (например, пептидные последовательности из участков эпитопа белка), предпочтительно соединенных пептидными связями. Миниген может также включать последовательности, которые кодируют лидерные последовательности и/или другие последовательности, используемые для облегчения экспрессии или транспортировки пол