Набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченного зонда для идентификации рнк энтеровирусов методом обратной транскрипции - полимеразной цепной реакции с гибридизационно-флуоресцентной детекцией
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, а именно к набору олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченного зонда для идентификации РНК энтеровирусов. Предложенное изобретение может быть использовано в биотехнологии, медицине и эпидемиологии. Набор содержит 1 пару олигонуклеотидов, обладающих активностью прямого и обратного праймеров, и зонд, имеющие следующую структуру: 5' CAAGNACTTCTGTTNCCCCGGACYGA 3'; 5' ATNTNTCAATTGTCANCATAAGCAGCCA 3'; FAM -5' CCTYCGGCNCCTGAYTGCGGCTAATCC 3'- BHQ1. Предложенное изобретение позволяет с большой точностью выявлять генетический материал (РНК) энтеровирусов человека А, В, С, D. 4 ил., 1 табл., 1 пр.
Реферат
Изобретение относится к наборам для выявления генетического материала (РНК) энтеровирусов в клинических или секционных пробах, в образцах внешней среды с целью постановки диагноза, эпидемиологического расследования, а также для решения научно-исследовательских задач по изучению свойств энтеровирусов биотехнологии и может быть использовано в медицине и эпидемиологии. При помощи набора диагностических праймеров возможно выявление генетического материала (РНК) энтеровирусов человека А, В, С, D.
Энтеровирусы объединены в род Enterovirus, который относится к семейству Picornaviridae. Согласно последней версии классификации вирусов, принятой Международным комитетом по таксономии (http://www.ncbi.nlm.nih.gov/ICTVdb/lctv/index.htm), основанной на молекулярно-биологических характеристиках вирусов, энтеровирусы человека сгруппированы в четыре вида (энтеровирусы человека А, В, С, D), полиовирусы включены в вид энтеровирусов человека С.
Выявление энтеровирусов является актуальной задачей для здравоохранения, так как в настоящий момент даже во время вспышек энтеровирусной инфекции лабораторно удается подтвердить только 45-70% проб [Кузнецова В.Г., Мечетина А.А., Денисова А.А., Демина А.В. и др. Клинико-эпидемиологическая характеристика энтеровирусного менингита по данным вспышки 2004 года // Сборник материалов XV Научно-практической конференции врачей. Новосибирск, 2005. 415-416]. При этом этиология большинства инфекционных экзантем, вирусных кишечных инфекций, острых респираторных инфекций и серозных менингитов остается неуточненной. Важной задачей является контроль над циркуляцией полиовирусов в окружающей среде и своевременное выявление больных и носителей, что доказывают недавние случаи заноса данной инфекции из Таджикистана в нашу страну [http://www.interfax.ru/news.asp?id=141999, http://rospotrebnadzor.ru/documents/proto/27880/].
Энтеровирусы относятся к РНК-содержащим вирусам, и их титр в образцах, как правило, достаточно низок, поэтому в некоторых случаях в пробах энтеровирусы не выявляются либо данные носят неоднозначный характер. Подбор качественных праймеров является сложной процедурой, так как энтеровирусы человека имеют более 100 серотипов и генетически вариабельны даже в пределах одного генотипа.
В настоящее время в России для ПЦР диагностики энтеровирусов используются ПЦР-тест-системы с детекцией результатов методом электрофореза производства следующих компаний: ЗАО «БиоХимМак» (http://www.biochemmack.ru/product/moleculardiagnostics/infectious/), ЗАО «Литех» (наборы реагентов для ПЦР производства "ИзоГен") (http://www.lytech.ru/catalog_69.htm). Набор с гибридизационно-флуоресцентной детекцией производит компания «ИнтерЛабСервис» (ЦНИИЭ, Россия), (http://www.interlabservice.ru/catalog/reagents/index.php?sid=678).
Известно использование набора олигонуклеотидных праймеров, изготовленных ООО «Литех» (г.Москва) для выявления энтеровирусов методом ОТ-ПЦР (патент РФ №2313792, МПК G01N 33/50, C12Q 1/68, опубл. 27.12.2007 г.
Известен набор олигонуклеотидных праймеров для ОТ-ПЦР, используемых в способе обнаружения и дифференциации РНК энтнровирусов (патент РФ №2189396, МПК C12Q 1/68, опубл. 20.09.2002 г.).
Однако вышеприведенные аналоги, в том числе известные коммерческие тест-системы, позволяют определить род энтеровирусов, но не позволяют определить его серотип. Например, в наборе Real-Time PCR (с гибридизационно-флуоресцентной детекцией) компании «ИнтерЛабСервис» можно получить фрагмент, длиной только 190 н.п., что не позволяет провести определение нуклеотидной последовательности с последующим генотипированием.
Существующие тест-системы не позволяют определять количество вирусной РНК в исследуемом образце. В предложенном наборе могут быть использованы контрольные образцы с известной концентрацией для выявления вирусной нагрузки в исследуемой пробе.
Наиболее близким аналогом (прототипом) является заявка на патент США №20110045458, МПК C12Q 1/70, опубл. 24.02.2011 г. «Детекция энтеровирусов», в которой приведены праймеры и зонды на консервативную область 5'UTR генома РНК энтеровирусов.
Однако вышеупомянутые праймеры и зонды отличаются по структуре от праймеров и зонда, предлагаемых в заявляемом техническом решении. Разработанный авторами набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченного зонда дает возможность получить фрагмент до 450 н.п., что позволяет провести генотипирование энтеровирусов на основании нуклеотидной последовательности ампликона с большей точностью.
Техническим результатом заявляемого изобретения является получение такого набора олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченного зонда, который обеспечивал бы определение не только рода, но и серотипа энтеровируса с большей точностью.
Указанный технический результат достигается получением набора олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченного зонда для идентификации РНК энтеровирусов методом обратной транскрипции полимеразной цепной реакции (ОТ-ПЦР) с гибридизационно-флуоресцентной детекцией в клинических образцах и окружающей среде, содержащего 1 пару олигонуклеотидов, обладающих активностью прямого и обратного праймеров, и зонд, имеющие следующую структуру:
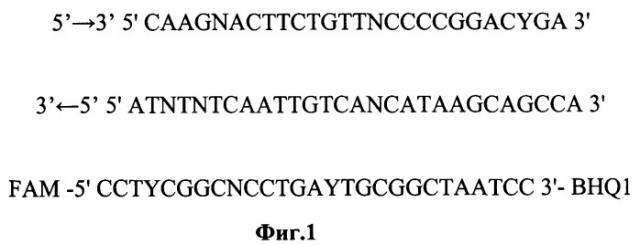
5'→3' 5' CAAGNACTTCTGTTNCCCCGGACYGA 3'
3'←5' 5' ATNTNTCAATTGTCANCATAAGCAGCCA 3'
FAM -5' CCTYCGGCNCCTGAYTGCGGCTAATCC 3'- BHQ1
Заявляемый набор получен путем:
- конструирования диагностических праймеров и флуоресцентно-меченного зонда на консервативную область 5'UTR гена энтеровирусов;
- конструирования рекомбинантной плазмидной ДНК pCR 2.1 (ТОРО), несущей специфический для энтеровирусов участок ДНК-матрицы.
Условия проведения амплификации оптимизировались по следующим параметрам: концентрация ионов магния, концентрация праймеров и зондов в реакционной смеси; температура отжига праймеров и зонда.
На начальном этапе для всех видов энтеровирусов человека А, В, С, D были подобраны и синтезированы специфические олигонуклеотидные праймеры и зонд для гибридизационно-флуоресцентной детекции продуктов ПЦР. Для этого в базе данных GenBank при помощи программного обеспечения BLAST (http://www.ncbi.nlm.nih.gov/) были выбраны наиболее консервативные участки геномов (5'UTR) всех видов энтеровирусов человека (А, В, С, D). Анализ свойств олигонуклеотидных праймеров и зондов проводился с использованием программного обеспечения Vector NTI 9.0.0 (InforMax). Результаты приведены в таблице и на фиг.1.
| Таблица | |||
| Структура набора заявляемых праймеров для выявления РНК энтеровирусов в клинических образцах и окружающей среде ОТ-ПЦР с гибридизационно-флуоресцентной детекцией | |||
| Структура праймера (5'->3') | Наименование | Т отжига (°С) | Локализация на геноме |
| CAAGNACTTCTGTTNCCCCGGACYGA | F903-30 | 60 | 72-98 (5'UTR) |
| ATNTNTCAATTGTCANCATAAGCAGCCA | R41-32 | 60 | 493-521 (5'UTR) |
| FAM-CCTYCGGCNCCTGAYTGCGGCTAATCC-BHQ1 | Z951 | 73 | 354-381 (5'UTR) |
Важно отметить, что разработка условий проведения ОТ-ПЦР осуществлена нами исключительно с использованием коммерчески доступных ферментов и прибора для амплификации, предназначенных для массового применения в диагностических лабораториях России. Этот факт позволяет просто, быстро и надежно применить данное изобретение в лабораторной практике.
Инактивацию образцов и выделение РНК проводили в условиях, регламентированных Методическими указаниями МУ 1.3. 2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности».
Процедуру выделения РНК из исследуемого материала проводили с использованием набора реагентов «Рибо-сорб» (ЦНИИЭ, Россия) в соответствии с инструкцией по применению.
Реакцию обратной транскрипции проводили с использованием набора реагентов «Реверта-L» (ЦНИИЭ, Россия) в соответствии с инструкцией по применению.
Для проведения ПЦР в режиме реального времени готовили смесь компонентов следующего состава (из расчета на одну пробу в 30 мкл смеси): 0,2 мМ каждого из дезоксинуклеотидтрифосфатов, 1,5 мМ MgCl2, 30 мМ Трис-HCl (рН 8,5 при +25°С), 16 мМ (NH4)2SO4, 0,1% Nonidet P40 («Sigma»), по 15 мкМ специфических олигонуклеотидных праймеров, зонд (концентрация 5-10 мкМ) и 1,5U/30µl Taq ДНК полимеразы («СибЭнзим», Россия).
В качестве отрицательного контрольного образца в реакционную смесь добавляли ТЕ-буфер.
ОТ-ПЦР в режиме реального времени и регистрацию результатов проводили в приборе "Rotor Gene 6000" (Corbett) по каналам Green (470 nm /510 nm).
Программирование амплификатора / параметры эксперимента:
| 1. Hold/Удержание температуры | 95°С - 5 мин |
| 2. Cycling/Циклирование (10 циклов) | 95°С - 10 сек |
| 60°С - 60 сек | |
| 3. Cycling 2/Циклирование 2 (35 циклов) | 95°С - 10 сек |
| 60°С - 60 сек - детекция |
4. Флюоресценцию измеряют при температуре отжига праймеров на канале FAM/Green.
Результаты оценивали по наличию флюоресценции до 30-го цикла, которые представлены на графике, фиг.2. На Фиг.2 изображены кривые 1-5 - положительные на энтеровирусы образцы; кривая 6 - положительный контроль; кривая 7 - отрицательный контроль и другие отрицательные образцы.
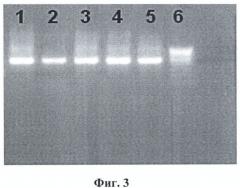
Дополнительно результаты оценивали по наличию фрагментов ДНК, полосы которых располагались на том же уровне в геле, что и полоса маркера молекулярного веса, соответствующая размерам фрагментов ДНК в 450 п.н. (фиг.3) для энтеровирусов. Электрофорез проводился в 2,5%-ном агарозном геле для детекции ДНК, выделенной из вируссодержащего материала. Дорожки: 1-5 - положительные на энтеровирусы образцы; 6 - маркер молекулярного веса.
Положительные контрольные образцы были получены методом молекулярной трансформации компетентных бактериальных клеток Escherichia coli TOP 10 рекомбинантными плазмидами pCR 2.1, включающими синтетическую вставку ДНК, соответствующую выбранному участку геномной РНК энтеровирусов.
Анализ эффективности молекулярной трансформации осуществляли проведением ПЦР в режиме реального времени в соответствии с протоколом, описанным выше, где в реакционную смесь вместо кДНК добавляли по 3 мкл концентрата плазмиды pCR, несущей вставку кДНК, соответствующего участкам геномов энтеровирусов.
Для тестирования созданной диагностической системы в качестве анализируемых образцов использовали клинический материал (спинно-мозговую жидкость и фекалии) от пациентов с серозным менингитом, а также плазмидную ДНК, полученную выделением из компетентных бактериальных клеток Escherichia coli, трансформированных бактериальными плазмидами pCR, включающими вставку кДНК, соответствующую детектируемым участкам геномов энтеровирусов.
Исследование проводили с соблюдением принципов добровольности и конфиденциальности в соответствии с «Основами законодательства РФ об охране здоровья граждан» (ред. Указ Президента РФ от 24.12.1993 Т2288, Федеральные законы №30-ФЗ от 02.03.1998, №214-ФЗ от 20.12.1999). Опрос респондента и взятие клинических образцов проводили после получения письменного информированного согласия. Порядок проведения исследования одобрен этическим комитетом ФГУН ГНЦ ВБ «Вектор» от 20 мая 2008 года.
Для определения чувствительности набора из концентрированного раствора плазмидной ДНК были приготовлены последовательные 10-кратные разведения. Определение концентрации ДНК в разведениях при исследовании чувствительности праймеров осуществляли при помощи флуориметра QUBIT (Invitrogen, США) и наборов реагентов производителя.
Изобретение иллюстрируется следующим примером идентификации конкретных образцов.
Пример
Для диагностики и уточнения этиологии серозного менингита в лабораторию молекулярной вирусологии РНК-содержащих вирусов ФГУН ГНЦВБ «Вектор» поступило 15 образцов спинномозговой жидкости от больных, госпитализированных в МБУЗ г.Новосибирска Городской инфекционной клинической больницы №1 в период с июля по сентябрь 2008 г.
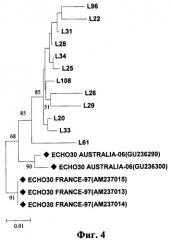
После проведения исследования методом ОТ-ПЦР в режиме реального времени выявлено 12 положительных образцов (80%) на энтеровирусную инфекцию. Фрагменты ДНК были исследованы методом секвенирования. Филогенетический анализ нуклеотидных последовательностей фрагментов 5'UTR выявил принадлежность проб L20, L22, L25, L26, L29, L28, L31, L33, L34, L61, L96, L108 к геному энтеровируса ЕСНО30. Наиболее близкие по последовательности изоляты этих генотипов ранее были выявлены в Австралии (Australia-2006(GU236299), Australia-2006(GU236300)), Франции (France-1997(AM237015), France-1997(АМ237014), France-1997(AM237013). Результаты исследования представлены на филогенетическом дереве, фиг.4.
Филогенетическое древо энтеровирусов ЕСНО30 построено по нуклеотидной последовательности 5'UTR генома энтеровирусов (72 - 521 п.о.). Топология дерева восстановлена при помощи метода объединения ближайших соседей. Матрица генетических расстояний рассчитана с применением метода Кимуры с двухпараметрической метрикой.
Из вышеизложенного видно, что достигнут заявляемый технический результат, а именно: разработан набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченного зонда для идентификации РНК энтеровирусов методом обратной транскрипции - полимеразной цепной реакции (ОТ-ПЦР) с гибридизационно-флуоресцентной детекцией в клинических образцах и окружающей среде, позволяющий определить не только род, но и серотип энтеровируса. Также была определена аналитическая чувствительность набора для детекции энтеровирусов, которая составила 2×104 м.к. (геномных эквивалентов)/мл. Данная система может быть использована как для количественного анализа, так и для генотипирования.
Набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченного зонда для идентификации РНК энтеровирусов методом обратной транскрипции - полимеразной цепной реакции (ОТ-ПЦР) с гибридизационно-флуоресцентной детекцией в клинических образцах и окружающей среде, содержащий 1 пару олигонуклеотидов, обладающих активностью прямого и обратного праймеров, и зонд, имеющие следующую структуру:5'→3' 5' CAAGNACTTCTGTTNCCCCGGACYGA 3'3'←5' 5' ATNTNTCAATTGTCANCATAAGCAGCCA 3'FAM -5' CCTYCGGCNCCTGAYTGCGGCTAATCC 3'- BHQ1.