Промотор для тканеспецифической экспрессии генов в герминальных тканях млекопитающих
Иллюстрации
Показать всеИзобретение относится к биотехнологии и касается промотора для тканеспецифической экспрессии генов в герминальных тканях млекопитающих. Представленный промотор состоит из последовательности длиной 3574 пары нуклеотидов, расположенной выше точки начала транскрипции гена человека NDUFV1, с удаленной последовательностью протяженностью 91 п.о., расположенной непосредственно выше точки начала транскрипции этого гена. Представленное изобретение позволяет создать искусственный сильный промотор, который может быть использован для терапии герминальных тканей, создания трансгенных животных или модифицированных клеточных линий с заданными функциями. 5 ил., 1 табл., 4 пр.
Реферат
Настоящее изобретение относится к биотехнологии, в частности к генной инженерии животных, к искусственным ДНК-конструкциям, демонстрирующим высокую активность транскрипционного промотора, с которого осуществляется экспрессия расположенной ниже произвольной нуклеотидной последовательности, транскрибируемой РНК-полимеразой II. Активность промотора ограничена герминальными клетками (ГК) и соответствующими тканями млекопитающих. Промотор может быть использован для терапии терминальных тканей, а также для создания трансгенных животных или модифицированных клеточных линий с заданными функциями.
Экспрессия генов обеспечивается геномными регуляторными элементами, включающими, в том числе, промоторы, энхансоры и сайленсеры различной структуры.
Эти регуляторные элементы содержат уникальный набор более коротких мотивов, связывающих регуляторные белки, например, различные белки-факторы транскрипции. Получающийся уникальный репертуар участков связывания регуляторных белков, по-видимому, в основном и обуславливает транскрипционный контроль генов. Некоторые гены транскрибируются во всех тканях организма, некоторые - в нескольких тканях, а некоторые другие - только в единственной ткани. Регуляторные участки генов, характеризующихся такой тканеспецифической транскрипцией, можно использовать для создания генно-инженерных конструкций с целью специфической экспрессии интересующих последовательностей (РНК или белка) в строго определенной ткани (или в группе тканей) организма. Такая задача может быть поставлена, например, при создании стратегии генной терапии или при решении исследовательских задач. Генно-терапевтические применения могут быть нацелены на восполнение дефицита какого-либо белкового продукта в организме (например, введение в гематопоэтические стволовые клетки пациентов, страдающих наследственными формами гемофилии, конструкций, содержащих экспрессионную кассету с нормальной копией гена фактора свертываемости IX (Mates, L., Chuah, M.K., Belay, E., Jerchow, В., Manoj, N., Acosta-Sanchez, A., Grzela, D.Р., Schmitt, A., Becker, K., Matrai, J., Ma, L., Samara-Kuko, E., Gysemans, C., Pryputniewicz, D., Miskey, C., Fletcher, В., Vandendriessche, Т., Ivies, Z., and Izsvak, Z, (2009). Molecular evolution of a novel hyperactive Sleeping Beauty transposase enables robust stable gene transfer in vertebrates. Nat Genet 41, 753-61)), а также на борьбу с аутоиммунными и раковыми заболеваниями (de Bruin, Е.С., and Medema, J. P. (2008). Apoptosis and non-apoptotic deaths in cancer development and treatment response. Cancer Treat Rev 34, 737-49).
В настоящее время ведется интенсивная разработка препаратов нового поколения, способных селективно воздействовать на раковые клетки с уменьшенной амплитудой побочных эффектов на нормальные ткани организма. Принцип действия таких препаратов основан на знании природы развития того или иного типа опухолей и происходящих в них биохимических процессов, зачастую - с учетом индивидуальных особенностей пациента.
Известны препараты, специфично узнающие и убивающие клетки, на повышенном уровне экспрессирующие те или иные поверхностные антигены (часто - рецепторы клеточных факторов роста), клетки с инактивированными генами онкосупрессоров, клетки с аберрантно блокированными путями апоптоза (Frenzel, A., Grespi, F., Chmelewskij, W., and Villunger, A. (2009). Bcl2 family proteins in carcinogenesis and the treatment of cancer. Apoptosis 14, 584-96).
В качестве средств доставки геннотерапевтических препаратов используют липосомы, вирусные частицы, полиплексы (Sobolev, A.S. (2008). Modular transporters for subcellular cell-specific targeting of anti-tumor drugs. Bioessays 30,278-87), "голая" ДНК или ДНК-липосахаридные комплексы (Yu, H., and Wagner, E. (2009). Bioresponsive polymers for nonviral gene delivery. Curr Opin Mol Ther 11, 165-78).
Этот подход предусматривает введение в клетки организма генно-инженерных конструкций, специфично воздействующих на раковые клетки и приводящие к гибели последних. Широко рассматриваются, например, перспективы специфической активации внутриклеточных онкосупрессорных генов (Garcia-Echeverria, С., and Sellers, W.R. (2008). Drug discovery approaches targeting the PI3K/Akt pathway in cancer. Oncogene 27, 5511-26). Весьма многообещающим подходом представляется доставка в клетку "киллерных" генов (или "генов-убийц") под транскрипционным контролем промоторов, обладающих повышенной активностью в раковых клетках. При этом активность таких промоторов может характеризоваться сильной тканеспецифичностью, то есть быть специфичной для определенных типов тканей (соответственно, и определенных видов рака). Это свойство особенно полезно при лечении метастазов рака одной природы в ткани другого происхождения (например, метастазы рака груди в костную ткань (Rabbani, S.A., and Mazar, A.P. (2007). Evaluating distant metastases in breast cancer: from biology to outcomes. Cancer Metastasis Rev 26, 663-74)). Чрезвычайно важна "тонкая настройка" системы ген-промотор, которая должна обеспечить безвредность генно-терапевтического препарата для нормальных тканей организма. Иными словами, должно быть исключено "подтекание" промотора на уровне, обеспечивающем экспрессию гена-убийцы на достаточном для терапевтического эффекта уровне в здоровых клетках. Для этого в ряде случаев используемые промоторные последовательности модифицируют, удаляя или вводя в их состав регуляторные последовательности, как правило, - сайты узнавания транскрипционных факторов. Это позволяет модулировать тканеспецифичность экспрессии создаваемых генно-инженерных конструкций.
В то же время ни одна из вышеперечисленных систем не может обеспечить сильной строго тканеспецифической экспрессии эффекторного гена в герминальных клетках (ГК).
Тканеспецифическая экспрессия генов в герминальных клетках (ГК) обусловлена наличием в этом типе клеток ряда уникальных транскрипционных факторов, узнающих особые нуклеотидные мотивы в составе промоторов регулируемых генов. Специфичность действия большего числа таких транскрипционных факторов пока не установлена, но для промоторов значительного числа генов известна их тканеспецифическая активация именно в ГК млекопитающих (Wu, H., Chen, Y., Miao, S., Zhang, С., Zong, S., Koide, S. S., and Wang, L. Sperm associated antigen 8 (SPAG8), a novel regulator of activator of CREM in testis during spermatogenesis. FEBS Lett 584, 2807-15). При этом характеристика регуляторных элементов в составе таких промоторов, как правило, не проведена, а точные границы промоторов не определены. Например, для гена человека MAST2, кодирующего особую форму ассоциированной с микротрубочками серин/треониновой киназы, известна ярко выраженная тканеспецифичность его экспрессии в клетках зародышевого пути, но регуляция экспрессии гена не исследована и последовательность промотора функционально не охарактеризована. Известно также, что в ГК активизируются промоторы некоторых повторяющихся элементов генома, в частности, длинные концевые повторы эндогенных ретровирусов человека семейства HERV-K(HML-2) (Buzdin, A. (2007). Human-specific endogenous retroviruses. ScientificWorldJournal 7, 1848-68). Как и в предыдущем случае, диапазон транскрипционных факторов, ответственных за регуляцию этих элементов в ГК, неизвестен.
Ряд промоторов, преимущественно активных в ГК, был запатентован для получения различных тканеспецифичных генетических конструкций. Так, промотор гена сурвивина может быть использован для преимущественной транскрипции генно-инженерных кассет в клетках рака различной этиологии (Jyunichi, 2009).
Однако же такие промоторы имеют существенные недостатки: они или демонстрируют значительную транскрипционную активность и в других типах клеток, нежели ГК, или/и не могут обеспечить высокую транскрипцию нижележащих генов во вводимых конструкциях.
Промоторы для тканеспецифической экспрессии генов в ГК высоковостребованы. Например, низкодифференцированные герминальные опухоли человека (около 1% всех детектируемых случаев рака) приводят к наиболее агрессивным видам злокачественных герминогенных опухолей. Создание терапевтических конструкций для их лечения с использованием новых высокоэффективных тканеспецифических промоторов является перспективным направлением биотехнологических и фармакогенетических исследований.
Прототипом настоящего изобретения является модель использования тканеспецифического промотора человеческого гена инволюкрина для экспрессии различного рода белков в эпителиальных клетках (United States Patent Application 20050193431; Tissue specific promoters and transgenic mouse for the screening of pharmaceuticals). Эта модель использует свойство уникального фрагмента генома человека, заключающееся в тканеспецифичной промоторной активности. Изобретение позволяет получать тканеспецифическую экспрессию любых вводимых генов в эпителии почек, мочеточников, мочевого пузыря, матки, пищевода, предстательной железы, селезенки и бронхов. Вместе с тем, изобретение-прототип не позволяет добиться тканеспецифичной экспрессии вводимых генов в ГК.
Изобретение решает задачу создания искусственного сильного промотора, обладающего высокой тканевой специфичностью экспрессии генов в ГК.
Поставленная задача решается за счет структуры промотра, состоящего из вышележащей последовательности гена человека NDUFV1 длиной 3574 пары нуклеотидов с удаленной проксимальной последовательностью длиной 91 п.о.
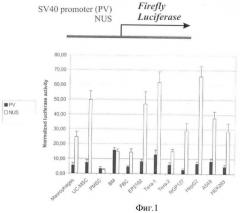
Ген человека NDUFV1 является геном домашнего хозяйства и кодирует белок, вовлеченный в осуществление клеточного метаболизма в митохондриях (Dieteren, С.Е., Willems, P.H., Vogel, R.О., Swarts, H.G., Fransen, J., Roepman, R., Crienen, G., Smeitink, J.A., Nijtmans, L.G., and Koopman, W. J. (2008). Subunits of mitochondrial complex I exist as part of matrix- and membrane-associated subcomplexes in living cells. J Biol Chem 283, 34753-61). Как на уровне РНК, так и на белковом уровне, этот ген экспрессируется во всех тканях человека. Транскрипционная регуляция этого гена осуществляется вышележащей (относительно точки начала транскрипции) последовательностью, включающей в себя промотор и ряд отдаленных регуляторных элементов. Эксперимент по транзиентной трансфекции плазмидных векторов, содержащих вышележащую регуляторную последовательностью гена NDUFV1 длиной 3665 пар нуклеотидов, показывает, что она обеспечивает экспрессию репортерного гена люциферазы на уровне, превышающем уровень экспрессии люцифеназы для раннего промотора вируса SV40, в большинстве из двенадцати протестированных человеческих клеточных линий различного происхождения (Фиг.1).
Используют следующие клеточные линии: ЕР2102, Tera1 (недифференцированный зародышевый рак яичка), Tera-2 (зародышевый рак яичка, частично дифференцированный в клетки нервной трубки), NGP127 (клетки нейробластомы), HepG2 (гепатокарцинома), А549 (карцинома легкого) и HEK 293 (эмбриональный рак почки). Кроме того, используют первичные человеческие клеточные культуры: макрофаги периферической крови, пуповинные мезенхимальные стволовые клетки (UC-MSC), плацентарные мезенхимальные стволовые клетки (PMSC) и мезенхимальные стволовые клетки костного мозга (BM-MSC), а также трансформированные клетки зародышевого мозга (FBC).
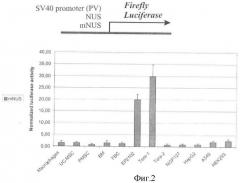
Удаление 91 пары нуклеотидов, располагающихся на самом 3'-конце этой вышележащей последовательности, приводит к резкому падению экспрессии репортерного гена во всех клеточных линиях, кроме линий герминального рака яичка человека Tera 1 и ЕР-2102 (Фиг.2). В этих линиях, являющихся производными трансформированных низкодифференцированных клеток зародышевого пути, фиксируют уменьшение уровня экспрессии репортерного гена в ~2,9-2,4 раза до значений, превышающих таковые для раннего промотора вируса SV40, тогда как в других клеточных линиях уровень экспрессии упал в 15-80 раз до труднодетектируемых значений.
Такая укороченная регуляторная последовательность длиной 3574 пары нуклеотидов обеспечивает экспрессию репортерного гена в клеточной линии Tera 1 на высоком уровне, соответствующем стандартному промотору CMV и около двух раз превосходящем уровень промотора SV40, тогда как в остальных линиях экспрессия детектируется лишь на ничтожно малом уровне (Фиг.3).
Карта потенциальных участков связывания транскрипционных факторов, построенная при помощи программы AliBaba и базы данных TRANSFAC (Фиг.4) показывает, что наибольшая частота таких участков приходится на последовательность расположенного на 5'-конце промотора одиночного длинного концевого повтора эндогенного ретровируса семейства HERV-K(HML-2). В дальнейших экспериментах сравнивают транскрипционную активность исходного промотора длиной 3574 пары нуклеотидов и варианта промотора, несущего делецию по полной последовательности длинного концевого повтора HERV-K(HML-2). При удалении элемента HERV-K(HML-2), промоторная активность падает в клеточных линиях Tera-1 and ЕР2102 в 3-4 раза, а в остальных протестированных клеточных линиях - остается без изменений. Таким образом, последовательность HERV-K(HML-2) является важным регуляторным элементом промотора, исполняющим функцию тканеспецифического энхансора.
Промотор протестирован на модели трансгенных животных. Созданы три линии мышей BALB/C, несущих вставленную в геномную ДНК кассету, включающую промотор и находящийся под его транскрипционным контролем ген красного флуоресцентного белка Ds-Red (Clontech). В дальнейшем микросрезы тканей гомозиготных и гетерозиготных по наличию вставки мышей анализируют на флуоресцентном микроскопе. Установлено, что как в гомо-, так и в гетерозиготных животных промотор обеспечивал сильный уровень экспрессии гена флуоресцентного белка в яичках, сравнимый с уровнем экспрессии гена GAPDH (преимущественно в ГК) и в меньшей мере - в яичниках, тогда как в других тканях экспрессия гена наблюдалась на уровне фона.
Промотор (SEQ ID NO 1) можно использовать для тканеспецифической экспрессии генов в клетках зародышевого пути человека и млекопитающих. На основе последовательности промотора можно создавать генно-инженерные конструкции для исследовательских нужд, для направленной дифференцировки клеток и для генной терапии различных заболеваний, например, рака герминальных тканей.
Путем дальнейших генно-инженерных манипуляций размер и состав базового промотора длиной 3574 пар нуклеотидов может быть изменен для достижения дополнительных или особых целей, как то: получение более компактной регуляторной последовательности, повышение или понижение уровня тканеспецифичности, введение дополнительных участков связывания транскрипционных факторов, введение рестриктных сайтов, введение дополнительных последовательностей генов, и другие.
На основе последовательности промотора могут быть созданы плазмидные, вирусные или иные векторные конструкции для тканеспецифической экспрессии любого гена или различных генов в клетках зародышевого пути, в эмбриональных и в стволовых клетках. При этом размер промотора может быть увеличен, может быть уменьшен до итогового значения 400 пар нуклеотидов, а нуклеотидная последовательность может быть изменена до конечного уровня идентичности 80% и более с последовательностью (SEQ ID NO 1). Последовательность может быть введена в качестве единственного промотора, либо в качестве дополнительного промотора, либо в составе генно-инженерной конструкции к ней могут быть добавлены другие регуляторные и генетические элементы.
Изобретение иллюстрируют графические материалы.
Фигура 1. Активность репортерного гена люциферазы светлячка в трансфицированных клеточных линиях.
Активность репортерного гена измеряют при помощи метода «двойной люциферазы» и нормируют на активность контрольного вектора pRL-TK (Promega), содержащего промотор тимидинкиназы вируса простого герпеса. По оси абсцисс отложена нормализованная активность люциферазы светлячка. Черные столбцы соответствуют трансфекции вектором, содержащим перед геном люциферазы поздний промотор вируса SV40 (PV); светлые столбцы соответствуют трансфекции вектором, содержащим регуляторную последовательность длиной 3665 пар нуклеотидов гена человека ND UFV1 (NUS). Трансфекция проводят для человеческих клеточных линий следующего происхождения: герминогенные опухоли - недифференцированная (линия Tera1) и сильно дифференцированная (Tera2), нейроглиальная опухоль (NGP127), рак печени (HepG2), рак легкого (А549), первичная культура макрофагов, первичная культура плацентарных фибробластов (FBTs), первичная культура фибробластов пуповинной крови (PCF), первичная культура клеток костного мозга (ВМ), рак эмбриональной почки (HEK293). Для всех линий, кроме HEK293, трансфекцию проводят в 6 повторностях во время двух независимых экспериментов, для линии HEK293 - в 4 повторностях во время одного эксперимента. Видна в целом более сильная промоторная активность промотора NDUFV1 по сравнению с промотором вируса SV40.
Фигура 2. Активность репортерного гена люциферазы светлячка в трансфицированных клеточных линиях.
По оси абсцисс отложена нормализованная активность люциферазы светлячка. Столбцы соответствуют трансфекции вектором, содержащим перед геном люциферазы модифицированную регуляторную последовательность гена человека NDUFV1 (mNUS) длиной 3574 пары нуклеотидов. Наблюдают наличие значимой промотрной активности mNUS, сравнимой с активностью промотора CMV, только в клеточных линиях Tera-1 и ЕР2102.
Фигура 3. Схема вышележащего района гена NDUFV1 человек.
Последовательность NUS длиной 3665 пар нуклеотидов содержит высококонсервативный участок длиной 91 п.н., расположенный непосредственно выше точки начала транскрипции гена NDUFV1. На 5'-конце последовательности NUS располагается одиночный концевой повтор эндогенного ретровируса HERV-K (HML-2).
Фигура 4. Схема предсказанных участков связывания транскрипционных факторов в пределах всей последовательности NUS длиной 3665 п.н.
Отдельно показан элемент HERV-K(HML-2) и консервативная последовательность длиной 91 п.н. Знаки выше и ниже черты обозначают предсказанных участков связывания транскрипционных факторов в прямой и обратной ориентациях, соответственно. Темные овалы обозначают предсказанные участки связывания транскрипционного фактора SRY/SOX3 соответствующие консенсусной последовательности АСААААСА.
Фигура 5. Сравнение активности промотора длиной 3574 пары нуклеотидов (mNUS) в транспозиционном тесте с использованием системы транспозона Sleeping Beauty на клеточных линиях Tera-1 и HEK293.
(А) Общая схема транспозиционного теста. Только клетки, получившие геномную вставку кассеты устойчивости к пуромицину, могут делиться и формировать колонии на среде с антибиотиком. При случайных геномных вставках, не связанных с SB 100-системой, число колоний в десятки раз ниже числа колоний, наблюдаемого при высокой активности гена транспозазы SB100X. (В) Репрезентативный скрининг числа колоний. Для каждого типа эксперимента, под репрезентативными чашками Петри, показаны сосчитанные числа колоний.
| Измерение доли живых клеток в экспериментах с линиями Tera-1 и HEK-293. | ||||
| Экспериментa | Tera-1 | HEK-293 | ||
| ПИ - тестb | Аннексин Vc | ПИ - тестb | Аннексии Vc | |
| -5ФЦ; -Трансф. | 9.2±2.3 | ND | 7.7±1.5 | ND |
| -5ФЦ; н/п-ЦДА | 9.0±1.7 | ND | 7.4±1.7 | ND |
| -5ФЦ; mNUS-ЦДА | 8.8±2.9 | ND | 7.8±2.1 | ND |
| -5ФЦ; CMV-ЦДА | 9.9±2.5 | ND | 8.2±2.2 | ND |
| +5ФЦ; - Трансф. | 9.4±2.1 | 10.9±3.3 | 7.4±1.8 | 8.7±2.3 |
| +5ФЦ; н/п-ЦДА | 9.1±2.5 | 10.7±2.6 | 7.7±1.6 | 8.6±2.9 |
| +5ФЦ; mNUS-ЦДА | 59.5±6.4 | 59.1±3.9 | 7.8±1.7 | 8.4±2.8 |
| +5ФЦ; CMV-ЦДА | 67.3±7.5 | 64.9±5.6 | 73.8±11.3 | 75.5±8.6 |
| aИзмерения жизнеспособности клеток делались через 24 часа после добавления 5-флуороцитозина (5ФЦ). "-5ФЦ" обозначает отсутствие 5ФЦ в культуральной среде, "+5ФЦ" обозначает эксперименты с добавленным в среду 5ФЦ. "-Трансф.", "н/п-ЦДА", "mNUS- ЦДА" and "CMV- ЦДА" обозначает, соответственно, "нет трансфекции", "трансфекция с конструкцией, несущей ген цитозиндезаминазы (ЦДА), но лишенной промотора», "трансфекция конструкцией mNUS-ЦДА" и "трансфекция конструкцией СМУ-ЦДА". | ||||
| bТесты с использованием пропидиум-иодида (ПИ) делались в четырех повторностях. Полученные значения отражают совместную пропорцию некротических и апоптотических клеток. | ||||
| cТесты с использованием аннексина V проводили в трех повторностях для всех экспериментов с добавлением к среде 5ФЦ. Полученные значения отражают совместную пропорцию некротических и апоптотических клеток. |
Изобретение иллюстрируют примеры.
Пример 1.
a) клонирование последовательности промотора в вектор pGL3 basic (Promega). Последовательность промотора, ПЦР-амплифицированная с матрицы геномной ДНК человека с использованием праймеров: NDfor, ACGCGTTGAGTATGCTGCAGGCTTGG; NDrev, AGATCTGCTGCGCCCCTTCAACTTCGCC, клонируют в вектор pGL3 basic в прямой ориентации в положение выше гена люциферазы с использованием сайтов рестрикции ферментов MluI и BglII. Первичная структура клонированного промотора была проверена прямым секвенированием и оказалась на 100% идентичной референтной последовательности генома человека (геномный контиг, размещенный в GenBank с кодом доступа NT_167190.1, координаты 12676563-12680136).
b) тестирование полученного вектора на клеточных линиях.
Проводят серии транзиентных трансфекций с использованием трансфицирующего реагента Lipofectamine 2000 (Invitrogen) или Унифектин 5000 (Русбиолинк). Клетки исследуемых культур (ЕР2102, Tera1 (недифференцированный зародышевый рак яичка), Tera-2 (зародышевый рак яичка, частично дифференцированный в клетки нервной трубки), NGP127 (клетки нейробластомы), HepG2 (гепатокарцинома), А549 (карцинома легкого) и HEK 293 (эмбриональный рак почки), макрофаги периферической крови, пуповинные мезенхимальные стволовые клетки (UC-MSC), плацентарные мезенхимальные стволовые клетки (PMSC) и мезенхимальные стволовые клетки костного мозга (BM-MSC), а также трансформированные клетки зародышевого мозга (FBC)) высаживают на 24-луночные планшеты. Для скрининга активности люциферазы, используют набор Dual luciferase system (Promega). Для каждой трансфекций, используют 0.5 мкг смеси в пропорции 10:1 аналитической плазмиды (содержащей исследуемый промотор выше гена люциферазы светлячка) и нормализационной плазмиды. Для нормализации используют плазмиду pRL-TK (Promega), содержащую другой репортерный ген - люциферазу Renilla reniformis, под контролем промотора тимидинкиназы вируса простого герпеса. Вектор pRL-TK обеспечивает постоянный уровень экспрессии люциферазы Renilla в различных типах человеческих клеточных линий. Обе люциферазные активности измеряют только для экспериментов с эффективностью трансфекций, лежащей в диапазоне ~50-85%. Эффективность трансфекций измеряют при котрансфекции с вектором pTurbo-GFP (Evrogen), при измерении флуоресценции зеленого флуоресцентного белка. Через 24 часа после трансфекций, клетки лизируют и измеряют активности люцифераз светлячка и Renilla с помощью Dual-Luciferase Reporter Assay System (Promega) на люминометре «GENios Pro» (Tecan). Для минимизации значения ошибки полученные значения для люциферазы светлячка нормализуют на значения люциферазы Renilla. Каждый эксперимент проводят как минимум в четырех повторностях.
с) Результаты.
В результате было установлено, что из 12 видов клеточных культур исследованный промотор обладает промоторной активностью лишь в ГК. В ГК его промоторная сила в 2-2,5 раза превосходит силу промотора SV40. Тканеспецифическая экспрессия люциферазы может быть полезна при сокультивировании клеток различного типа для маркировки ГК, а также при изготовлении стабильно трансфицированных клеточных линий и отработке механизмов их направленной дифференцировки для нужд клеточной биологии или тканевой инженерии.
Пример 2. Использование промотора для тканеспецифической экспрессии гена рекомбинантной цитозиндезаминазы в ГК
а) клонирование гена рекомбинантной цитозиндезаминазы под контроль исследуемого промотора.
Бифункциональный ген рекомбинантной цитозиндезаминазы (RCD) является геном фермента метаболизма нуклеиновых кислот, эффективно используемым при суицидальной терапии опухолей. В присутствии в среде нетоксичного специфического субстрата белкового продукта этого гена - 5-фторцитозина - под действием фермента тот превращается в набор высокотоксичных для клетки продуктов. Благодаря способности токсических метаболитов выходить из клетки и проникать в соседние клетки, оказывается воздействие не только на клетки, получившие и экспрессирующие RCD, но и на соседние клетки, что значительно повышает терапевтическую ценность гена. Ген RCD, ранее в работе (Graepler, F., Lemken, M.L., Wybranietz, W.A., Schmidt, U., Smimow, I., Gross, C.D., Spiegel, M., Schenk, A., Graf, H., Lauer, U.A., Vonthein, R., Gregor, M., Armeanu, S., Bitzer, M., and Lauer, U.M. (2005). Bifunctional chimeric SuperCD suicide gene -YCD: YUPRT fusion is highly effective in a rat hepatoma model. World J Gastroenterol 11, 6910-9) названный "SuperCD suicide fusion gene", клонируют согласно экспериментальному протоколу, опубликованному в этой работе. Ген RCD ставят под контроль исследуемого промотора в вектор согласно пункту а) из примера 1 с использованием рестриктных сайтов ферментов NotI-SalI. Аналогично ген клонируют под контроль цитомегаловирусного промотора CMV и в вектор pGL3 basic (Promega), не несущий никакого промотора, с использованием рестриктных сайтов HindIII и NotI. Идентичность гена RCD ожидаемой последовательности во всех конструкциях подтверждают полным прямым секвенированием плазмидных векторов.
b) тестирование полученных векторов с геном RCD на клеточных линиях.
Проводят серии транзиентных трансфекций с использованием трансфицирующего реагента Унифектин 2000 (Русбиолинк). Клетки исследуемых культур (в этом примере - Tera1 (недифференцированный зародышевый рак яичка) и HEK 293 (эмбриональный рак почки) высаживают на 6-луночные планшеты. Экспрессию RCD подтверждают Вестерн-блот анализом с поликлональными овечьими антителами против фрагмента RCD (Abeam) через 24 часа после трансфекций. Функциональное тестирование проводят следующим образом: клетки котрансфецируют смесью в пропорции 10:1 из вектора, содержащего RCD, и вектора pTurbo-GFP (Evrogen). pTurbo-GFP служит нормализационным вектором для оценки эффективности трансфекций. Для расчетов берут только результаты экспериментов с эффективностью трансфекций в диапазоне 65-80%. Через 12 часов после трансфекций, к клеткам добавляют среду, содержащую 500µМ 5-фторцитозин (5FC). Жизнеспособность клеток анализировали через 24 часа после добавления среды с 5FC. Каждый эксперимент повторяли в четырех повторностях для теста с использованием пропидиум иодида (PI) и в трех повторностях - для теста на аннексии V (Annexin V test). Результаты PI - теста анализируют на проточном цитофлуориметре согласно стандартному протоколу (например, как описано в работе (Kholodenko, R., Kholodenko, I., Sorokin, V., Tolmazova, A., Sazonova, O., and Buzdin, A. (2007). Anti-apoptotic effect ofretinoic acid on retinal progenitor cells mediated by a protein kinase A-dependent mechanism. Cell Res 17, 151-62). Тест на аннексии V и подсчет мертвых и апоптотических клеток проводят с использованием набора Annexin V kit (Caltag Laboratories) согласно рекомендациям производителя, при помощи проточного цитофлуориметра Coulter EPICS XL (Beckman Coulter).
c) Результаты.
Показано, что исследованный промотор на высоком уровне (сравнимом с таковым для промотора CMV) обуславает экспрессию гена RCD только в ГК, тогда как в контрольной клеточной линии HEK 293 продукт RCD под его контролем не нарабатывается. В ГК его промоторная сила составляет около 85-90% силы промотора CMV. Клетки, экспрессирующие RCD, чувствительны к 5FC и отправляются в апоптоз, в отличие от большинства клеток, не экспрессирующих RCD (Табл. 1). Пример показывает возможность использования промотора для направленной терапии опухолей ГК, таких как семинома. Терапевтическая конструкция, которая может включать RCD или любой другой ген, активна только в ГК (например, в клетках герминального рака), но безвредна для других тканей.
Пример 3. Использование промотора для тканеспецифической стабильной трансфекции ГК
a) Клонирование гена транспозазы Sleeping Beauty под контроль исследуемого промотора.
Из вектора на основе плазмиды pGL3 basic по пункту а) примера 1, содержащего ген люциферазы светлячка под контролем исследуемого промотора, при помощи эндонуклеаз рестрикции BglII u XbaI ген люциферазы заменяют на ген транспозазы ДНК-транспозона Sleeping Beauty, вариант гена транспозаы SBlOOXva плазмидного вектора pCMV-SBlOOX (Mates, L., Chuah, M.K., Belay, E., Jerchow, В., Manoj, N., Acosta-Sanchez, A., Grzela, D.P., Schmitt, A., Becker, K., Matrai, J., Ma, L., Samara-Kuko, E., Gysemans, C., Pryputniewicz, D., Miskey, C., Fletcher, В., Vandendriessche, Т., Ivies, Z., and Izsvak, Z. (2009). Molecular evolution of a novel hyperactive Sleeping Beauty transposase enables robust stable gene transfer in vertebrates. Nat Genet 41, 753-61).
Транспозаза высокоэффективно осуществляет встройку в геном фрагментов ДНК различной длины, ограниченных опознаваемыми ей особыми последовательностями - так называемыми инвертированными концевыми повторами (англ. ITR, inverted terminal repeats). Кассета, предназначенная для встройки в геном и ограниченная ITR, доставляется в клетку в составе плазмидного вектора. При одновременной доставке вектора и осуществляющейся в клетке экспрессии транспозазы, кассета вырезается из вектора и встраивается в произвольное место в геноме клетки-хозяина. Таким образом, высокоэффективно осуществляется стабильная трансфекция клеточных культур, а также изготавление трансгенных животных.
b) Получение стабильно трансфицированных линий ГК.
Клетки линий, относящихся к ГК: Tera-1 u EP2102, а также линии HEK293 (контрольные клетки), высаживают на 6-луночные пластиковые культуральные планшеты, и растят до достижения 70-100% уровня конфлюентности. Затем клетки трансфицируют набором плазмид при помощи трансфицирующих реагентов Унифектин 2000 (Русбиолинк) и FuGENE (Roche). Используют следующие векторы: pTIB/puro, включающий ограниченный ITR ген устойчивости к антибиотику пуромицину под контролем промотора SV40; pCMV-SB100X, содержащий ген SB100X под контролем промотора CMV; pNo-SB100X, не содеражащий промотора перед геном транспозазы; pMNUS-SB100X, содержащий ген SB100X под контролем исследуемого промотора; pTurboGFP (Evrogen), включающий ген GFP под контролем промотора CMV. Эффективность трансфекции оценивают по флуоресценции GFP. Используют следующие комбинации векторов: а) только pT2B/puro, b) pT2B/puro+no-SB100X, с) pT2B/puro+CMV-SB100X, d) pT2B/puro+mNUS-SB100X. После трансфекции, клетки инкубируют при 37С, 5% CO2, в течение 48 часов. Клетки отмывают от среды и пересаживают на 10 см чашки Петри для пуромициновой селекции (~7 дней). В каждую чашку добавляют 10 ml среды с пуромицином. По окончании периода селекции, выжившие клетки формируют колонии диаметром 2-3 мм каждая. Колонии окрашивают после фиксации в 10% формальдегиде в PBS и инкубации в течение 20 минут при комнатной температуре под тягой. Клетки дважды отмывают PBS и добавляют к каждой чашке 5 мл окрашивающего раствора (0,5% метиленовый синий в PBS), затем инкубируют в течение 30 минут. Краситель удаляют, чашки промывают и высушивают. Эффективность образования стабильно трансфицированных колоний считают как отношение числа колоний, образованных в присутствии транспозазы, к числу колоний, сформированных без транспозазы благодаря случайной вставке в геном вектора с кассетой устойчивости к пуромицину.
с) Результаты.
Судя по эффективности образования стабильно трансфицированных колоний (Фиг.5), установлено, что исследуемый промотор направляет экспрессию гена SB100X только в ГК, но не в контрольных клетках. Сила промотора сравнима с промотором CMV. Таким образом, данный пример наглядно демонстрирует, что исследуемый промотор может быть использован для эффективной селективной стабильной трансфекции ГК любыми генетическими кассетами.
Пример 4. Получение трансгенных животных, экспрессирующих ген флуоресцентного белка в ГК и соответствующих тканях и органах
Согласно методике, подробно описанной в статье (Zaitseva, I., Zaitsev, S., Alenina, N.. Bader, M., and Krivokharchenko, A. (2007). Dynamics of DNA-demethylation in early mouse and rat embryos developed in vivo and in vitro. Mol Reprod Dev 74, 1255-61), получают трансгенные линии мышей BALB/C. При этом мышам в ооциты вводят плазмидную конструкция по пункту а) из примера 1, содержащую под контролем исследуемого промотора ген флуоресцентного белка Ds-red (Clontech, США) вместо гена люциферазы светлячка. Мыши, в геном которых произошла вставка, определяют из первого помета в ходе ПЦР-анализа геномной ДНК, выделенной из мышиных хвостов, по появлению новых генетических маркеров. В общей сложности было получено три новых трансгенных линии мышей. Затем для животных, гомо- и гетерозиготных по геномной вставке вышеописанной конструкции, проводят микроскопическое исследование гистологических срезов. Во всех случаях для самцов в яичках наблюдалась флуоресценция, характерная для белка Ds-red, тогда как в других органах сопоставимых уровней флуоресценции не отмечалось. У самок отмечалась более слабая, нежели у самцов в яичках, флуоресценция в области яичников, на фоне отсутствия флуоресценции в других органах.
Пример доказывает применимость настоящего промотора для создания трансгенных животных, обладающих характерными профилями тканеспецифической экспрессии генов в ГК. Кроме того, пример показывает возможность использования промотора для генной терапии, в части отсутствия побочных эффектов для иных, нежели целевые, тканей и органов.
Промотор для тканеспецифической экспрессии генов в герминальных тканях млекопитающих, состоящий из последовательности длиной 3574 пары нуклеотидов, расположенной выше точки начала транскрипции гена человека NDUFV1, с удаленной последовательностью протяженностью 91 п.о., расположенной непосредственно выше точки начала транскрипции этого гена.