Способ определения биоактивности почв, грунтов, вод, отходов, препаратов на основе гуминовых веществ
Иллюстрации
Показать всеИзобретение относится к области биохимии. Предложен способ определения биоактивности почв, грунтов, вод, отходов, препаратов на основе гуминовых веществ. Для этого семена предварительно замачивают в течение суток в растворе исследуемого вещества. После чего семена проращивают при 25°С в течение 3-х дней на субстрате, размещенном в вертикально установленном прозрачном пластиковом контейнере. Контейнер представляет собой основу и крышку прямоугольной формы, одинаковых по размеру, установленных параллельно и соединенных между собой по всему периметру с помощью креплений типа «кнопка». При этом в контейнере предусмотрена возможность установления съемной центральной горизонтальной перегородки для размещения субстрата. Перед проращиванием субстрат увлажняют, на него укладывают фильтр, на котором размещают семена в один ряд вдоль линии центральной горизонтальной перегородки на расстоянии 1 см от нее. После проращивания у проростков определяют длину корней по отношению к контролю. При снижении длины корней в опытных образцах по сравнению с контрольными на 20% или более делают заключение о токсичном эффекте исследуемого вещества, при увеличении длины корней по сравнению с контролем - о стимулирующем эффекте, а в остальных случаях делают вывод об отсутствии биоактивности или слабой токсичности исследуемого вещества. Способ позволяет проводить серийные исследования, отличается простотой и экспрессностью, экспонирование семян осуществляется в короткий срок и при определении длины корешков исключается их механическое повреждение. 3 ил., 1 табл., 1 пр.
Реферат
Изобретение относится к области биотехнологии, в частности к способам биотестирования и оценки токсичности или биоактивности различных объектов и материалов с помощью биообъектов.
В условиях роста техногенной нагрузки на окружающую среду все более актуальными становятся вопросы оценки ее экологического благополучия. Появление новых поллютантов, а также синтез в гетерогенных условиях среды специфичных соединений, способных обладать существенно большим токсичным потенциалом, приводит к тому, что количественные показатели загрязнения, такие как ПДК, ПДУ, не могут охватить всего многообразия поллютантов, дать корректную оценку экологического благополучия исследуемых объектов. Кроме того, даже нетоксичные соединения при комбинированном действии могут вызывать значительный токсический эффект. В связи с этим в настоящее время растет интерес к биотест-системам, которые способны интегрально и оперативно дать токсикологическую характеристику природных и техногенных сред.
Биотестирование считается эффективным методом оценки потенциальной опасности химического, физического или биологического воздействия на природные среды, в том числе почву. Принцип метода биотестирования в широком смысле основан на чувствительности живых организмов к экзогенному воздействию. Суть метода заключается в определении действия испытуемых веществ на специально выбранные организмы в стандартных условиях с регистрацией различных поведенческих, физиологических или биохимических тест-реакций. Тест-реакцию (или тест-функцию) определяют как одну из закономерно возникающих ответных реакций тест-системы на воздействие комплекса внешних факторов. Количественным выражением тест-реакции является тест-параметр. Критерием токсичности служит значение тест-параметра или правило, на основании которого делают вывод о токсичности исследуемой пробы. В понятие «тест-система» включают пространственно ограниченную совокупность чувствительных биологических элементов (сенсоров) и исследуемой среды, в которой они находятся. Для обозначения основных элементов, составляющих тест-систему, широко применяются термины «тест-объект» и «тест-культура» (или «тест-организм»). При этом тест-объект правильно трактовать как пробу или образец, который подвергается исследованию и оказывает воздействие, вызывая тест-реакцию.
Известны различные подходы к оценке биологического воздействия токсикантов и других объектов окружающей среды на живые организмы. В качестве тест-объектов (тест-организмов) используются различные животные, растения, микроорганизмы (например дафнии, гидробионты, водоросли, микроорганизмы).
Для этой же цели применяются способы фитотестирования как наиболее экспрессные и экономичные.
Фитотестирование широко используется не только как способ токсикологической оценки сред, например почв и вод, но и как весьма распространенный прием оценки токсичности или биоактивности различных материалов, химикатов, промышленных отходов. Особую востребованность фитотесты, наряду с другими биотестами, получили в новой сфере - интенсивно развивающейся технологии для оценки биобезопасности наноматериалов (Lin D. Phytotoxicity of nanoparticles: inhibition of seed germination and root growth // Environmental Pollutants, 2007, Vol.150, Iss.2, p.243-250).
Известен способ комплексного биотестирования воды, почвы, биологически активных веществ в фитотестах, который предусматривает выявление цитогенетических, генетических структурно-метаболических и морфофизиологических нарушений в фитотестах у Allium сера и Phaseolus vulgaris (RU 2322669, 2007).
Данный способ является сложным и трудоемким и как экспресс-методика не воспроизводится.
Известен также способ определения чувствительности растений к неблагоприятным факторам среды, в частности почвам, содержащим ионы алюминия, основанный на том, что семена растений проращивают в растворах с разной концентрацией хлорида алюминия (до 10-4 М). Определяют способность генотипов сортов растений активировать рост колеоптиля в ответ на присутствие низких концентраций ионов алюминия. Оценивают чувствительность сортов растений для определения наиболее адаптированных из них к росту на почвах, содержащих ионы алюминия. Фактически способ осуществляют следующим образом: семена помещают на полоску фильтровальной бумаги (10 см × 30 см), располагая их по верхней части широкой стороны бумаги, скручивают бумагу в виде рулона и помещают в стаканчики с тестовыми растворами. Растворы готовят на основе сульфата кальция (10-4 М). Проростки выращивают 7-10 дней, после чего измеряют длину вегетативной части (колеоптиля). Определение чувствительности к ионам алюминия проводят на основании степени интенсификации ростовых процессов, выраженных в увеличении линейных размеров колеоптиля.
Данный способ позволяет оценить чувствительность растений к загрязнению почвы ионами алюминия, но он недостаточно удобен и не обеспечивает стабильной воспроизводимости результатов. Способ не может использоваться в полевых условиях как экспресс-методика.
Существующая в настоящее время методика (MP 2.1.7.2297-07 «Обоснование класса опасности отходов…») подразумевают проращивание семян в чашках Петри. При этом корешки в процессе роста сворачиваются, так как лежат на горизонтальной плоскости, в которую упираются. Вследствие этого рост корня вертикально вниз невозможен (Рис.1). В итоге корешки переплетаются между собой и скручиваются. По окончании опыта каждый корешок требуется аккуратно развернуть вручную и измерить с помощью линейки. Такая процедура очень трудоемка и существенно сказывается на качестве результатов.
Существует также способ выращивания семян в сосудах с грунтом - в этом случае корни растут вертикально, но их требуется отмывать от земли, способ требует длительного проращивания (от 1 месяца) и трудоемкой постановки опыта (Рис.2).
Задачей изобретения является создание способа определения биоактивности почв, грунтов, вод, отходов, препаратов гуминовых веществ, который позволял бы качественно, быстро и относительно просто осуществить фитотестирование, а также оценить его результаты.
Техническим результатом заявленного способа является обеспечение его упрощения, экспрессность, снижение времени тестирования и обеспечение высокой точности результатов. Ценным преимуществом заявляемого способа является расширение сферы его применения в отношении тестируемых сред материалов и препаратов, а также возможность проведения серийных исследований. Упрощение способа определения биоактивности достигается за счет использования прозрачных пластиковых контейнеров, в которых семена развиваются в двухмерном пространстве. В данном случае не требуется разворачивания скрученных корешков, не происходит их механических повреждений, разрывов, что сказывается на качестве результатов. Экспрессность обеспечивается 3-х дневным сроком экспозиции семян, что значительно быстрее существующих на данный момент методик. По окончании эксперимента возможно использование автоматического способа сбора данных с помощью компьютерной обработки цифровых изображений (фотоснимков) проростков, что дает высокую точность результатов. Возможно, также измерение корешков и линейкой прямо в контейнерах через прозрачную крышку, причем в этом случае корни не деформируются и не повреждаются, что имеет место при их извлечении из чашек Петри или других сосудов.
Предлагается способ определения биоактивности почв, грунтов, вод, отходов, препаратов на основе гуминовых веществ, который предусматривает проращивание семян растений как при непосредственном контакте с исследуемыми субстратами (на образцах почвы, грунта и т.п.), так и в присутствии исследуемого вещества путем приготовления водной вытяжки/суспензии из тестируемого объекта и пропитывания ею бумажной основы из фильтровальной бумаги, выступающей субстратом для роста растений. Далее для обозначения всех типов тестируемых веществ (как твердых, так и водных вытяжек или суспензий) будем использовать термин «субстрат». В случае проращивания семян непосредственно на твердом субстрате последний предварительно увлажняется дистиллированной водой в количестве, необходимом для достижения наименьшей полевой влагоемкости. Экспонирование (проращивание) семян осуществляется в течение 3-х дней при температуре 25°С.
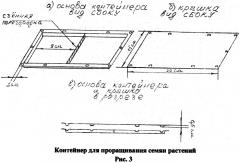
Проращивание семян проводят в вертикально установленном прозрачном пластиковом контейнере, который представляет собой основу и крышку прямоугольной формы одинаковые по размеру, установленные параллельно и соединенные между собой по всему периметру с помощью креплений типа «кнопка», при этом в контейнере предусмотрена возможность установления съемной центральной горизонтальной перегородки для фиксации размещенного в одной части контейнера сыпучего субстрата (почвы, грунта и т.п.). Чертеж используемого контейнера представлен на рисунке 3. Основу контейнера представляет емкость (определенного рода бокс) для размещения субстрата и поддержания роста растений. Она плотно закрывается плоской крышкой, препятствующей испарению влаги из контейнера. Соотношение длины к ширине у стенок контейнера - не более 1,5. После проращивания у проростков определяют длину корней и при снижении их длины в опытных образцах по сравнению с контрольными на 20% или более делают заключение о токсичном эффекте исследуемого вещества, при увеличении длины корней по сравнению с контролем - о стимулирующем эффекте, а в остальных случаях делают вывод об отсутствии биоактивности или слабой токсичности исследуемого вещества. В общем виде последовательность основных этапов постановки эксперимента по оценке биоактивности проб изложена ниже (Схема 1).
1. Пустой контейнер («основа») размещается на горизонтальной поверхности (например, на рабочем столе).
2. В один из отсеков основной части контейнера с помощью пинцета укладывается фильтровальная бумага (подложка), пропитанная водным раствором препарата (или водной вытяжкой из твердых образцов, которая плотно прилипает к основе контейнера и фиксируется между стенками контейнера.
3. Семена растений, предварительно замоченные в течение суток в водных растворах или водных вытяжках из тестируемых образцов, раскладываются на расстоянии 0.5-1 см от перегородки. Более чем на 1 см отступать от перегородки не рекомендуется, поскольку при дальнейшей вэкспозиции контейнера в вертикальном положении растущие вниз корни могут достигать нижней границы контейнера. При размещении семян на расстоянии более 1 см от перегородки нижняя часть корешка может начать загибаться, что приведет к необходимости его ручного выпрямления и усложнит эксперимент. В качестве тест-культуры обычно используются семена горчицы белой (Sinapis alba L.).
4. Контейнер с семенами на подложке закрывается «крышкой», которая фиксируется при помощи замков-кнопок, и устанавливается вертикально. Семена проращиваются при 25°С в течение 3-х суток.
5. По истечении трех суток у проростков семян измеряют длину корешков (с помощью линейки либо автоматически путем переноса на компьютер цифровых изображений контейнеров с проростками). Измерения проводятся от точки начала роста корня до его нижней границы.
Точка начала роста корня обычно хорошо заметна - она чуть толще самого корешка и стебля и отличается от них по цвету.
Схема 1. Основные этапы определения биоактивности
Пример
В примере рассматриваются особенности определения биоактивности различных форм тестируемых веществ - как в твердом виде, так и в виде водных вытяжек/суспензий.
А) Твердые субстраты (на примере почвы)
В качестве контроля используется эталонный субстрат (эталонная незагрязненная почва), выбор которого определяется целями исследований, либо подложка, пропитанная дистиллированной водой. Опыт проводят в 3-х повторностях (готовят 3 контейнера с контролем и 3 контейнера с тестируемым объектом).
1. Подготовка субстрата
Тестирование проводится на объектах, насыщенных влагой до уровня наименьшей полевой влагоемкости. Берут около 1 дм3 тестируемой почвы и просеивают ее через сито диметром 2 мм, чтобы избежать попадания грубого материала. В градуированный лабораторный стакан кладут 90 см3 почвы и добавляют 50 мл дистиллированной воды. Почву размешивают с водой до тех пор, пока она не пропитается жидкостью, и затем отстаивают, после чего лишняя жидкость выступает на поверхности почвы. В зависимости от гранулометрического состава процесс влагонасыщения может занять от нескольких минут (для песчаных почв) до нескольких часов (для глинистых почв). Рассчитывают объем воды, необходимый для водонасыщения. Данный объем равен объему воды, добавленной в почву, за вычетом объема воды, образовавшейся на ее поверхности после отстаивания.
Лабораторным стаканом отмеряют 90 мл просеянной почвы и переносят ее в нижнее отделение контейнера. Почву увлажняют путем добавления дистиллированной воды в объеме, необходимом для достижения уровня наименьшей полевой влагоемкости. Используют шпатель, чтобы разровнять увлажненную почву в нижнем отделении контейнера.
2. Размещение семян
10 семян одного вида растения, предварительно замоченных в течение суток в растворе, содержащем исследуемое вещество (вытяжка), размещают по поверхности почвы в один ряд, на равном расстоянии друг от друга. Семена раскладывают примерно на расстоянии 1 см от центральной перегородки в контейнере. Далее разделительную перегородку вынимают, контейнер накрывают крышкой и защелкивают кнопки.
На левый верхний угол основы контейнера приклеивают наклейку с указанием варианта опыта (тип почвы, тип семян, номер повторности),
3. Инкубация семян
6 заполненных контейнеров с семенами (3 с тестируемой почвой и 3 - с контрольной) размещают вертикально. Контейнеры ставят в инкубатор и экспонируют при 25°С в течение 3-х суток.
4. Анализ результатов
Подсчет количества проросших семян
Подсчитывают количество проросших семян в контрольных экспериментах. Процент всхожести семян должен составлять не менее 80%, иначе семена характеризуются плохим качеством и их использование не достоверно.
Измерение длин корней проросших семян.
Длина корешка отсчитывается от точки начала роста корня до его окончания, измеряется с помощью линейки. Также возможна цифровая обработка изображений. По полученным данным рассчитывают среднюю длину корней для контрольной и тестируемой почвы.
Процент торможения или стимуляции роста корней рассчитывают по формуле:
где
А - средняя длина корней в контрольной почве
В - средняя длина корней в тестируемой почве
Пример расчета приведен в Таблице 1.
Б) Водные вытяжки/суспензии
В качестве контроля используют подложку, пропитанную дистиллированной водой. Опыт проводят в 3-х повторностях (готовят 3 контейнера с контролем и 3 контейнера с тестируемым объектом).
1. Подготовка субстрата
Из исследуемых тест-объектов готовят водные вытяжки/суспензии (в соответствии с ГОСТ). Далее фильтровальную бумагу размером 15×9 см (половина площади контейнера) опускают с помощью пинцета в подготовленный раствор/суспензию, вынимают, дожидаются стекания гравитационной воды в течение нескольких секунд и размещают в один из отсеков контейнера.
2. Размещение семян
Семена размещают на расстоянии 1 см от верхнего края бумажной основы (верхний край соответствует середине контейнера)
Последующие операции (2-4) проводятся аналогично описанному примеру для твердых субстратов (А).
| ТАБЛИЦА 1 | |||||||||||||||
| Пример обработки результатов при определении биоактивности | |||||||||||||||
| Образец | Контроль, незагрязненная почваДлина корня, мм | ||||||||||||||
| Номер корня | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | Среднее внутри повторности, мм | Итоговое среднее, мм | Стандартное отклонение между повторностями, мм | Биоактивность, % | Токсичность |
| Повтор-ность 1 | 70 | 72 | 43 | 48 | 52 | 35 | 64 | 60 | 66 | 57 | 56 | 3 | |||
| Повтор-ность 2 | 78 | 75 | 52 | 63 | 45 | 60 | 44 | 45 | 58 | 56 | 58 | ||||
| Повторность 3 | 32 | 65 | 71 | 58 | 47 | 65 | 50 | 36 | 62 | 37 | 52 | ||||
| Образец | Почва, загрязненная фосфогипсом в концентрации 1,1% | ||||||||||||||
| Длина корня, мм | |||||||||||||||
| Номер корня | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | Среднее внутри повторно-сти, мм | Итоговое среднее, мм | Стандартное отклонение между повторностями, мм | Биоактив-ность, % | Токсич-ность |
| Повтор-ность 1 | 70 | 52 | 45 | 35 | 54 | 48 | 49 | 65 | 52 | 54 | 4 | -3,2 | нетоксично | ||
| Повтор-ность 2 | 47 | 55 | 69 | 60 | 70 | 60 | 65 | 37 | 58 | ||||||
| Повторность 3 | 40 | 38 | 42 | 39 | 39 | 80 | 73 | 29 | 74 | 57 | 51 | ||||
| Образец | Почва, загрязненная фосфогипсом в концентрации 3,3% | ||||||||||||||
| Длина корня, мм | |||||||||||||||
| Номер корня | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | Среднее внутри повторно-сти, мм | Итоговое среднее, мм | Стандартное отклонение между повторностями, мм | Биоактив-ность, % | Токсич-ность |
| Повторность 1 | 75 | 57 | 42 | 35 | 43 | 40 | 37 | 35 | 48 | 47 | 46 | 45 | 1 | -18,7 | нетоксично |
| Повторность 2 | 30 | 54 | 55 | 33 | 44 | 35 | 45 | 44 | 61 | 45 | |||||
| Повторность 3 | 60 | 51 | 41 | 37 | 36 | 42 | 52 | 17 | 68 | 45 | |||||
| Образец | Почва, загрязненная фосфогипсом в концентрации 7,5% | ||||||||||||||
| Длина корня, мм | |||||||||||||||
| Номер корня | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | Среднее внутри повтор-ности, мм | Итоговое среднее, мм | Стандартное отклонение между повторностями, мм | Биоактив-ность, % | Токсич-ность |
| Повтор-ность 1 | 35 | 32 | 2 | 30 | 27 | 27 | 35 | 27 | 27 | 2 | -50,7 | токсично | |||
| Повтор-ность 2 | 43 | 27 | 31 | 28 | 30 | 19 | 23 | 24 | 38 | 32 | 30 | ||||
| Повтор-ность 3 | 45 | 18 | 31 | 30 | 14 | 28 | 20 | 20 | 26 |
Способ определения биоактивности почвы, грунта, воды, отходов, препаратов на основе гуминовых веществ, предусматривающий проращивание семян растений на исследуемых субстратах или в присутствии исследуемого вещества, определение тест-реакции проращиваемых семян и оценку результатов проращивания, предусматривающий то, что семена предварительно замачивают в течение суток в растворе исследуемого вещества, после чего семена проращивают при 25°С в течение 3 дней на субстрате, размещенном в вертикально установленном прозрачном пластиковом контейнере, представляющем собой основу и крышку прямоугольной формы, одинаковых по размеру, установленных параллельно и соединенных между собой по всему периметру с помощью креплений типа «кнопка», при этом в контейнере предусмотрена возможность установления съемной центральной горизонтальной перегородки для размещения субстрата, перед проращиванием субстрат увлажняют, на него укладывают фильтр, на котором размещают семена в один ряд вдоль линии центральной горизонтальной перегородки на расстоянии 1 см от нее, затем после проращивания у проростков определяют длину корней по отношению к контролю, при снижении длины корней в опытных образцах по сравнению с контрольными на 20% или более делают заключение о токсичном эффекте исследуемого вещества, при увеличении длины корней по сравнению с контролем - о стимулирующем эффекте, а в остальных случаях делают вывод об отсутствии биоактивности или слабой токсичности исследуемого вещества.