Наночастицы, включающие циклодекстрин и биологически активную молекулу, и их применение
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и представляет собой наночастицы, включающие биоразлагаемый полимер, циклодекстрин или его производное и биологически активную молекулу, где указанным биоразлагаемым полимером является сополимер метилвинилового эфира и малеинового ангидрида (PVM/MA); и указанной биологически активной молекулой является вещество, представляющее собой субстрат фермента Р-гликопротеина. Изобретение обеспечивает повышение при пероральном введении биодоступности лекарственных препаратов с липофильной природой и/или тех, которые является субстратом Р-гликопротеина. 3 н. и 6 з.п. ф-лы, 8 ил., 9 табл., 7 пр.
Реферат
Область изобретения
Изобретение относится к наночастицам с биоадгезивными характеристиками, включающим биоразлагаемый полимер, циклодекстрин или его производное и биологически активную молекулу. Изобретение также относится к способу их получения, к композициям, содержащим указанные наночастицы, и их применениям.
Предшествующий уровень техники изобретения
В последние несколько лет было разработано применение биоразлагаемых полимерных наночастиц в качестве носителей для введения лекарственных средств, особенно пероральным путем. Наночастицы обычно определяют как коллоидные системы типа твердых частиц с размером менее чем один микрометр, образованные природными или синтетическими полимерами. В зависимости от способа, которому следуют при их получении, могут быть получены два типа структур: наносферы или нанокапсулы. Наносферы имеют структуру типа полимерной матрицы, в которой диспергирован активный ингредиент, тогда как нанокапсулы имеют сердцевину, содержащую активный ингредиент, окруженную оболочкой, такой как полимерная оболочка. Из-за высокоспецифичной поверхности таких систем активный ингредиент также может быть адсорбирован на поверхности системы наночастиц.
Пероральный путь является наиболее популярным и привлекательным путем для введения медицинских продуктов. Применение такого пути связано с существенным увеличением приемлемости препарата пациентом и с более низкими медицинскими затратами. Однако существенное количество лекарственных средств имеет очень низкую эффективность при введении посредством такого пути. Такой феномен может быть опосредован одним или несколькими следующими факторами, которые влияют на пероральную биодоступность лекарственного средства: (i) низкая протекающая способность активной молекулы для пересечения слизистых оболочек (обычно ассоциированная с гидрофильными лекарственными средствами), (ii) низкая стабильность в желудочно-кишечной среде (присутствие экстремальных значений рН, ферментов и др.), (iii) неполное высвобождение лекарственного средства из дозированной формы, (iv) низкая растворимость активного ингредиента в желудочно-кишечном окружении (ассоциированная с гидрофобными лекарственными средствами) и (v) пресистемный метаболизм.
В ряде случаев системы наночастиц позволяют существенно увеличить биодоступность биологически активной молекулы и, следовательно, допускают новые методики введения. Улучшение биодоступности, полученное с использованием таких носителей, может быть объяснено способностью полимерных наночастиц развивать биоадгезивные взаимодействия со слизистой оболочкой желудочно-кишечного тракта. Следовательно, когда суспензию наночастиц вводит перорально, такие носители могут взаимодействовать и развивать адгезивные взаимодействия с несколькими компонентами слизистой оболочки. В зависимости от определенных физико-химических параметров (таких как природа полимера, размер, заряд поверхности или присутствие определенных оболочек или лигандов в носителе) биоадгезивные характеристики наночастиц могут варьироваться и позволяют в определенных случаях достичь поверхности энтероцитов и, возможно, развивать биоадгезивные взаимодействия во множестве специфических участков желудочно-кишечного тракта. Все такие феномены приводят к (i) увеличению времени прохождения дозированной формы в тесном контакте с поверхностью слизистой оболочки или к (ii) специфическому расположению носителя (с лекарственным веществом) в определенной области. Когда наночастицы прилипают к слизистой оболочке, они могут запускать абсорбцию несомого лекарственного средства и его доступ в большой круг кровообращения посредством нескольких механизмов.
Иллюстративные примеры лекарственных средств, пероральная биодоступность которых увеличивается посредством их инкапсулирования или ассоциации с наночастицами, включают кальцитонин лосося, фуросемид, аварол, дикумарол, нифедипин, фторпиримидины, плазмиды и др.
Гомо- и сополимеры молочной и гликолевой кислот (PLGA) являются особенно важными в качестве биоразлагаемых полимеров для производства систем частиц, так как они имеют хорошую тканевую совместимость, являются нетоксичными, используются в течение многих лет в качестве реабсорбируемых шовных материалов. Такие (со)полимеры являются растворимыми в органических растворителях, таких как хлороформ, дихлорметан, ацетон и этилацетат, и нерастворимыми в водной среде; однако они могут захватывать воду и в большей или меньшей степени разбухать в зависимости от их молекулярной массы и от их состава. Среди недостатков этих полимеров необходимо отметить, что PLGA могут быть более гидрофобными по сравнению с множеством антигенов, которые они несут. Более того, гидратирование и дегидратирование PLGA являются обязательными требованиями для высвобождения антигена в рамках фазы разрушения. Такое разрушение способствует скорее кислому микроокружению из-за накопления продуктов деградации полимеров, молочной и гликолевой кислот; рН может падать до порядка 2-3. В таких состояниях высвобождаемые белки подвергаются гидролизу и агрегации в подкисленной среде, и множество антигенов теряют свою антигенную способность. Наконец, их высокая стоимость может ограничивать их применение и способствует поиску других менее дорогих материалов.
В качестве альтернативы полиэфирам было доказано, что наночастицы, полученные с другими полимерами, подходят для перорального введения лекарственных средств. Одним из наиболее используемых полимеров является хитозан. Хитозан является полимером, сходным с целлюлозой, образующимся в результате деацетилирования хитина, основного компонента экзоскелета ракообразных. Хитозан может быть введен в наночастицы различных размеров, в которых заключено лекарственное средство. Частицы хитозана могут увеличивать абсорбцию белка на поверхности слизистой оболочки, индуцируя транзиторное открытие плотных соединений. Более того, хитозан может обладать иммуномодулирующим эффектом, стимулируя продукцию цитокинов in vitro и улучшая естественный баланс Th2/Th3 на уровне слизистой оболочки в отсутствие антигена.
Сополимер метилвинилового эфира и малеинового ангидрида (PVM/MA) [Gantrez®] в последнее время был предложен в качестве биоразлагаемого материала для получения наночастиц (Arbos et al., J. Control. Release, 83 (2002) 321-330). Такие сополимеры PVM/MA широко используются в качестве загустителей, стабилизаторов водных растворов, зубных адгезивных компонентов, кожных пластырей и в таблетках для перорального введения. Среди основных преимуществ таких полиангидридов должна быть отмечена их низкая стоимость, их низкая пероральная токсичность и доступность функциональных групп, которые могут легко реагировать с молекулами, содержащими гидроксильные или аминогруппы (Arbos et al., J. Control. Release, 89 (2003) 19-30). Следовательно, в водной среде ангидридная группа гидролизуется, давая две карбоксильные группы, и такая реакция способствует более легкому связыванию лигандов с полимерной цепью или с поверхностью полученных наночастиц.
Циклодекстрины (CD) представляют собой группу циклических олигосахаридов, полученных ферментативным разложением крахмала. Они формируются из единиц α-1,4-глюкопиранозы, связанных друг с другом, образуя структуру типа усеченного конуса с гидрофобной внутренней полостью. CD могут содержать более чем 15 единиц α-1,4-глюкопиранозы, хотя наиболее широко распространенные содержат 6 (α-CD), 7 (β-CD) или 8 (γ-CD) единиц α-1,4-глюкопиранозы. В фармацевтических применениях наиболее широко используемыми являются β-CD и его производные, особенно 2-гидроксипропил-β-циклодекстрин (ОН-β-CD). Такой CD имеет высокую растворимость в воде, более низкую токсичность, а также более гидрофобную полость по сравнению с начальным соединением (β-CD). Комплексы, образованные посредством использования циклодекстринов, могут обеспечивать молекулу-носитель со стабильностью и увеличенной водной растворимостью, что может приводить к увеличению биодоступности такой молекулы (например, лекарственного средства) и/или снижению побочных эффектов. Более того, способность увеличивать нагрузочную способность липосом и микрочастиц описана в литературе. CD также могут модифицировать профиль высвобождения инкапсулированного лекарственного средства.
Ряд противоопухолевых средств вводят парентерально, что вызывает несколько проблем. Среди основных преимуществ, обусловленных пероральным введением противоопухолевых средств, должны быть отмечены улучшение качества жизни пациентов, а также снижение медицинских затрат. Такой путь введения допускает длительное воздействие на раковые клетки противоопухолевого средства в подходящем и непрерывном уровне концентрации, что может улучшить терапевтический индекс и снизить побочные эффекты. Однако большинство таких лекарственных средств (например, паклитаксел) имеют низкую биодоступность при пероральном введении.
Паклитаксел (Taxol®, Bristol Myers Squibb Company) - продукт, экстрагированный из дерева Taxus brevifolia, был впервые описан в 1971, и с 1993 он является наиболее используемым химиотерапевтическим средством против рака во всем мире. Паклитаксел действует на клеточном уровне, запуская полимеризацию тубулина. Микротрубочки, образующиеся в присутствии паклитаксела, следовательно, являются чрезвычайно стабильными и нефункциональными, таким образом, вызывая гибель клеток из-за динамической и функциональной неспособности микротрубочек для деления клеток. В Европе этот лекарственный препарат показан и в качестве единственного средства, и в комбинации с другой онкологической терапией для лечения рака яичника, рака молочной железы и немелкоклеточного рака легких, всех прогрессирующих и метастатических.
Основной недостаток такого лекарственного средства лежит в его плохой пероральной биодоступности из-за низкой растворимости в воде и преимущественно из-за эффекта метаболизма первого прохода. После перорального введения паклитаксел является субстратом Р-гликопротеина, а также других членов суперсемейства АВС (АТР-связывающая кассета), таких как BCPR и MRP2. Суперсемейство белковых переносчиков АВС играет центральную роль в защите организма от токсических соединений и от некоторых противораковых средств. Указанные белки (Р-гликопротеин, MRP2 и BCPR) расположены в апикальной области мембран кишечника, печени и почек, опосредуя подачу ксенобиотиков и токсинов в кишечный и желчный просвет и мочу. Более того, и Р-гликопротеин и MRP2 расположены объединенными вместе с CYP3A4, глютатион-S-трансферазой и UDP-глюкуронозилтрансферазой, которые оказывают синергическое действие в регуляции пероральной биодоступности вводимых лекарственных средств.
Из-за вышеуказанного паклитаксел в настоящее время включают в композицию для его применения в клинической практике посредством внутривенного пути в носителе, образованном Chremophor EL:этанолом (1:1). С целью предотвращения и минимизации токсических эффектов Chremophor EL для внутривенного введения и улучшения терапевтического индекса лекарственного средства в последнее время на рынке появилась новая композиция на основе инкапсулирования лекарственного средства в альбуминовых наночастицах, называемая Abraxane® (Green et al., Annals of Oncology 17: 1263-1268, 2006).
Следовательно, необходимо разрабатывать системы введения лекарственных средств, которые могут увеличивать при пероральном введении биодоступность ряда активных ингредиентов, особенно лекарственных препаратов с липофильной природой и/или тех, которые являются субстратом Р-гликопротеина (например, паклитаксел). Преимущественно указанные системы введения должны обладать биоадгезивными свойствами, должны обладать способностью включать различные количества липофильных лекарственных средств и, в идеале, должны быть способны предотвращать действие Р-гликопротеина на транспортируемое лекарственное средство. Такие цели могут быть достигнуты с помощью наночастиц, предоставляемых настоящим изобретением.
Сущность изобретения
Достаточно неожиданно в настоящее время было обнаружено, что ассоциация наночастиц биоразлагаемого полимера, такого как сополимер метилвинилового эфира и малеинового ангидрида (PVM/MA), с циклодекстринами, связанными с биологически активными молекулами, допускает получение наночастиц с физико-химическими характеристиками и характеристиками биоадгезии к слизистой оболочке желудочно-кишечного тракта, что делает их очень интересными системами в качестве транспортеров всех типов биологически активных молекул, особенно гидрофобных (липофильных) биологически активных молекул, таких как паклитаксел. Указанные наночастицы могут удлинять время нахождения в слизистой оболочке после их перорального введения. Более того, указанные наночастицы могут улучшить биодоступность биологически активных молекул, которые могут являться субстратами Р-гликопротеина. Аналогично, указанные наночастицы могут использоваться в качестве систем для введения лекарственных средств с высокой токсичностью (например, цитостатиков), так как они дают длительные и постоянные уровни биологически активной молекулы в плазме в течение периодов времени до 24 часов, что дает возможные варианты альтернативные лечению в больнице, способствуя снижению медицинских затрат на лечение такими видами лекарственных средств.
Следовательно, изобретение предлагает наночастицы со способностью связывать большие количества биологически активных молекул, особенно гидрофобной природы, для их эффективного введения через слизистые оболочки, особенно пероральным путем, из-за того факта, что они имеют подходящие биоадгезивные характеристики, обеспечивающие взаимодействие наночастиц (содержащих биологически активную молекулу) с поверхностью слизистой оболочки, они могут переносить широкий спектр биологически активных молекул, особенно липофильной природы, и, кроме этого, они могут высвобождать биологически активную молекулу, обеспечивая ее устойчивый и постоянный уровень в плазме при их введении перорально или через любые другие слизистые оболочки организма. Если транспортируемая биологически активная молекула представляет собой субстрат Р-гликопротеина, наночастицы по изобретению могут предотвращать действие этого белка на интересующую биологически активную молекулу.
Наночастицы, предлагаемые настоящим изобретением, включают биоразлагаемый полимер, циклодекстрин или его производное, и биологически активную молекулу. В частности, было обнаружено, что наночастицы, образованные сополимером поливинилметилового эфира и малеинового ангидрида и β-циклодекстрина (β-CD), 2-гидроксипропил-β-циклодекстрина (ОН-β-CD) или 6-монодезокси-6-моноамино-β-циклодекстрина (NH-β-CD) легко получать и обеспечивать превосходные характеристики биоадгезии, размера и зета-потенциала, которые делают их подходящими для введения гидрофобных биологически активных молекул (например, паклитаксела). Более того, было обнаружено, что выбор типа циклодекстрина, используемого при их получении, допускает подходящую модуляцию характеристик таких наночастиц, которые могут преимущественно использоваться в соответствии с типом переносимых биологически активных молекул и/или способом введения фармацевтической композиции. Наконец, было обнаружено, что включение паклитаксела в такие наночастицы позволяет очень существенным образом увеличить их пероральную биодоступность, минимизируя эффект Р-гликопротеина на уровне слизистой оболочки желудочно-кишечного тракта.
Следовательно, в первом аспекте, изобретение относится к наночастицам, включающим биоразлагаемый полимер, циклодекстрин или его производное и биологически активную молекулу, применимым для переноса биологически активных молекул. В определенном варианте осуществления изобретения биоразлагаемый полимер представляет собой сополимер метилвинилового эфира и малеинового ангидрида (PVM/MA). В другом определенном варианте осуществления изобретения циклодекстрин представляет собой β-CD, OH-β-CD или NH-β-CD.
В определенном варианте осуществления изобретения биологически активная молекула, присутствующая в наночастицах по изобретению, представляет собой паклитаксел. В таком случае наночастицы дают эффектное увеличение пероральной биодоступности паклитаксела, пероральное всасывание которого является фактически нулевым из-за его физико-химических характеристик (высокая липофильность) и из-за того факта, что он является субстратом Р-липопротеина, расположенного в желудочно-кишечном тракте.
В другом аспекте изобретение относится к фармацевтической композиции, содержащий указанные наночастицы.
В другом аспекте изобретение относится к способу получения указанных наночастиц.
Краткое описание чертежей
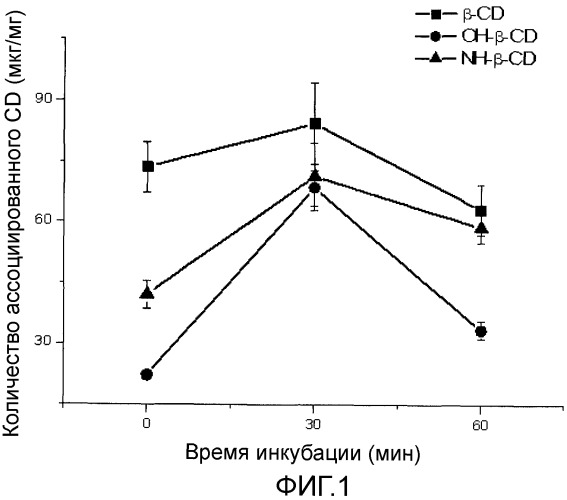
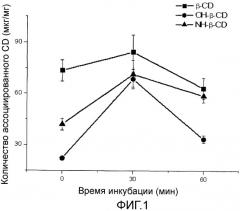
Фиг.1 представляет собой график, показывающий вариации количества циклодекстрина (CD), ассоциированного с наночастицами PMV/MA, в соответствии с типом используемого CD [β-CD: β-циклодекстрин, OH-β-CD: 2-гидроксипропил-β-циклодекстрин; NH-β-CD: 6-монодезокси-6-моноамино-β-циклодекстрин] и временем инкубации последнего с сополимером метилвинилового эфира и малеинового ангидрида (PVM/MA) (100 мг) перед получением наночастиц. Результаты показывают среднее ± стандартное отклонение (n=8).
Фиг.2 представляет собой фотографию результатов, полученных при подвергании лиофилизированного образца наночастиц, основанных на PVM/MA с β-циклодекстрином (β-CD-NP), сканированию электронной микроскопией.
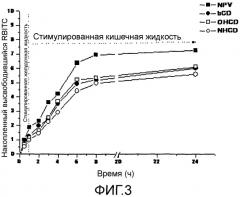
Фиг.3 представляет собой график, который показывает высвобождение RBITS из наночастиц, содержащих циклодекстрины (β-CD-NP: наночастицы на основе PVM/MA с β-CD; ОН-β-CD-NP: наночастицы на основе PVM/MA с ОН-β-CD; NH-β-CD-NP: наночастицы на основе PVM/MA с NH-β-CD) и из контрольных наночастиц (NP) после их инкубации в стимулированной желудочной среде (в течение первого часа:0-1 ч) и в стимулированной кишечной среде (1-24 ч) при 37±1ºС. Данные показывают среднее ± стандартное отклонение (n=3).
На фиг.4 показана столбчатая диаграмма, представляющая собой распределение (А) наночастиц на основе PVM/MA с гидроксипропил-β-CD (ОН-β-CD-NP); (В) наночастиц на основе PVM/MA с β-CD и (С) контрольных наночастиц (NP) в слизистой оболочке желудочно-кишечного тракта после перорального введения 10 мг наночастиц, флуоресцентно меченных RBITC. Ось Х представляет собой различные сегменты слизистой оболочки; ось y представляет собой фракцию наночастиц, прилипших к слизистой оболочке; и ось Z представляет собой время после введения.
Фиг.5 представляет собой график, показывающий кривые биоадгезии, полученные при представлении фракции наночастиц, прилипших по всему желудочно-кишечному тракту, в отношении времени. Представленные композиции представляют собой (●) ОН- β-CD-NP; (▲)β-CD-NP; и (■) контрольные NP. Значения представляют собой среднее ± стандартное отклонение (n=3).
На фиг.6 представлена группа фотографий, показывающих вид флуоресцентной микроскопии контрольных наночастиц (А) и ОН-β-CD-NP (В,С), прилипших к подвздошной кишке крыс через 2 часа после перорального введения однократной дозы 10 мг.
Фиг.7 представляет собой график, показывающий изменение количества паклитаксела (PTX), инкапсулированного в различные композиции в соответствии с типом используемого циклодекстрина и исходно добавленным количеством лекарственного средства. Результаты показывают среднее ± стандартное отклонение (n=6). PTX-NP: обычные наночастицы PVM/MA с паклитакселом; PTX-β-CD-NP: наночастицы PVM/MA и β-CD с паклитакселом; PTX-ОН-β-CD-NP: наночастицы PVM/MA и ОН-β-CD с паклитакселом; и PTX-NH-β-CD-NP: наночастицы PVM/MA и NH-β-CD с паклитакселом.
Фиг.8 представляет собой группу графиков, представляющих концентрации паклитаксела в плазме (PTX) в соответствии со временем после введения различных композиций PTX лабораторным животным. Результаты показывают среднее ± стандартное отклонение (А). Внутривенный путь, доза: 10 мг/кг. Taxol®: коммерческая композиция паклитаксела. (В) Пероральный путь, доза 10 мг/кг. Taxol®: коммерческая композиция паклитаксела; PTX-β-CD: комплекс β-CD с паклитакселом; PTX-ОН-β-CD: комплекс ОН-β-CD с паклитакселом; PTX-NH-β-CD: комплекс NH-β-CD с паклитакселом. (С) Пероральный путь, доза: 10 мг/кг. PTX-NP: обычные наночастицы PVM/MA с паклитакселом; PTX-β-CD-NP: наночастицы PVM/MA и β-CD с паклитакселом; PTX-ОН-β-CD-NP: наночастицы PVM/MA и ОН-β-CD с паклитакселом; и PTX-NH-β-CD-NP: наночастицы PVM/MA и NH-β-CD с паклитакселом; Taxol®: коммерческая композиция с паклитакселом. Значения, полученные для коммерческой композиции таксола и PTX-NP, перекрываются и указаны на оси Х (Таблица 9).
Подробное описание изобретения
Наночастицы
В одном аспекте изобретение относится к наночастицам, далее в настоящем описании наночастицам по изобретению, включающим биоразлагаемый полимер, циклодекстрин или его производное и биологически активную молекулу.
Наночастицы по изобретению имеют подходящие физико-химические характеристики, характеристики специфичности и биоадгезии к слизистой оболочке желудочно-кишечного тракта, что делает их потенциально применимыми системами для транспортировки биологически активных молекул, особенно липофильных биологически активных молекул (например, паклитаксела, и др.) и/или биологически активных молекул, которые являются субстратами Р-гликопротеина. Наночастицы по изобретению могут улучшить биодоступность биологически активных молекул в общем и, в частности, липофильных биологически активных молекул и/или биологически активных молекул, которые могут являться субстратом Р-гликопротеина. Действительно, наночастицы по изобретению могут удлинять время нахождения в слизистой оболочке после их перорального введения. Также наночастицы по изобретению могут быть использованы в качестве системы для транспортировки биологически активных молекул с высокой токсичностью, например цитостатиков, из-за того факта, что они дают устойчивые и постоянные уровни таких лекарственных препаратов в плазме в течение временных периодов до 24 часов, что позволяет создавать варианты, альтернативные лечению в больнице, приводя к снижению медицинских затрат на лечение с помощью таких видов лекарственных средств.
Как используется в настоящем описании, термин «наночастицы» относится к сферам или сходным формам со средним размером менее чем 1,0 микрометр (мкм). Наночастицы по изобретению обычно имеют средний размер частиц, составляющий между 1 и 999 нанометрами (нм), предпочтительно между 10 и 900 нм. В определенном варианте осуществления изобретения наночастицы по изобретению имеют средний размер частиц, составляющий между 100 и 400 нм.
«Средний размер» понимают как средний диаметр группы наночастиц, двигающихся совместно в водной среде. Средний размер таких систем может быть измерен стандартными методиками, известными специалистам в данной области, и которые описаны, в качестве иллюстрации, в экспериментальной части, сопровождающей описанные ниже примеры. На средний размер частиц могут влиять преимущественно количество и молекулярная масса биоразлагаемого полимера, природа и количество циклодекстрина или его производного, и природа и количество биологически активной молекулы, присутствующей в наночастицах по изобретению (обычно чем выше количество или молекулярная масса указанных компонентов, тем больше средний размер наночастиц), и некоторые параметры способа получения указанных наночастиц, такие как скорость перемешивания и др.
Биоразлагаемый полимер
Наночастицы по изобретению включают биоразлагаемый полимер. Как используется в настоящем описании, термин «биоразлагаемый» относится к полимерам, которые растворяются или разрушаются за период времени, который приемлем для желаемого применения, в данном случае in vivo терапии при воздействии на них физиологического раствора с рН, составляющем между 1 и 9, обычно между 4 и 9 при температуре, составляющей между 25°С и 40°С.
Фактически любой биоразлагаемый полимер, известный в области техники как дающий образование наночастиц, может быть использован для внедрения настоящего изобретения в практику. Иллюстративно, неограничивающие примеры указанных биоразлагаемых полимеров включают полигидроксикислоты, такие как полимолочная кислота, полигликолевая кислота и др., и их сополимеры, например, поли(молочная-ко-гликолевая кислота) [PLGA], и др.; полиангидриды; полиэфиры; полисахариды, и др., хитозан, и др. Молекулярная масса указанных биоразлагаемых полимеров может варьироваться в широком диапазоне, с условием, что он соответствует установленным условиям формирования наночастиц и является биразлагаемым.
В определенном варианте осуществления изобретения используемым биоразлагаемым полимером является сополимер метилвинилового эфира и малеинового ангидрида в ангидридной форме (PVM/MA). В специфическом варианте осуществления изобретения может быть использован, например, сополимер PVM/MA, имеющийся на рынке под торговым наименованием Gantrez® AN. В определенном варианте осуществления изобретения указанный сополимер PVM/MA имеет молекулярную массу, составляющую между 100 и 2400 кДа, предпочтительно между 200 и 2000 кДа, более предпочтительно между 180 и 250 кДа. Такой биоразлагаемый полимер (PVM/MA) является особенно преимущественным, так как он широко используется в фармакологической технологии из-за его низкой токсичности (LD50=8-9 г/кг пероральным путем) и превосходной биосовместимости. Более того, его легко получать и из-за количества и из-за его стоимости. Такой биоразлагаемый полимер (PVM/MA) может реагировать с различными гидрофильными веществами из-за присутствия ангидридных групп, не прибегая к обычным органическим реагентам (глутаральдегид, производные карбодиимида, и др.), которые обладают существенной токсичностью. В водной среде сополимер PVM/MA является нерастворимым, но его ангидридные группы гидролизуются с формированием карбоксильных групп. Растворение медленное и зависит от условий, в которых оно возникает. Из-за доступности функциональных групп в PVM/MA при обычной инкубации в водной среде возникает ковалентная связь молекул с нуклеофильными группами, такими как гидроксид или амино.
Международная патентная заявка WO 02/069938, содержание которой включено в настоящее описание путем ссылки, описывает наночастицы сополимера PVM/MA. В качестве иллюстрации, указанные наночастицы сополимера PVM/MA могут быть легко получены путем десольватации сополимера посредством добавления к его органическому раствору первого полярного растворителя (смешиваемого с раствором сополимера) и последующего добавления второй нерастворяющей жидкости, такой как водноспиртовой раствор. Необязательно, может быть добавлен сшивающий агент.
Циклодекстрин и его производные
Наночастицы по изобретению включают, в добавление к биоразлагаемому полимеру, циклодекстрин или его производное.
Как используется в настоящем описании, термин «циклодекстрин» включает любой циклический олигосахарид, образованный единицами глюкозы, связанными α-1,4 (α-1,4-глюкопираноза) глюкозидными связями. Такие мономеры образуются в результате реакции внутримолекулярного трансгликозилирования разложения крахмала ферментом циклодекстринглюканотрансферазой (CGTазы).
«Циклодекстрин» может содержать более чем 15 единиц α-1,4-глюкопиранозы, хотя наиболее обычные содержат 6, 7 или 8 единиц α-1,4-глюкопиранозы, образуя так называемые альфа-циклодекстрины (α-CD), бета-циклодекстрины (β-CD) или гамма-циклодекстрины (γ-CD) соответственно. Все из них имеют структуру типа усеченного конуса с гидрофобной внутренней полостью и гидрофильной наружной поверхностью. Это происходит из-за того факта, что гидроксильные группы ориентированы в направлении от циклодекстрина, т.е. в их гидрофобную внутреннюю полость, она покрыта водородами метиленовой группы, а также кислородами типа простого эфира. Следовательно, они действуют в качестве носителя посредством полного или частичного захвата инородной молекулы. В определенном варианте осуществления изобретения указанный циклодекстрин представляет собой альфа-циклодекстрин, бета-циклодекстрин или гамма-циклодекстрин.
Как используется в настоящем описании, термин «производное циклодекстрина» включает любой циклодекстрин, имеющий, по меньшей мере, одну модифицированную гидроксильную группу. Химическая модификация циклодекстринов может изменять их физико-химические свойства, улучшая растворимость, стабильность и регулируя химическую активность молекул, с которыми они связаны (инородные молекулы). Было описано включение алкила, арила, карбоксиалкила, цианоалкила, гидроксиалкила, сульфоалкила, амино, азидо, гетероциклической, ацетильной, бензоильной, сукциновой групп и других групп, содержащих фосфор, серу и др. посредством реакции ОН групп циклодекстринов (Robyt (1998) “Essentials of carbohydrate chemistry”, Ed. Charles R. Canto, Springer Advanced Text in Chemistry). В определенном варианте осуществления изобретения по меньшей мере одна из указанных концевых гидроксильных групп модифицирована с заменой водорода линейной или разветвленной С1-С8 алкильной группой, например метил, этил, пропил, и др.; три(С1-С8)алкилсилил, например т-бутилдиметилсилил, и др., С1-С8гидроксиалкил, например 2-гидроксиэтил, 2-гидроксипропил, и др.; (С1-С8)алкилкарбонил, необязательно замещенный карбоксильной группой, например ацетил, сукцинил, и др.; арилкарбонил, например, бензоил, и др.; (С1-С2)цианоалкил, например, цианометил, цианоэтил; амино, необязательно замещенная; азидо; сульфо; (С1-С4)сульфоалкил; или сахаридный радикал, например глюкозил, маннозил, и др. В другом определенном варианте осуществления изобретения две или более концевых гидроксильных групп CD, например, 2, 3, 4, 5, 6 или 7 концевых гидроксильных группы, присутствующие в β-CD, модифицированы любой из указанных групп.
Исходные циклодекстрины (т.е. без изменений), особенно β-CD, обладают ограниченной водной растворимостью по сравнению с ациклическими сахаридами, частично из-за сильных связей между молекулами циклодекстрина в кристаллическом состоянии. Более того, β-CD могут образовывать внутримолекулярные водородные связи между вторичными гидроксильными группами, таким образом давая неблагоприятные энтальпии раствора и, следовательно, низкую водную растворимость. Замещение любой из водородных связей гидрофобными группами, такими как метокси- или этокси-, приводит к увеличению водной растворимости. Например, водная растворимость β-CD составляет 1,85% (мас./об.) при комнатной температуре, но она может увеличиваться до 150 раз при увеличении степени метилирования (метил-β-CD). Другим особенно важным производным циклодекстрина является 2-гидроксипропил-β-циклодекстрин (ОН-β-CD), полученный после обработки β-CD пропиленоксидом, который обладает водной растворимостью 60% (мас./об.). Аналогично, такие производные могут улучшить токсикологический профиль, способность инкапсулировать биологически активные молекулы и модулировать их профиль высвобождения. Основной проблемой исходных циклодекстринов является нефротоксичность после парентерального введения, преимущественно для β-CD, из-за его низкой водной растворимости. Следовательно, наиболее гидрофильные производные, такие как ОН- β-CD, уменьшают такие проблемы нефротоксичности, так как они могут легче выделяться. То же самое не имеет места для метилированных производных β-CD, которые, несмотря на то, что являются более растворимыми, чем β-CD, не исключают развития системной токсичности из-за их большей способности взаимодействовать с эндогенными липидами, что ограничивает их парентеральное применение. Наоборот, исследования токсичности, проводимые после перорального введения, показывают, что циклодекстрины, а также их производные, нетоксичны при таком пути введения.
Циклодекстрины являются водорастворимыми макромолекулами, которые одобрены для перорального, парентерального и местного введения лекарственных средств. Применение циклодекстринов при пероральном введении лекарственных средств происходит преимущественно из-за улучшения пероральной биодоступности лекарственного средства, из-за увеличения растворимости, увеличения стабильности лекарственного средства в желудочно-кишечном тракте и/или в композиции. Более того, для определенных лекарственных средств среди остальных интересна эффективность циклодекстринов в уменьшении местного раздражения, вызванного самим лекарственным препаратом, контроль за высвобождением лекарственного средства на протяжении желудочно-кишечного тракта или маскировка нежелательных органолептических характеристик. Таким является случай итраконазола, который имеется на рынке в Соединенных Штатах и Европе, ассоциированный с ОН-β-CD для перорального введения, существенно снижая раздражение в желудочно-кишечном тракте при отдельном введении.
Кроме того, циклодекстрины также используются из-за их способности увеличивать проникновение лекарственного средства через кожу и слизистые оболочки, что вызывает лучшее и более однородное всасывание лекарственного средства. Это приводит к увеличению активности лекарственного средства после его введения, такого как, например, комплекс, образованный между флутамидом и ОН-β-CD, существенно улучшая всасывание лекарственного средства после его перорального введения.
В определенном варианте осуществления изобретения указанным производным циклодекстрина является производное альфа-циклодекстрина или производное бета-циклодекстрина или производное гамма-циклодекстрина. Иллюстративно, неограничивающим примером производных циклодекстрина, которые могут использоваться для внесения настоящего изобретения в практику, являются этил-β-CD, гептакис(2,3,6-три-О-этил)-β-CD, 2-гидроксипропил-β-CD, 2-О-гидроксипропил-β-CD, 2-гидроксиэтил-β-CD, сукцинилированные производные β-CD, сукцинилированные производные 2-гидроксипропил-β-CD, бутил-β-CD, гептакис(2,6-ди-О-н-бутил)-β-CD, гептакис(2,6-ди-О-н-пентил)-β-CD, метил-β-CD, метил-β-CD, карбоксиметил-β-CD, карбоксиэтил-β-CD, гептакис(2,6-ди-О-метил)-β-CD, гептакис(2,3,6-три-О-метил)-β-CD, ацетил-β-CD, гептакис(3-О-ацетил-2,6-ди-О-н-пентил)-β-CD, гептакис(3-О-ацетил-2,6-ди-О-метил)-β-CD, сульфо-β-CD, сульфапропил-β-CD, н-бутил-β-CD, гептакис(3-О-н-бутирил-2,6-ди-О-пентил)-β-CD, 2-цианоэтил-β-CD, 6-монодезокси-6-моноазидо-β-CD, гептакис(2,3,6-три-О-бензил)-β-CD, гептакис(2,3,6-три-О-бензоил)-β-CD, 6-монодезокси-6-моноамино-β-CD, гептакис(2,6-ди-О-н-пентил-3-О-трифторацетил)-β-CD, гептакис(2,3,6-три-О-н-октил)-β-CD, гептакис(2,3-ди-О-ацетил-6-О-трет-бутилдиметилсилил)-β-CD, гептакис(6-О-трет-бутилдиметилсилил)-β-CD, гептакис(6-О-трет-бутилдиметилсилил-2,3-ди-О-метил)-β-CD, гептакис(2,6-ди-трет-бутилдиметилсилил)-β-CD, гептакис(2,3,6-три-О-трифторацетил)-β-CD, гептакис(2,6-ди-О-метил-3-О-н-пентил)-β-CD.
Массовое соотношение между циклодекстрином или его производными и биоразлагаемым полимером может варьироваться в широком диапазоне, в определенном варианте осуществления изобретения указанное массовое соотношение циклодекстрина (или его производного): биоразлагаемого полимера составляет 1:1-10, предпочтительно 1:1-5, более предпочтительно около 1:4. В определенном варианте осуществления изобретения указанным биоразлагаемым полимером является PVM/MA.
Как было упомянуто ранее, наиболее широко используемыми в фармацевтических применениях являются β-CD и его производные, особенно 2-гидроксипропил-β-циклодекстрин (ОН-β-CD), так как он имеет высокую водную растворимость, низкую токсичность и более гидрофобную полость, чем таковая β-CD.
В определенном варианте осуществления изобретения циклодекстрин, присутствующий в наночастицах по изобретению, не имеет каких-либо замещенных гидроксильных групп. В специфическом варианте осуществления изобретения указанным циклодекстрином является бета-циклодекстрин (β-CD), содержащий 7 единиц α-1,4-глюкопиранозы. Хотя массовое соотношение β-CD:биоразлагаемый полимер составляет 1:1-10, предпочтительно 1:1-5, соотношение 1:4 дает хорошие результаты. В качестве иллюстрации приблизительно 0,25 мг β-CD/мг биоразлагаемого полимера дает эффективную ассоциацию. В таком случае количество β-CD, ассоциированое с наночастицами, составляет приблизительно 90 микрограмм/мг наночастиц. Такие наночастицы характеризуются обычно как имеющие сферическую форму и размер близкий к 150 нм.
В другом определенном варианте осуществления изобре