Средство, обладающее актопротекторной, противогипоксической, нейропротекторной, антиамнестической и термопротекторной активностью
Иллюстрации
Показать всеПредложено применение 2-этил-6-метил-3-оксипиридиния L-аспарагината в качестве средства, обладающего актопротекторной, противогипоксической, нейропротекторной, антиамнестической и термопротекторной активностью. Средство предназначено, в частности, для повышения физической работоспособности как в обычных, так и в экстремальных условиях, а также для лечения острых и хронических нарушений мозгового кровообращения, в том числе ишемического инсульта и других состояний и заболеваний, сопровождающихся снижением когнитивных функций и нейродегенерацией, в том числе при старении. Показано, что актопротекторная активность этого химического соединения в дозе 1 мг/кг превосходит активность ближайшего аналога заявляемого средства мексидола в дозе 5 и 10 мг/кг. Термопротекторная активность этого вещества в дозе 5 мг/кг вдвое превосходит активность ближайшего аналога заявляемого средства мексидола в дозе 50 и 100 мг/кг. Противогипоксическая, нейропротекторная и антиамнестическая активность заявленного средства у животных на разных моделях превосходит и/или не уступает ближайшему аналогу мексидолу и другим препаратам сравнения. 10 табл.
Реферат
Изобретение относится к медицине, а именно к созданию средства, обладающего актопротекторной, противогипоксической, нейропротекторной, антиамнестической и термопротекторной активностью, предназначенного, в частности, для повышения физической работоспособности как в обычных, так и в экстремальных условиях, а также для лечения острых и хронических нарушений мозгового кровообращения, в том числе ишемического инсульта и других состояний и заболеваний, сопровождающихся снижением когнитивных функций и нейродегенерацией, в том числе при старении.
В последние годы учащается воздействие на человека различных экстремальных факторов, возникающих при природных катаклизмах и в результате техногенной деятельности человека, а также увеличивается число людей, деятельность которых связана с работой в чрезвычайных и осложненных ситуациях: военнослужащие, сотрудники МЧС России (Министерство Российской Федерации по делам гражданской обороны, чрезвычайным ситуациям и ликвидации последствий стихийных бедствий), МВД (Министерство внутренних дел Российской Федерации), ФСБ (Федеральная служба безопасности Российской Федерации), спасатели, спортсмены, альпинисты и др. [5, 17, 18, 21]. Поэтому необходим поиск и изучение новых эффективных веществ с актопротекторной активностью.
Также одна из актуальных проблем современной медицины - изыскание и разработка новых средств, способных эффективно защищать мозг. Актуальность этого определяется, в частности, высокой летальностью при инсульте, а также тем, что применяемые при нем препараты разных фармакологических групп, как правило, не являются средствами патогенетической терапии, малоэффективны и имеют серьезные побочные эффекты [7, 8, 19].
Ближайший аналог заявляемого средства (как по химическому строению, так и по фармакологическим свойствам) - отечественный лекарственный препарат мексидол (этилметилгидроксипиридина сукцинат: 2-этил-6-метил-3-оксипиридипа сукцинат), который является производным 3-оксипиридина и обладает нейротропной, нейропротекторной и антиоксидантной активностью, из-за чего его широко используют в неврологии при острой и хронической недостаточности мозгового кровообращения и связанных с ней заболеваниях, в том числе при инсульте и его последствиях [3, 6, 7, 14, 20]. Однако препарат оказывает незначительное или умеренное актопротекторное и противогипоксическое действие [3, 22]. Кроме того, установлено, что в клинике и эксперименте мексидол не всегда эффективен при этой патологии. Например, мексидол давал положительный клинический эффект лишь у 63% больных, который преобладал у пациентов с дисциркуляторной эпцефалопатией атеросклеротического генеза [16]. Более того, мексидол обладает недостаточной ноотропной активностью.
Поэтому необходимо изыскание в ряду производных 3-оксипиридина новых веществ, имеющих широкий спектр фармакологического действия и способных повышать физическую работоспособность как в обычных, так и в экстремальных условиях, а также действовать более эффективно, в частности, на модели инсульта в эксперименте.
В связи с изложенным задачей настоящего изобретения является создание нового средства, обладающего актопротекторной, противогипоксической, нейропротекторной, антиамнестической и термопротекторной активностью.
Поставленная цель достигается применением в качестве нового средства 2-этил-6-метил-3-оксипиридиния L-аспарагината (ОА) в эффективных количествах, имеющего выраженное актопротекторное действие в сочетании с противогипоксической, нейропротекторпой, антиамнестической и термопротекторной активностью.
Изобретение иллюстрируется следующими ниже примерами. При этом примеры 2-6 иллюстрируют эффективность ОА в качестве актопротекторного, противогипоксического, термопротекторного, антиамнестического и нейропротекторного средства в сравнении с ближайшим аналогом мексидолом, а также другими препаратами сравнения.
Пример 1. В трехгорлую колбу, снабженную мешалкой, термометром и холодильником, загружают 10 мл воды, затем при перемешивании постепенно добавляют 1,37 г (0,01 М) 2-этил-6-метил-3-оксипиридина и 1,33 г (0,01 М) L-аспарагиновой кислоты.
Реакционную массу тщательно перемешивают, нагревают до 90-95°C и выдерживают при перемешивании в течение 20-30 минут. Полученный раствор фильтруют, затем охлаждают до комнатной температуры, приливают 2 мл спирта, тщательно перемешивают и кристаллизуют при температуре 5-10°C. Осадок сушат до постоянного веса при 80-85°C.
Получают 2,0 г белого кристаллического порошка с Т.пл. 295-297°C (с разложением).
Найдено, %: С 55,29; Н 6,77; N 10,37. C12H18N2O5
Вычислено, %: С 55,33; Н 6,66; N 10,40
ИК-спектр (ν, см-1): 3280 (NH), 2450 (N+), 1720 (C=O), 1610 (С=С, аром.), 1560 (NHCO)
При выполнении экспериментальной части работы (опыты на животных - примеры 2-6) в соответствии с Российскими национальными правилами исследований («Правила лабораторной практики в Российской Федерации»; приказ Минздрава России №267 от 19.06.2003; и др.) и международными требованиями были использованы модели и методы, рекомендованные Фармакологическим комитетом для проведения подобных исследований, утвержденные Министерством здравоохранения и социального развития РФ и соответствующие рекомендациям ВОЗ, касающимся правил надлежащей лабораторной практики (GLP - "Good Laboratory Practice") [11]. Животных получали из Центрального питомника лабораторных животных РАМН («Столбовая», Московская область). Содержание животных соответствовало правилам GLP и осуществлялось в соответствии с нормативным документом «Санитарные правила по устройству, оборудованию и содержанию вивариев», утвержденным Главным государственным санитарным врачом 06.04.1973 г. №1045-73, и приказом МЗ РФ №267 от 19.06.2003.
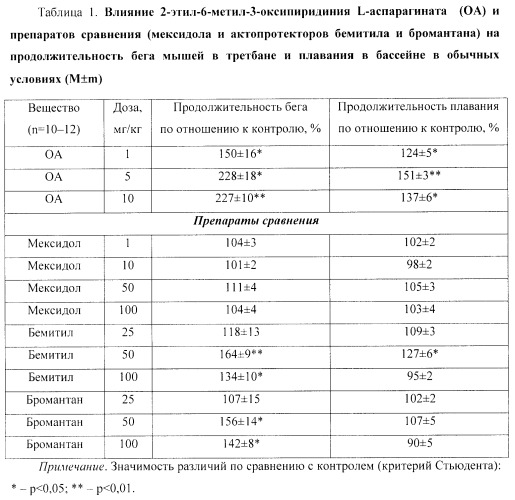
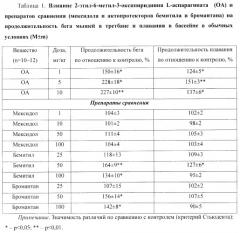
Пример 2. Актопротекторное действие 2-этил-6-метил-3-оксипиридиния L-аспарагината (ОА) по тестам бега мышей в третбане и плавания в бассейне в обычных и экстремальных условиях (табл.1-2)
Исследования выполнены на белых нелинейных мышах-самцах массой 20-25 г. Физическую работоспособность мышей в обычных и экстремальных условиях оценивали по тестам бега в третбане (скорость движения ленты составляла 32 м/мин) [13] и плавания в бассейне с грузом, составляющим 7% (в обычных условиях) или 5% (в условиях острой гипоксии с гиперкапнией) массы животных (температура воды 28°С) [12]. Гипертермию моделировали в термокамере (температура воздуха 40°С и относительная влажность 50%), а острую нормобарическую гипоксическую гипоксию с гиперкапнией - в гермокамере с бассейном (объем воздушного пространства составлял 250 см3, воды - 1750 см3) [1].
Исследуемые фармакологические вещества вводили однократно внутрибрюшинно (в/б) за 60 минут (мин) до опыта. Животным контрольных групп вводили в/б 0,9% раствор натрия хлорида (NaCl) в том же объеме. Об эффективности веществ судили по увеличению продолжительности бега в третбане и плавания в бассейне подопытных животных по сравнению с мышами контрольных групп.
В качестве препаратов сравнения были взяты оригинальный отечественный препарат мексидол, родоначальник класса актопротекторов бемитил и актопротектор с психо- и иммуностимулирующим действием бромантан [3, 10, 15, 19].
Было обнаружено, что ОА в дозах 1, 5 и 10 мг/кг значимо увеличивал продолжительность бега мышей в третбане на 50%, 128% (p<0,05) и 127% (p<0,01) соответственно (табл.1).
Препарат сравнения мексидол в дозах 1, 10, 50 и 100 мг/кг достоверно не влиял на этот показатель. Актопротектор бемитил в дозе 25 мг/кг также достоверно не изменял этот показатель, а в дозах 50 и 100 мг/кг значимо увеличивал продолжительность бега животных на 64% (p<0,01) и 34% (p<0,05) соответственно по сравнению с контролем. Актопротектор бромантан в дозе 25 мг/кг достоверно не влиял на продолжительность бега мышей в третбане, а в дозах 50 и 100 мг/кг значимо (p<0,05) увеличивал этот показатель на 56% и 42% соответственно (табл.1).
По выраженности действия на продолжительность бега мышей ОА (10 мг/кг) значимо превосходил препараты сравнения - мексидол (50 мг/кг) в 2 раза, бемитил (50 мг/кг) в 1,4 раза и бромантан (50 мг/кг) в 1,5 раза (p<0,001).
ОА в дозах 1, 5 и 10 мг/кг значимо увеличивал продолжительность плавания мышей в бассейне в обычных условиях на 24% (p<0,05), 51% (p<0,01) и 37% (p<0,05) соответственно (табл.1).
Среди препаратов сравнения эффективным оказался только бемитил в дозе 50 мг/кг, который увеличивал физическую работоспособность на 27% в сравнении с контролем.
По выраженности влияния на продолжительность плавания в бассейне в обычных условиях ОА значимо превосходил препараты сравнения: в дозе 1 мг/кг - мексидол (50 мг/кг) и бромантан (50 мг/кг) в 1,2 раза (p<0,05); в дозе 5 мг/кг - бемитил (50 мг/кг) в 1,2 раза (p<0,05), а мексидол (50 мг/кг) и бромантан (50 мг/кг) в 1,4 раза (p<0,001); в дозе 10 мг/кг - мексидол (50 мг/кг) и бромантан (50 мг/кг) в 1,3 раза (p<0,001).
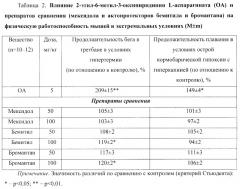
ОА также повышал физическую работоспособность мышей в экстремальных условиях (табл.2). Так, ОА в дозе 5 мг/кг значимо (p<0,01) увеличивал на 109% продолжительность бега в третбане при гипертермии.
Напротив, бемитил и бромантан были эффективны в небольшой степени только в высокой в дозе (100 мг/кг), а мексидол (50 и 100 мг/кг) достоверно не влиял на этот показатель (табл.2).
При этом по выраженности актопротекторного действия (в условиях гипертермии) ОА значимо (p<0,001) превосходил препараты сравнения: мексидол (50 мг/кг) в 2 раза, бемитил (100 мг/кг) в 1,8 раза и бромантан (100 мг/кг) в 1,7 раза.
ОА в дозе 5 мг/кг значимо (p<0,05) на 49% увеличивал продолжительность плавания мышей в бассейне в условиях острой нормобарической гипоксии с гиперкапнией (в гермокамере). Напротив, мексидол, бемитил и бромантан были неэффективны.
При этом по выраженности актопротекторного действия (в гермокамере) ОА значимо превосходил препараты сравнения: мексидол (50 мг/кг) в 1,5 раза, бемитил (50 мг/кг) в 1,4 раза и бромантан (50 мг/кг) в 1,3 раза (p<0,001).
Итак, ОА способен повышать физическую работоспособность мышей в обычных и экстремальных условиях, превосходя по выраженности актопротекторного действия такие препараты сравнения как мексидол (его ближайший аналог) и актопротекторы бемитил и бромантан.
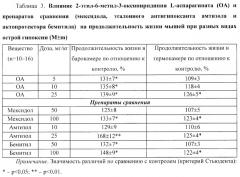
Пример 3. Противогипоксическое действие 2-этил-6-метил-3-оксипиридиния L-аспарагината (ОА) на разных моделях острой гипоксии у мышей (табл.3)
Исследования выполнены на белых нелинейных мышах-самцах массой 20-28 г по методикам, описанным в «Методических рекомендациях по экспериментальному изучению препаратов, предлагаемых для клинического изучения в качестве антигипоксических средств» [9] и «Руководстве по экспериментальному (доклиническому) изучению новых фармакологических веществ» [11].
Острую гипобарическую гипоксию моделировали у мышей в проточно-вытяжной барокамере; животных поднимали со скоростью 50 м/с до "высоты" 11000 м. Острую нормобарическую гипоксическую гипоксию с гиперкапнией воспроизводили путем помещения мышей (поодиночке) в гермокамеру. Регистрировали продолжительность жизни животных. Исследуемые вещества вводили однократно в/б за 30 (эталонный антигипоксант амтизол) или 60 минут (все остальные вещества) до опыта. Животным контрольных групп вводили в/б 0,9% раствор NaCl в том же объеме.
На модели острой гипобарической гипоксии ОА в дозах 5, 10 и 25 мг/кг значимо (p<0,05) увеличивал продолжительность жизни мышей на 31%, 35% и 39% соответственно (табл.3).
Препарат сравнения мексидол в дозе 50 мг/кг достоверно не влиял, а в дозе 100 мг/кг значимо (p<0,05) увеличивал данный показатель на 33%. Эталонный антигипоксапт амтизол в дозе 10 мг/кг также достоверно не влиял на продолжительность жизни мышей, а в дозе 25 мг/кг значимо (p<0,01) увеличивал ее на 68%. Актопротектор бемитил в дозах 50 и 100 мг/кг значимо (p<0,05) увеличивал этот показатель на 32% и 48% соответственно (табл.3).
При этом по выраженности противогипоксического действия на модели острой гипобарической гипоксии ОА (25 мг/кг) не уступает препаратам сравнения: мексидолу (100 мг/кг), амтизолу (25 мг/кг) и бемитилу (50 и 100 мг/кг).
На модели острой нормобарической гипоксической гипоксии с гиперкапнией (в гермокамере) ОА в дозах 5 и 10 достоверно не изменял, а в дозе 25 мг/кг значимо (p<0,05) увеличивал продолжительность жизни мышей на 26% (табл.3).
Мексидол в дозе 50 мг/кг достоверно не влиял, а в дозе 100 мг/кг значимо (p<0,05) увеличивал данный показатель на 23%. Амтизол в дозе 10 мг/кг также достоверно не влиял на продолжительность жизни мышей, а в дозе 25 мг/кг значимо (p<0,01) увеличивал ее на 25%. Бемитил в дозе 50 мг/кг достоверно не изменял этот показатель, а в дозе 100 мг/кг значимо (p<0,05) увеличивал его на 22%.
При этом по выраженности противогипоксического действия на модели острой нормобарической гипоксической гипоксии с гиперкапнией ОА (25 мг/кг) не уступает препаратам сравнения; мексидолу (100 мг/кг), амтизолу (25 мг/кг) и бемитилу (100 мг/кг).
Итак, ОА способен увеличивать продолжительность жизни мышей на двух моделях острой гипоксии, не уступая при этом по выраженности противогипоксического действия таким препаратам сравнения как мексидол (его ближайший аналог), эталонный антигипоксант амтизол и актопротектор бемитил.
Пример 4. Термопротекторное действие 2-этил-6-метил-3-оксипиридиния L-аспарагината (ОА) у мышей (табл.4)
Гипертермию моделировали у белых нелинейных мышей-самцов массой 20-24 г в термокамере (температура воздуха 45°C и относительная влажность 70%), передняя стенка которой была выполнена из прозрачного органического стекла для визуальной регистрации поведенческих реакций и продолжительности жизни животных. Продолжительность жизни мышей регистрировали с помощью секундомера (до остановки дыхания) в минутах (с точностью до 0,1 мин). Исследуемые вещества [ОА и препараты сравнения (мексидол и известный актопротектор бемитил)] и 0,9% раствор NaCl (контроль) вводили однократно в/б за 60 мин до помещения мышей в термокамеру. Выбор актопротектора бемитила в качестве препарата сравнения был обусловлен тем, что хорошо известна его способность повышать устойчивость организма человека и животных к нежелательному воздействию высоких температур [1, 15].
Было обнаружено, что ОА в дозе 30 мг/кг дает отчетливый термопротекторный эффект, увеличивая на 27% (p<0,02) продолжительность жизни мышей в термокамере (табл.4).
Мексидол в дозе 50 мг/кг достоверно не влиял, а в дозе 100 мг/кг значимо (p<0,05) увеличивал продолжительность жизни животных в термокамере на 23%. Бемитил в дозе 100 мг/кг значимо (p<0,02) увеличивал этот показатель на 30%.
При этом по выраженности термопротекторного действия ОА (30 мг/кг) не уступает препаратам сравнения мексидолу (100 мг/кг) и бемитилу (100 мг/кг).
Итак, ОА способен увеличивать продолжительность жизни мышей в термокамере, не уступая при этом по выраженности термопротекторного действия мексидолу и бемитилу.
Пример 5. Антиамнестическое действие 2-этил-6-метил-3-оксипиридиния L-аспарагината (ОА) на различных моделях амнезии у мышей и крыс (табл. 5-8)
Исследования выполнены на белых нелинейных мышах-самцах массой 20-28 г. Влияние ОА и препаратов сравнения (мексидол, традиционный ноотроп пирацетам, оригинальное отечественное ноотропное средство семакс и эталонный антигипоксант амтизол) на процессы обучения и памяти у животных исследовали, используя условную реакцию пассивного избегания (УРПИ) электрокожного раздражения [2]. Выработку УРПИ у мышей производили на основе электрокожного подкрепления по методу Cumin et al. (1982) [23] с учетом рекомендаций Mondadori et al. (1990) [25]. Мышей подвергали воздействию электросудорожного шока (ЭСШ) (50 Гц, 50 мА, 0,3 с, транспиннеально) сразу после обучения УРПИ [11]. У животных контрольной группы вызывали псевдоЭСШ. Для воспроизведения модели скополаминовой амнезии м-холиноблокатор вводили мышам в/б в дозе 1 мг/кг сразу после обучения УРПИ [11], Острую нормобарическую гипоксическую гипоксию с гиперкапнией воспроизводили путем помещения мышей (поодиночке) в гермокамеру. В качестве комплексного экстремального воздействия использовали плавание мышей в холодной воде (ПМХВ) с одновременным вращением колеса до изнеможения. Исследуемые вещества вводили однократно в/б за 10 (семакс), 30 (амтизол) или 60 мин (все остальные вещества) до обучения мышей. Семакс на модели амнезии, вызванной ЭСШ, вводили в/б в период генерализованных судорог. Животные контрольных групп получали (в/б) в том же объеме 0,9% раствор NaCl. Сохранность УРПИ проверяли через 24 часа после амнезирующего воздействия.
На модели амнезии, вызванной электросудорожным шоком, было обнаружено, что у мышей ОА (30 мг/кг) существенно ослаблял выраженность амнезии УРПИ в 2,9 раза (p<0,01).
Препарат сравнения мексидол (50 мг/кг) также значимо (p<0,01) ослаблял амнестический эффект в 2,3 раза, а пирацетам (800 мг/кг) почти полностью предупреждал развитие амнезии УРПИ. Мексидол (30 мг/кг), семакс (0,025, 0,1 и 0,2 мг/кг), пирацетам (200 мг/кг) и эталонный антигипоксант амтизол (30 мг/кг) существенно не влияли на амнезию УРПИ (табл.5).
При этом по выраженности антиамнестического действия ОА (30 мг/кг) не уступает препаратам сравнения мексидолу (50 мг/кг) и пирацетаму (800 мг/кг).
На модели скополаминовой амнезии было обнаружено, что у мышей ОА (30 мг/кг) существенно ослаблял выраженность амнезии УРПИ в 2,5 раза (p<0,05).
Препарат сравнения мексидол (50 мг/кг) также значимо (p<0,01) ослаблял амнестический эффект в 2,2 раза. Ноотропы пирацетам (800 мг/кг) полностью и семакс (0.1 мг/кг) почти полностью предупреждали развитие амнезии УРПИ. Мексидол (30 мг/кг), семакс (0,025 и 0,2 мг/кг), пирацетам (200 мг/кг) и эталонный антигипоксант амтизол (30 мг/кг) существенно не влияли на амнезию УРПИ (табл.6).
При этом по выраженности антиамнестического действия ОА (30 мг/кг) не уступает препаратам сравнения мексидолу (50 мг/кг), семаксу (0,1 мг/кг) и пирацетаму (800 мг/кг).
На модели амнезии, вызванной острой нормобарической гипоксической гипоксией с гиперкапнией (в гермокамере), было обнаружено, что у мышей ОА (30 мг/кг), препараты сравнения мексидол (50 мг/кг) и пирацетам (800 мг/кг) практически полностью предупреждают развитие амнезии УРПИ (табл.7). Эталонный антигипоксант амтизол (30 мг/кг) был менее эффективным - ослаблял выраженность амнезии в 2,1 раза (p<0,05). Мексидол (30 мг/кг) и пирацетам (200 мг/кг) существенно не влияли на амнезию УРПИ.
При этом по выраженности антиамнестического действия ОА (30 мг/кг) не уступает препаратам сравнения мексидолу (50 мг/кг) и пирацетаму (800 мг/кг).
На модели амнезии, вызванной ПМХВ с одновременным вращением колеса до изнеможения, было обнаружено, что у мышей ОА (30 мг/кг) существенно ослаблял выраженность амнезии УРПИ в 2,3 раза (p<0,01).
Препарат сравнения мексидол (50 мг/кг) также значимо (p<0,05) ослаблял амнестический эффект в 1,9 раза. Ноотропы пирацетам (800 мг/кг) полностью и семакс (0,2 мг/кг) почти полностью предупреждали развитие амнезии УРПИ. Мексидол (30 мг/кг), семакс (0,025 и 0,1 мг/кг), пирацетам (200 мг/кг) и эталонный антигипоксант амтизол (30 мг/кг) существенно не влияли на амнезию УРПИ (табл.8).
Итак, на разных моделях амнезии ОА оказывает выраженное антиамнестическое действие, не уступая в этом отношении мексидолу (его ближайший аналог), ноотропам семаксу и пирацетаму и эталонному антигипоксанту амтизолу.
Пример 6. Нейропротекторпое действие 2-этил-6-метил-3-оксипиридиния L-аспарагината (ОА) (табл.9-10)
В I серии опытов исследовали пейропротекторное действие ОА и препаратов сравнения у крыс (массой 220-260 г) с экспериментальной ишемией головного мозга. В качестве препаратов сравнения были выбраны мексидол, широко используемый сегодня в неврологии при лечении ишемического инсульта, и эталонный антигипоксант амтизол. Ишемию головного мозга у крыс воспроизводили путем одномоментной перевязки (под эфирным наркозом) обеих общих сонных артерий. У ложнооперированных животных (контрольная группа №1) операция была ограничена этапом доступа к общим сонным артериям. В контрольной группе №2 крысы получали только 0,9% раствор NaCl. В подопытных группах животным вводили в/б различные вещества (ОА и препараты сравнения) 1 раз в сутки (сут) в течение 7 сут; в первые сутки - через 1 час (ч) после операции. Животных после операции наблюдали в течение 2 недель с учетом выживаемости крыс. Неврологический дефицит у животных определяли (слепым методом) по шкале McGraw et al. [24] (в баллах) каждый час в течение 24 ч, а затем 1 раз в сутки. Тяжесть состояния определяли по сумме соответствующих баллов. У ложнооперированных животных неврологический дефицит отсутствовал.
Результаты исследования нейропротекторного действия веществ представлены в табл.9. Из нее видно, что у крыс контрольной группы №2 неврологический дефицит был наиболее выражен (8,9±0,1 балла) через 2 сут после двусторонней перевязки общих сонных артерий; при этом в контроле наблюдалась гибель 31% (15 крыс из 49) животных.
Было установлено, что ОА в дозе 30 мг/кг/сут оказывает нейропротекторное действие - уменьшает летальность крыс до 12% (погибли 3 крысы из 25; p<0,05) и значимо (p<0,05) ослабляет выраженность неврологического дефицита в 1,4-1,5 раза.
Препарат сравнения мексидол в дозе 50 мг/кг/сут оказывал нейропротекторное действие - уменьшал летальность крыс до 11% (погибли 3 крысы из 27; p<0,05). Сходные достоверные изменения происходили под влиянием мексидола и с неврологическим дефицитом (ослабление в 1,4-1,6 раза, p<0,05).
Другой препарат сравнения - амтизол в дозе 30 мг/кг/сут оказал незначительное благоприятное действие: незначимо (p>0,05) снижал летальность крыс до 18% и несколько уменьшал (p<0,05) неврологический дефицит (в 1,2-1,3 раза).
Итак, можно заключить, что наиболее выражено действуют ОА (30 мг/кг/сут) и мексидол (50 мг/кг/сут). При этом ОА по влиянию на летальность и неврологический дефицит не уступает препарату сравнения мексидолу. Более того, ОА значимо (p<0,05) превосходит эталонный антигипоксант амтизол по влиянию на неврологический дефицит в 1,1-1,2 раза.
Во II серии опытов исследовали нейропротекторное действие ОА и препаратов сравнения у крыс на модели гравитационной перегрузки. Опыты проводили на белых нелинейных крысах-самцах массой 220-290 г. Гравитационную радиальную перегрузку создавали в кранио-каудальном направлении с помощью специальной центрифуги диаметром 2 м [4]. Для этого бодрствующих крыс помещали в контейнеры центрифуги в строго кранио-каудальном направлении относительно вектора центростремительного ускорения, величина которого составляла 10 g в течение 6 мин. После центрифугирования у животных определяли неврологический дефицит, как описано выше в I серии опытов. Фармакологические вещества вводили (до воздействия) в/б 4 раза (1 раз/сут в течение 3 сут и за 45 минут до начала центрифугирования). Животные контрольной группы получали 0,9% раствор NaCl.
Из 55 животных контрольной группы после 6-минутного центрифугирования (ускорение 10 g) погибли 10 крыс (18%). После центрифугирования у контрольных крыс проявлялся неврологический дефицит в виде вялости, замедленности движений, тремора конечностей, полуптоза/птоза, пареза/паралича одной или нескольких конечностей (табл.10). Однако через 6 ч после центрифугирования визуально уже не выявлялись признаки неврологического дефицита.
ОА в дозе 30 мг/кг/сут значимо (p<0,05) снижал летальность до 3% (из 30 крыс погибла 1) и ослаблял выраженность неврологического дефицита в 1,7 раза.
Из препаратов сравнения мексидол в дозе 90 мг/кг/сут оказал значимое (p<0,05) защитное действие, снижая летальность до 0% и ослабляя выраженность неврологического дефицита в 1,7 раза (табл.10). Мексидол и амтизол в дозе 30 мг/кг/сут значимо (p<0,05) ослабляли выраженность неврологического дефицита в 1,5 раза, но летальность уменьшали только до 6-10% (p>0,05).
По выраженности действия в отношении неврологического дефицита ОА (30 мг/кг/сут) значимо (p<0,05) превосходил мексидол и амтизол в дозе 30 мг/кг/сут в 1,1 раза и не уступал мексидолу в дозе 90 мг/кг/сут.
Значит, ОА оказывает нейропротекторное действие на модели ишемии головного мозга, вызванной у крыс воздействием гравитационной перегрузки, превосходя по выраженности действия в отношении неврологического дефицита эталонный антигипоксант амтизол и не уступая мексидолу (в дозе в 3 раза выше).
Таким образом, на разных моделях ишемии головного мозга у крыс ОА оказывает нейропротекторное действие, превосходя по его выраженности эталонный антигипоксант амтизол и не уступая другому препарату сравнения - мексидолу (в более высоких дозах).
Итак, ОА способен повышать физическую работоспособность мышей в обычных и экстремальных условиях, превосходя по выраженности актопротекторного действия такие препараты сравнения как мексидол (его ближайший аналог) и актопротекторы бемитил и бромантан.
На двух моделях острой гипоксии (острой гипобарической гипоксии и острой нормобарической гипоксической гипоксии с гиперкапнией) ОА способен увеличивать продолжительность жизни мышей, не уступая при этом по выраженности противогипоксического действия мексидолу и другим препаратам сравнения - эталонному антигипоксанту амтизолу и актопротектору бемитилу.
ОА также способен увеличивать продолжительность жизни мышей в термокамере, не уступая при этом по выраженности термопротекторного действия мексидолу и бемитилу.
На разных моделях амнезии ОА оказывает выраженное антиамнестическое действие, не уступая в этом отношении мексидолу, ноотропам семаксу и пирацетаму и эталонному антигипоксанту амтизолу.
На разных моделях ишемии головного мозга у крыс (модель ишемического инсульта и ишемии, вызванной воздействием гравитационной перегрузки) ОА оказывает нейропротекторное действие, превосходя по его выраженности эталонный антигипоксант амтизол и не уступая другому препарату сравнения - мексидолу (в более высоких дозах).
Таким образом, на разных моделях ОА превосходит и/или не уступает ближайшему аналогу заявляемого средства мексидолу, а также другим препаратам сравнения.
Литература
1. Бобков Ю.Г., Виноградов В.М., Катков В.Ф. и др. Фармакологическая коррекция утомления. - М.: Медицина, 1984. - 208 с.
2. Буреш Я., Бурешова О., Хьюстон П.Д. Методики и основные эксперименты по изучению мозга и поведения: пер. с англ. / Под. ред. Батуева А.С. - М., Высш. шк., 1991. - 399 с.
3. Воронина Т.А. Отечественный препарат нового поколения мексидол: основные эффекты, механизм действия, применение. - М., 2004. - 21 с.
4. Гаевый М.Д., Аджиенко Л.М., Макарова Л.М., Абдулсалам А.А. Ишемия головного мозга, вызванная гравитационной перегрузкой // Экспер. и клин. фармакол. - 2000. - Т.63, №3. - С.63-64.
5. Гончаров С.Ф., Гармаш О.А., Власенко В.Ф. Служба специализированной (санитарно-авиационной) скорой медицинской помощи: состояние и перспективы развития // Медицина катастроф. - 2008. - №1. - С.5-10.
6. Гусев Е.И., Скворцова В.И. Ишемия головного мозга. - М.: Медицина, 2001. - 328 с.
7. Инсульт: диагностика, лечение, профилактика / Под редакцией З.И.Суслиной, М.А.Пирадова - М. «МЕДпресс-информ», 2008. - 288 с.
8. Машковский М.Д. Лекарственные средства. 15-е изд. - М. «Новая Волна», 2008. - 1206 с.
9. Методические рекомендации по экспериментальному изучению препаратов, предлагаемых для клинического изучения в качестве антигипоксических средств / Под редакцией Л.Д.Лукьяновой. - М., 1990. - 18 с.
10. Морозов И.С., Климова Н.В., Сергеева С.А. и др. Производные адамантана, повышающие устойчивость организма к экстремальным воздействиям // Вестник Российской академии медицинских наук. - 1999. - №3. - С.28-32.
11. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ / Под редакцией Р.У.Хабриева. - М. Минздрав РФ, 2005. - 832 с.
12. Рылова М.Л. Методы исследования хронического действия вредных факторов в эксперименте. М.: «Медицина». - 1964. - 228 с.
13. Самойлов Н.Н., Стратиенко Е.П., Цеева Ф.Н. и др. Методика оценки физической работоспособности мышей в условиях гипоксии с гиперкапнией // Вестник Межд. акад. наук экологии и безопасности жизнедеятельности. - 2002. - №5. С.-189-191.
14. Скворцова В.И. Ишемический инсульт: патогенез ишемии, терапевтические подходы // Невролог. журн. - 2001. - Т.6, №3. - С.4-9.
15. Смирнов А.В. Актопротекторы как самостоятельный фармакологический класс // Николай Васильевич Лазарев и современная наука / Под ред. А.В.Смирнова и Г.А.Софропова. - СПб., 1997. - С.45-60.
16. Суслина З.А., Смирнова И.П., Танашян М.М. и др. Клиническая эффективность мексидола и влияние его на реологические свойства крови и гемоперфузию головного мозга при хронических формах цереброваскулярных заболеваний. - М., 2002. - 19 с.
17. Ушаков И.Б., Володин А.С., Чикова С.С., Зуева Т.В. Медицинские аспекты защиты здоровья населения от вредного воздействия факторов окружающей среды // Гигиена и санитария. - 2005. - №6. - С.29-34.
18. Ушаков И.Б., Зинкин В.Н., Солдатов С.К. и др. Влияние высокоинтенсивного авиационного шума на показатели гемодинамики инженерно-технического состава Военно-Воздушных Сил // Воен.-мед. журн. - 2007. - Т.328, №1. - С.52-57.
19. Федеральное руководство по использованию лекарственных средств (формулярная система). Выпуск XI // Под редакцией А.Г.Чучалина, Ю.Б.Белоусова, В.В.Яснецова - М.: «Эхо», 2010. - 944 с.
20. Федин А.И., Румянцева С.А., Миронова О.П., Евсеев В.П. Применение антиоксиданта мексидола у больных с острыми нарушениями мозгового кровообращения. Методические рекомендации. - М., 2002. - 16 с.
21. Чиж И.М., Шелепов A.M., Максимов Г.К. и др. О законах (закономерностях) и принципах медицинского обеспечения Вооруженных Сил // Воен.-мед. журн. - 2004. - Т.325, №9. - С.4-10.
22. Яснецов Вик.В., Воронина Т.А. Исследование противогипоксических и антиамнестических свойств мексидола и семакса // Экспер. и клин. фармакол. - 2010. - Т.73, №4. - С.2-7.
23. Cumin R., Bandle E.F., Gamzu E., Haefely W.E. Effect of the novel compound antiracetam (Ro 13-5057) upon impared learning and memory in rodents // Psychopharmacol. - 1982. - Vol.78. - P.104-111.
24. McGraw С.P., Pashayan A.G., Wendel O.T. Cerebral infarction in the Mongolian gerbil exacerbated by phenoxybenzaminetreatment // Stroke. - 1976 - Vol.7, No 5. - P.485-488.
25. Mondadori С., Bhatnagar A., Borkovski J., Häusler A. Involvement of a steroidal component in the mechanism of action of piracetam-like nootropics // Brain Res. - 1990. - Vol.506 - P.101-108.
Применение химического соединения 2-этил-6-метил-3-оксипиридиния L-аспарагината в качестве средства, обладающего актопротекторной, противогипоксической, нейропротекторной, антиамнестической и термопротекторной активностью.