Вакцина против лаймской болезни собак
Иллюстрации
Показать всеГруппа изобретений относится к области ветеринарии и представляет собой вакцину от лаймской болезни собак и способы ее применения. Вакцинная композиция содержит иммунологически эффективное количество организмов из первого штамма геновида Borrelia и иммунологически эффективное количество организмов из второго штамма геновида Borrelia. При этом организмы упомянутого второго штамма проявляют OspA антиген, OspB антиген, или проявляют оба антигена OspA и OspB на поверхности своей клетки, а введение указанной вакцинной композиции собаке вызывает значительные уровни боррелиацидных антител против В.burgdorferi 50772 (АТСС No. PTA-439). Вакцинная композиция позволяет индуцировать значительные уровни боррелиацидных антител OspA и OspC, которые в свою очередь способны стерилизовать инфицированных клещей. Также вакцина предотвращает восстановление В.burgdorferi ss из кожи, серологическое проявление инфекции, выраженные нарушения в конечностях/суставах, эрозивные изменения, связанные с инфицированием. 3 н. и 13 з.п. ф-лы, 7 ил., 17 табл., 8 пр.
Реферат
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка не является предварительной заявкой и испрашивает приоритет согласно 35 Свода законов США §119(е) предварительной заявки США No. 60/864,258, поданной 3 ноября 2006 г., содержание которой во всей полноте включено здесь посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к вакцине против лаймской болезни собак. Также обеспечиваются способы изготовления и применения вакцины как таковой или в комбинации с другими защитными агентами.
УРОВЕНЬ ТЕХНИКИ
Лаймская болезнь собак вызывается инфицированием спирохетами видов Borrelia (spp.), включая, главным образом, В.burgdorferi sensu stricto (ss) в Соединенных Штатах и В.burgdorferi ss, В.garnii и В. afzelii в Европе (Baranton et al.. Int. J.Sys. Bacteriol. 1992, 42:378-383. Hovius et al., J.Clin. Microbiol. 2000, 38:2611-2621). Спирохеты передаются, когда инфицированные клещи Ixodes spp. высасывают кровь, и получение инфекции собаками приводит к клиническим симптомам от бессимптомного синовита до острой аритмии и артралгии (Jacobson et al.. Int. J. Sys. Bacteriol. 1996, 11:172-182; Summers et al., J.Comp. Path. 2005, 133:1-13). Важно, что частота случаев заболевания лаймской болезнью собак ежегодно увеличивается синхронно с увеличивающимся числом случаев заболевания у людей (Haninckova et al., Emerg. Infect. Dis., 2006, 12:604-610).
Антитела, продуцируемые в ответ на инфицирование Borrelia spp., имеют две различные функции, но, тем не менее, оба ответа могут быть неэффективными в уничтожении секвестированных спирохет в хозяевах-млекопитающих. Был предложен ряд объяснений этого дефекта в нормальном иммунном ответе на природное инфицирование, включая антигенную вариацию (Schwan, Biochem. Soc. Trans. 2003, 31:108-112; Tokarz et al., Infect. Immun. 2004, 72:5419-5432), хозяйскую мимикрию (Barbour et al., Microbiol. Rev. 1986, 50:381-400) и внутриклеточную локализацию (Ма et al., Infect. Immun. 1991, 59:671-678).
Наиболее обычным гуморальным иммунным ответом является продуцирование неспецифических связывающих/опсонизирующих (обволакивающих) антител, которые «отмечают» спирохету для поглощения фагоцитами. К сожалению, опсонизирующие антитела индуцируются несколькими белками, обычными для других микроорганизмов (а именно 41 кДа белками, которые включают бактериальный жгутик), что делает их значение для индуцируемого вакцинацией опосредуемого антителами иммунитета, в лучшем случае, сомнительным.
Вторым обычным иммунным ответом является продуцирование боррелиацидных (летальных для Borrelia) антител. В противоположность опсонизирующим антителам, боррелиацидные антитела распознают эпитопы только на нескольких белках Borrelia spp. После связывания со специфической мишенью на спирохете боррелиацидные антитела весьма часто индуцируют комплемент с образованием атакующего мембраны комплекса, который убивает организм без необходимости удаления его фагоцитами.
Бактерины лаймской болезни собак, используемые в настоящее время в вакцинах, были разработаны, чтобы обеспечить защиту посредством индуцирования OspA-боррелиацидных антител (Hsien-Chu et al., JAVMA 1992, 201:403-411; Ма et al., Vaccine 1996, 14:1366-1374; Wikle et al.. Intern. J. Appl. Res. Vet. Med. 2006, 4:23-28; Straubinger et al., Vaccine 2001, 20:181-193), которые уничтожают спирохеты, экспрессирующие OspA в инфицированных клещах, когда паразиты высасывают кровь (Fikrig et al., Proc. Natl. Acad. Sci. USA 1992, 89:5418-5421). Straubinger et al., (Vaccine 2002, 20:181-193) сообщили, что цельно-клеточная вакцина индуцировала значительно более высокие титры боррелиацидных антител, чем рекомбинантный OspA. Несмотря на то что такие вакцины были достаточно успешны, сообщалось о неудачных вакцинациях (Levy et al., JAVMA 1993, 202:1834-1838; Ма et al., Vaccine 1996, 14:1366-1374; Schutzer et al., N.Engl. J.Med. 1997, 337:794-795).
Теперь понятно, что производимыми OspA-боррелиацидными антителами часто не удается стерилизовать развивающихся клещей, так как антитела только лишь распознают В. burgdorferi ss (Jobe et al., J. din. Microbiol. 1994, 32:618-622; Lovrich et al., Infect. Immunol. 1995, 63:2113-2119), которые экспрессируют OspA, а клещи обычно инфицированы спирохетами В. burgdorferi ss, которые не экспрессируют OspA (Fikrig et al., Infect. Immun. 1995, 63:1658-1662; Ohnishi et al., Proc. Natl. Acad. Sci. 2001, 98:670-675). Кроме того, клещи обычно также инфицированы другими патогенными Borrellia spp., включая В.afzelii и В.garinii (Ornstein et al., J. din. Microbiol. 2001, 39:1294-1298), в то время как OspA-антитела являются специфическими для геновида (Lovrich et al., Infect. Immunol. 1995, 63:2113-2119). Более того, «окно возможностей» для защиты с помощью OspA-боррелиацидных антител ограничено, даже когда спирохеты являются восприимчивыми, поскольку экспрессия OspA, которая опосредуется присоединением к средней кишке клеща (Pat et al. J. din., Invest. 2000, 106:561-569), быстро идет на спад после того, как инфицированные клещи начинают высасывание (Schwan et al., Proc. Natl. Acad. Sci. USA 1995, 92:2909-2913).
В. burgdorferi ss OspC является другой потенциальной мишенью для опосредованного боррелиацидными антителами иммунитета (Rousselle et al., J. Infect. Dis. 1998, 178:733-741). Этот белок, очевидно, имеет эпитоп, который ответственен за индуцирование боррелиацидных антител, и является консервативным среди патогенных Borrellia spp. (Lovrich et al., din. Diagn. Lab. Immunol. 2005, 12:746-751). Хотя специфическая функция OspC остается неизвестной, предполагают, что экспрессия OspC требуется для инфицирования млекопитающих, но не для инфицирования клещами (Grimm et al., 2004, Proc. Natl. Acad. Sci. 101(9):3142-3147). В любом случае, спирохеты лаймской болезни экспрессируют OspC сразу же после того, как клещи начинают высасывание (Schwan et al., Proc. Natl. Acad. Sci. USA 1995, 92:2909-2913), и должны продолжать экспрессировать OspC, чтобы осуществить инфицирование у млекопитающих (Stewart et al.. Infect. Immune. 2006, 74:3547-3553, Tilly et al., Infect. Immun. 2006, 74:3554-3564). Следовательно, «окно эффективности» OspC-боррелиацидных антител значительно увеличено по сравнению с OspA-боррелиацидными антителами.
Было показано, что OspC-белок может индуцировать защитные боррелиацидные антитела (Rousselle et al., J. Infect. Dis. 1998, 178:733-741, Ikushima et al., FEMS Immunol. Med. Microbiol. 2000, 29:15-21), но в соответствии с некоторыми предшествующими исследованиями по «картированию» эпитопы были локализованы в высокогетерологичных областях белка (Buckles et al., din. Vacc. Immunol. 2006, 13:1162-1165). Поэтому боррелиацидные OspC-антитела, созданные против этих областей, обеспечивали бы лишь опосредуемый антителами иммунитет против небольшого числа изолятов Borrelia spp. Lovrich et al. (Clin. Diagn. Lab. Immunol. 2005, 12:746-751) идентифицировали эпитоп OspC боррелиацидных антител в пределах 7 С-концевых аминокислот (OspC7) белка. Более существенно, что этот эпитоп является консервативным среди патогенных Borrelia spp. Однако с традиционными лабораторными изолятами В. burgdorferi ss, которые экспрессируют OspA (т.е., содержат ospA/ospB оперон), невозможно манипулировать в лабораторных условиях, чтобы также индуцировать значительные уровни OspC боррелиацидных антител без существенного ослабления их способности индуцировать OspA боррелиацидные антитела. Более того, вакцинация, которая убивает традиционные лабораторные изоляты В. burgdorferi ss, которые экспрессируют OspA, не индуцирует боррелиацидные OspC-антитела (Schwan et al., Proc. Natl. Acad. Sci. USA 1995, 92:2909-2913, Obonio et al., 1999, J. Clin. Microbiol., 37:2137-2141).
Callister et al. (патенты США №№6,210,676 и 6,464,985, включенные здесь посредством ссылки) предложили использовать иммуногенный полипептидный фрагмент OspC, один или в комбинации с OspA-полипептидом, для приготовления вакцины для защиты людей и других млекопитающих от лаймской болезни. Livey et al. (патент США №6,872,550, включенный здесь посредством ссылки) также предложили вакцину для иммунизации от лаймской болезни, приготовленную из комбинации рекомбинаннтых OspA-, OspB- и OspC-белков. Однако на сегодняшний день никакая вакцина из рекомбинантных белков не показала улучшения по сравнению с вакцинами, которые в настоящее время продаются на рынке. Таким образом, сохраняется долгожданная потребность в средствах для улучшенной вакцины для защиты млекопитающих, и особенно собак, от лаймской болезни.
Цитирование любой приведенной здесь ссылки не должно толковаться как допущение, что такая ссылка представляет собой известный «уровень техники» для настоящей заявки.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Соответственно, настоящее изобретение обеспечивает новые иммуногенные композиции, которые могут быть использованы в вакцинах. В одном аспекте настоящего изобретения, вакцина защищает от лаймской болезни. В конкретном воплощении этого типа, реципиентом вакцины является собака. В другом воплощении, реципиентом вакцины является домашняя кошка. Другие домашние млекопитающие могут быть защищены вакциной и/или способами настоящего изобретения, такие как лошади и/или скот. Настоящее изобретение далее обеспечивает комбинацию вакцин для вызывания защитного иммунитета к лаймской болезни и других болезней, например других инфекционных болезней собак. Также обеспечиваются способы изготовления и применения вакцин согласно настоящему изобретению.
Вакцина согласно настоящему изобретению включает иммунологически эффективное количество организмов первого или единственного штамма (при необходимости инактивированного), который экспрессирует OspC-антиген. Штамм является таким, который, когда выращен при стандартных условиях культивирования, убит в присутствии OspC-специфических боррелиацидных антител (при необходимости требуется комплемент), включая боррелиацидные антитела против консервативного эпитопа OspC7, вызванного у животного, вакцинированного В.burgdorferi ss 50772 (АТСС №РТА-439). В конкретном воплощении этого типа, первый или единственный штамм геновида Borrelia конститутивно экспрессирует OspC-антиген. В более конкретном воплощении, первым штаммом является В.burgdorferi ss 50772 (АТСС №РТА-439).
Вакцинная композиция согласно настоящему изобретению далее может включать иммунологически эффективное количество инактивированных организмов из одного или более дополнительных штаммов (которые могут быть обобщенно обозначены здесь как второй штамм) из патогенного геновида Borrelia. В конкретном воплощении второй штамм обнаруживает OspA- и OspC-антигены.
Примеры подходящих вторых штаммов включают один или более из следующих:
В. burgdorferi ss S-1-10 (ATCC №РТА-1680), В.burgdorferi ss B-31 (АТСС №РТА-35210), В.afzelii (например, доступный как АТСС №51567) и В. garnii (например, доступный как АТСС №№51383 и 51991), В.burgdorferi ss DK7, В.burgdorferi ss 61BV3, В.burgdorferi ss ZS7, В.burgdorferi ss Pka, B.burgdorferi ss IP1,IP2,IP3, B.burgdorferi ss HII, B.burgdorferi ss P1F, B.burgdorferi ss Mil, B.burgdorferi ss 20006, B.burgdorferi ss 212, B.burgdorferi ss ESP1, B.burgdorferi ss Ne-56, B.burgdorferi ss Z136, B.burgdorferi ss ia и/или любые их комбинации.
Вакцинная композиция по широте охвата включает примерно от 1×104 до примерно 1×1010 организмов на миллилитр каждого соответствующего штамма. В конкретном воплощении, вакцина включает примерно от 1×106 до примерно 5×109 организмов на миллилитр каждого соответствующего штамма. В другом воплощении, вакцина включает примерно от 1,0×108 до примерно 5×108 организмов на миллилитр (или каждого) второго штамма и примерно от 5,0×108 до примерно 5×109 организмов на миллилитр первого штамма.
Вакцинная композиция также может включать фармацевтически приемлемый адъювант, например, такой как соединения алюминия (например, фосфат алюминия, гидроксид алюминия), метаболизируемые и неметаболизируемые масла, блок-полимеры, иммуностимулирующие комплексы, витамины и минералы и CARBOPOL® (например, CARBOPOL 941). В конкретном воплощении фармацевтически приемлемый адъювант включает однородно диспергированные капли масла микронного размера в в водной эмульсии (например, как продающиеся под торговой маркой Emulsigen®).
При необходимости, вакцинная композиция также включает фармацевтически приемлемый иммуностимулятор, например цитокины, факторы роста, хемокины, супернатанты из клеточных культур лимфоцитов, моноцитов или клеток из лимфоидных органов, препаратов из клеток и/или экстрактов из растений, бактерий или паразитов, или митогенов.
Изобретение далее обеспечивает способ иммунизации собаки или другого млекопитающего против патогенного Borrelia spp., особенно В. burgdorferi ss, включающий инъецирование собаки иммунологически эффективным количеством вышеупомянутой вакцины согласно изобретению. Такие вакцины могут включать примерно от 1×108 до примерно 3×109 организмов каждого соответствующего штамма, например. Вакцины могут вводиться такими способами, как внутримышечная инъекция, подкожная инъекция, внутривенная инъекция, внутрикожная инъекция, оральное введение, интраназальное введение и их комбинации. В конкретном воплощении, после вакцинации иммунизированная собака продуцирует боррелиацидные антитела.
Изобретение далее обеспечивает сыворотку, полученную от вакцинированного животного, которая содержит боррелиацидные антитела, которые связываются с В. burgdorferi ss OspC. Аналогично, изобретение обеспечивает очищенные антитела, которые связываются с OspC. В конкретном воплощении, сыворотка содержит значительную долю OspC-специфических боррелиацидных антител.
Изобретение далее обеспечивает комбинированные вакцины, которые включают один или более штаммов геновида Borrelia согласно настоящему изобретению в комбинации с одним или более другими патогенами собак и/или иммуногенами, включая, например, иммуногены для вызывания иммунитета к вирусу чумы собак, аденовирусу собак, парвовирусу собак, вирусу парагриппа собак, коронавирусу собак, вирусу гриппа собак и/или сероварам Leptospira, например, Leptospira kirscheneri серовар grippotyphosa, Leptospira interrogans серовар canicola, Leptospira interrogans серовар icterohaemorrhagiae, и/или Leptospira interrogans серовар potmona. Другие патогены собак, которые могут быть добавлены в комбинированную вакцину согласно настоящему изобретению, включают организмы Leishmania, такие как Leishmania major и Leishmania infantum;
Bordetella bronchiseptica; виды Mycoplasma (например, Mycoplasma cynos), вирус бешенства; организмы anaplasma, такие как anaplasma phagocytophilum и anaplasma platys; и Ehrlichia cams.
Эти и другие аспекты настоящего изобретения будут лучше оценены ссылкой на следующие чертежи и подробное описание.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
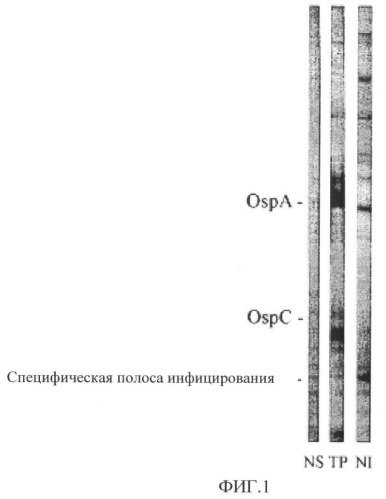
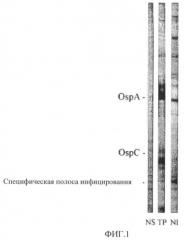
На фиг.1 представлен Western-блот контроля нормальной собачьей сыворотки (NS) или сывороток из собаки после вакцинации (43-й день исследования) с тестируемым продуктом (ТР) или после контрольного заражения (134-й день исследования) В. burgdorferi ss-инфицированными клещами (N1). Отмечается присутствие специфических для инъекции антител против белка с молекулярным весом приблизительно 20 кДа.
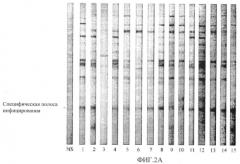
На фиг.2А представлен Western-блот контроля нормальной собачьей сыворотки (NS) или сывороток из отдельных групп индивидуальных собак (пронумерованных 1-15) после вакцинации плацебо и контрольного заражения В. burgdorferi ss-инфицированными клещами (134-й день исследования).
На фиг.2В представлен Western-блот контроля нормальной собачьей сыворотки (NS) или сывороток из отдельных групп индивидуальных собак (пронумерованных 1-15) после вакцинации тестируемым продуктом. Отмечается присутствие специфических для инъекции 20 кДа-антител у 14 собак (93%), вакцинированных плацебо (Фиг.2А) и у 0 собак (p<0,0001), вакцинированных тестируемым продуктом (Фиг.2 В).
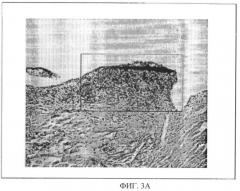
Фиг.3А является характерным примером гистопатологических изменений в суставах вакцинированных плацебо собак, которые были инфицированы В.burgdorferi ss. Область внутри прямоугольника показывает значительную инфильтрацию нейтрофильных и мононуклеарных клеток, характерных для артрита, вызываемого лаймской болезнью собак.
Фиг.3В является характерным примером отсутствия гистопатологических изменений в суставах вакцинированных тестируемым продуктом собак, которые были инфицированы В.burgdorferi ss. Область внутри овала свободна от каких-либо инфильтрующих нейтрофильных и мононуклеарных клеток.
Фиг.4 иллюстрирует определение OspC7 ELISA-реактивности, используя нормальные сыворотки (N) от особей без предыдущей истории (сводная диаграмма) лаймских или родственных лаймским симптомов (n=36), неохарактеризованные сыворотки от доноров крови (BD, n=100) или особей, подвергшихся холестерольным скринингам (CS, n=100), или сыворотки от добровольцев с факторами крови или болезнями, которые обычно перекрестно-реактивны с антигенами В.burgdorferi ss, включая антинуклеарные антитела (ANA, n=20), ревматоидным фактором (RF, n=20), мононуклеозом (EBV, n=10), цитомегаловирусом (CMV, n=10), сифилисом (SYPH, n=13) или американским клещевым риккетсиозом (RMSF, n=4). Сплошная линия обозначает три стандартных отклонения от средней величины поглощения нормальной и потенциально перекрестно-реактивной сывороток. Значения над линией соответствуют положительным результатам с 99%-ной вероятностью (1% - фоновое значение).
Фиг.5 иллюстрирует OspC7 ELISA-реактивность, используя сыворотки от пациентов с вероятной лаймской болезнью с мигрирующей эритемой (n=86), представительных пациентов с типичными поражениями лаймской болезнью, пациентов с вероятной лаймской болезнью с «атипичными поражениями» (n=22) и пациентов с возможной лаймской болезнью с конституциональными симптомами (n=49) [самые ранние клинические симптомы]. Сплошная линия обозначает три стандартных отклонения от средней величины поглощения нормальной и потенциально перекрестно-реактивной сывороток.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение обеспечивает вакцинные композиции, которые включают иммунологически эффективное количество организмов из одного или более штаммов геновида Borrelia, которые индуцируют эффективный опосредованный боррелиацидными антителами иммунитет у реципиентного вакцинированного животного. Когда организмы таких штаммов выращивают при стандартных для роста геновида Borrelia условиях, они поражаются в присутствии OspC-специфических антител, например, антитела или антител, вызванных у животных, вакцинированных В. burgdorferi ss 50772 (АТСС №РТА-439).
В одном аспекте настоящего изобретения, окно эффективности антител, индуцируемых вакциной согласно настоящему изобретению, значительно увеличено по сравнению с традиционными вакцинами, основанными единственно на OspA боррелиацидных антителах. В другом аспекте, вакцина согласно настоящему изобретению обеспечивает лучшую возможность стимулирования выгодного иммунологического ответа памяти, например, благодаря экспрессии OspC in vivo, и/или дополнительную и/или усиленную защиту от многочисленных патогенных штаммов Borrelia spp.
В одном воплощении настоящего изобретения, когда организмы таких штаммов выращивают в стандартных для роста геновида Borrelia условиях, они конститутивно экспрессируют OspC-антиген. В конкретном воплощении этого типа, когда организмы таких штаммов выращивают в стандартных для роста геновида Borrelia условиях, они уничтожаются специфической комплементарной реакцией. В еще одном воплощении, значительная доля OspC-специфических боррелиацидных антител в сыворотке, индуцируемых вакциной, включающей организмы таких штаммов, является специфичной к консервативному эпитопу OspC7 и, тем самым, обеспечивает защиту от многочисленных патогенных геновидов Borrelia (например, В.burgdorferi ss, В.afzelii и В.garinii). В еще одном воплощении, в организмах таких штаммов не обнаруживается ни OspA-, ни OspB-антигена. В другом воплощении, организмы таких штаммов имеют любые два или более из этих свойств. В еще одном воплощении, организмы таких штаммов имеют любые три или более из этих свойств. И в еще одном воплощении, организмы таких штаммов имеют любые четыре или более из этих свойств. В конкретном воплощении, организмы таких штаммов имеют все эти свойства. Одним из таких конкретных штаммов является В.burgdorferi ss 50772 (АТСС №РТА-439).
В альтернативном воплощении, изобретенная вакцина представляет собой композицию, которая включает оба описанных выше первых штамма и эффективное количество организмов, по крайней мере, второго штамма. Второй штамм предпочтительно относится к патогенному геновиду Borrelia, который индуцирует боррелиацидные OspA-антитела, когда вводится как часть изобретенной вакцины. В композицию могут быть дополнительно включены один или более дополнительных вакцинных геновидов. Кроме того, вакцины согласно настоящему изобретению могут включать один или более других патогенов и/или иммуногенов млекопитающих (например, собак).
Для более полной оценки изобретения ниже приводятся следующие определения.
Использование терминов в единственном числе в целях удобства в описании никоим образом не предполагает, что оно является ограничением. Так, например, ссылка на композицию, включающую «полипептид», включает ссылку на один или более таких полипептидов. Кроме того, ссылка на «организм» включает ссылку на множество таких организмов, если не указано иначе.
Используемый здесь термин «приблизительно» применяется взаимозаменяемо с термином «около» и означает, что величина находится в пределах пятидесяти процентов от указанного значения, т.е. композиция, содержащая «приблизительно» 1×1010 организмов на миллилитр, содержит от 5×109 до 5×1010 организмов на миллилитр.
Термин «геновид» впервые был использован и получил определение у Baranton et al., 1992, International J. of Systematic Bacteriology 42: 378-383, и используется здесь в том же значении, что и термин «вид» используется при описании таксономии организмов, не относящихся к Borrelia.
«Стандартные условия выращивания» для культивирования геновидов Borrelia требуют роста при температуре в интервале от около 33°С до около 35°С в среде BSK (Barbour Stoenner Kelly). BSK-среду, как она здесь описана, приготовляли в соответствии с Callister et al. [Detection of Borreliacidal Antibodies by Flow Cytometry, Section 11.5.1 - 11.5.12, Current Protocols in Cytometry, John Wiley and Sons, Inc. Supplement 26, (2003) - включена здесь во всей полноте в качестве ссылки]. (BSK-среда также коммерчески доступна, например, от Sigma, St. Louis, МО).
Как используется здесь, «OspC7» означает иммунодоминантный эпитоп OspC боррелиацидного антитела, расположенный в области из 7 аминокислот (Lovrich et al., 2005, Clin. Diagn. Lab. Immunol., 12:746-751, включенная здесь во всей полноте в качестве ссылки) в пределах 50 С-концевых аминокислот OspC, как раскрыто Callister et al. (Патенты США №6,210.676 В1 и №6,464,985 В1, которые во всей полноте включены здесь в качестве ссылки), которая является абсолютно консервативной среди известных патогенных Borrelia spp. Консервативность легко подтверждается blast-поиском кодонного сегмента, кодирующего сегмент из 7 аминокислот, описанный Lovrich et al. Такой поиск, проведенный 9 октября 2006 г., дал список результатов из 100 видов Borrelia, содержащих упомянутый выше 7-мерный кодирующий сегмент эпитопа OspC.
«OspC-специфическое боррелиацидное антитело» представляет собой антитело, которое обнаруживается, например, в сыворотке животного, вакцинированного В. burgdorferi ss 50772 (АТСС №РТА-439), и является антителом, которое избирательно связывается с любым эпитопом OspC-антигена и уничтожает спирохеты, зависимые или независимые от комплемента. «OspC-специфическое боррелиацидное антитело» представляет собой антитело, которое обнаруживается, например, в сыворотке животного, вакцинированного В. burgdorferi ss 50772 (АТСС №РТА-439), и является антителом, которое избирательно связывается с 7 С-концевыми аминокислотами OspC, как описано Lovrich et al. [Clin. Diagn. Lab. Immunol., 12:746-751, (2005), включенная здесь во всей полноте в качестве ссылки] и уничтожает спирохеты (как правило, посредством индуцирования атаки комплемент-опосредованным мембранным комплексом). Специфичность OspC боррелиацидных антител твердо установлена. Например, OspC боррелиацидные антитела обычно обнаруживаются в сыворотке заболевшего лаймской болезнью с помощью измерения восприимчивости В.burgdorferi ss 50772 в тесте боррелиацидных антител. Сыворотки от пациентов-людей с близкородственными заболеваниями редко (2%) содержат перекрестно-реактивные антитела, которые также убивают штамм 50772 (подробно описано Callister et al., 1996, Clinical and Diagnostic Laboratory Immunology 3(4):399-402). Более того, пептидный ELISA, который использует OspC боррелиацидный эпитоп, точно захватывает боррелиацидные антитела в сыворотке лаймской болезни, а сыворотки от пациентов с другими близкородственными заболеваниями редко (2%) содержат перекрестно-реактивные антитела, которые связывают OspC7-пептид (иллюстрируется Фиг.4 и 5).
Когда «значительная доля» OspC-специфических боррелиацидных антител в сыворотках, индуцируемых вакциной, являются специфическими для консервативного эпитопа OspC7, это означает, что имеется измеримое уменьшение OspC-специфических боррелиацидных антител в сыворотках после поглощения этих сывороток OspC7. Предпочтительно, оно определяется как, по крайней мере, 2-кратное уменьшение титра боррелиацидных антител сывороток, обнаруживаемое при использовании В. burgdorferi ss 50772, и более предпочтительно, как 2-4-кратное или большее уменьшение титра боррелиацидных антител сывороток после поглощения этих сывороток OspC7.
«Комплемент-специфическая реакция» - это реакция антител, которая требует присутствия сывороточного комплемента, чтобы организм(ы) Borrelia spp.были уничтожены боррелиацидным антителом.
Для целей данного изобретения «инактавированный» организм Borrelia burgdorferi ss означает организм, который способен вызывать иммунный ответ у животного, но не способен инфицировать это животное. Изоляты Borrelia burgdorferi ss могут быть инактивированы агентом, выбранным из группы, состоящей из бинарного этиленимина, бета-пропиолактона, тимеросала или тепла. В конкретном воплощении, изоляты Borrelia burgdorferi ss инактивируют бинарным этиленимином.
Термины «адъювант» и «иммуностимулятор» используются здесь взаимозаменяемо и определяются как одно или более веществ, которые вызывают стимуляцию иммунной системы. В данном контексте, адъювант используют для усиления иммунного ответа на один или более вакцинных антигенов/изолятов. Адъювант может вводиться животной мишени до, в комбинации с или после введения вакцины. Адъюванты согласно настоящему изобретению могут быть получены из любого числа источников, включая природные источники, рекомбинантные источники и/или может быть химически синтезированным, и т.д. Примеры химических соединений, которые могут быть использованы в качестве адъювантов, включают, но не ограничиваются ими, соединения алюминия, метаболизируемые или неметаболизируемые масла, блок-полимеры, ISCOМы (иммуностимулирующие комплексы), витамины и минералы (включая, но без ограничения ими: витамин Е, витамин А, селен и витамин В12), Quil А (сапонины) и полимеры акриловой кислоты, перекрестно-связанной с полиалкениловыми эфирами или дивинил гликолем, например, CARBOPOL®.
Дополнительные примеры адъювантов, которые иногда специфически называют иммуностимуляторами, включают компоненты бактериальных и грибковых клеток (например, липополисахариды, липопротеины, гликопротеины, мурамилпептиды, бета-1,3/1,6-глюканы), различные сложные углеводы, происходящие из растений (например, гликаны, ацеманнан), различные белки и пептиды, происходящие из животных (например, гормоны, цитокины, ко-стимулирующие факторы), и новые нуклеиновые кислоты, происходящие из вирусов и других источников (например, двунитевая РНК, CpG). Кроме того, любое число комбинаций вышеупомянутых веществ может обеспечить эффект адъюванта и, следовательно, может представлять собой адъювант согласно настоящему изобретению. Одним из предпочтительных адъювантов является Emulsigen®.
В.burgdorferi ss 50772 (АТСС №РТА-439), как он заявлен в патенте US 6,210,676, и В.burgdorferi ss S-1-10 (АТСС №РТА-1680), как он заявлен в патенте US 6,316,005, были депонированы в Американской Коллекции Типов Культур, 10801 University Boulevard Manassas (VA) 20110, 30 июля 1999 и 11 апреля 2000, соответственно. Совладельцы прав на настоящее изобретение по отдельности имеют права на эти два вышеупомянутые патента.
Следует также понимать, что данное изобретение не ограничивается конкретными конфигурациями, стадиями процессов и материалами, раскрытыми здесь, поскольку конфигурации, стадии процессов и материалы могут в определенной мере варьироваться. Также следует понимать, что использованная здесь терминология применяется единственно с целью описания конкретных воплощений и без намерения являться ограничительной, поскольку объем настоящего изобретения ограничивается только прилагаемыми пунктами притязаний и их эквивалентами.
Дополнительные вакцинные штаммы
Дополнительные OspC штаммы
В одном аспекте, настоящее изобретение обеспечивает применение В.burgdorferi ss 50772 (АТСС №РТА-439) в вакцине, которая защищает от лаймской болезни, одного или в комбинации с другими штаммами геновида Borrelia. Примечательно, что В. burgdorferi ss 50772 первоначально был отвергнут в качестве кандидата для использования в вакцине, потому что было некорректно сообщено, что этот штамм не экспрессирует OspC (Anderson et al., 1996, J. Clin. Microbiol., 34: 524-529).
Настоящее изобретение далее обеспечивает уникальные и специфические критерии отбора/идентификации других таких полезных изолятов для вакцин согласно настоящему изобретению. В частности, изоляты могут быть отобраны/идентифицированы, как чувствительные к уничтожению OspC-специфическими антителами, и, предпочтительно, также, как обладающие одним или более, или всеми из следующих свойств: (i) чувствительность к возможности быть уничтоженными OspC-специфическими антителами у реципиента, вакцинированного этим изолятом, (ii) способность индуцировать OspC-боррелиацидные антитела у реципиента, вакцинированного этим изолятом;
(iii) чтобы значительная доля OspC-боррелиацидных антител, индуцированных указанным образом, являлась специфической для консервативного эпитопа в пределах 7 С-концевых аминокислот (OspC7); (iv) отсутствие способности экспрессировать OspA или OspB; и/или (v) способность конститутивно экспрессировать OspC in vitro.
А. Супрессия OspA/B-экспресии и усиление экспрессии OspC с помощью условий культивирования
Obonyo et al. (J. Clin. Microbiol. 1999, 37: 2137-2141) было показано, что экспрессия OspA может быть ослаблена, а экспрессия OspC может быть повышена в течение пятидневного периода посредством со-культивирования нормального патогенного штамма Borrelia spp (штаммы JMNT и N40 В.burgdorferi ss) с клеточной линией клеща (Ixodes scapularis ISE6). Самый отчетливый эффект наблюдался при культивировании при 37°С. Таким образом, данный способ превращает один или более традиционных патогенных штаммов Borrelia в форму, полезную для вакцины согласно настоящему изобретению.
В. Супрессия OspA/B-экспрессии и усиление экспрессии OspC с помощью мутации
В следующем воплощении, использовалось генетическое манипулирование со штаммом Borrelia spp., который первоначально экспрессирует OspA и OspB, для уменьшения экспрессии или чтобы делегировать гены, которые кодируют экспрессию OspA и OspB, что приводит к увеличению экспрессии OspC. Подразумевается, что любой известный в данной области техники способ генетического манипулирования может использоваться для этой цели. Например, инактивированный аналог OspA/OspB-гена вводится во множество организмов доступного штамма Borrelia spp. в форме, совместимой с Borrelia spp. плазмиды, полученной с помощью антибиотического селективного маркера (см., например, Grimm et al., 2004, Proc. Nat11 Acad. Sci. 101(9): 3142-3147, где сообщается, что экспрессия OspC может блокироваться в Borrelia spp. путем введения OspC-инактивирующих и комплементационных плазмид в В.burgdorferi B31-A3 штамм). Рекомбинационные события между введенной плазмидой и природно встречающейся плазмидой, несущей OspA/OspB, приводят к определенному числу успешно рекомбинировавших организмов Borrelia spp., несущих мутированную OspA/OspB-плазмиду. Селекция может предполагаться, например, через связанную с антибиотиками устойчивость и рост в присутствии соответствующего антибиотика. Подразумевается, что организмы Borrelia spp.с селективно ликвидированной экспрессией OspA/OspB будут иметь повышенную экспрессию OspC.
В следующем возможном воплощении, один или более дополнительных организмов В. burgdorferi ss или Borrelia spp., которые экспрессируют OspA, OspB и/или один или более дополнительных Osp антигенов, могут быть включены в вакцинную композицию как дополнительные организмы.
Предпочтительно, каждый соответствующий инактивированный организм представлен в вакцине в концентрации в интервале примерно от 1×104 до примерно 1×1010 организмов/мл. В частности, вакцину предпочтительно вводят собаке в дозе не менее 1,0×108 организмов/мл В. burgdorferi ss S-1-19 и не менее 5,0×108 организмов/мл В. burgdorferi ss 50772.
Дополнительные OspA-штаммы
Вторым штаммом, обеспечивающим OspA-антиген, может быть традиционный лабораторный патогенный изолят В. burgdorferi ss (Barbour et al., 1985, J. din. Microbiol. 52: 478-484), такой как В. burgdorferi ss B-31 (ATCC №35210). Конкретный второй организм может быть представлен В. burgdorferi ss S-1-10 (ATCC №РТА-1680). Дополнительные штаммы, пригодные для использования в качестве второго организма для вакцинной композиции, оптимизированной для регионов за пределами Северной Америки, включают, например, штаммы: В.burgdorferi ss B-31 (ATCC №35210), В.afzelii (например, доступный как ATCC №51567) и В.garinii (например, доступный как ATCC №№51383 и 51991), а также те, которые перечислены ниже в Таблице 1.
| Таблица 1 | ||
| Штамм | Страна | культивирован из |
| В.burgdorferi ss DK71 | Дания | кожи |
| В.burgdorferi ss 61BV31 | Германия | кожи |
| В.burgdorferi ss ZS71 | Швейцария | клеща |
| В.burgdorferi ss Pka1 | Германия | клеща |
| В.burgdorferi ss IP1, IP2, IP31 | Франция | CSF |
| В.burgdorferi ss НII1 | Италия | крови |
| В.burgdorferi ss P1F1 | Швейцария | синовиальной жидкости |
| В.burgdorferi ss Mil1 | Словакия | клеща |
| В.burgdorferi ss 200061 | Франция | клеща |
| В.burgdorferi ss 2121 | Франция | клеща |
| В.burgdorferi ss ESP11 | Испания | клеща |
| B.burgdorferi ss Ne-561 | Швейцария | клеща |
| B.burgdorferi ss Z1361 | Германия | клеща |
| B.burgdorferi ss ia2 | Финляндия | CSF |
| 1Lagal et al., J. Clin. Microbiol. 2003, 41: 5059-5065. | ||
| 2Heikkia et al„ J. Clin. Microbiol. 2002, 40: 1174-1180. |
Вакцинная композиция может включать фармацевтически приемлемый адъювант.«Адъюванты» - это агенты, которые неспецифически увеличивают иммунный ответ на конкретный патоген, уменьшая, таким образом, количество антигена, необходимого в любой данной вакцине, и/или частоту введения инъекций, необходимую для того, чтобы создать адекватный иммунный ответ к представляющему интерес антигену. Подходящие адъюванты для вакцинации животных включают, но без ограничения ими, Адъювант 65 (содержащий арахисовое масло, маннида моноолеат и алюминия моностеарат); полный или неполный адъювант Фрейнда; минеральные гели, такие как алюминия гидроксид, алюминия фосфат и алюминиевые квасцы; сурфактанты, такие как гексадесиламин, октадециламин, лизолецитин, диметилдиоктадециламмония бромид, N,N-диактадецил-N′,N′-бис(2-гидроксиметил) пропандиамин, метоксигексадецилглицерол и плюрониевые полиолы; полианионы, такие как пиран, декстран сульфат, поли 1C, полиакриловая кислота и CARBOPOL® (например, CARBOPOL 941); пептиды, такие как мурамил дипептид, диметилглицин и тафцин; и масляные эмульсии. Сведения, касающиеся адъювантов, раскрыты, например, в выпуске Р.Tijssen [Practice and Theory of Enzyme Immunoassays, 3rd Edition, 1987, Elsevier, New York, включенном здесь в качестве ссылки].
При необходимости, вакцинная композиция может дополнительно включать фармацевтически приемлемый иммуностимулятор, такой как компоненты стенок бактериальных и/или грибковых клеток (например, липополисахариды, липопротеины, гликопротеины, мурамилпептиды), различные сложные углеводы, происходящие из растений (например, гликаны, ацеманнан), различные белки и пептиды, происходящие из животных (например, гормоны, цитокины, ко-стимуляторные факторы) и новые нуклеиновые кислоты, происходящие из вирусов и/или других источников (например, двунитевую РНК, CpG).
Вакцинная композиция легко вводится любым стандартным путем, включая внутривенную, внутримышечную, подкожную, оральную, интраназальную, внутрикожную и/или внутрибрюшинную вакцинацию. Специалисту будет понятно, что вакцинная композиция предпочтительно составляется конкретно для каждого типа реципиентного животного и способа введения.
Таким образом, настоящее изобретение обеспечивает также способы иммунизации собаки против В. burgdorferi ss и других Borrelia spp. Один из таких способов включает инъецирование собаки посредством иммунологически эффективного количества вакцины согласно настоящему изобретению, так что собака продуцирует соответствующие OspA и OspC боррелиацидные антитела.
В одном воплощении, подкожное введение согласно настоящему изобретению приводит к продуцированию высоких концентраций OspA и OspC боррелиацидных антител, включая боррелиацидные антитела, специфические для OspC7. В другом воплощении, настоящее изобретение обеспечивает вакцину, которая включает специфическое минимальное количество каждого штамма В.burgdorferi ss, которое является эффективным против приносящего вред Borrelia spp. В еще одном воплощении, вакцина согласно настоящему изобретению является эффективной для защиты от В.burgdorferi ss и других патогенных инфекций Borrelia spp. у собак. В конкретном воплощении, вакцина включает безопасн