Глицерин-связанные пэгилированные сахара и гликопептиды
Иллюстрации
Показать всеИзобретение относится к области медицины. Предложен пептидный конъюгат, содержащий гликозилированный пептид, который ковалентно связан с фрагментом полиэтиленгликоля (ПЭГ) через интактную гликозильную связывающую группу. Изобретение обеспечивает получение нового химического соединения, содержащего разветвленную молекулу ПЭГ, сиалильную связывающую группу и пептид с пониженной антигенностью. 2 з.п. ф-лы, 7 ил., 10 пр.
Реферат
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет предварительной патентной заявки США No.60/828208, поданной 4 октября 2006, которая приведена в настоящем описании в качестве ссылки в полном объеме для любой цели.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В иллюстративном варианте "гликоPEGилированные" молекулы по настоящему изобретению получают в результате опосредствованного ферментами образования конъюгата между гликозилированным или негликозилированным пептидом и ферментативно трансферабельным сахарильным фрагментом, который включает внутри своей структуры модифицирующую группу, такую как полимерная модифицирующая группа, такая как поли(этиленгликоль). Например, в одном из вариантов пептидом является представитель, выбранный из морфогенетических белков кости (например, BMP-1, BMP-2, BMP-3, BMP-4, BMP-5, BMP-6, BMP-7, BMP-8, BMP-9, BMP-10, BMP-11, BMP-12, BMP-13, BMP-14, BMP-15), нейротрофинов (например, NT-3, NT-4, NT-5), факторов роста и дифференциации (например, GDF-5), нейротрофического фактора, выделенного из линии глиальных клеток (GDNF), нейротрофического фактора, выделенного из головного мозга (BDNF), фактора роста нервов (NGF), протеазы фактора фон Виллебранда (vWF), фактора VII, фактора VIIa, фактора VIII, фактора IX, фактора X, фактора XI, фактора VIII с удаленным В-доменом, слитого белка vWF-фактор VIII с полноразмерным фактором VIII, слитого белка vWF-фактор VIII с удаленным B-доменом фактора VIII, эритропоэтина (EPO), гранулоцитарного колониестимулирующего фактора (G-CSF), гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF), интерферона альфа, интерферона бета, интерферона гамма, α1-антитрипсина (ATT, или ингибитора α-1 протеазы), глюкоцереброзидазы, активатора плазминогена тканевого типа (TPA), интерлейкина-2 (IL-2), урокиназы, ДНКазы человека, инсулина, поверхностного белка гепатита B (HbsAg), гормона роста человека, слитого белка рецептора TNF - Fc-участка IgG (Enbrel™), моноклонального антитела против HER2 (Herceptin™), моноклонального антитела к белку F респираторного синцитиального вируса (Synagis™), моноклонального антитела против TNF-α (Remicade™), моноклонального антитела к гликопротеину IIb/IIIa (Reopro™), моноклонального антитела к CD20 (Rituxan™), анти-тромбина III (AT III), хорионического гонадотропина человека (hCG), альфа-галактозидазы (Fabrazyme™), альфа-идуронидазы (Aldurazyme™), фолликулостимулирующего гормона, бета-глюкозидазы, моноклонального антитела против TNF-альфа (MLB 5075), глюкагоно-подобного пептида-1 (GLP-1), глюкагоно-подобного пептида-2 (GLP-2), бета-глюкозидазы, альфа-галактозидазы A и фактора роста фибробластов. Полимерная модифицирующая группа присоединена к сахарильному фрагменту (то есть через единственную группу, образованную в результате реакции двух реакционных групп) или через линкерный фрагмент, например замещенный или незамещенный алкил, замещенный или незамещенный гетероалкил, и т.д.
Таким образом, в одном из аспектов настоящее изобретение относится к конъюгату PEG фрагмента, например, PEG, и пептида, который обладает in vivo активностью, подобной или каким-либо другим образом аналогичной активности терапевтического пептида, разрешенного в настоящей области. В конъюгате по настоящему изобретению PEG фрагмент ковалентно связан с пептидом через интактную гликозильную связывающую группу. Примеры интактных гликозильных связывающих групп включают фрагменты сиаловой кислоты, которые являются PEG производными сиаловой кислоты.
Полимерная модифицирующая группа может быть присоединена в любом положении гликозильного фрагмента пептида. Более того, полимерная модифицирующая группа может быть связана с гликозильным остатком в любом положении аминокислотной последовательности дикого типа или мутантного пептида.
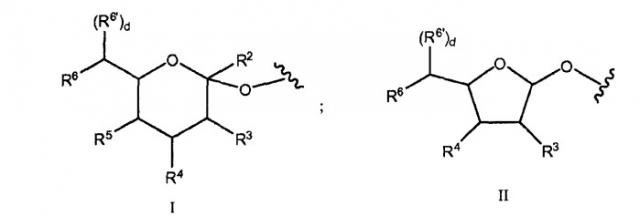
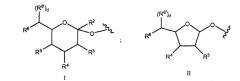
Например, в одном из вариантов настоящего изобретения предложен пептид, который конъюгирован через гликозильную связывающую группу с полимерной модифицирующей группой. Примеры пептидных конъюгатов включают гликозильную связывающую группу формулы, выбранной из:
и
В формулах I, Ia, II или IIa, R2 представляет собой H, CH2OR7, COOR7, COO- или OR7, где R7 представляет собой H, замещенный или незамещенный алкил или замещенный или незамещенный гетероалкил. Символы R3, R4, R5, R6 и R6' независимо включают H, замещенный или незамещенный алкил, OR8, NHC(O)R9 и сахарильную группу. Индекс d равен 0 или 1. R8 и R9 независимо выбраны из H, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, сиаловой кислоты. По меньшей мере, один из R3, R4, R5, R6 или R6' включает полимерную модифицирующую группу, например PEG. В одном из примеров варианта осуществления R6 и R6' вместе с атомом углерода, к которому они присоединены, являются компонентами боковой цепи сиалильного фрагмента. В следующем примере варианта осуществления указанная боковая цепь изменена с помощью полимерной модифицирующей группы.
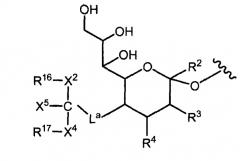
В одном из примеров варианта осуществления полимерная модифицирующая группа связана с гликозильной связывающей группой, обычно через гетероатом гликозильного ядра (например, N, O) через линкер L, как представлено далее:
R1 представляет собой полимерную модифицирующую группу, и L выбран из связи и связывающей группы. Индекс w представляет собой целое число, выбранное из 1-6, предпочтительно 1-3 и более предпочтительно 1-2. Примеры связывающих групп включают замещенный или незамещенный алкил, замещенные или незамещенные гетероалкильные фрагменты и сиаловую кислоту. Примером компонента линкера является ацильный фрагмент. Другим примером связывающей группы является аминокислотный остаток (например, цистеин, серин, лизин и короткие олигопептиды, например, Lys-Lys, Lys-Lys-Lys, Cys-Lys, Ser-Lys и т.д.).
Если L представляет собой связь, то ее получают путем взаимодействия реакционноспособной функциональной группы предшественника R1 и реакционноспособной функциональной группы с комплементарной реакционной способностью предшественника гликозильной связывающей группы. Если L представляет собой связывающую группу ненулевого порядка, то L можно ввести в гликозильный фрагмент перед реакцией с R1 предшественником. Альтернативно, предшественники R1 и L можно включить в предварительно сформированную кассету, которая соответствующим образом присоединена к гликозильному фрагменту. Как будет показано далее, выбор и получение предшественников с соответствующими реакционноспособными функциональными группами находится в области знаний специалистов в данной области. Более того, присоединение предшественников осуществляется химическими способами, которые хорошо известны специалистам в данной области.
В одном из вариантов осуществления L представляет собой связывающую группу, которая образована аминокислотой или небольшим пептидом (например, из 1-4 аминокислотных остатков), обеспечивая модифицикацию сахара, в котором полимерный модифицирующий фрагмент присоединен через замещенный алкильный линкер. Примеры линкеров включают глицин, лизин, серин и цистеин. Аминокислотные аналоги, как определено в настоящем описании, также могут использовать в качестве линкерных компонентов. Аминокислоту можно модифицировать дополнительным линкерным компонентом, например алкилом, гетероалкилом, ковалентно связанным через ацильную связь, например, амидом или уретаном, образованными за счет аминного фрагмента аминокислотного остатка.
В одном из примеров вариантов осуществления гликозильная связывающая группа имеет структуру, показанную формулами I или Ia, и R5 включает полимерную модифицирующую группу. В другом примере варианта осуществления R5 включает как полимерную модифицирующую группу, так и линкер L, присоединяющий полимерную модифицирующую группу к гликозильному ядру. L может иметь линейную или разветвленную структуру. Аналогично, полимерная модифицирующая группа может быть разветвленной или неразветвленной.
Полимерная модифицирующая группа содержит два или более повторяющихся звена, которые могут быть водорастворимыми или практически нерастворимыми в воде. Примеры водорастворимых полимеров, которые можно использовать в соединениях по настоящему изобретению, включают PEG, например m-PEG, PPG, например, m-PPG, полисиаловую кислоту, полиглутамат, полиаспартат, полилизин, полиэтиленимин, биоразлагаемые полимеры (например полилактид, полиглицерид) и функционализированный PEG, например терминально-функционализированный PEG.
Гликозильное ядро гликозильных связывающих групп, которые можно использовать в пептидных конъюгатах, выбирают как из природных, так и неприродных фураноз и пираноз. Сахариды неприродного происхождения необязательно включают алкилированный или ацилированный гидроксильный и/или аминный фрагмент, например эфирные, сложноэфирные и амидные заместители кольца. Другие сахариды неприродного происхождения включают H, гидроксильный, эфирный, сложноэфирный или амидный заместитель в таком положении кольца, в котором такой заместитель отсутствует в природных сахаридах. Альтернативно, у углевода отсутствует заместитель, который должен был бы присутствовать у углевода при его названия, например, дезоксисахара. Следующие примеры неприродных сахаров включают как окисленные (например, -оновые и -уроновые кислоты), так и восстановленные (сахарные спирты) углеводы. Сахарный фрагмент может быть моно-, олиго- или полисахаридом.
Примеры природных сахаров, которые можно использовать в качестве компонентов гликозильных связывающих групп в соединениях по настоящему изобретению, включают глюкозу, глюкозамин, галактозу, галактозамин, фукозу, маннозу, маннозамин, ксиланозу, рибозу, N-ацетилглюкозу, N-ацетилглюкозамин, N-ацетилгалактозу, N-ацетилгалактозамин и сиаловую кислоту.
В одном из вариантов осуществления настоящее изобретение относится к пептидному конъюгату, содержащему группу:
где D представляет собой член, выбранный из -OH и R1-L-HN-; G представляет собой член, выбранный из H и R1-L- и -C(O)(C1-С6)алкила; R1 представляет собой фрагмент, содержащий неразветвленный или разветвленный поли(этиленгликолевый) остаток; и L представляет собой линкер, например, связь ("нулевого порядка"), замещенный или незамещенный алкил и замещенный или незамещенный гетероалкил. В иллюстративных вариантах, если D представляет собой OH, то G представляет собой R1-L-, и если G представляет собой -C(O)(C1-C6)алкил, то D представляет собой R1-L-NH-.
В другом аспекте настоящее изобретение относится к пептидному конъюгату, содержащему гликозильную связывающую группу, где гликозильная связывающая группа присоединена к аминокислотному остатку указанного пептида, и где указанная гликозильная связывающая группа содержит сиалильную связывающую группу, с формулой, где группа выбрана из:
и
где
представляют собой модифицирующие группы. R2 представляет собой член, выбранный из H, CH2OR7, COOR7, COO- и OR7. R7 представляет собой член, выбранный из H, замещенного или незамещенного алкила и замещенного или незамещенного гетероалкила. R3 и R4 представляют собой члены, независимо выбранные из H, замещенного или незамещенного алкила, OR8 и NHC(O)R9. R8 и R9 независимо выбран из H, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила и сиалила. La представляет собой линкер, выбранный из связи, замещенного или незамещенного алкила и замещенного или незамещенного гетероалкила. X5, R16 и R17 независимо выбран из нереакционноспособной группы и полимерных фрагментов (например, поли(алкиленоксид), например, PEG). Нереакционноспособные группы включают группы, которые рассматривают как практически нереакционноспособные, нейтральные и/или стабильные при физиологических значениях pH, например, H, замещенный или незамещенный алкил, замещенный или незамещенный гетероалкил и тому подобные. Примеры полимерного фрагмента включают разветвленные структуры, представленные формулами IIIa, и их примеры, описанные ниже. Специалистам должно быть понятно, что PEG фрагмент в указанных формулах может быть заменен другими полимерами. Примеры полимеров включают полимеры, относящиеся к семейству поли(алкиленоксидов). X2 и X4 независимо представляют выбранные фрагменты связи, соединяющие полимерные фрагменты R16 и R17 с C. Индекс j представляет собой целое число, выбранное из 1-15.
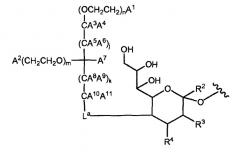
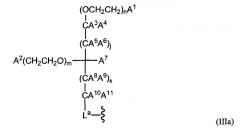
В другом примере варианта осуществления полимерная модифицирующая группа имеет структуру в соответствии со следующей формулой:
в которой индексы m и n представляют собой целые числа, независимо выбранные из 0-5000. A1, A2, A3, A4, A5, A6, A7, A8, A9, A10 и A11 представляют собой члены, независимо выбранные из H, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила, замещенного или незамещенного гетероарила, -NA12A13, -OA12 и -SiA12A13. A12 и A13 представляют собой члены, независимо выбранные из замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила и замещенного или незамещенного гетероарила.
В одном из примеров вариантов осуществления полимерная модифицирующая группа имеет структуру, включающую фрагмент, соответствующий следующим формулам:
и
В другом примере варианта осуществления в соответствии с представленными выше формулами полимерная модифицирующая группа имеет структуру, соответствующую следующей формуле:
В одном из примеров варианта осуществления m и n представляют собой целые числа, независимо выбранные из от около 1 до около 5000, предпочтительно от около 100 до около 4000, более предпочтительно от около 200 до около 3000, еще более предпочтительно от около 300 до около 2000 и еще более предпочтительно от около 400 до около 1000. В одном из примеров варианта осуществления m и n представляют собой целые числа, независимо выбранные из от около 1 до около 500. В одном из примеров варианта осуществления m и n представляют собой целые числа, независимо выбранные из от около 1 до около 70, от около 70 до около 150, от около 150 до около 250, от около 250 до около 375 и от около 375 до около 500. В одном из примеров варианта осуществления m и n представляют собой целые числа, независимо выбранные из от около 10 до около 35, от около 45 до около 65, от около 95 до около 130, от около 210 до около 240, от около 310 до около 370 и около 420 до около 480. В одном из примеров варианта осуществления m и n представляют собой целые числа, выбранные из от около 15 до около 30. В одном из примеров варианта осуществления m и n представляют собой целые числа, выбранные из от около 50 до около 65. В одном из примеров варианта осуществления m и n представляют собой целые числа, выбранные из от около 100 до около 130. В одном из примеров варианта осуществления m и n представляют собой целые числа, выбранные из от около 210 до около 240. В одном из примеров варианта осуществления m и n представляют собой целые числа, выбранные из от около 310 до около 370. В одном из примеров варианта осуществления m и n представляют собой целые числа, выбранные из от около 430 до около 470. В одном из примеров варианта осуществления A1 и A2 каждый представляет собой член, выбранный из -OH и -OCH3.
Примеры полимерных модифицирующих групп в соответствии с указанным вариантом включают фрагмент:
и
Настоящее изобретение относится к пептидному конъюгату, содержащему гликозильную связывающую группу, где гликозильная связывающая группа присоединена к аминокислотному остатку пептида и где гликозильная связывающая группа включает сиалильную связывающую группу формулы:
где
представляет собой модифицирующую группу. Индекс s представляет собой целое число, выбранное из 1-20. Индекс f представляет собой целое число, выбранное из 1-2500. Q представляет собой член, выбранный из H и замещенного или незамещенного C1-С6 алкила.
В одном из примеров варианта осуществления настоящее изобретение относится к модифицированному сахару следующей формулы:
где R1 представляет собой полимерный фрагмент; L выбран из связи и связывающей группы; R2 представляет собой член, выбранный из H, CH2OR7, COOR7 и OR7; R7 представляет собой член, выбранный из H, замещенного или незамещенного алкила и замещенного или незамещенного гетероалкила; R3 и R4 представляют собой члены, независимо выбранные из H, замещенного или незамещенного алкила, OR8 и NHC(O)R9; и R8 и R9 независимо выбирают из H, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, сиаловой кислоты и полисиаловой кислоты. Индекс w представляет собой целое число, выбранное из 1-6, предпочтительно из 1-3 и более предпочтительно из 1-2. Примеры связывающих групп включают замещенный или незамещенный алкил, замещенные или незамещенные гетероалкильные фрагменты и сиаловую кислоту. Примером линкерного компонента является ацильный фрагмент.
Настоящее изобретение относится к способам получения конъюгатов пептидов. Указанные способы включают приведение в контакт пептида с модифицированным донором сахара, который содержит модифицирующую группу, ковалентно связанную с сахаром. Модифицированный сахарный фрагмент переносится с донора на аминокислотный или гликозильный остаток пептида под действием фермента. Примеры ферментов включают, но ими не ограничиваются, гликозилтрансферазы, например сиалилтрансферазы. Указанный способ включает приведение в контакт пептида с: a) модифицированным донором сахара и b) ферментом, способным переносить модифицированный сахарный фрагмент от модифицированного донора сахара на аминокислотный или гликозильный остаток пептида, в условиях, позволяющих осуществить перенос модифицированного сахарного фрагмента от донора на аминокислотный или гликозильный остаток пептида, тем самым обеспечивая синтез указанного пептидного конъюгата.
В предпочтительном варианте осуществления перед осуществлением стадии a) пептид приводят в контакт с сиалидазой, тем самым удаляя, по меньшей мере, часть сиаловой кислоты пептида.
В другом предпочтительном варианте пептид приводят в контакт с сиалидазой, гликозилтрансферазой и модифицированным донором сахара. В указанном варианте пептид приводят в контакт с сиалидазой, гликозилтрансферазой и модифицированным донором сахара практически одновременно, вне зависимости от порядка добавления различных компонентов. Реакцию ведут в условиях, подходящих для удаления остатков сиаловой кислоты из пептида за счет сиалидазы и для переноса за счет гликозилтрансферазы модифицированного сахарного фрагмента с модифицированного донора сахара на аминокислотный или гликозильный остаток пептида.
В другом предпочтительном варианте осуществления процессы десиалилирования и конъюгирования осуществляют в одном реакторе и десиалилированный пептид предпочтительно не очищают перед стадией конъюгирования. В другом примере варианта осуществления указанный способ включает далее стадию 'кэппинга', включающую сиалилирование пептидного конъюгата. Указанную стадию осуществляют в том же реакторе, который содержит сиалидазу, сиалилтрансферазу и модифицированный донор сахара без предварительной очистки.
В другом предпочтительном варианте осуществления проводят десиалилирование пептида и асиалопептид очищают. Затем создают условия для реакции конъюгирования очищенного асиалопептида. В другом примере варианта осуществления указанный способ включает дополнительную стадию 'кэппинга', которая включает сиалилирование пептидного конъюгата. Указанную стадию осуществляют в том же реакторе, который содержит сиалидазу, сиалилтрансферазу и модифицированный донор сахара без предварительной очистки.
В другом примере варианта осуществления стадию кэппинга, сиалилирования пептидного конъюгата, осуществляют в том же реакторе, который содержит сиалидазу, сиалилтрансферазу и модифицированный донор сахара без предварительной очистки.
В одном из примеров варианта осуществления контактирование происходит в течение менее 20 часов, предпочтительно менее 16 часов, более предпочтительно менее 12 часов, еще более предпочтительно менее 8 часов и еще более предпочтительно менее 4 часов.
В другом аспекте настоящее изобретение относится к реакционной смеси пептидного конъюгата. Указанная реакционная смесь включает: a) сиалидазу; b) фермент, который является членом, выбранным из гликозилтрансферазы, экзогликозидазы и эндогликозидазы; c) модифицированный сахар и d)пептид.
В другом из примеров варианта осуществления отношение сиалидазы к пептиду выбрано из 0,1 ед./л : 2 мг/мл до 10 ед./л : 1 мг/мл, предпочтительно 0,5 ед./л : 2 мг/мл, более предпочтительно 1,0 ед./л : 2 мг/мл, еще более предпочтительно 10 ед./л : 2 мг/мл, еще более предпочтительно 0,1 ед./л : 1 мг/мл и наиболее предпочтительно 0,5 ед./л : 1 мг/мл, еще более предпочтительно 1,0 ед./л : 1 мг/мл и еще более предпочтительно 10 ед./л : 1 мг/мл.
В одном из примеров варианта осуществления, по меньшей мере, 10%, 20%, 30%, 40%, 50%, 60%, 70% или 80% указанного пептидного конъюгата включает, по меньшей мере, два PEG фрагмента. Указанные PEG фрагменты можно добавлять в общий реактор, или их можно добавлять после очистки асиалопептида.
В другом примере варианта осуществления, по меньшей мере, 10%, 20%, 30%, 40%, 50%, 60%, 70% или 80% пептидного конъюгата включает, по меньшей мере, один PEG фрагмент. Указанный PEG фрагмент можно добавлять в общий реактор, или его можно добавлять после очистки асиалопептида.
В следующем примере варианта осуществления указанный способ дополнительно включает "кэппинг", или добавление сиаловой кислоты к пептидному конъюгату. В другом примере варианта осуществления добавляют сиалидазу, затем с задержкой в 30 минут, 1 час, 1,5 часа или 2 часа, следует добавление гликозилтрансферазы, экзогликозидазы или эндогликозидазы.
В другом примере варианта осуществления добавляют сиалидазу, затем с задержкой в 30 минут, 1 час, 1,5 часа или 2 часа следует добавление гликозилтрансферазы, экзогликозидазы или эндогликозидазы. Другие цели и преимущества настоящего изобретения будут очевидны специалистам в данной области из приводимого далее подробного описания.
В другом примере варианта осуществления указанный способ включает: (a) приведение в контакт пептида, включающего гликозильную группу, выбранную из:
и
где а представляет собой целое число от 0 до 10, с модифицированным сахаром формулы:
в контакт с соответствующей трансферазой, которая переносит гликозильную связывающую группу на член, выбранный из GalNAc, Gal и Sia указанной гликозильной группы, в условиях, подходящих для указанного переноса. Примером модифицированного сахара является CMP-сиаловая кислота, модифицированная через линкерный фрагмент полимером, например неразветвленным или разветвленным поли(этиленгликолевым) фрагментом. Радикалы в вышеприведенной формуле практически такие же, что и те, которые приведены в идентичных формулах выше.
Пептид можно получить из практически любого источника, однако в одном из вариантов, перед описанной выше модификацией, пептид экспрессируют в подходящем хозяине. Млекопитающие (например, ВНК, СНО), бактерии (например, Е. coli) и клетки насекомых (например, Sf-9) являются примерами экспрессионных систем, обеспечивающих получение пептида, используемого в представленных далее композициях и способах по настоящему изобретению.
Другие цели и преимущества настоящего изобретения будут очевидны специалистам в данной области из приводимого далее подробного описания.
ОПИСАНИЕ ФИГУР
ФИГ. 1 иллюстрирует получение конъюгата СМР-сиаловая кислота-глицерин PEG 40 кДа.
ФИГ. 2 иллюстрирует условия реакции для получения конъюгата СМР-сиаловая кислота-глицерин PEG 40 кДа.
ФИГ. 3 иллюстрирует процесс очистки конъюгата СМР-сиаловая кислота-глицерин PEG 40 кДа, который является эффективным, крупномасштабным и дает продукт высокой степени числоты (>90%).
ФИГ. 4 иллюстрирует процесс очистки, включающий Q-сефарозу для конъюгата СМР-сиаловая кислота-глицерин PEG 40 кДа. Параметры процесса включают:
Крупные бусы Q-сефарозы (6 л, 18×23 см)
Бикарбонатная форма смолы
Подвижная фаза А: вода
Подвижная фаза В: 1,0 н NaCl
УФ: 274 нм
Загрузка: примерно 15 г СМР-3А-глицерин-РЕG-40 кДа
Смесь (30 г) после ТГФ (проводимость: 0,53 мС)
Скорость загрузки: 60 мл/мин
Элюирование:
1,67 CV подвиржная фаза А
2 CV градиент с 10%-80% подвижной фазой В при 125 мл/мин.
Объем элюента обессоливают, используя TFF
Millipore 1 кДа Pellicon 2 "MINI"
(2 × PLAC 1 кДа регинерированная целлюлозная мембрана; Screen Tyoe V; 0,1 м2)
Обессоленный продукт сушат вымораживанием
ФИГ. 5 представляет собой 1Н ЯМР спектр конъюгата СМР-сиаловая кислота-глицерин PEG 40 кДа.
ФИГ. 6 представляет собой таблицу примеров сиалилтрансфераз, которые используют при получении гликоконъюгатов по настоящему изобретению, например для гликоРЕGилирования пептидов модифицированной сиаловой кислотой.
ФИГ. 7 представляет собой таблицу пептидов, к которым одна или более из гликозильных связывающих групп может быть присоединена с целью получения пептидных конъюгатов по настоящему изобретению.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Аббревиатуры
PEG, поли(этиленгликоль); PPG, поли(пропиленгликоль); Ara, арабинозил; Fru, фруктозил; Fuc, фукозил; Gal, галактозил; GalNAc, N-ацетилгалактозаминил; Glc, глюкозил; GlcNAc, N-ацетилглюкозаминил; Man, маннозил; ManAc, маннозаминилацетат; Xyl, ксилозил; NeuAc, сиалил или N-ацетилнейраминил; Sia, сиалил или N-ацетилнейраминил; и их производные и аналоги.
Определения
Если нет других указаний, все использованные в настоящем описании технические и научные термины обычно имеют те же самые значения, которые хорошо известны специалистам в данной области настоящего изобретения. Обычно, используемая в настоящем описании номенклатура и используемые лабораторные процедуры в области клеточных культур, молекулярной генетики, органической химии и химии и гибридизации нуклеиновых кислот такие же, как хорошо известные и обычно используемые в указанных областях. Для синтеза нуклеиновых кислот и пептидов используют стандартные методики. Стандартные методики и процедуры обычно осуществляют в соответствии с общепринятыми способами в данной области и в соответствии с различными общими ссылками (см. Sambrook et al. MOLECULAR CLONING: A LABORATORY MANUAL, 2d ed. (1989) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., приведенный в качестве ссылки), которые представлены в настоящем документе. Используемая номенклатура и лабораторные процедуры аналитической химии и органического синтеза, описываемые далее, хорошо известны и обычно используются в указанной области. Для химического синтеза и химического анализа используют стандартные методики или их модификации.
Все описываемые в настоящем описании олигосахариды описаны с использованием названий или сокращений для невосстанавливающего сахарида (т.е. Gal), далее по конфигурации гликозидной связи (α или β), кольцевой связи (1 или 2), положению в кольце восстанавливающего сахарида, вовлеченного в связь (2, 3, 4, 6 или 8), и затем название или сокращение восстанавливающего сахарида (т.е. GlcNAc). Каждый сахарид является предпочтительно пиранозой. Для обзора стандартной номенклатуры в области гликобиологии см. Essentials of Glycobiology Varki et al. eds. CSHL Press (1999).
Известно, что олигосахариды содержат восстанавливающий конец и невосстанавливающий конец, независимо от того, является ли указанный сахарид на восстанавливающем конце действительно восстанавливающим сахаром. В соответствии с принятой номенклатурой олигосахариды изображают в настоящем описании с невосстанавливающим концом слева и восстанавливающим концом справа.
Термин "сиаловая кислота" или "сиалил" относится к любому члену семейства карбоксилированных сахаров, содержащих девять атомов углерода. Обычным членом семейства сиаловых кислот является N-ацетилнейраминовая кислота (2-кето-5-ацетамидо-3,5-дидеокси-D-глицеро-D-галактононулопираноз-1-оновая кислота (часто используется как аббревиатура Neu5Ac, NeuAc, или NANA). Вторым членом указанного семейства является N-гликолил-нейраминовая кислота (Neu5Gc или NeuGc), в которой N-ацетильная группа NeuAc является гидроксилированной. Третьим членом семейства сиаловых кислот является 2-кето-3-деоксинонулосоновая кислота (KDN) (Nadano et al. (1986) J. Biol. Chem. 261: 11550-11557; Kanamori et al., J. Biol. Chem. 265: 21811-21819 (1990)). Включены также 9-замещенные сиаловые кислоты, такие как 9-О-C1-C6 ацил-Neu5Ac, подобные 9-О-лактил-Neu5Ac или 9-О-ацетил-Neu5Ac, 9-деокси-9-фтор-Neu5Ac и 9-азидо-9-деокси-Neu5Ac. Обзор семейства сиаловых кислот представлен, например, в Varki, Glycobiology 2: 25-40 (1992); Sialic Acids: Chemistry, Metabolism and Function, R. Schauer, Ed. (Springer-Verlag, New York (1992)). Синтез и использование соединений сиаловых кислот в процедуре сиалилирования раскрыты в международной патентной заявке WO 92/16640, опубликованной 1 октября 1992.
Термин "пептид" относится к полимеру, в котором мономерами являются аминокислоты и они соединены вместе за счет амидных связей; альтернативно указанный термин относится к полипептиду. Кроме того, к термину также относятся неприродные аминокислоты, например β-аланин, фенилглицин и гомоаргинин. В рамках настоящего изобретения можно также использовать аминокислоты, которые не являются геннокодируемыми. Кроме того, в настоящем изобретении можно использовать аминокислоты, которые в результате модификации включают реакционноспособные группы, сайты гликозилирования, полимеры, терапевтические фрагменты, биологические молекулы и т.п. Все использованные в настоящем изобретении аминокислоты могут быть либо D-, либо L-изомерами. L-изомер, как правило, является предпочтительным. Кроме того, в настоящем изобретении используют также другие пептидомиметики. Как используется в настоящем описании, термин "пептид" относится как к гликозилированным, так и негликозилированным пептидам. Термин также включает пептиды, которые экспрессируют пептид, гликозилированый системой не полностью. Для общего обзора см. Spatola, A. F., in Chemistry and Biochemistry of amino acids, peptides and proteins, B. Weinstein, eds., Marcel Dekker, New York, p. 267 (1983). Список некоторых пептидов по настоящему изобретению приведен на фиг.7.
Термин "пептидный конъюгат" относится к соединениям по настоящему изобретению, в которых пептид конъюгирован с модифицированным сахаром, как будет показано далее.
Термин "аминокислота" относится к природным и синтетическим аминокислотам, а также к аминокислотным аналогам и имитирующим аминокислоты соединениям, которые функционируют аналогично природным аминокислотам. Природные аминокислоты являются аминокислотами, которые кодируются за счет генетического кода, также аминокислотами, которые были модифицированы позднее, например гидроксипролин, γ-карбоксиглутамат и O-фосфосерин. Термин аналоги аминокислот относится к соединениям, которые имеют ту же химическую структуру, что и природные аминокислоты, то есть α углерод связан с водородом, карбоксильной группой, аминогруппой и R группой, например гомосерин, норлейцин, метионинсульфоксид, метионинметилсульфоний. Такие аналоги содержат модифицированные R группы (например, норлейцин) или модифицированные пептидные скелеты, но сохраняют химическую структуру природных аминокислот. Имитирующие аминокислоты соединения относятся к химическим соединениям, которые обладают структурой, которая отличается от обычной структуры аминокислот, но функция которых аналогична функции природных аминокислот.
Как используется в настоящем описании, термин "модифицированный сахар" или "модифицированный сахарный остаток" относится природному или неприродному углеводу, который ферментативно связан с аминокислотным или гликозильным остатком пептида в способе по настоящему изобретению. Модифицированный сахар выбран из ферментных субстратов, включая, но ими не ограничиваясь, нуклеотиды сахаров (моно-, ди- и три-фосфаты), активированные сахара (например, гликозилгалогениды, гликозилмезилаты) и сахара, которые не являются ни активированным сахарами, ни нуклеотидами. "Модифицированный сахар" представляет собой сахар, ковалентно связанный с функциональной "модифицирующей группой". Подходящие модифицирующие группы включают, но ими не ограничиваются, PEG фрагменты, терапевтические фрагменты, диагностические фрагменты, биомолекулы и т.п. Модифицирующая группа предпочтительно не представляет собой неприродный или не модифицированный углевод. Местоположение функционализирования модифицирующей группой выбирают таким образом, чтобы ее наличие не мешало ферментативному присоединению "модифицированного сахара" к пептиду.
Как используется в настоящем описании, термин "полимерный фрагмент" относится к водорастворимому или к нерастворимому в воде полимеру. Термин "водорастворимый" относится к фрагментам, которые обладают некоторой детектируемой степенью растворимости в воде. Способы качественного и/или количественного определения растворимости в воде хорошо известны специалистам в данной области. Примеры водорастворимых полимеров включают пептиды, сахариды, поли(эфиры), поли(амины), поли(карбоновые кислоты) и т.п. Пептиды могут содержать смешанные последовательности, состоящие из одной аминокислоты, например, поли(лизин). Примером полисахарида является поли(сиаловая кислота). Примером поли(простого эфира) является поли(этиленгликоль). Поли(этиленимин) служит примером полиамина, и поли(акриловая) кислота является представительным примером поли(карбоновой кислоты). Предпочтительные водорастворимые полимеры являются практически не флуоресцентными, или их флуоресценция столь мала, что они не пригодны для использования в качестве флуоресцентного маркера в анализах. Можно использовать полимеры, которые не являются природными сахарами. Кроме того, можно использовать другие природные сахара, которые модифицированы за счет ковалентного присоединения других объектов (например, поли(этиленгликоля), поли(пропиленгликоля), поли(аспартата), биомолекул, терапевтических фрагментов, диагностических фрагментов и т.д.). Термин водорастворимый полимер включает также такие виды, как сахариды (например, декстран, амилоза, гиалуроновая кислота, поли(сиаловая кислота), гепараны, гепарины и т.д.); поли(аминокислоты), например, поли(глутаминовая кислота); нуклеиновые кислоты; синтетические полимеры (например, поли(акриловая кислота), поли(простые эфиры), например, поли(этиленгликоль); пептиды, белки и т.п. Примеры нерастворимых в воде полимеров включают, но ими не ограничиваются, полифосфазины, поли(виниловые спирты), полиамиды, поликарбонаты, полиалкилены, полиакриламиды, полиалкиленгликоли, полиалкиленоксиды, полиалкилентерефталаты, поливиниловые простые эфиры, поливиниловые сложные эфиры, поливинилгалогениды, поливинилпирролидон, полигликолиды, полисилоксаны, полиурета