Аминофуллерены и способ их получения
Иллюстрации
Показать всеИзобретение относится к химической и фармацевтической отраслям промышленности и может быть использовано в биомедицинских исследованиях и фармакологии, а также при получении наномодификаторов пластических масс. Новые аминофуллерены, являющиеся биосовместимыми и улучшающие механические свойства пластмасс, имеют общую формулу
, где X - отрицательный заряд («-»), (-Cl), (-NO2), (-ONO2), (-Н), линейный или разветвленный алкильный (CmH2m+1; m=1-20), алкенильный (CmH2m-1; m=2-20) или алкинильный радикал (CmH2m-3; m=2-20), O-R, S-R, где R - атом водорода, или линейный или разветвленный указанный алкильный, алкенильный или алкинильный радикал, или -S(CH2)nCOOH, -S(CH2)nCOOR*, -S(CH2)nCONR1R2, где n=1-20. NR1R2 выбран из группы, включающей остатки: амина, алифатических спиртов, простых эфиров, тиолов, кислот, их сложных эфиров или амидов, при этом R*, R1, R2, R1 и R2 - такие же, как R. Аминофуллерены указанной общей формулы получают взаимодействием хлорфуллерена с амином в присутствии основания при температуре не выше 70°С. 2 н.п. ф-лы, 11 ил., 11 пр.
Реферат
Изобретение относится к химической и фармацевтической отраслям промышленности и касается химической функционализации фуллерена С60, в частности, создания аминофуллеренов и разработки способа их получения. Изобретение может найти применение в биомедицинских исследованиях и в фармакологии, а также в разработке наномодификаторов для пластических масс, улучшающих их прочностные характеристики, компонентов связующих эпоксидных смол и в других областях техники.
После открытия фуллеренов в 1985 г. [1 - W.Kroto, J.R.Heath, S.C.O′Brien, R.F.Curl, R.E.Smalley. C60: Buckminsterfullerene, Nature, 318, 162-163 (1985)], разработки метода их получения в макроколичествах путем электродугового испарения графита [2 - W.Krätchmer, L.D.Lamb, K.Fostiropoulos, D.R.Huffman. C60: a new form of carbon. Nature, 347, 354-358 (1990)] или при неполном сгорании углеводородов [3 - Н.Murayama, S.Tomonoh, J.M.Alford, M.E.Karpuk. Fullerene production in tons and more: From science to industry. Full. Nanotub. Carbon Nanostruct., 12, 1-9 (2004)]) и эффективных методов разделения фуллеренов [4 - K.Nagata, E.Dejima, Y.Kikuchi, M.Hashiguchi. Kilogram-scale [60]fullerene separation from a fullerene mixture: Selective complexation of fullerenes with 1,8-diazabicyclo[5.4.0]undec-7-ene (DBU). Chem. Lett., 34, 178-179 (2005)] низший фуллерен С60 высокой чистоты стал доступен в килограммовых количествах по цене менее 15€/г [5 - http://www.neotechproduct.ru/str6.php?lang=rus].
Доступность фуллеренов для исследований позволила найти ряд областей практического использования этих соединений. Наиболее многообещающие результаты получены с использованием химически модифицированных фуллеренов С60 и С70. Например, производные фуллеренов являются незаменимыми компонентами органических солнечных батарей с КПД до 7-8% [6 - Y.Liang, Z.Xu, J.Xia, S.-T.Tsai, Y.Wu, G.Li, С.Ray, L.Yu, For the Bright Future-Bulk Heterojunction Polymer Solar Cells with Power Conversion Efficiency of 7.4%. Adv. Mater. 22, 1-4, (2010)] и полевых транзисторов [7 - T.D.Anthopoulos, С.Tanase et al. Ambipolar Organic Field-Effect Transistors Based on a Solution-Processed Methanofullerene. Adv. Mater., 16, 2174 (2004)]). Некоторые производные фуллеренов интересны как высокотемпературные сверхпроводники [8 - M.J.Rosseinsky. Recent developments in the chemistry and physics of metal fullerides. Chem. Mater., 10, 2665-2685 (1998)], материалы нелинейной оптики [9 - L. W. Tutt, A. Kost. Optical limiting performance of C60 and C70 solutions. Nature, 356, 225-226 (1992)], протонные проводники [10 - R.Maruyama. Electrochemical mass-flow control of hydrogen using a fullerene-based proton conductor. Electrochemica Acta, 48, 85-89 (2002)] и т.д.
В последние годы активно обсуждается возможность создания лекарственных препаратов на основе водорастворимых производных фуллеренов [11 - Л.Б.Пиотровский, О.И.Киселев. Фуллерены в биологии. СПб, Росток, 2006], в основном содержащих ионогенные группы - аминные [12 - О.Troshina, P.Troshin, A.Peregudov, V.Kozlovski, R.Lyubovskaya. Photoaddition of N-Substituted Piperazines to C60: An Efficient Approach to the Synthesis of Water-Soluble Fullerene Derivatives. Chem. Eur. Journal, 12, 5569-5577 (2006)] и карбоксильные [13 - M.Brettereich, A.Hirsch. A highly water-soluble dendro[60]fullerene. Tetrahedron Letters, 39, 2731-2734 (1998); 14 - O.Troshina, P.Troshin, A.Peregudov, V.Kozlovskiy, J.Balzarini, R.Lyubovskaya. Chlorofullerene C60Cl6: a precursor for straightforward preparation of highly water-soluble polycarboxylic fullerene derivatives active against HIV. Org. Biomol Chem., 5, 2783-2791 (2007)]. Подобные соединения фуллеренов являются потенциальными противовирусными [15 - S.Wilson in «Perspectives of Fullerene Nanotechnology», E.Osawa Ed. 2001, Kluver Academ; 16 - Патент РФ №2236852 C1 «Средство для ингибирования репродукции оболочечных вирусов, способ его получения, фармацевтическая композиция и способ ингибирования вирусных инфекций», ЗАО "Деско", директор Л.Д.Раснецов] и нейрозащитными препаратами [17 - A.Lin, S.Fang, S.Lin, С.Chou, Т.Luh, L.Ho. Local carboxyfullerene protects cortical infarction in rat brain. NeuroScience Research, 43, 317-321 (2002)]. Показана высокая противоопухолевая активность соединений фуллеренов в условиях фотодинамической терапии [18 - Y. Tabata, Т. Ishii, Т.Aoyama, R.Oki, Y.Hirano, O.Ogawa, Y.Ikada in «Perspectives of Fullerene Nanotechnology», E.Osawa (Ed.) 2001, Kluver Academ. Publ., Dordrecht-Boston-London; 19 - Андреев С.М., Лаптев В.П., Панферова Н.Г., Романова В.С., Петров В.В., Овчинников А.Е., заявка патент РФ 2005140680 А «Фармацевтическая композиция для фотодинамической терапии и способ лечения онкологического заболевания с ее использованием»] и химиотерапии раковых опухолей. [19 - K.YASUHIKO, О. KENK, IDEAL STAR INC, патент JP 2005053904 (A) «Fullerene and anticancer therapeutic agent»; 20 - Заявка на патент №PST/RU2007/000337. 2007 «Полифункциональные аминокислотные производные фуллерена С60, содержащие биологически активные группировки, пептиды или белки, способы их получения (варианты), применение их в качестве доноров монооксида азота и в качестве вазодилататоров, а также способ ингибирования процесса метастазирования». Котельников А.И., Романова B.C., Богданов Г.Н., Коновалова Н.П., Котельникова Р.А., Файнгольд И.И., Фрог Е.С., Писаренко О.И., Бубнов Ю.Н., Давыдов М.И., Алдошин С.М.]. Приведенные источники информации однозначно показывают практическую ценность органических производных фуллеренов.
Наиболее близким структурным аналогом заявляемых аминофуллеренов является группа соединений общей формулы 2 [12, 24 - Н.Isobe, Т.Tanaka, W.Nakanishi, L.Lemie′gre, E. Nakamura. J. Org. Chem., 70, 4826 (2005); 25 - О.А. Трошина, П.А. Трошин, Р.Н. Любовская, «Водорастворимые аминофуллерены и способы их получения", патент РФ №2358904 от 25.12.2005].
Принципиальным отличием заявляемых соединений общей формулы 1 является наличие пяти аминных фрагментов (NR′1R′2), а не четырех, как в соединениях общей формулы 2. Заметим также, что соединения общей формулы 2 получают по реакции фотохимического присоединения аминов к фуллереновому каркасу, которая применима лишь к ограниченному кругу субстратов (в частности, лишь ко вторичным аминам) и отличается плохой воспроизводимостью, длительностью процесса и низкими выходами продуктов.
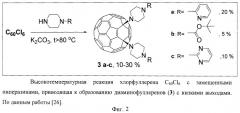
Прототипом заявляемого способа получения аминофуллеренов является реакция хлорфуллерена С60Cl с N-замещенными пиперазинами (Фиг.2), описанная в 2006 году [26 - О.A.Troshina, P.A.Troshin, A.S.Peregudov, E.M.Balabaeva, V.I.Kozlovskiy, R.N.Lyubovskaya, "Reactions of chlorofullerene C60Cl6 with N-substituted piperazines", Tetrahedron 2006, 62, 10147-10151]. В этом случае взаимодействие хлорфуллерена с аминами проводили при высокой температуре, что приводило к образованию соединений общей формулы (3).
Задачей изобретения являются аминофуллерены, описывающиеся общей формулой (1), которые являются новым, ранее неизвестным классом соединений фуллеренов. Заявляемые аминофуллерены могут найти применение в фармакологических и медицинских исследованиях в качестве биосовместимой формы фуллерена, которая может проявлять и другие типы биологических активностей. В то же время перспективным может быть их использование в технике в качестве наномодификаторов, позволяющих улучшить механические свойства пластических масс, связующих эпоксидных смол и других клеевых составов.
Поставленная задача решается новым классом аминофуллеренов общей формулы (1), а именно:
где в общей формуле 1 X выбран из группы, но не ограничивается:
- отрицательный заряд («-»), локализованный на фуллереновом каркасе, или
- атом хлора (-Сl), присоединенный к углеродному каркасу, или
- нитрогруппа (-NO2) или нитратная группа (-ONO2), присоединенная к углеродному каркасу, или
- атом водорода (-Н), линейный или разветвленный алкильный (CmH2m+1; m=1-20), алкенильный (CmH2m-1; m=2-20) или алкинильный радикал (CmH2m-3; m=2-20), присоединенный к фуллереновому каркасу, или
- алкоксильный O-R или тиолатный фрагмент S-R, присоединенный к фуллереновому каркасу, где R - атом водорода или линейный или разветвленный алкильный (CmH2m+1; m=1-20), алкенильный (CmH2m-1; m=2-20) или алкинильный радикал (CmH2m-3; m=2-20), или
- остаток тиокислоты -S(CH2)nCOOH или ее эфира -S(CH2)nCOOR*, или амида - S(CH2)nCONR1R2, присоединенный к фуллереновому каркасу, где n=1-20, a R*, R1 и R2 - атомы водорода или линейные или разветвленные алкильные (CmH2m+1; m=1-20), алкенильные (CmH2m-1; m=2-20) или алкинильные (CmH2m-3; m=2-20) радикалы;
где фрагмент NR1R2 выбран из группы, но не ограничивается нижеследующими определениями:
- остаток амина, где R1 и R2 - атомы водорода или линейные или разветвленные алкильные (CmH2m+1; m=1-20), алкенильные (CmH2m-1; m=2-20) или алкинильные радикалы (CmH2m-3; m=2-20);
- остатки алифатических спиртов -(СН2)nOH, простых эфиров -(CH2)nOR′1
и -(CH2CH2O)nR′1, тиолов -(CH2)nSH, кислот -(СН2)nCOOH, их сложных эфиров -(CH2)nCOOR′1 или амидов -(CH2)nCONR′1R′2, для которых n=0-20, a R′1 и R′2 - это атомы водорода или линейные или разветвленные алкильные (CmH2m+1; m=1-20), алкенильные (CmH2m-1; m=2-20) или алкинильные радикалы (CmH2m-3; m=2-20);
- фрагменты общей формулы -NH-*CH(R*1)(CH2)nCOX1, независимо от пространственной конфигурации заместителей у хирального центра *С (D и L энантиомеры и рацематная форма), где R*1 - один из остатков, входящих в состав природных аминокислот (глицина (R*1=H), аланина (R*1=CH3), фенилаланина (R*1=C6H5CH2-) и аналогично аргинина, аспарагина, аспарагиновой кислоты, валина, гистидина, глутамина, глутаминовой кислоты, лейцина, изолейцина, лизина, метионина, серина, тирозина, треонина, триптофана, цистеина, селеноцистеина и пирролизина), а X1 - это остаток спирта O-R′2, или амина NR′2R′3, где R′2 и R′3 - это атомы водорода или линейные или разветвленные алкильные (CmH2m+1; m=1-20), алкенильные (CmH2m-1; m=2-20) или алкинильные радикалы (CmH2m-3; m=2-20), а также X1 может быть остатком пептида или алкалоида;
- фрагмент общей формулы 2а,
где X1 - это остаток спирта O-R′2, или амина NR′2R′3, где R′2 и R′3 - это атомы водорода или линейные или разветвленные алкильные (CmH2m+1; m=1-20), алкенильные (CmH2m-1; m=2-20) или алкинильные радикалы (CmH2m-3; m=2-20), а также X1 может быть остатком пептида или алкалоида;
- остаток циклического амина общей формулы 2b
,
где х, y - 0-10, a R′1 и R′2 - это атомы водорода или линейные или разветвленные алкильные (CmH2m+1; m=1-20), алкенильные (CmH2m-1; m=2-20) или алкинильные радикалы (CmH2m-3; m=2-20), арильные или гетероарильные группы состава C6-kH5-k-mZ′1Ym, в которых l=0-2, k=0-2, m=0-3; Z′=O, N, NH, S, Se, a Y=ОН, NH2, Cl, Br, I, F, а также линейные или разветвленные алкильные (CmH2m+1; m=1-20), алкенильные (CmH2m-1; m=2-20) или алкинильные радикалы (CmH2m-3; m=2-20), a Z=О, S, Se, (CH2)j, где j=0-10;
- остаток пиперазина общей формулы 2с-1 или 1,4-дигидропиридина общей формулы 2с-2,
где R, R′1, R′2 R′3 и R′4 - это атомы водорода или линейные или разветвленные алкильные (CmH2m+1; m=1-20), алкенильные (CmH2m-1; m=2-20) или алкинильные радикалы (CmH2m-3; m=2-20), арильные или гетероарильные группы состава C6-kH5-k-mZ′1Ym, в которых l=0-2, k=0-2, m=0-3; Z′=O, N, NH, S, Se, a Y=OH, NH2, Cl, Br, I, F, а также линейные или разветвленные алкильные (CmH2m+1; m=1-20), алкенильные (CmH2m-1; m=2-20) или алкинильные радикалы (CmH2m-3; m=2-20), а также остатки алифатических спиртов -(СН2)nOH, простых эфиров -(CH2)nOR′5, тиолов -(CH2)nSH, кислот -(СН2)nCOOH, их сложных эфиров -(CH2)nCOOR′5 или амидов -(CH2)nCONR′5R′6, для которых n=0-20, a R′5 и R′6 - это атомы водорода или линейные или разветвленные алкильные (CmH2m+1; m=1-20), алкенильные (CmH2m-1; m=2-20) или алкинильные радикалы (CmH2m-3; m=2-20). Кроме того, поставленная задача решается способом синтеза соединений формулы (1), включающим взаимодействие хлорфуллерена с амином, согласно которому процесс ведут в присутствии основания при температуре не выше 70°С.
Сущность изобретения заключается в следующем. Заявляемые аминофуллерены, описывающиеся общей формулой (1), являются новым, ранее неизвестным классом соединений фуллеренов. Предполагается, что эти аминофуллерены найдут применение в фармакологических и медицинских исследованиях в качестве биосовместимой формы фуллерена, которая может проявлять антибактериальную [21 - Т.Mashino, D.Nishikawa, K.Takanashi, N.Usui, Т.Yamori, M.Seki, Т.Endo, M.Mochizuki. Bioorg. Med. Chem. Lett., 13, 4395-4397 (2003)], противовирусную [22 - Т.Mashino, K.Shimotohno, N.Ikegami, D.Nishikawa, K.Okuda, K.Takahashi, S.Nakamura, M.Mochizuki. Bioorg. Med. Chem. Lett., 15, 1107-1109 (2005)], противораковую [23 - V.P.Gubskaya, L.S.Berezhnaya, A.T.Gubaidullin, I.I.Faingold, R.A.Kotelnikova, N.P.Konovalova, V.I.Morozov, L.A.Litvinov, L.A.Nuretdinov. Org. Biomol. Chem., 5, 976-981 (2007)] и другие типы биологических активностей. В то же время перспективным может быть их использование в технике в качестве наномодификаторов, позволяющих улучшить механические свойства пластических масс, связующих эпоксидных смол и других клеевых составов.
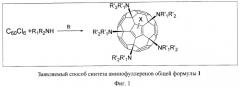
Способ получения аминофуллеренов общей формулы (1) основан на взаимодействии хлорфуллерена С60Сl6 с первичными и вторичными аминами в присутствии основания (фиг.1). В качестве основания можно использовать гидроксиды, карбонаты и гидрокарбонаты щелочных металлов, третичные амины, например триэтиламин, а также любые другие соединения, к которым может применяться термин «основания» ввиду их способности связывать выделяющийся в реакции HCl. Заметим, что роль основания также может выполнять избыток амина. Наилучшие результаты были получены с использованием карбоната калия и ацетата натрия в качестве основания.
Наиболее гладко реакции протекают при комнатной температуре и, как правило, с количественным выходом и со 100% селективностью приводят к образованию аминофуллерена общей формулы (1). В случае, когда из-за низкого качества реагента или особенностей его строения реакция протекает с меньшей селективностью, целевой продукт может быть выделен в чистом виде с выходом более 70% с использованием хроматографического разделения.
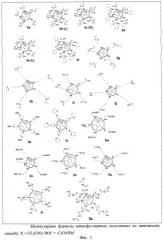
В прототипе заявляемого способа получения аминофуллеренов описана реакция хлорфуллерена С60С16 с N-замещенными пиперазинами (фиг.2),взаимодействие хлорфуллерена с аминами проводили при высокой температуре, что приводило к образованию соединений общей формулы (3). Принципиальным отличием заявляемого способа синтеза от протопипа является проведение реакции между хлорфуллереном С60С16 и аминами в более мягких условиях, позволяющих замещать пять атомов хлора в молекуле на аминные группы с образованием соединений общей формулы (1). Как уже было отмечено, заявляемый способ отличается чрезвычайно высокой селективностью и позволяет получать самые разнообразные производные фуллеренов. Молекулярные формулы соединений, полученных по разработанному способу, представлены на фиг.3.
В качестве реагентов успешно использовали трет-бутиловые эфиры природных и неприродных длинноцепочечных аминокислот, что позволило получить аддукты 3а-3е и 3g-3h, которые в результате кислотного гидролиза дают соответствующие поликарбоксильные производные 3f, 3i-3j. Соли этих поликарбоксильных производных отличаются высокой растворимостью в воде (>50 мг/мл). Те же самые аминокислотные производные были получены и в одну стадию в результате непосредственного взаимодействия аминокислот с хлорфуллереном C60Cl6 в присутствии ацетатов щелочных металлов в качестве основания. По этой же реакции удалось присоединить и короткий пептидный фрагмент с образованием соединения 3s.
Использование моно-ВОС-защищенных диаминов (ВОС - классическая защитная группа, используемая в пептидном синтезе - трет-бутоксикарбонил) позволило получить аминофуллерены 3k, 3m-3n, обработка которых трифторуксусной кислотой позволила получить соли 3o-3q, хорошо растворимые в воде (>50 мг/мл).
Заметим, что заявляемый способ позволяет получить два взаимодополняющих класса водорастворимых производных фуллеренов: поликарбоксильные, содержащие анионоидные СО- группы, и полиаминные, содержащие катионоидные NH3 + группы.
Одним из наиболее наглядных примеров является синтез соединения 3r, в котором не нужно использовать дополнительных оснований. Выделяющийся в реакции HCl связывается продуктом реакции с образованием соли 3r, отличающейся высокой растворимостью в воде. Образование 3r протекает почти мгновенно при смешении реагентов, а выделение осуществляется путем фильтрования реакционной среды и отделения осадка продукта. Таким образом, граммовые количества 3r были получены в течение нескольких минут.
Необходимо отметить, что в зависимости от структуры выбранного амина, жесткости используемого основания и условий проведения реакции, образующиеся соединения могут содержать атом хлора в качестве шестого адденда, присоединенного к фуллереновому каркасу, или атом водорода, или гидроксильную группу или просто отрицательный заряд, локализованный в циклопентадиенильном фрагменте на фуллереновом каркасе. В последнем случае образуются фуллереновые анионы, такие как 3g, 3i и 3j, которые отличаются чрезвычайной устойчивостью и не протонируются в водной среде и даже при действии органических кислот (уксусная, трифторуксусная). Подобные стабильные фуллереновые анионы являются уникальными и могут найти практические приложения, в частности, в нелинейной оптике и для получения материалов с необычными магнитными свойствами [27 - P.W.Stephens, D.Cox, J.W.Lauher, L.Mihaly, J.B.Wiley, P.-M.Allemand, A.Hirsch, K.Holczer, Q.Li, J.D.Thompson, F.Wudl. Nature, 355, 331 (1992)].
Состав и строение полученных соединений были доказаны с использованием комплекс физико-химических методов исследования: спектроскопии ЯМР на ядрах 1Н и 13C, двумерной корреляционной спектроскопии, ИК-спектроскопии, оптической спектроскопии поглощения и элементного анализа. Чистота соединений подверждалась с использованием высокоэффективной жидкостной хроматографии. Обсуждение всех полученных спектральных и аналитических данных не представляется возможным в рамках данной заявки. Поэтому приводятся данные для наиболее типичных соединений.
На фиг.4 и фиг.5 приведены ЯМР спектры соединения 3d, которые полностью согласуются с молекулярной структурой этого соединения. Отсутствие посторонних сигналов в спектрах (за исключением сигналов растворителя) свидетельствует о высокой чистоте препарата. Более того, для соединения 3d структура была подтверждена методом рентгеноструктурного анализа (данные не приводятся). Высокая чистота аминофуллерена 3d подтверждена также хроматографически (фиг.6).
На фиг.7 приведены ЯМР спектры соединения 3n, которые подтверждают Cs-симметричную структуру этого соединения. Высокая чистота препарата подтверждается хроматограммой, приведенной на фиг.8.
На фиг.9 приведены ЯМР спектры соединения 3g, отличительной особенностью которого является наличие отрицательного заряда, локализованного в циклопентадиенильном фрагменте на фуллереновом каркасе. Это соединение представляет собой фуллереновый анион, не имеющий аналогов, сопоставимых по своей стабильности и описанных в литературе. Спектр ЯМР 1Н содержит лишь сигналы, принадлежащие пяти эквивалентным по симметрии остаткам трет-бутилового эфира аминокапроновой кислоты. Область слабых полей в спектре ЯМР 13С содержит пик при 173 м.д., соответствующий карбонильной группе (С=О), семь сигналов, принадлежащих фуллереновому каркасу и еще четыре сигнала (три интенсивных, один слабый) от примеси растворителя - толуола. Таким образом, молекула 3g имеет уникальную для соединений фуллеренов симметрию C5v, причем ось симметрии пятого порядка проходит через циклопентадиенильный анион, локализованный на фуллереновом каркасе. Анализ соединения 3g методом ВЭЖХ оказался невозможным ввиду его прочного связывания с сорбентом. Однако данные элементного анализа и других физико-химических методов подтверждают состав и строение соединения 3g.
В результате кислотного гидролиза электронейтрального соединения 3h было получено соединение 3j, которое содержит в каркасе фрагмент циклопентадиенильного аниона, который оказался устойчивым в водных растворах и даже при действии органических кислот (уксусная, трифторуксусная). Спектры аниона 3j подтверждают его C5v-симметричное строение (фиг.10).
Заявляемое изобретение иллюстрируется, но никак не ограничивается, следующими примерами:
Пример 1. Синтез аминофуллерена 3а.
Хлорфуллерен C60Cl6 (933 мг, 1 ммоль) растворяли в атмосфере аргона в 800 мл свежеперегнанного толуола. К раствору прибавляли большой избыток (5-10 г) измельченного в ступке сухого карбоната калия, после чего добавляли 1.006 г (6 ммоль) гидрохлорида трет-бутилового эфира глицина. Реакционную смесь интенсивно перемешивали в течение 10-20 часов (контроль степени протекания реакции с помощью ТСХ или ВЭЖХ) при температуре не выше 70°С, после чего отделяли осадок фильтрованием, а фильтрат упаривали на роторном испарителе, промывали петролейным эфиром и сушили на воздухе. Согласно аналитическим данных, был получен продукт с чистотой 98+%. Выход оранжево-красного кристаллического порошка 3а составил 1.307 г (93% от теории).
1Н ЯМР (600 МГц, CDCl3, δ, м.д): 1.40-1.55 (м, 45Н), 3.89-4.20 (м, 10Н). 13С ЯМР (150 МГц, CDCl3, δ, м.д): 28.04 (СН3), 28.09 (СН3), 28.13 (СН3), 48.65 (СН2), 49.57 (СН2), 50.85 (СН2), 64.61 (sp3 каркас), 67.00 (sp3 каркас), 69.08 (sp3 каркас), 76.36 (С-Cl), 81.24 (СООС(СН3)3), 81.55 (СООС(СН3)3), 81.58 (СООС(СН3)3), 139.59, 142.53, 143.00, 143.40, 143.69, 143.83, 143.92, 144.13, 144.22, 144.82, 145.23, 145.31, 147.17, 147.19, 147.23, 147.29, 147.91, 148.34, 148.37, 148.45, 148.72, 148.88, 149.62, 150.33, 153.75, 154.37, 171.20 (СООС(СН3)3), 171.80 (СООС(СН3)3), 171.96 (СООС(СН3)3).
Пример 2. Синтез аминофуллерена 3b.
Хлорфуллерен C60Cl6 (933 мг, 1 ммоль) растворяли в атмосфере аргона в 800 мл свежеперегнанного толуола. К раствору прибавляли большой избыток (5-10 г) измельченного в ступке сухого карбоната калия, после чего добавляли 0.871 г (6 ммоль) трет-бутилового эфира L-аланина. Реакционную смесь интенсивно перемешивали в течение 20-30 минут (контроль степени протекания реакции с помощью ТСХ или ВЭЖХ) при температуре не выше 70°С, после чего отделяли осадок фильтрованием, а фильтрат упаривали на роторном испарителе, промывали петролейным эфиром и сушили на воздухе. Согласно аналитическим данным, был получен продукт с чистотой 99+%. Выход ярко-красного кристаллического порошка 3b составил 1.284 г (87% от теории).
1Н ЯМР (600 МГц, CDCl3, δ, м.д): 1.35 (с, 9Н), 1.37 (с, 9Н), 1.38 (с, 9Н), 1.39 (с, 9Н), 1.45 (с, 9Н), 1.50-1.57 (м, 15Н), 4.32-4.78 (м, 5Н). 13С ЯМР (150 МГц, CDCl3, δ, м.д): 20.62 (СН3), 20.64 (СН3), 20.88 (СН3), 21.18 (СН3), 27.86 (СООС(СН3)3), 27.94 (СООС(СН3)3), 27.96 (СООС(СН3)3), 27.97 (СООС(СН3)3), 54.21 (СН), 54.38 (СН), 54.47 (СН), 55.03 (СН), 56.33 (СН), 64.34 (sp3 каркас), 64.57 (sp3 каркас), 66.45 (sp3 каркас), 66.79 (sp3 каркас), 69.17 (sp3 каркас), 76.6 (C-Cl), 80.55 (COOC(CH3)3), 81.02 (СООС(СН3)3), 81.06 (СООС(СН3)3), 81.13 (СООС(СН3)3), 140.25, 140.29, 142.45, 142.48, 142.80, 142.96, 143.10, 143.22, 143.35, 143.50, 143.79, 143.85, 143.90, 143.95, 144.16, 144.20, 144.36, 144.38, 144.48, 144.51, 144.73, 145.09, 145.32, 145.56, 145.76, 147.10, 147.17, 147.21, 147.24, 147.28, 147.35, 147.90, 147.95, 148.25, 148.33, 148.37, 148.44, 148.49, 148.65, 148.73, 148.80, 150.11, 150.20, 150.53, 151.66, 153.98, 154.23, 154.59, 154.92, 175.59 (СООС(СН3)3), 175.99 (СООС(СН3)3), 176.15 (СООС(СН3)3).
Пример 3. Синтез аминофуллерена 3с.
Хлорфуллерен C60Cl6 (933 мг, 1 ммоль) растворяли в атмосфере аргона в 800 мл свежеперегнанного толуола. К раствору прибавляли большой избыток (5-10 г) измельченного в ступке сухого карбоната калия, после чего добавляли 1.090 г (6 ммоль) гидрохлорида трет-бутилового эфира D-аланина. Реакционную смесь интенсивно перемешивали в течение 10-20 часов при температуре не выше 70°С (контроль степени протекания реакции с помощью ТСХ или ВЭЖХ), после чего отделяли осадок фильтрованием, а фильтрат упаривали на роторном испарителе, промывали петролейным эфиром и сушили на воздухе. Хроматографическая очистка в системе толуол/метанол с варьируемым соотношением компонентов позволила получить аналитически чистый продукт (99+%) в количестве 1.358 г (92% от теории).
1H ЯMR (600 МГц, CDCl3, δ, м.д): 1.35 (с, 9Н), 1.37 (с, 9Н), 1.38 (с, 9Н), 1.39 (с, 9Н), 1.45 (с, 9Н), 1.53 (м, 15Н), 4.34 (кв., 1Н), 4.38 (кв., 1H), 4.50 (кв., 1H), 4.57 (кв., 1Н), 4.74 (кв., 1Н). 13С ЯМР (150 МГц, CDCl3, δ, м.д): 20.62, 20.64, 20.89, 21.19, 27.85, 27.94, 27.96, 27.98, 28.15, 54.21, 54.38, 54.46, 55.03, 56.33, 64.34, 64.56, 66.44, 66.78, 69.18, 80.57, 81.04, 81.06, 81.14, 140.23, 140.28, 142.45, 142.48, 142.8, 142.96, 143.08, 143.22, 143.35, 143.5, 143.79, 143.85, 143.89, 143.9, 143.95, 144.16, 144.2, 144.36, 144.38, 144.48, 144.52, 144.73, 145.08, 145.32, 145.56, 145.76, 147.09, 147.17, 147.21, 147.24, 147.28, 147.35, 147.9, 147.95, 148.24, 148.32, 148.34, 148.37, 148.44, 148.49, 148.65, 148.73, 148.79, 150.13, 150.19, 150.53, 151.65, 153.97, 154.23, 154.59, 154.91, 175.61, 176.02, 176.16, 176.18.
Пример 4. Синтез аминофуллерена 3d.
Хлорфуллерен C60Cl6 (933 мг, 1 ммоль) растворяли в атмосфере аргона в 800 мл свежеперегнанного толуола. К раствору прибавляли большой избыток (5-10 г) измельченного в ступке сухого карбоната калия, после чего добавляли 1.548 г (6 ммоль) гидрохлорида трет-бутилового эфира L-фенилаланина. Реакционную смесь интенсивно перемешивали в течение 10-20 часов при температуре не выше 70°С (контроль степени протекания реакции с помощью ТСХ или ВЭЖХ), после чего отделяли осадок фильтрованием, а фильтрат упаривали на роторном испарителе, промывали петролейным эфиром и сушили на воздухе. Хроматографическая очистка в системе толуол/метанол с варьируемым соотношением компонентов позволила получить аналитически-чистый продукт (99+%) в количестве 1.559 г (84% от теории).
1Н ЯМР (600 МГц, CDCl3, δ, м.д): 1.04 (с, 9Н), 1.15 (с, 9Н), 1.17 (с, 9Н), 1.21 (с, 9Н), 1.24 (с, 9Н), 2.99 (м, 3Н), 3.07 (м, 3Н), 3.26 (м, 2Н), 3.39 (м, 1Н), 3.49 (м, 1Н), 3.70 (м, 1Н), 3.77 (м, 2Н), 3.87 (м, 2Н), 7.20 (м, 4Н), 7.26 (м, 6Н), 7.32 (м, 3Н), 7.43 (д, 2Н), 7.48 (дд, 4Н). 13С ЯМР (150 МГц, CDCl3, δ, м.д): 27.73, 27.74, 27.8, 27.82, 27.84, 40.45, 40.59, 41.13, 41.39, 41.92, 58.93, 59.69, 59.88, 61.89, 62.58, 63.83, 64.29, 65.52, 67.2, 68.45, 77.56, 80.98, 81.27, 81.36, 81.4, 126.42, 126.47, 126.5, 126.61, 126.64, 128.18, 128.33, 128.37, 129.17, 129.44, 129.95, 130, 130.04, 137.32, 137.35, 137.38, 137.66, 137.81, 140.83, 141.53, 142.41, 142.45, 142.62, 142.75, 142.86, 143.44, 143.52, 143.58, 143.62, 143.77, 144.06, 144.16, 144.18, 144.31, 144.34, 144.39, 144.44, 144.64, 144.88, 145.49, 145.58, 145.95, 147.15, 147.18, 147.23, 147.3, 147.34, 147.38, 147.95, 148.01, 148.25, 148.34, 148.37, 148.42, 148.52, 148.58, 148.75, 148.83, 149.76, 150.56, 151.05, 151.55, 154.18, 154.23, 154.76, 155.33, 174.74, 174.98, 175.6, 175.69, 175.81.
Пример 5. Синтез аминофуллерена 3g.
Хлорфуллерен C60Cl6 (933 мг, 1 ммоль) растворяли в атмосфере аргона в 800 мл свежеперегнанного толуола. К раствору прибавляли большой избыток (5-10 г) измельченного в ступке сухого карбоната калия, после чего добавляли 1.123 г (6 ммоль) трет-бутилового эфира ε-аминокапроновой кислоты. Реакционную смесь интенсивно перемешивали в течение 20-30 минут при температуре не выше 70°С (контроль степени протекания реакции с помощью ТСХ или ВЭЖХ), после чего отделяли нерастворимую часть фильтрованием, а фильтрат упаривали на роторном испарителе, промывали петролейным эфиром и сушили на воздухе. Получен аналитически чистый продукт (95+%) в количестве 1.305 г (79% от теории).
1Н ЯМР (600 МГц, CDCl3, δ, м.д): 1.17 (м, 10Н), 1.39 (с, 45Н), 1.63 (м, 10Н), 2.00 (м, 5Н) 2.34 (м, 10Н), 3.20 (м, 5Н), 3.36 (м, 5Н), 3.52 (м, 10Н). 13С ЯМР (150 МГц, CDCl3, δ, м.д): 24.49, 28.09, 28.15, 35.35, 41.32, 47.53, 64.05, 80.01, 125.35, 143.24, 145.46, 146.17, 146.97, 149.6, 172.8.
Пример 6. Синтез аминофуллерена 3h.
Хлорфуллерен C60Cl6 (933 мг, 1 ммоль) растворяли в атмосфере аргона в 800 мл свежеперегнанного толуола. К раствору прибавляли большой избыток (5-10 г) измельченного в ступке сухого карбоната калия, после чего добавляли 1.544 г (6 ммоль) трет-бутилового эфира 11-аминоундекановой кислоты. Реакционную смесь интенсивно перемешивали в течение 20-30 минут при температуре не выше 70°С (контроль степени протекания реакции с помощью ТСХ или ВЭЖХ), после чего отделяли нерастворимую часть фильтрованием, а фильтрат упаривали на роторном испарителе, промывали петролейным эфиром и сушили на воздухе. Аналитически чистый продукт (96+%) получен путем хроматографической очистки на силикагеле с использованием системы толуол/метанол в качестве элюента. Выход продукта составил 1.528 г (75% от теории). 1Н ЯМР (600 МГц, CDCl3, δ, м.д): 1.31 (м, 60Н), 1.45 (м, 10Н), 1.46 (с, 45Н), 1.59 (м, 10Н), 1.70 (м, 10Н), 2.22 (т, 10Н), 3.28 (м, 5Н). 13С ЯМР (150 МГц, CDCl3, δ, м.д): 25.13, 27.52, 27.54, 28.14, 29.16, 29.38, 29.52, 29.55, 29.63, 29.67, 29.68, 35.63, 46.97, 47.30, 65.52, 67.84, 69.62, 77.59, 79.89, 140.45, 142.49, 143.27, 143.49, 143.82, 143.95, 144.25, 144.35, 144.4, 144.63, 144.83, 145.21, 145.49, 146.99, 147.2, 147.26, 147.29, 147.86, 148.31, 148.36, 148.39, 148.41, 148.66, 148.85, 149.84, 151.02, 153.82, 154.16, 173.3, 173.35.
Пример 7. Синтез аминофуллерена 3m.
Хлорфуллерен C60Cl6 (933 мг, 1 ммоль) растворяли в атмосфере аргона в 800 мл свежеперегнанного толуола. К раствору прибавляли большой избыток (5-10 г) измельченного в ступке сухого карбоната калия, после чего добавляли 0.961 г (6 ммоль) моно-ВОС-защищенного этилендиамина (трет-бутил-2-аминоэтилкарбамата).
Реакционную смесь интенсивно перемешивали в течение 10-20 минут при температуре не выше 70°С (контроль степени протекания реакции с помощью ТСХ или ВЭЖХ), после чего отделяли нерастворимую часть фильтрованием, а фильтрат наносили на хроматографическую колонку, заполненную силикагелем. Аналитически чистый продукт (98+%) получен путем хроматографической очистки с использованием системы толуол/метанол в качестве элюента. Выход продукта составил 1.194 г (77% от теории).
1Н ЯМР (600 МГц, CDCl3, δ, м.д): 1.37-1.50 (м, 45Н), 3.30-3.60 (м, 20Н). 13С ЯМР (150 МГц, CDCl3, δ, м.д): 28.47 (СН3), 28.53 (СН3), 41.00 (СН2), 41.35 (СН2), 41.69 (СН2), 46.41 (СН2), 46.57 (СН2), 48.68 (СН2), 65.05 (sp3 каркас), 67.43 (sp3 каркас), 69.92 (sp3 каркас), 79.29 (СООС(СН3)3), 79.41 (СООС(СН3)3), 79.46 (СООС(СН3)3), 136.54, 137.89, 139.69, 142.56, 142.97, 143.56, 143.89, 144.02, 144.07, 144.18, 144.97, 145.31, 147.16, 147.17, 147.27, 147.90, 148.33, 148.39, 148.44, 148.75, 148.93, 149.65, 150.64, 153.65, 153.91, 156.30 (СООС(СН3)3), 156.46 (СООС(СН3)3), 156.51 (СООС(СН3)3).
Пример 8. Синтез аминофуллерена 3n.
Хлорфуллерен C60Cl6 (933 мг, 1 ммоль) растворяли в атмосфере аргона в 800 мл свежеперегнанного толуола. К раствору прибавляли большой избыток (5-10 г) измельченного в ступке сухого карбоната калия, после чего добавляли 1.298 г (6 ммоль) моно-ВОС-защищенного гексаметилендиамина (трет-бутил-6-аминогексилкарбамата).
Реакционную смесь интенсивно перемешивали в течение 10-20 минут при температуре не выше 70°С (контроль степени протекания реакции с помощью ТСХ или ВЭЖХ), после чего отделяли нерастворимую часть фильтрованием, а фильтрат наносили на хроматографическую колонку, заполненную силикагелем. Аналитически чистый продукт (97+%) получен путем хроматографической очистки с использованием системы толуол/метанол в качестве элюента. Выход продукта составил 1.520 г (83% от теории).
1Н ЯМР (600 МГц, CDCl3, δ, м.д): 1.37-1.58 (м, 75Н), 1.72 (м, 10Н), 3.14 (м, 10Н), 3.28 (м, 10Н). 13С ЯМР (150 МГц, CDCl3, δ, м.д): 28.47 (СН3), 26.83 (СН2), 26.96 (СН2), 27.11 (СН2), 27.17 (СН2), 27.20 (СН2), 30.09 (СН2), 30.16 (СН2), 30.62 (СН2), 30.80 (СН2), 40.59 (СН2), 46.83 (СН2), 47.14 (СН2), 49.18 (СН2), 65.48 (sp3 каркас), 67.82 (sp3 каркас), 69.61 (sp3 каркас), 79.00 (СООС(СН3)3), 140.34, 142.49, 143.21, 143.50, 143.83, 143.98, 144.22, 144.29, 144.36, 144.59, 144.83, 145.17, 145.45, 146.21, 147.00, 147.19, 147.25, 147.28, 147.86, 148.31, 148.38, 148.41, 148.66, 148.85, 149.79, 150.94, 153.85, 154.09, 156.05 (СООС(СН3)3).
Пример 9. Синтез аминофуллерена 3j из аминофуллерена 3h.
В круглодонную колбу на 500 мл помещается 450 мг аминофуллерена 3h, 150 мл хлористого метилена и 35 мл трифторуксусной кислоты. Смесь перемешивается при комнатной температуре в течение часа, после чего упаривается досуха на роторном испарителе. Остаток промывается диэтиловым эфиром или этилацетатом и сушится на воздухе. Выход продукта количественный.
1Н ЯМР (600 МГц, ацетон-Д6, δ, м.д): 1.34 (м, 70Н), 1.58 (м, 10Н), 2.09 (м, 10Н), 2.24 (м, 10Н), 3.68 (м, 5Н). 13С ЯМР (150 МГц, ацетон-Д6, δ, м.д): 26.66, 27.16, 27.51, 27.72, 29.7, 29.82, 29.95, 33.55, 47.16, 47.40, 64.19, 125.02, 143.25, 145.87, 146.18, 146.5, 146.99, 149.67, 173.71.
Пример 10. Синтез аминофуллерена 3j непосредственно из хлорфуллерена C6oCl6
Хлорфуллерен C60Cl6 (933 мг, 1 ммоль) растворяли в атмосфере аргона в 800 мл смеси хлорбензола и тетрагидрофурана. К раствору прибавляли 5-10 г измельченного в ступке сухого ацетата натрия и большой избыток 11-аминоундекановой кислоты (3-4 г, 13-19 ммоль). Реакционную смесь нагревали до 50-60°С при интенсивном перемешивании в течение 20-30 минут. Протекание реакции сопровождалось образованием красно-оранжевого осадка продукта. После окончания реакции осадок отфильтровывали, промывали ацетоном и затем смывали с фильтра дистиллированной водой. В полученный ярко-красный раствор добавляли по каплям соляную кислоты до полного осаждения аминофуллерена 3j. Образовавшийся ярко-красный осадок отделяют центрифугированием, промывают трижды дистиллированной водой и затем переносят с ацетоном в круглодонную колбу на 500 мл и упаривают досуха. Выход продукта составил 1.218 г (68% от теории). Спектральные характеристики продукта идентичны приведенным в примере 9.
Пример 11. Синтез аминофуллерена 3r
Хлорфуллерен C60Cl6 (933 мг, 1 ммоль) растворяли в атмосфере аргона в 800 мл свежеперегнанного толуола. К раствору прибавляли 0.600 г (6 ммоль) N-метилпиперазина. Реакционную смесь интенсивно перемешивали в течение 2-5 минут при температуре не выше 70°С, после чего отделяли выпавший осадок фильтрованием, промывали гексаном и сушили на воздухе. В этих условиях образуется аналитически чистый продукт (95+%), хорошо растворимый в воде. Выход продукта составил 1.502 г (98% от теории). 1Н ЯМР (600 МГц, CDCl3, δ, м.д): 2.37 (м, 15Н), 2.67 (м, 20Н), 3.17 (м, 20Н), 6.37 (м, 20Н). 13С ЯМР (150 МГц, CDCl3, δ, м.д):, (ppm), 43.85, 45.95, 46.06, 50.75, 52.32, 54.88, 71.14, 72.79, 73.38, 80.35, 130.52, 131.11, 131.28, 134.21, 142.06, 142.17, 142.9, 143.08, 143.16, 143.4, 143.62, 143.71, 144.87, 145.57, 146.35, 146.88, 146.97, 147.15, 147.18, 147.64, 147.96, 148.06, 148.15, 148.81, 148.86, 148.92, 153.37.
1. Аминофуллерены общей формулы 1, а именно где X обозначает, но не ограничивается:отрицательный заряд («-»), локализованный на фуллереновом каркасе, илиатом хлора (-Cl), присоединенный к углеродному каркасу, илинитрогруппу (-NO2), или нитратную группу (-ONO2), присоединенную к углеродному каркасу, илиатом водорода (-Н), линейный или разветвленный алкильный (CmH2m+1; m=1-20), алкенильный (CmH2m-1; m=2-20) или алкинильный радикал (CmH2m-3; m=2-20), присоединенный к фуллереновому каркасу, илиалкоксильный O-R или тиолатный фрагмент S-R, присоединенный к фуллереновому каркасу, где R - атом водорода, или линейный, или разветвленный алкильный (CmH2m+1; m=1-20), алкенильный (CmH2m-1; m=2-20) или алкинильный радикал (CmH2m-3; m=2-20), илиостаток тиокислоты -S(CH2)nCOOH или ее эфира -S(CH2)nCOOR*, или амида -S(CH2)nCONR1R2, присоединенный к фуллереновому каркасу, где n=1-20, a R*, R1 и R2 - атомы водорода, или линейные, или разветвленные алкильные (CmH2m+1; m=1-20), алкенильные (CmH2m-1; m=2-20) или алкинильные (CmH2m-3; m=2-20) радикалы;где фрагмент NR1R2 выбран из группы, но не ограничивается нижеследующими определениями:остаток амина, где R1 и R2 - атомы водорода, или линейные, или разветвленные алкильные (CmH2m+1; m=1-20), алкенильные (CmH2m-1; m=2-20) или алкинильные радикалы (CmH2m-3; m=2-20);остатки алифатических спиртов -(СН2)nOH, простых эфиров -(CH2)nOR'1 и -(CH2CH2O)nR'1, тиолов -(CH2)nSH, кислот -(СН2)nCOOH, их сложных эфиров -(CH2)nCOOR'1 или амидов -(CH2)nCONR'1R'2, для которых n=0-20, a R'1 и R'2 - это атомы водорода, или линейные, или разветвленные алкильные (CmH2m+1; m=1-20), алкенильные (CmH2m-1; m=2-20) или алкинильные радикалы (CmH2m-3; m=2-20);фрагменты общей формулы -NH-*CH(R*1)(CH2)nCOX1, независимо от пространственной конфигурации заместителей у хирального центра *С (D и L энантиомеры и рацематная форма), где R*1 - один из остатков, входящих в состав природных аминокислот (глицина (R*1=H), аланина (R*1=CH3), фенилаланина (R*1=C6H5CH2-) и аналогично аргинина, аспарагина, аспарагиновой кислоты, валина, гистидина, глутамина, глутаминовой кислоты, лейцина, изолейцина, лизина, метионина, серина, тирозина, треонина, триптофана, цистеина, селеноцистеина и пирролизина), а X1 - это остаток спирта O-R'2, или амина NR'2R'3, где R'2 и R'3 - это атомы водорода, или линейные, или разветвленные алкильные (CmH2m+1; m=1-20), алкенильные (CmH2m-1; m=2-20) или алкинильные радикалы (CmH2m-3; m=2-20), а также X1 может быть остатком пептида или алкалоида;фрагмент общей формулы 2а где X1 - это остаток спирта O-R'2, или амина NR'2R'3, где R'2 и R'3 - это атомы водорода, или линейные, или разветвленные ал