Материал на основе кремниевого золя для изготовления биологически расщепляющихся и/или рассасывающихся силикагелевых материалов, их изготовление и применение
Иллюстрации
Показать всеИзобретение относится к материалу на основе кремниевого золя, а также его применению для изготовления биологически рассасывающихся и биологически расщепляющихся силикагелевых материалов с улучшенными свойствами. Указанные силикагелевые материалы, такие как волокна, нетканый материал, порошок, монолит и/или покрытие, используют, например, в медицинской технике и/или медицине, прежде всего для лечения ран. Материал получен способом, включающим кислотно катализируемую реакцию гидролитической конденсации соединений кремния вида SiX4, например тетраэтоксисилана, в присутствии водорастворимого растворителя в течение не менее 16 часов (предпочтительно от 3 до 8 дней), последующего упаривания с получением однофазного раствора, охлаждения до 4°C и кинетически контролируемого созревания. Готовый однофазный раствор пригоден для прядения волокон. Технический результат изобретения - получение нетоксичного биологически разлагаемого однофазного материала, полностью пригодного для получения волокон. 5 н. и 8 з.п. ф-лы, 2 табл., 3 пр., 4 ил.
Реферат
Настоящее изобретение относится к новому материалу на основе кремниевого золя, используемому в качестве исходного материала для изготовления обладающих улучшенными свойствами биологически расщепляющихся и/или рассасывающихся силикагелевых материалов, а также к способу изготовления и применению подобных силикагелевых материалов. Кроме того, изобретение относится к биологически расщепляющимся и/или биологически рассасывающимся материалам из силикагелевых волокон.
Известны многочисленные попытки создания биологически расщепляющихся и/или биологически рассасывающихся материалов, предназначенных для использования в самых разных сферах медицины и медицинской техники. Вместе с тем постоянно растет уровень предъявляемых к указанным материалам требований, которые прежде всего касаются их биологической совместимости, биологической эффективности и токсикологических свойств.
Рассасывающиеся силикагели известны из уровня техники. Так, например, в немецкой заявке на патент DE 19609551 C1 описаны биологически расщепляющиеся и рассасывающиеся волокна. Подобные волокна могут быть изготовлены с помощью золь-гель технологии, в соответствии с которой из прядильной массы вытягивают нити, при необходимости подвергаемые последующей сушке. Прядильная масса содержит одно или несколько частично или полностью гидролитически конденсированных соединений кремния, образующихся в результате гидролитической конденсации мономеров общей формулы SiX4. Недостаток предлагаемых в цитируемой заявке волокон состоит в том, что их испытание на цитотоксичность при расщеплении, осуществляемом непосредственно по завершении процесса прядения, не приводит к оптимальным результатам, в связи с чем указанные волокна следует считать в определенной степени цитотоксичными. Подобная токсичность волокон, проявляющаяся при их применении в медицине или медицинской технике, например в сфере заживления ран, как правило, является нежелательной. Кроме того, предлагаемый в цитируемой заявке способ изготовления волокон страдает недостатком, состоящим в том, что смесь, образующаяся на стадии гидролитической конденсации после удаления растворителя, является многофазной, и для удаления твердого вещества приходится осуществлять ее фильтрование. Помимо этого, вследствие образования твердой фазы и необходимости фильтрования теряют значительную часть пригодного для прядения золя. В соответствии с предлагаемым в цитируемой заявке способом не удается также надежно предотвращать происходящее во время созревания образование довольно значительного количества твердой фазы, прежде всего гелеобразование. Подобное образование твердой фазы обусловливает дополнительное сокращение количества пригодной для прядения зольмассы.
Независимо от этого было обнаружено, что предлагаемые в настоящем изобретении волокна и нетканые материалы обладают улучшенной способностью заживлять раны. Кроме того, обнаружено, что предлагаемые в изобретении волокна и нетканые материалы особенно пригодны для применения в качестве опорных структур для клеток.
В основу настоящего изобретения была положена задача предоставить новый материал на основе кремниевого золя, используемый для изготовления биологически расщепляющихся и/или биологически рассасывающихся силикагелевых материалов. Другая задача настоящего изобретения состояла в том, чтобы предложить биологически расщепляющиеся и/или биологически рассасывающиеся силикагелевые материалы, которые отличаются улучшенной цитотоксичностью и/или способностью заживлять раны. Кроме того, задача настоящего изобретения состояла в том, чтобы предложить улучшенные опорные структуры для клеток, предназначенные, например, для изготовления имплантатов кожи, хрящей и костей in-vitro.
Указанные выше задачи решаются с помощью материала на основе кремниевого золя по пункту 1 формулы изобретения. Предлагаемый в изобретении материал на основе кремниевого золя может быть изготовлен следующим образом:
a) при необходимости в присутствии водорастворимого растворителя в течение по меньшей мере 16 часов при температуре от 0 до 80°C и начальном показателе pH от 0 до ≤7 осуществляют кислотно катализируемую реакцию гидролитической конденсации одного или нескольких соединений кремния формулы (I):
,
в которой остатки X, одинаковые или разные, означают гидрокси, водород, галоген, амино, алкокси, ацилокси, алкилкарбонил и/или алкоксикарбонил и являются производными алкильных остатков, представляющих собой при необходимости замещенные неразветвленные, разветвленные или циклические остатки с 1-20 атомами углерода, предпочтительно с 1-10 атомами углерода, которые могут быть прерваны атомами кислорода или серы или аминогруппами,
b) путем последующего упаривания формируют однофазный раствор, вязкость которого, измеренная при скорости сдвига 10 с-1 и температуре 4°C, составляет от 0,5 до 2 Па·с,
c) полученный раствор затем охлаждают и
d) подвергают кинетически контролируемому созреванию, в результате которого образуется гомогенный однофазный золь.
На стадии a) используют одно или несколько разных соединений кремния формулы (I):
в которой остатки X, одинаковые или разные, означают гидрокси, водород, галоген, амино, алкокси, ацилокси, алкилкарбонил и/или алкоксикарбонил и являются производными алкильных остатков, представляющих собой при необходимости замещенные неразветвленные, разветвленные или циклические остатки с 1-20 атомами углерода, предпочтительно с 1-10 атомами углерода, которые могут быть прерваны атомами кислорода или серы или аминогруппами.
В предпочтительной форме исполнения изобретения X в формуле (I) означает при необходимости замещенный неразветвленный, разветвленный и/или циклический алкоксильный остаток с 1-20 атомами углерода, предпочтительно с 1-10 атомами углерода. Остаток X в формуле (I) особенно предпочтительно означает при необходимости замещенный неразветвленный и/или разветвленный алкоксильный остаток с 1-5 атомами углерода. Кроме того, X в формуле (I) особенно предпочтительно означает замещенный, предпочтительно незамещенный, неразветвленный и/или разветвленный алкоксильный остаток с 2-3 атомами углерода, например, такой, как этокси, N-пропокси и/или изопропокси.
Согласно изобретению для осуществления предлагаемой в изобретении гидролитической конденсации в качестве соединения кремния еще более предпочтительно используют тетраэтоксисилан. В качестве водорастворимого растворителя предпочтительно можно использовать этанол или смесь этанола с водой. При этом отношение соединения кремния к этанолу может составлять ≥1:1.
В предпочтительной форме исполнения изобретения начальное значение показателя pH, которому соответствует диапазон от 0 до ≤7, предпочтительно от 2 до 5, устанавливают посредством азотнокислой воды. Однако для осуществления настоящего изобретения можно использовать также другие кислые смеси и/или растворы, пригодные для местного высвобождения монооксида азота (NO) или диоксида азота (NO2). Речь при этом идет, например, о кислых смесях и/или растворах, которые в содержащей молекулярный кислород физиологической среде ферментативно (посредством нитроксид-синтазы) генерируют монооксид азота, в свою очередь, быстро превращающийся в организме в диоксид азота, или об органических нитратах, соответственно нитроэфирах (так называемых донорах монооксида азота), например этилнитрате, выделяющих NO в присутствии органической нитратредуктазы. Для подобного ферментативного высвобождения монооксида азота требуется присутствие тиольных групп (цистеина).
Таким образом, согласно изобретению для установления необходимого показателя pH (в диапазоне от слабокислого до среднекислого) помимо разбавленной азотной кислоты можно использовать также в качестве субстрата для нитроксид-синтазы водный или спиртовый (особенно предпочтительно разбавленный этанолом водный) раствор физиологически совместимой кислоты (например, лимонной, янтарной, винной, уксусной или аскорбиновой кислоты) и по меньшей мере одной эссенциальной аминокислоты (например, особенно предпочтительно L-аргинина, а также L-валина, L-лейцина, L-изолейцина, L-фениланилина, L-тироксина, L-метионина, L-бетаина или L-триптофана) или неэссенциальной аминокислоты (например, L-гутамина, L-глутаминовой кислоты, L-аспарагина, L-аспарагиновой кислоты, L-цистеина, L-глицина, L-аланина, L-пролина, L-гистидина или L-тирозина).
В соответствии с предпочтительной формой исполнения изобретения реакцию гидролитической конденсации реализуют при молярном соотношении между соединением кремния и азотнокислой водой, составляющем от 1:1,7 до 1:1,9, особенно предпочтительно от 1:1,7 и 1:1,8. При этом азотнокислую воду можно использовать в виде 0,01 Н азотной кислоты.
Гидролитическую конденсацию осуществляют в течение промежутка времени, составляющего, по меньшей мере, 16 часов, предпочтительно, по меньшей мере, 18 часов, при температуре от 0 до 80°C, предпочтительно от 0 до 78°C, особенно предпочтительно от 20 до 60°C, еще более предпочтительно в примерном интервале от 20 до 50°C, и, например, в случае использования предлагаемых в изобретении материалов для лечения ран, при комнатной температуре (то есть примерно от 20 до 25°C) или при температуре около 37°C.
В предпочтительной форме исполнения изобретения гидролиз можно осуществлять в течение промежутка времени, составляющего, по меньшей мере, 16 часов, предпочтительно, по меньшей мере, от 18 часов до 4 недель. Длительность гидролиза предпочтительно составляет от 24 часов до 18 дней, особенно предпочтительно от 3 до 8 дней. Неожиданно было обнаружено, что в случае длительности гидролитической конденсации, увеличенной по сравнению с обычной длительностью протекания этой реакции при комнатной температуре, которая не превышает нескольких часов, в результате реализуемого на стадии b) удаления растворителя может быть сформирован гомогенный однофазный раствор, который не требует фильтрования перед реализуемым на стадии d) созреванием.
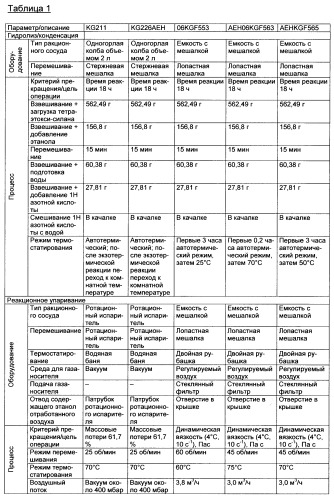
Первичную реакцию гидролитической конденсации предпочтительно осуществляют в периодическом режиме в снабженной мешалкой емкости, соответственно круглодонной колбе. В указанные резервуары предпочтительно загружают соединение кремния формулы (I) (например, тетраэтоксисилан) и растворитель (например, этанол). Затем осуществляют медленную подачу кислоты предпочтительно в виде 0,01 Н азотной кислоты (например, из расчета 0,01 моль HNO3 на моль тетраэтоксисилана). В связи с повышенной концентрацией кислоты в реакционной смеси реакция гидролитической конденсации протекает с высокой скоростью, и содержимое резервуара разогревается до температуры около 40°C, пока в ходе реакции (то есть на стадии (a)) температура не станет снижаться вследствие естественного охлаждения до температуры окружающей среды, соответственно теплоносителя.
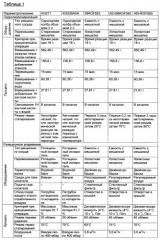
В предпочтительной форме исполнения изобретения удаление водорастворимого растворителя (например, этанола, воды) на стадии (b) осуществляют в закрытом аппарате с возможностью перемешивания (предпочтительно в ротационном испарителе и/или в емкости с мешалкой) при одновременном удалении растворителя (воды, этанола), реализуемом путем его испарения при давлении от 1 до 1013 мбар, предпочтительно менее 600 мбар, при необходимости с непрерывной подачей от 1 до 8 м3/ч (предпочтительно от 2,5 до 4,5 м3/ч) химически инертного газа-носителя, осуществляемой с целью снижения парциального давления испаряющихся компонентов, при реакционной температуре от 30 до 90°C, предпочтительно от 60 до 75°C, более предпочтительно от 60 до 70°C, и предпочтительно при осторожном перемешивании реакционной системы мешалкой, вращающейся со скоростью до 80 об/мин (предпочтительно от 20 до 60 об/мин), пока вязкость смеси не окажется в интервале от 0,5 до 30 Па·с, предпочтительно в интервале от 0,5 до 2 Па·с, особенно предпочтительно около 1 Па·с (вязкость измеряют при 4°C и скорости сдвига 10 с-1).
Согласно изобретению термин «поток газа-носителя» используют для обозначения газового потока, который поступает в газовый объем над жидкой фазой реакционной системы. При этом для поддержания постоянного давления в реакционном сосуде из него следует выводить газообразный объемный поток, который состоит как из газа-носителя, так и из подлежащего(их) испарению компонента(ов). Происходящее вследствие этого снижение парциального давления подлежащего(их) испарению компонента(ов), то есть уменьшение его (их) концентрации в газовом объеме реактора, обусловливает увеличение движущей силы, способствующей испарению растворителя на поверхности жидкости.
В соответствии с особенно предпочтительной формой исполнения изобретения поток газа-носителя распределяют посредством надлежащего устройства для распределения газа, которое устанавливают в газовом объеме реактора таким образом, чтобы можно было обеспечить достаточно полную замену газа-носителя вблизи поверхности жидкости без непосредственного конвекционного обтекания последней газом-носителем. Конвекционное обтекание поверхности жидкости газом-носителем в наихудшем случае может приводить к нежелательному гелеобразованию. Устройства для распределения газа, которые можно использовать для реализации данной формы исполнения изобретения, известны специалистам.
По мере сопровождаемого повышением вязкости протекания реакции/полимеризации происходит смещение фазового равновесия с одновременным постепенным снижением соответствующего равновесного давления растворителя в паровой фазе. При снижении равновесного давления до величины, соответствующей общему давлению в газовой фазе, испарение растворителя прекращается.
В соответствии с этим с целью дальнейшего испарения растворителя в оптимальном варианте необходимо снижать давление, надлежащим образом изменять расход газа-носителя и/или повышать температуру.
В предпочтительной форме исполнения изобретения варьируют во времени, по меньшей мере, один из следующих технологических параметров: давление, расход газа-носителя и/или температуру.
В предпочтительной форме исполнения изобретения упаривание на стадии b) осуществляют при постоянной температуре и варьируемом во времени давлении.
В предпочтительной форме исполнения изобретения для снижения парциального давления растворителя в качестве химически инертного газа-носителя используют азот и/или воздух.
В предпочтительной форме исполнения изобретения водорастворимый растворитель удаляют благодаря комбинированному использованию вакуума и газа-носителя. В соответствии с предпочтительной формой исполнения изобретения общее давление и расход газа-носителя можно поддерживать постоянными или независимо друг от друга варьировать во времени. В предпочтительной форме исполнения изобретения в идеальном случае варьируют во времени, по меньшей мере, один из следующих технологических параметров: давление, расход газа-носителя и/или температуру. Тем самым, например, может быть обеспечено протекание реакции в течение определенного общего промежутка времени при необходимой степени упаривания, и/или скорость упаривания может быть приведена в соответствие с кинетикой реакции.
В соответствии с предпочтительной формой исполнения изобретения упаривание на стадии b) выполняют при постоянной температуре и варьируемом во времени давлении, причем вплоть до завершения вторичной реакции гидролитической конденсации давление снижают от нормального или слегка пониженного значения до величины, составляющей менее 600 мбар, предпочтительно менее 500 мбар, особенно предпочтительно менее 100 мбар.
В случае использования комбинированного технологического режима (совместного использования вакуума и газа-носителя) предпочтительным является постоянное или варьируемое разрежение, составляющее менее 600 мбар.
Температура выше 60°C является особенно предпочтительной, чтобы в случае значительного повышения концентрации азотной кислоты в остаточном растворителе способствовать восстановлению HNO3 до монооксида азота. Монооскид азота, который является чрезвычайно легколетучим газом (температура его кипения при нормальном давлении составляет около -150°C), после улетучивания из жидкой фазы при контакте с воздухом окисляется до легкокипящего диоксида азота (температура кипения около 21°C), который удаляют из системы вместе с отходящим воздухом или соответственно отходящим газовым потоком. Подобным образом ограничивают, соответственно снижают, концентрацию кислоты в предлагаемом в изобретении материале. В другом варианте концентрацию кислоты можно снижать также на одной из последующих стадий, например, путем проветривания твердого материала, например нетканого материала.
В случае использования вместо азотной кислоты системы органическая кислота/аргинин повышение показателя pH, соответственно снижение концентрации кислоты, выполняют при необходимости, например, посредством трис-растворов (если удаление кислоты, например, уксусной кислоты, не представляется возможным), осуществляя промывку материала незадолго до его применения в водном трис-растворе.
Неожиданно было обнаружено, что благодаря реализуемому в соответствии с настоящим изобретением осторожному перемешиванию реакционной системы (скорости вращения мешалки соответствует интервал от 20 до 80 об/мин) в противоположность немецкой заявке на патент DE 19609551 C1 можно предотвратить формирование концентрационных градиентов по высоте композиции, находящейся в реакционном сосуде на стадии реакционного упаривания (стадии b). Помимо увеличения продолжительности реакции гидролитической конденсации, по меньшей мере, до 16 часов подобное осторожное перемешивание способствует тому, что в соответствии с предлагаемым в изобретении способом прядению может быть подвергнуто, по меньшей мере, 70%, предпочтительно, по меньшей мере, 80% и еще более предпочтительно, по меньшей мере, 90% совокупной реакционной смеси.
Стадию (b) предпочтительно реализуют до тех пор, пока не образуется однофазный раствор, вязкость которого, измеренная при скорости сдвига 10 с-1 и температуре 4°C, составляет от 0,5 до 2 Па·с.
В соответствии с предпочтительной формой исполнения изобретения протекание реакции на стадии b) контролируют по изменению вязкости реакционной системы.
Гомогенный однофазный раствор, образующийся в результате гидролитической конденсации на стадии b), может быть охлажден и в предпочтительном варианте подвергнут кинетически контролируемому количественному созреванию, реализуемому при необходимости без предшествующего фильтрования.
Согласно изобретению созревание на стадии с) можно осуществлять при температуре от -20 до 10°C, предпочтительно от 2 до 4°C (например, в холодильнике). Созревание особенно предпочтительно осуществляют при температуре 4°C. Низкая температура созревания благоприятствует кинетически контролируемому протеканию дополнительной конденсации соединений кремния указанной выше формулы (I) в процессе созревания. В соответствующей смеси может происходить образование олигомеров и/или полимеров силоксанов и/или силанолов. Олигомеры и/или полимеры могут также соединяться посредством водородных мостиковых связей. Согласно изобретению в результате созревания может быть сформирована структурно-вязкая гомогенная однофазная прядильная зольмасса. Преимуществом настоящего изобретения является возможность максимального подавления конкурирующего образования пространственной полимерной сетчатой структуры (гелеобразования). В связи с этим согласно изобретению можно получать гомогенную прядильную зольмассу, которая преимущественно не содержит дополнительной твердой фаза, прежде всего геля.
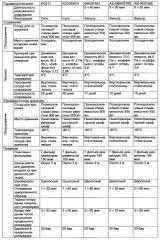
Длительность реализуемого на стадии d) созревания согласно изобретению может составлять от 3 до 4 недель, предпочтительно, по меньшей мере, 10 дней, более предпочтительно, от 14 до 40 дней, например, от 14 до 28 дней, еще более предпочтительно по меньшей мере 25 дней и, в частности, в случае использования предлагаемых в изобретении материалов для заживления ран, от 25 до 40 дней. Согласно изобретению вязкость образующегося на стадии d) золя предпочтительно составляет от 30 до 100 Па·с (вязкость измеряют при температуре 4°C и скорости сдвига 10 с-1) при коэффициенте потерь (4°C, 10 с-1, деформация 1%), составляющим от 2 до 5, предпочтительно от 2,5 до 3,5 (коэффициент потерь представляет собой отношение вязкой составляющей динамической вязкости к ее упругой составляющей). Указанные условия созревания являются особенно предпочтительными в случае, если образовавшийся на стадии d) кремниевый золь подлежит прядению в волокна.
В случае использования предлагаемых в изобретении волокон/нетканого материала для лечения ран вязкость образующегося на стадии d) кремниевого золя, измеренная при температуре 4°C и скорости сдвига 10 с-1, предпочтительно составляет от 35 до 75 Па·с и еще более предпочтительно от 35 до 45 Па·с при коэффициенте потерь, измеренном при температуре 4°C, скорости сдвига 10 с-1 и деформации 1%, который предпочтительно находится в интервале от 2,5 до 3,5.
Слишком высокий коэффициент потерь означает слишком высокую эластичность материала, которая препятствует, например, формированию при прядении стабильных нитей из-за их желирования или обрыва. В случае слишком низкого коэффициента потерь материал характеризуется текучестью (образованием капель), что не позволяет формировать из него стабильные нити.
В случае если предлагаемый в изобретении кремниевый золь предназначен для последующей переработки в порошок, а не в прядильные волокна, условия созревания можно варьировать. В подобном случае динамическая вязкость, измеренная при температуре 4°C и скорости сдвига 10 с-1 по завершении стадии (d), предпочтительно составляет около 60 Па·с.
В случае переработки кремниевого золя в монолит динамическая вязкость, измеренная при температуре 4°C и скорости сдвига 10 с-1 по завершении стадии (d), предпочтительно больше или равна 70 Па·с. В случае если кремниевый золь подлежит использованию для нанесения на твердые тела или поверхности, динамическая вязкость в зависимости от требуемой толщины покрытия меньше или равна 10 Па·с (скорость сдвига 10 с-1, температура 4°C).
Полученную зольмассу, по меньшей мере, почти количественно предпочтительно можно использовать для реализации дополнительной технологической стадии и/или технологического процесса изготовления биологически расщепляющихся и/или рассасывающихся силикагелевых материалов. Полученный на стадии d) золь предпочтительно пригоден для прядения. Согласно изобретению может быть предусмотрена дополнительная стадия е), на которой осуществляют процесс прядения.
Подобная технологическая стадия может быть реализована при использовании обычных условий прядения, приведенных, например, в немецких заявках на патент DE 19609551 C1 и DE 102004063599 A1.
При этом золь пропускают через пластину с фильерами, например, посредством резервуара со сжатым газом (давление газа составляет от 1 до 100 бар, предпочтительно от 20 до 30 бар).
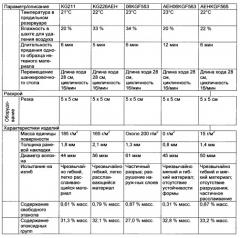
Длина прядильной шахты обычно составляет от 1 до 5 м, предпочтительно 2 м. В прядильной шахте осуществляют регулирование температурно-влажностного режима. Температура в прядильной шахте предпочтительно составляет от 20 до 30°C, точка росы находится в интервале от -5 до 10°C, что соответствует относительной влажности, составляющей от 20 до 40%, предпочтительно от 20 до 25% и особенно предпочтительно около 20%.
Волокна, образующиеся в результате пропускания зольмассы через прядильную шахту, обладают стабильной формой и их раскладывают на шанжировочном столе. Размер ячеек формируемого на шанжировочном столе волокнистого материала регулируют, в частности, путем варьирования скорости шанжирования. Последняя составляет несколько см/с. Вследствие двухосного движения шанжировочного стола происходит формирование мелкоячеистого волокнистого материала (нетканого материала) с остаточным содержанием этоксигрупп, составляющим, как правило, от 25 до 33% в пересчете на тетраэтоксисилан в качестве исходного кремнийсодержащего соединения.
В случае использования предлагаемых в изобретении материалов для заживления ран масса единицы поверхности волокнистого материала предпочтительно составляет, по меньшей мере, 90 г/м2, особенно предпочтительно по меньшей мере 150 г/м2. Толщина раневой накладки из получаемого прядением волокон нетканого материала предпочтительно составляет по меньшей мере 0,8 мм, особенно предпочтительно по меньшей мере 1,5 мм. Диаметр волокон предпочтительно составляет по меньшей мере около 45 мкм.
Силикагелевые волокнистые материалы и изделия, изготавливаемые из получаемого предлагаемым в изобретении способом силикагелевого материала, например, такие, как нити, волокна, нетканые материалы и/или ткани, обладают отличной способностью к биологической деструкции и биологическому рассасыванию.
Другое преимущество силикагелевых волокнистых материалов, изготавливаемых из предлагаемых в изобретении волокон, по сравнению с материалами из волокон, которые могут быть получены описанным в немецкой заявке на патент DE 19609551 C1 способом, состоит в том, что при испытании предлагаемых в настоящем изобретении материалов в присутствии фибропластов мышей L929 они характеризуются гораздо более благоприятными показателями цитотоксичности (смотри пример 1 и сравнительный пример). В связи с этим изделия, изготавливаемые из предлагаемого в изобретении материала на основе кремниевого золя, отличаются особенно высокой биологической совместимостью. Таким образом, предлагаемые в изобретении нити, волокна или нетканые материалы предпочтительно можно использовать в медицине или медицинской технике в качестве биологически расщепляющихся и/или биологически рассасывающихся материалов и изделий.
Независимо от этого экспериментально установлено, что предлагаемые в изобретении волокна и нетканые материалы обладают улучшенной способностью заживлять раны. В связи с этим предлагаемые в изобретении материалы прежде всего можно использовать предпочтительно в сфере лечения и заживления ран. Так, например, нити можно использовать в качестве хирургического материала для наложения швов или в качестве армирующих волокон. Предлагаемые в изобретении нетканые материалы особенно предпочтительно можно использовать для лечения поверхностных ран.
Предлагаемые в изобретении биологически расщепляющиеся и биологически рассасывающиеся волокна и нетканые материалы могут быть изготовлены благодаря реализации контролируемой гидролитической конденсации указанных выше соединений кремния и азотнокислой воды, включающей следующие стадии:
a) при необходимости в присутствии водорастворимого растворителя в течение, по меньшей мере, 16 часов, предпочтительно, по меньшей мере, 18 часов, при температуре от 0 до 80°C, предпочтительно от 20 до 60°C, особенно предпочтительно от 20 до 50°C, например, при комнатной температуре (примерно от 20 до 25°C) или при температуре около 37°С, при начальном показателе pH от 0 до ≤7 осуществляют кислотно катализируемую реакцию гидролитической конденсации одного или нескольких соединений кремния формулы (I):
,
в которой остатки X, одинаковые или разные, означают гидрокси, водород, галоген, амино, алкокси, ацилокси, алкилкарбонил и/или алкоксикарбонил и являются производными алкильных остатков, представляющих собой при необходимости замещенные неразветвленные, разветвленные или циклические остатки с 1-20 атомами углерода, предпочтительно с 1-10 атомами углерода, которые могут быть прерваны атомами кислорода или серы или аминогруппами,
b) путем последующего упаривания формируют однофазный раствор, вязкость которого, измеренная при скорости сдвига 10 с-1 и температуре 4°C, составляет от 0,5 до 2 Па·с,
c) полученный раствор затем охлаждают и
d) подвергают кинетически контролируемому созреванию, в результате которого образуется гомогенный однофазный золь, и
e) осуществляют прядение полученного по пункту d) золя.
В случае если для реализуемой на стадии а) гидролитической конденсации в качестве соединения кремния используют, например, тетраэтоксисилан, причем гидролиз выполняют в течение достаточно длительного времени, в результате реализуемого на стадии b) упаривания образуется гомогенный раствор. В процессе последующего созревания, реализуемого при пониженной температуре на стадии c), может протекать кинетически контролируемая реакция. В подобном случае смесь может находиться на стадии d) в виде гомогенной растворенной однофазной массы, то есть в виде пригодной для прядения зольмассы.
Изготавливаемые в соответствии с изобретением волокна или нетканые материалы предпочтительно можно использовать в качестве биологически рассасывающихся и/или биологически активных материалов в медицине, медицинской технике, технологии фильтрования, биотехнологии или промышленности изоляционных материалов. Изготавливаемые в соответствии с изобретением материалы предпочтительно можно использовать прежде всего для лечения и заживления ран. Волокна можно использовать, например, в качестве шовного хирургического материала или в качестве армирующих волокон. Нетканые материалы особенно предпочтительно можно использовать для лечения поверхностных ран, например, для фильтрования содержащихся в организме жидкостей, в частности крови, или в биотехнологии в качестве вспомогательных средств для выращивания микроорганизмов.
Другой формой исполнения изобретения может являться система доставки лекарственного средства к зоне его действия и/или лекарственный препарат в виде микропорошка и/или нанопорошка.
Соответствующие порошковые формы могут быть изготовлены путем совмещения предлагаемого в изобретении кремниевого золя с необходимым действующим веществом, например с одним или несколькими лекарственными средствами (благодаря реализации дополнительной реакции гидролитической конденсации действующее вещество при необходимости может быть также соединено с кремниевым золем ковалентными связями), и формирования соответствующей гомогенной смеси. Смесь кремниевого золя с действующим(и) веществом(ами) подвергают реализуемой в мягких условиях сушке, например, распылительной или сублимационной сушке, что прежде всего относится к смесям, содержащим чувствительные к температуре действующие вещества. В случае если действующее вещество не обладает повышенной термочувствительностью или смесь не содержит чувствительных к температуре действующих веществ, указанную сушку можно выполнять также при повышенных (существенным образом) температурах. При этом вокруг действующего вещества предпочтительно образуется биологически рассасывающаяся и/или биологически активная матрица из силикагеля. Подобная матрица прежде всего пригодна для капсулирования и контролируемого высвобождения жидких действующих веществ при одновременном сохрании их долговременной стабильности. Капсулирование способствует механической и химической стабилизации действующих веществ, предоставляет возможность более удобного обращения с жидкими действующими веществами и лекарственными средствами и позволяет избежать неконтролируемого улетучивания действующих веществ. В готовой композиции (порошке) в зависимости от ее назначения, очевидно, могут присутствовать также другие добавки и/или вспомогательные вещества. Размер частиц (средний диаметр) предлагаемого в изобретении микропорошка предпочтительно составляет от 0,01 до 100 мкм, прежде всего от 0,1 до 20 мкм. Размер (средний диаметр) частиц нанопорошка, как правило, составляет ≤100 нм.
Согласно другой форме исполнения изобретения смесь, по меньшей мере, одного действующего вещества с предлагаемым в изобретении кремниевым золем можно выливать в форму. В результате сушки подобной смеси может быть получен монолит. Подобные монолиты, например, в виде сплошных подкожных имплантатов можно использовать в качестве систем доставки действующих веществ к зоне их действия. Их можно использовать, например, в качестве депо для контрацептивов, высвобождающего действующее вещество в течение длительного периода времни. Подобные предлагаемые в изобретении имплантаты характеризуются отличной биологической совместимостью. Монолиты могут обладать диаметром, предпочтительно составляющим ≥0,5 мм. В другом варианте монолиты можно подвергать также измельчению в порошок и размалыванию.
В другой форме исполнения изобретения кремниевый золь можно использовать для нанесения покрытий, которые выполняют обычными методами, например окунанием подлежащего облицовке тела в кремниевый золь, его поливу кремниевым золем, а также центробежным методом или распылением кремниевого золя. Кремниевый золь предпочтительно можно использовать в качестве покрытия драже или капсулы. С этой целью спрессованные порошкообразные смеси лекарственных средств снабжают биологически рассасывающимся и/или биологически активным покрытием из предлагаемого в изобретении кремниевого золя. Это позволяет контролировать и/или регулировать (например, путем варьирования толщины покрытия и/или последовательности слоев) высвобождение (других) действующих веществ композиции. Указанное покрытие можно наносить также на внедряемые в тело имплантаты, что позволяет повысить (биологическую) совместимость подобных имплантатов, например ослабить или предотвратить реакции их отторжения.
Согласно другой форме исполнения изобретения предлагаемым в изобретении силикагелем можно дополнять или заменять высоковязкие золи, прежде всего гидрогели. Высоковязкие золи и гидрогели используют в медицине и в косметике в качестве действующих веществ или соответственно основ лекарственных средств. Гидрогели в общем случае часто используют для лечения и заживления ран большой площади. В предпочтительном варианте добавление к ним кремниевого золя способствует повышению биологической совместимости, а следовательно, более быстрому заживлению ран. Таким образом, предлагаемые в изобретении гидрогели предпочтительно можно использовать в качестве биологически рассасывающихся и/или биологически активных изделий, используемых прежде всего в медицине или медицинской технике.
Кроме того, настоящее изобретение относится к способу размножения клеток in-vitro, в соответствии с которым матрица, состоящая из предлагаемых в изобретении волокон, выполняет функцию опорной структуры для выращивания клеток и/или направляющей структуры для формирующейся из клеток внеклеточной матрицы, соответственно предоставляет клеткам возможность находить пространственное положение, которое позволяет им размножаться и/или достигать генетически обусловленной дифференцировки. Преимущества предлагаемого в изобретении способа находят соответствующее экспериментальное подтверждение (смотри пример 3).
В качестве клеток можно использовать, например, недифференцированные плюрипотентные стволовые клетки или генетически измененные или нативные дифференцированные клетки с варьируемыми характером и степенью дифференцировки.
Клетки, наносимые на волокнистую матрицу, прилипают к ней или размножаются на ней главным образом двухмерно, совместно образуя внеклеточную матрицу, соответственно медиаторы (гормоны). Волокнистая матрица предпочтительно обладает формой плоскостного элемента, прежде всего нетканого материала или ткани из предлагаемых в изобретении волокон. Подобная волокнистая матрица предпочтительно обладает пористой структурой, в связи с чем нанесенные на нее клетки проникают внутрь, распределяясь в ее объеме, и в соответствии с их генетически обусловленной дифференцировкой или индуцированной факторами дифференцировки дополнительной дифференцировкой могут инициировать пространственный рост тканей и органов, соответственно высвобождать медиаторы. В другой форме исполнения изобретения ма