Карбамоилоксиарилалканоиларилпиперазиновое соединение, фармацевтические композиции, содержащие его, и способ лечения боли, беспокойства и депрессии
Иллюстрации
Показать всеИзобретение относится к производным общей формулы 1, их фармацевтически приемлемым солям или гидратам, фармацевтическим композициям на их основе и способу лечения боли, беспокойства или депрессии. В общей формуле 1:
может селективно образовывать циклическое кольцо; R1 и R2 каждый независимо выбирают из группы, состоящей из водорода, с прямой или разветвленной цепью алкила, имеющего от 1 до 6 атомов углерода и фенэтила или R1 и R2, взятые вместе, образуют 5-членное или 6-членное гетероциклическое кольцо или R1 и R2, взятые вместе с Ar1, образуют бициклическое кольцо; Ar1 выбирают из группы, состоящей из фуранила, тионила, метилендиоксифенила и фенила, которые могут быть замещены по крайней мере одним одинаковым или различным заместителем, выбранным из группы, состоящей из водорода, с прямой или разветвленной цепью алкила, имеющего от 1 до 6 атомов углерода, галогена, такого как F, Cl и Br, с прямой или разветвленной цепью алкокси, имеющего от 1 до 6 атомов углерода, нитро и трифторметила; Z представляет собой водород или фтор, или взятый вместе с Ar1, образует бициклическое кольцо; Ar2 выбирают из группы, состоящей из фенила, метилендиоксифенила, пиридина пиримидина, нафтила, бис(фторфенил)метила и хиноксалина, которые все могут быть замещены по крайней мере одним одинаковым или различным заместителем, выбранным из группы, состоящей из водорода, с прямой или разветвленной цепью алкила, имеющего от 1 до 6 атомов углерода, гидрокси, галогена, с прямой или разветвленной цепью алкокси, имеющего от 1 до 6 атомов углерода, нитро, ацетила, трет-бутилацетила, трифторметила, амино и ацетата; n представляет собой целое число, равное 1 или 2; и m представляет собой целое число в диапазоне от 0 до 2. 4 н. и 22 з.п. ф-лы, 2 cx., 2 табл., 87 пр.
Реферат
Область изобретения
Настоящее изобретение относится к новому карбамоилоксиарилалканоиларилпиперазиновому соединению, фармацевтическим композициям, содержащим это соединение, и способу лечения болей, включая острую боль, хроническую боль, невротическую боль, послеоперационную нейропатическую боль, диабетическую нейропатическую боль, постгерпетическую невралгию, воспалительную боль, боль в суставах, мигрень и тому подобные, беспокойства и депрессии у млекопитающих путем введения данного соединения млекопитающим, которые нуждаются в лечении.
Уровень техники
До настоящего времени арилпиперазиновые соединения показывают, что они являются эффективными к различным симптомам в области центральной нервной системы. В частности, US 3002976 сообщает, что нижеследующее тиофен-вводимое, арилпиперазиновое соединение имеет фармакологический эффект для лечения депрессии. В указанной формуле, R представляет собой водород, метильную группу или галоген.
Также известно, что эффективность баспирона и его структурно связанных соединений при лечении беспокойства осуществляется благодаря их селективной активности в серотониновом (5-гидрокситриптанин:5НТ) подтипе рецетора, представленного рецептором 5-НТ1А. В частности, US 4988814 раскрывает пиперазиновые производные, демонстрирующие сродство к рецептору 5-НТ1А, характеризующиеся как терапевтические агенты для лечения депрессии и беспокойства.
где R1 представляет собой алкил, имеющий от 1 до 6 атомов углерода; R2 и R3 каждый независимо представляет собой алкил, имеющий от 1 до 6 атомов углерода или R2 и R3, взятые вместе с Ar, образуют полиметилен, имеющий от 2 до 12 атомов углерода или образуют остаток 5-норборнен-2-ила с атомами углерода, связанными с радикалами R2 и R3; Х выбирают из группы, состоящей из -CO2-, -ОСО-, -OCO2-, -N(R7)CO2-, -NHNHCO-, -ON(R7)CO-, -CON(R7)-, -N(R7)CO-, -OCON(R7)- и -N(R7)CON(R8) (где R7 и R8 каждый независимо выбирают из группы, состоящей из водорода; алкила, имеющего от 1 до 6 атомов углерода; фенила; бензила; и фенила или бензила, замещенных галогеном, алкилом, имеющим от 1 до 6 атомов углерода, алкокси, имеющим от 1 до 6 атомов углерода, циано, нитро или пергалогенметилом); R4 представляет собой водород или алкил, имеющий от 1 до 6 атомов углерода; R5 выбирают из группы, состоящей из водорода; алкила, имеющего от 1 до 8 атомов углерода; гидроксиалкила, имеющего от 1 до 3 атомов углерода; фенила; бензила; и фенила или бензила, замещенных гидрокси, галогеном, алкилом, имеющих от 1 до 6 атомов углерода, алкокси, имеющего от 1 до 6 атомов углерода, трифторметилом, нитро, циано, карбалкокси, имеющих от 2 до 7 атомов углерода, карбоксамидо, амино, алкиламино, имеющих от 1 до 6 атомов углерода или диалкиламино, имеющий от 1 до 12 атомов углерода; R6 представляет собой фенил, бензил, 2-, 3- или 4-пиридинил, 2-пиримидинил или 2-пиразинил, которые могут быть замещены по крайней мере одним из заместителей, выбиранных из группы, состоящей из гидрокси, галогена, алкила, имеющего от 1 до 6 атомов углерода, алкокси, имеющего от 1 до 6 атомов углерода, трифторметила, нитро, циано, карбалкокси, имеющих от 2 до 7 атомов углерода, карбоксамидо, амино, алкиламино, имеющих от 1 до 6 атомов углерода и диалкиламино, имеющего от 2 до 12 атомов углерода; n является целым числом, выбранным из группы, состоящей из 0, 1, 2, 3, 4 и 5, при условии, что R6 не является 2-пиримидинилом, когда Х представляет собой -CON(R7)- (где R7 представляет собой алкил) и R6 не является 3,5-ди(трифторметил)фенилом, когда Х представляет собой CO2, R1, R2 и R3 представляют собой метил и n равен 1.
Подтверждено, что арилпиперазиновая структура соотносится с эффектом лечения болей, так же как беспокойства и депрессии, потем проведения всеобъемлющих исследований арилпиперазиновой структуры, и найдено, что новые карбамоилоксиарилалканоиларилпиперазиновые соединения обладают лечебным действием на различных животных моделях, у котороых вызвали боль. В частности, авторы настоящего изобретения обнаружили, что новые карбамоилоксиарилалканоиларилпиперазиновые соединения демонстрируют свои терапевтические эффекты в лечении широкого спектра болей, включая острую боль, хроническую боль, нейропатическую боль, послеоперационную нейропатическую боль, диабетическую боль, постгерпетическую невралгию, воспалительную боль, боль в суставах, мигрень и тому подобные, беспокойство и депрессию. Таким образом, настоящее изобретение было завершено на основании вышеупомянутых фактов.
Сущность изобретения
Один из аспектов настоящего изобретения предусматривает карбамоилоксиарилалканоиларилпиперазиновые производные соединения и их фармацевтически приемлемые соли или гидраты.
Другой аспект настоящего изобретения предусматривает фармацевтическую композицию для лечения боли, беспокойства или депрессии, включающую эффективное количество данного соединения.
Еще один аспект настоящего изобретения предусматривает способ лечения боли, беспокойства или депрессии у млекопитающих путем введения эффективного количества данного соединения млекопитающим, которые нуждаются в таком лечении.
Технический результат
В соответствии с аспектом настоящего изобретения, обеспечено новое карбамоил арилалканоиларилпиперазиновое производное соединения, имеющего многочисленные рацемические или энантиомерные характеристики, представленное следующей Формулой 1 и его фармацевтически приемлемые соли и гидраты:
Формула 1
где может селективно образовывать циклическое кольцо;
R1 и R2 каждый независимо выбирают из группы, состоящей из водорода, с прямой или разветвленной цепью алкила, имеющего от 1 до 6 атомов углерода и фенэтила или R1 и R2, взятые вместе с Ar, образуют 5-членное или 6-членное гетероциклическое кольцо или R1 и R2, взятые вместе с Ar с Ar1, образуют бициклическое кольцо;
Ar1 выбирают из группы, состоящей из фуранила, тионила, метилендиоксифенила и фенила, которые могут быть замещены по крайней мере одним одинаковым или различным заместителем, выбранным из группы, состоящей из водорода, с прямой или разветвленной цепью алкила, имеющего от 1 до 6 атомов углерода, галогена, такого как F, Cl и Br, с прямой или разветвленной цепью алкокси, имеющего от 1 до 6 атомов углерода, нитро и трифторметила;
Z представляет собой водород или фтор, или взятый вместе с Ar1, образует бициклическое кольцо;
Ar2 выбирают из группы, состоящей из фенила, метилендиоксифенила, пиридина, пиримидина, нафтила, бис(фторфенил)метила и хиноксалина, которые все могут быть замещены по крайней мере одним одинаковым или различным заместителем, выбранным из группы, состоящей из водорода, с прямой или разветвленной цепью алкила, имеющего от 1 до 6 атомов углерода, гидрокси, галогена, с прямой или разветвленной цепью алкокси, имеющего от 1 до 6 атомов углерода, нитро, ацетила, трет-бутилацетила, трифторметила, амино и ацетата;
n представляет собой целое число, равное 1 или 2; и
m представляет собой целое число в диапазоне от 0 до 2.
В соответствии с другим аспектом настоящего изобретения, обеспечена фармацевтическая композиция для лечения боли, беспокойства или депрессии, включающая эффективное количество соединения, имеющего многочисленные рацемические или энантиомерные характеристики.
В соответствии с еще другим аспектом настоящего изобретения, обеспечен способ лечения боли, беспокойства или депрессии у млекопитающих путем введения млекопитающим, нуждающимся в таком лечении, эффективного количества соединения, имеющего многочисленные рацемические или энантиомерные характеристики.
Преимущества
Как описано выше, новое карбамоилоксиарилалканоиларилпиперазиновое производное соединение и его соли и гидраты согласно настоящему изобретению могут быть эффективно применены в качестве терапевтического агента для лечения болей, включая острую боль, хроническую боль, нейропатическую боль, послеоперационную нейропатическую боль, диабетическую нейропатическую боль, постгерпетическую невралгию, воспалительную боль, боль в суставах и мигрень, и тому подобные, беспокойство и депрессию.
Предпочтительный вариант осуществления изобретения
В дальнейшем настоящее изобретение будет описано более подробно.
Настоящее изобретение относится к карбамоилоксиарилалканоиларилпиперазиновому производному соединению, имеющему многочисленные рацемические или энантиомерные характеристики, представленному следующей Формулой 1 и его фармацевтически приемлемым солям и гидратам:
Формула 1
где может селективно образовывать циклическое кольцо;
R1 и R2 каждый независимо выбирают из группы, состоящей из водорода, с прямой или разветвленной цепью алкила, имеющего от 1 до 6 атомов углерода и фенэтила или R1 и R2, взятые вместе с Ar, образуют 5-членное или 6-членное гетероциклическое кольцо или R1 и R2, взятые вместе с Ar с Ar1, образуют бициклическое кольцо;
Ar1 выбирают из группы, состоящей из фуранила, тионила, метилендиоксифенила и фенила, которые могут быть замещены по крайней мере одним одинаковым или различным заместителем, выбранным из группы, состоящей из водорода, с прямой или разветвленной цепью алкила, имеющего от 1 до 6 атомов углерода, галогена, такого как F, Cl и Br, с прямой или разветвленной цепью алкокси, имеющего от 1 до 6 атомов углерода, нитро и трифторметила;
Z представляет собой водород или фтор, или взятый вместе с Ar1, образует бициклическое кольцо;
Ar2 выбирают из группы, состоящей из фенила, метилендиоксифенила, пиридина пиримидина, нафтила, бис(фторфенил)метила и хиноксалина, которые все могут быть замещены по крайней мере одним одинаковым или различным заместителем, выбранным из группы, состоящей из водорода, с прямой или разветвленной цепью алкила, имеющего от 1 до 6 атомов углерода, гидрокси, галогена, с прямой или разветвленной цепью алкокси, имеющего от 1 до 6 атомов углерода, нитро, ацетила, трет-бутилацетила, трифторметила, амино и ацетата;
n представляет собой целое число, равное 1 или 2; и
m представляет собой целое число в диапазоне от 0 до 2.
Также настоящее изобретение относится к соединению, представленному следующей Формулой 2, и его фармацевтически приемлемым солям и гидратам:
Формула 2
где R1, R2, Z, Ar2, n и m определены как в Формуле 1; и
X1, по крайней мере один, выбирают из группы, состоящей из водорода, с прямой или разветвленной цепью алкила, имеющего от 1 до 6 атомов углерода, галогенов, таких как F, Cl и Br, с прямой или разветвленной цепью алкокси, имеющего от 1 до 6 атомов углерода, нитро и трифторметила,
при условии, что когда X1, по крайней мере два, выбирают из групп, два заместителя могут быть одинаковыми или различными друг от друга.
Кроме того, настоящее изобретение относится к соединению, представленному следующей Формулой 3, и его фармацевтически приемлемым солям и гидратам:
Формула 3
где X1, R1, R2, Z, Ar2, n и m являются теми, как определено выше; и
Х2, по крайней мере один, выбирают из группы, состоящей из водорода, с прямой или разветвленной цепью алкила, имеющего от 1 до 6 атомов углерода, гидрокси, галоген, с прямой или разветвленной цепью алкокси, имеющего от 1 до 6 атомов углерода, нитро, ацетила, трет-бутилацетила, трифторметила, амино и ацетата,
при условии, что когда Х2, по крайней мере два, выбирают из групп, два заместителя могут быть одинаковыми или различными друг от друга.
Соединения в соответствии с одним экспериментальным воплощением настоящего изобретения могут быть химически синтезированы в соответствии со следующими Схемами 1 и 2. Тем не менее они описаны только для иллюстративной цели и не ограничивают особенно настоящее изобретение.
На следующих Схемах НХ представляет собой кислоты, которые могут образовывать фармацевтически приемлемые соли с соединением, имеющим в основе атомы азота. Кислоты включают, например, соляную кислоту, серную кислоту, фосфорную кислоту, уксусную кислоту, бензойную кислоту, лимонную кислоту, малоновую кислоту, салициловую кислоту, яблочную кислоту, фумаровую кислоту, щавелевую кислоту, янтарную кислоту, винную кислоту, молочную кислоту, глюконовую кислоту, аскорбиновую кислоту, малеиновую кислоту, аспарагиновую кислоту, бензолсульфоновую кислоту, метансульфоновую кислоту, этансульфоновую кислоту, гидроксиметансульфоновую кислоту и гидроксиэтансульфоновую кислоту, но настоящее изобретение не ограничивается этим перечнем. Аддитивные кислоты могут перечисляться в уровне техники ["Pharmaceutical Salts," J. Pharm. Sci., 1977; 66(1): 1-19]. Получение соединений по настоящему изобретению осуществляют в реакционной среде, которая может быть представлена как эфирный растворитель (тетрагидрофуран, этиловый эфир, пропиловый эфир, изопропиловый эфир и бутиловый эфир), спиртовой растворитель (метанол, этанол и изопропиловый спирт), сложноэфирый растворитель (этилацетат), галогенированный углеводородный растворитель (дихлорметан, хлороформ) и их смеси.
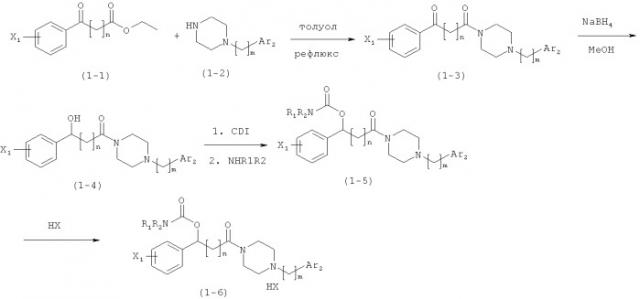
Схема 1
Ацетофенон, замещенный с помощью X1, как показано на Схеме 1, и соединение (1-2) нагревают при температуре кипения с обратным холодильником в толуольном растворителе, чтобы синтезировать соединение (1-3). Соединение (1-3) восстанавливают боргидридом натрия (NaBH4), чтобы получить промежуточный спирт (1-4), и промежуточный спирт (1-4) взаимодействует с 1,1-карбонилдиимидазолом (CDI) и затем с различными аминами (NHR1R2), чтобы получить соединение (1-5). На Схеме 1 НХ представляет собой кислоту, которая может дать фармацевтически приемлемые соли с основным амином. В соответствии со Схемой 1, соединение (1-5) растворяют в реакционной среде, такой как эфирный растворитель (тетрагидрофуран, этиловый эфир), сложноэфирый растворитель (этилацетат), галогенированный углеводородный растворитель (дихлорметан, хлороформ) или им подобные и медленно добавляют соответствующий НХ, чтобы получить соль соединения (1-6). В частности, обычно получают соль соляной кислоты и метансульфонатную соль и оценивают их биологическую активность. Также реакционный продукт (1-5) или (1-6), полученный на Схеме 1, получают весь в форме рацемического соединения.
Схема 2
Как показано на Схеме 2,3-гидрокси-3-фенилпропионовую кислоту, замещенную X1, и фенилпиперазиновое соединение (2-2) подвергают реакции связывания в присутствии 1-этил-3-(3-диметиламинопропил)карбодиимид/1-гидроксибензотриазола (EDC/HOBT), чтобы синтезировать амидное соединение (2-3). Амидное соединение (2-3) взаимодействует с 1,1-карбонилдиимидазолом (CDI) и затем взаимодействует с различными аминами (NHR1R2), чтобы получить соединение (2-4) и его соль (2-5).
Стереохимия реакционного продукта (2-5) зависит только от исходного продукта (2-1); поскольку реакционный продукт, имеющий (S)-энантиомер, получают только из исходного продукта (2-1), являющегося (S)-энантиомером, и реакционный продукт, имеющий (R)-энантиомер, получают только из исходного продукта (2-1), представляющего собой (R)-энантиомер.
В соответствии с настоящим изобретением, обеспечена фармацевтическая композиция, включающая эффективное количество соединения для лечения боли, беспокойства или депрессии. При этом фармацевтическая композиция включает в качестве активного компонента по крайней мере одно соединение среди соединений, представленных в настоящей заявке, и композиция в соответствии с настоящим изобретением может включать любую комбинацию соединений в соответствии с настоящим изобретением.
Фармацевтическая композиция по настоящему изобретению может быть, в частности, приготовлена так, что она может вводиться в любой форме, подходящей для путей введения. В этом случае подходящие пути введения могут, например, включать пероральный, ректальный, назальный, внутрилегочный, местный, чрескожный, интрацистернальный, интраперитонеальный, вагинальный и парентеральный (включая подкожный, внутримышечный, интратекальный, внутривенный и чрескожные пути) пути. Фармацевтическую композицию по настоящему изобретению предпочтительно вводят посредством перорального пути. Предпочтительные пути введения будут, несомненно, варьировать в зависимости от множества факторов, включая общее состояние и возраст субъекта, подвергнутого лечению, тяжесть патологического состояния, по поводу которого проводится лечение, и выбранные активные компоненты и так далее
Фармацевтические препараты, приготовленные согласно настоящему изобретению, могут быть введены перорально в любой лекарственной форме, такой как подходящие виды таблеток, капсул, порошка, гранул, пеллет, пастилок, драже, пилюль или пастилок, раствора или суспензии в водной или неводной жидкости, или жидкая эмульсия масло-в-воде или вода-в-масле, эликсир, сироп и т.д. или может вводиться парентерально в форме инъекций. Другие фармацевтические композиции, которые могут быть введены парентерально, включают дисперсию, суспензию и эмульсию, так же как стерильные порошки, включающие стерильный раствор для инъекций или дисперсию перед их применением. Предполагается, что депонированные препараты для инъекций также попадают в рамки настоящего изобретения. Другие подходящие формы введения включают суппозитории, спрей, мазь, крем, желатин, аэрозоль, накожный пластырь и так далее. Композиция по настоящему изобретению может быть приготовлена согласно различным способам, известным в этой области. Также фармацевтически приемлемый носитель, разбавитель, наполнитель или другие добавки, которые обычно используются в этой области, могут быть применены в данном случае.
Носитель, который обычно используется в препаратах, включает, помимо прочего, лактозу, декстрозу, кальция силикат, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, воду, сироп, метилцеллюлозу, метилгидроксибензоат, пропилгидроксибензоат, тальк, стеарат магния, минеральное масло и так далее. Композиция по настоящему изобретению может также включать консервант, улучшающее стабильность соединение, улучшающее/регулирующее вязкость соединение, улучшающее растворимость соединение, подсластитель, краситель, улучшающее вкус соединение, осмотическую соль, буфер, антиоксидант и так далее.
Там, где упомянутые выше соединения демонстрируют требуемый эффект для лечения боли, беспокойства или депрессии, соединения могут быть использованы в виде сольватов, сложных эфиров, стереоизомеров и так далее, включая свободные соединения, фармацевтически приемлемые соли и гидраты. Также все упомянутые выше соединения включены в рамки настоящего изобретения.
В соответствии с настоящим изобретением, фармацевтически приемлемые соли могут включать фармацевтически приемлемые кислотно-аддитивные соли. Фармацевтически приемлемые кислотно-аддитивные соли могут быть получены из неорганических кислот, таких как соляная кислота, азотная кислота, фосфорная кислота, серная кислота, бромистоводородная кислота, йодистоводородная кислота, азотистая кислота и фосфорная кислота; и нетоксичных органических кислот, таких как алифатические моно- и ди-карбоксилат, фенил-замещенный алканоат, гидроксиалканоат и алкадионат, ароматические кислоты, алифатические и ароматические сульфоновые кислоты; и им подобные. Конкретные примеры фармацевтически приемлемых солей включают, но без ограничения, сульфат, пиросульфат, бисульфат, сульфит, бисульфит, нитрат, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат хлорид, бромид, иодид, фторид, ацетат, пропионат, деканоат, каприлат, акрилат, формиат, изобутират, капрат, гептаноат, пропионат, оксалат, малоат, сукцинат, суберат, себакат, фумарат, малеат, бутан-1,4-диоат, гексан-1,6-диоат, бензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, фталат, терефталат, бензолсульфонат, толуолсульфонат, хлорбензолсульфонат, ксилолсульфонат, фенилацетат, фенилпропионат, фенилбутират, цитрат, лактат, 3-гидроксибутират, гликолат, малеат, тартрат, метансульфонат, пропансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат и манделат. Особенно соляная кислота и метансульфонат являются предпочтительными.
Настоящее изобретение предусматривает способ лечения боли, беспокойства или депрессии у млекопитающих, характеризующийся тем, что эффективное количество соединения вводят млекопитающим, которые нуждаются в таком лечении.
Боль, которая может быть пролечена с помощью соединения по настоящему изобретению, включает широкий спектр болей, таких как острая боль, хроническая боль, нейропатическая боль, послеоперационная нейропатическая боль, диабетическая нейропатическая боль, постгерпетическая невралгия, воспалительная боль, боль в суставах, мигрень и тому подобные, беспокойство и депрессию.
Как правило, фармацевтическая композиция по настоящему изобретению вводится при содержании активного компонента в единице дозирования от приблизительно 20 до 500 мг. Общая суточная доза, как правило, может вводиться в количестве от приблизительно 10 до 7000 мг, предпочтительно от 20 до 3500 мг активного соединения по настоящему изобретению. Тем не менее, активное соединение может быть введено в некотором количестве, выходящим за рамки диапазона дозирования, при изучении состояния пациентов, и также учитывая активность вводимых агентов. В этом случае оптимальное количество таких агентов в дозе в конкретных условиях должно определяться с помощью традиционных экспериментов.
Соединение по настоящему изобретению может вводиться один или много раз в сутки, и доза соединения может быть предпочтительно разделена на 1 - 4 приема в день. Соединение по настоящему изобретению может быть введено в чистом виде или в комбинации фармацевтически приемлемого носителя или наполнителя. Фармацевтическая композиция согласно настоящему изобретению может быть приготовлена в фармацевтически приемлемом носителе или разбавителе, так же как в среде и наполнителе, которые широко известны в данной области. Для удобства препараты могут быть приготовлены в дозах, подходящих для такого введения посредством способов, известных в области фармакологии.
Способ получения
В дальнейшем экспериментальные воплощения настоящего изобретения будут описаны подробно. Тем не менее, должно быть понятно, что описание, предложенное в настоящем изобретении, представляет собой только предпочтительный пример для иллюстративной цели и не предназначено для ограничения объема изобретения.
1. Синтез карбамоилоксиарилалканоиларилпиперазиновых соединений
Пример 1: карбаминовой кислоты 3-[4-(4-фторфенил)-пиперазин-1-ил]-3-оксо-1-фенилпропиловый эфир
Этилбензоилацетат (2.887 ммоль) и 4-фторфенилпиперазин (2.887 ммоль) растворяют в толуоле и нагревают при температуре кипения с обратным холодильником в течение 24 часов. Полученную реакционную смесь концентрируют при пониженном давлении, растворяют в метаноле и охлаждают до температуры 0°С и к полученной смеси добавляют по каплям боргидрид натрия (2.887 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 2 часов, концентрируют при пониженном давлении, разбавляют водой и затем экстрагируют несколько раз этилацетатом, чтобы получить органическую фазу. Указанную органическую фазу сушат над сульфатом магния, фильтруют и затем концентрируют при пониженном давлении. Полученную смесь очищают с помощью хроматографии на колонке (смесь гексан:этилацетат = 1:1), чтобы получить соединение. Полученное соединение растворяют в тетрагидрофуране (10 мл) и к полученной смеси добавляют 1,1'-карбодиимидазол (5 ммоль). Затем полученную смесь перемешивают при комнатной температуре в течение часа и к реакционной смеси добавляют избыточное количество гидроксида аммония. Полученную реакционную смесь перемешивают при комнатной температуре в течение часа. Реакционную смесь разбавляют водой и экстрагируют несколько раз этилацетатом, чтобы получить органическую фазу. Указанную органическую фазу сушат над сульфатом магния, фильтруют и затем концентрируют при пониженном давлении. Полученную гранулу очищают с помощью хроматографии на колонке (этилацетат), чтобы получить указанное в заголовке соединение.
1Н ЯМР (200 МГц, CDCl3) δ: 2.82 (дд, 1H), 3.03 (м, 5Н), 3.60 (м, 2Н), 3.76 (м, 2Н), 4.73 (широкий, 2Н), 6.16 (т, 1H), 6.95 (м, 4Н), 7.38 (м, 5Н)
Соединения по Примерам с 2 по 60 получают в соответствии с методикой, аналогичной методике получения соединения по Примеру 1, за исключением того, что в Примерах со 2 по 60 используют различные исходные продукты.
Пример 2: карбаминовой кислоты 3-[4-(4-метоксифенил)-пиперазин-1-ил]-3-оксо-1-фенилпропиловый эфир
Указанное в заголовке соединение получают в соответствии с методикой, аналогичной методике получения соединения по Примеру 1, за исключением того, что для этой цели используют этилбензоилацетат и 4-метоксифенилпиперазин:
1Н ЯМР (200 МГц, CDCl3) δ: 3.00 (м, 6Н), 3.60 (м, 2Н), 3.79 (м, 5Н), 4.82 (широкий, 2Н), 6.18 (т, 1Н), 6.88 (м, 4Н), 7.38 (м, 5Н).
Пример 3: карбаминовой кислоты 3-[4-(3,4-дихлорфенил)-пиперазин-1-ил]-3-оксо-1-фенилпропиловый эфир
Указанное в заголовке соединение получают в соответствии с методикой, аналогичной методике получения соединения по Примеру 1, за исключением того, что для этой цели используют этилбензоилацетат и 3,4-дихлорфенилпиперазин.
1Н ЯМР (200 МГц, CDCl3) δ: 2.82 (дд, 1Н), 3.09 (м, 5Н), 3.58 (м, 2Н), 3.74 (м, 2Н), 4.81 (широкий, 2Н), 6.14 (т, 1Н), 6.73 (дд. 1Н), 6.94 (д, 1Н), 7.40 (м, 6Н)
Пример 4: карбаминовой кислоты 3-оксо-1-фенил-3-(4-п-толилпиперазин-1-ил)-пропиловый эфир
Указанное в заголовке соединение получают в соответствии с методикой, аналогичной методике получения соединения по Примеру 1, за исключением того, что для этой цели используют этилбензоилацетат и 4-метилфенилпиперазин.
1Н ЯМР (200 МГц, CDCl3) δ: 2,30 (с, 3Н), 2.82 (дд, 1Н), 3.05 (м, 5Н), 3.60 (м, 2Н), 3.77 (м, 2Н), 4.77 (широкий, 2Н), 6.15 (т, 1Н), 6.84 (д, 2Н), 7.10 (д, 2Н), 7.38 (м, 5Н)
Пример 5: карбаминовой кислоты 3-[4-(3,4-диметоксифенил)-пиперазин-1-ил]-3-оксо-1-фенилпропиловый эфир
Указанное в заголовке соединение получают в соответствии с методикой, аналогичной методике получения соединения по Примеру 1, за исключением того, что для этой цели используют этилбензоилацетат и 3,4-диметоксифенилпиперазин.
1H ЯМР (200 МГц, CDCl3) δ: 2.82 (дд, 1Н), 3.04 (м, 5Н), 3.61 (м, 2Н), 3.77 (м, 2Н), 3.88 (д, 6Н), 4.77 (широкий, 2Н), 6.15 (т, 1Н), 6.42 (д, 1Н), 6.57 (с, 1Н), 6.82 (д, 1Н), 7.41 (м, 5Н)
Пример 6: карбаминовой кислоты 1-(4-хлорфенил)-3-[4-(3,4-диметоксифенил)-пиперазин-1-ил]-3-оксопропиловый эфир
Указанное в заголовке соединение получают в соответствии с методикой, аналогичной методике получения соединения по Примеру 1, за исключением того, что для этой цели используют этил-4-хлорбензоилацетат и 3,4-диметоксифениллиперазин.
1H ЯМР (200 МГц, CDCl3) δ: 2.82 (дд, 1Н), 3.01 (м, 5Н), 3.61 (м, 2Н), 3.77 (м, 2Н), 3.86 (д, 6Н), 4.84 (широкий, 2Н), 6.15 (т, 1Н), 6.42 (д, 1Н), 6.57 (с, 1Н), 6.82 (д, 1Н), 7.35 (с, 4Н)
Пример 7: карбаминовой кислоты 3-[4-(3,4-диметоксифенил)-пиперазин-1-ил]-1-(4-фторфенил)-3-оксопропиловый эфир
Указанное в заголовке соединение получают в соответствии с методикой, аналогичной методике получения соединения по Примеру 1, за исключением того, что для этой цели используют этил-4-фтор-бензоилацетат и 3,4-диметоксифенилпиперазин.
1Н ЯМР (200 МГц, CDCl3) δ: 2.82 (дд, 1Н), 3.01 (м, 5Н), 3.60 (м, 2Н), 3.75 (м, 2Н), 3.86 (д, 6Н), 4.92 (широкий, 2Н), 6.15 (т, 1Н), 6.42 (д, 1Н), 6.56 (д, 1Н), 6.80 (д, 1Н), 7.04 (т, 2Н), 7.38 (т, 2Н)
Пример 8: карбаминовой кислоты 3-[4-(3,4-диметоксифенил)-пиперазин-1-ил]-3-оксо-1-п-толилпропиловый эфир
Указанное в заголовке соединение получают в соответствии с методикой, аналогичной методике получения соединения по Примеру 1, за исключением того, что для этой цели используют этил-4-метилбензоилацетат и 3,4-диметоксифенилпиперазин.
1Н ЯМР (200 МГц, CDCl3) δ: 2.35 (с, 3Н), 2.82 (дд, 1Н), 3.04 (м, 5Н), 3.62 (м, 2Н), 3.77 (м, 2Н), 3.88 (д, 6Н), 4.67 (широкий, 2Н), 6.11 (т, 1Н), 6.47 (дд, 1Н), 6.58 (д, 1Н), 6.81 (д,1Н),7.18(д,2Н),7.32(д,2Н)
Пример 9: карбаминовой кислоты 3-[4-(2,4-диметоксифенил)-пиперазин-1-ил]-3-оксо-1-фенилпропиловый эфир
Указанное в заголовке соединение получают в соответствии с методикой, аналогичной методике получения соединения по Примеру 1, за исключением того, что для этой цели используют этилбензоилацетат и 2,4-диметоксифенилпиперазин.
1Н ЯМР (200 МГц, CDCl3) δ: 2.89 (м, 6Н), 3.59 (м, 2Н), 3.82 (м, 8Н), 4.98 (широкий, 2Н 6.12 (т, 1Н), 6.42 (дд, 1H), 6.49 (д, 1Н), 6.79 (д, 1Н), 7.35 (м, 5Н)
Пример 10: карбаминовой кислоты 3-[4-(3,5-дихлорфенил)-пиперазин-1-ил]-3-оксо-1-фенилпропиловый эфир
Указанное в заголовке соединение получают в соответствии с методикой, аналогичной методике получения соединения по Примеру 1, за исключением того, что для этой цели используют этилбензоилацетат и 3,5-дихлорфенилпиперазин.
1Н ЯМР (200 МГц, CDCl3) δ: 2.82 (дд, 1Н), 3.13 (м, 5Н), 3.56 (м, 2Н), 3.75 (м, 2Н 4.76 (широкий, 2Н), 6.14 (т, 1Н), 6.73 (м, 2Н), 6.86 (м, 1Н), 7.39 (м, 5Н)
Пример 11: карбаминовой кислоты 3-[4-(3,5-диметоксифенил)-пиперазин-1-ил]оксо-1-фенилпропиловый эфир
Указанное в заголовке соединение получают в соответствии с методикой, аналогичной методике получения соединения по Примеру 1, за исключением того, что для этой цели используют этилбензоилацетат и 3,5-диметоксифенилпиперазин.
1Н ЯМР (200 МГц, CDCl3) δ: 2.82 (дд, 1Н), 3.1 1 (м, 5Н), 3.56 (м, 2Н), 3.80 (м, 8Н 4.79 (широкий, 2Н), 6,08 (м, 4Н), 7.39 (м, 5Н)
Пример 12: карбаминовой кислоты 3-[4-(2,3-дихлорфенил)-пиперазин-1-ил]-3-оксо-1-фенилпропиловый эфир
Указанное в заголовке соединение получают в соответствии с методикой, аналогичной методике получения соединения по Примеру 1, за исключением того, что для этой цели используют этилбензоилацетат и 2,3-дихлорфенилпиперазин.
1H ЯМР (200 МГц, CDCl3) δ: 2.96 (м, 6Н), 3.62 (м, 2Н), 3.80 (м, 2Н), 4.73 (широкий, 2Н), 6.16 (т, 1Н), 6.88 (дд, 1H), 7.31 (м, 7Н)
Пример 13: карбаминовой кислоты 3-[4-(2,4-дифторфенил)-пиперазин-1-ил]-3-оксо-1-фенилпропиловый эфир
Указанное в заголовке соединение получают в соответствии с методикой, аналогичной методике получения соединения по Примеру 1, за исключением того, что для этой цели используют этилбензоилацетат и 2,4-дифторфенилпиперазин.
1Н ЯМР (200 МГц, CDCl3) δ: 2.95 (м, 6Н), 3.61 (м, 2Н), 3.80 (м, 2Н), 4.69 (широкий, 2Н), 6.15 (т, 1Н), 6.82 (м, 3Н), 7.35 (м, 5Н)
Пример 14: карбаминовой кислоты 3-(4-бензо[1,3]диоксол-5-ил-пиперазин-1-ил)-3-оксо-1-фенилпропиловый эфир
Указанное в заголовке соединение получают в соответствии с методикой, аналогичной методике получения соединения по Примеру 1, за исключением того, что для этой цели используют этилбензоилацетат и 3,4-метилендиоксифенилпиперазин.
1Н ЯМР (200 МГц, CDCl3) δ: 2.98 (м, 6Н), 3.59 (м, 2Н), 3.76 (м, 2Н), 4.71 (широкий, 2Н), 5.94 (с, 2Н), 6.15 (т, 1Н), 6.36 (дд, 1Н), 6.55 (с, 1Н), 6.74 (д, 1Н), 3.40 (м, 5Н)
Пример 15: карбаминовой кислоты 1-(4-метоксифенил)-3-оксо-3-(4-фенилпиперазин-1-ил)-пропиловый эфир
Указанное в заголовке соединение получают в соответствии с методикой, аналогичной методике получения соединения по Примеру 1, за исключением того, что для этой цели используют этил-4-метоксибензоилацетат и фенилпиперазин.
1Н ЯМР (200 МГц, CDCl3) δ: 2.82 (дд, 1Н), 3.1 1 (м, 5Н), 3.60 (м, 2Н), 3.74 (м, 2Н), 3.78 (с, 3Н), 5.01 (широкий, 2Н), 6.08 (т, 1Н), 6.91 (м, 5Н), 7.33 (м, 4Н)
Пример 16: карбаминовой кислоты 1-(4-хлорфенил)-3-оксо-3-(4-фенилпиперазин-1-ил)-пропиловый эфир
Указанное в заголовке соединение получают в соответствии с методикой, аналогичной методике получения соединения по Примеру 1, за исключением того, что для этой цели используют этил-4-хлорбензоилацетат и фенилпиперазин.
1Н ЯМР (200 МГц, CDCl3) δ: 2.82 (дд, 1Н), 3.14 (м, 5Н), 3.60 (м, 2Н), 3.74 (м, 2Н 4.81 (широкий, 2Н), 6.12 (т, 1Н), 6.94 (м, 3H), 7.33 (м, 6Н)
Пример 17: карбаминовой кислоты 3-[4-(4-трет-бутилфенил)-пиперазин-1-ил]-3-оксо-1-фенилпропиловый эфир
Указанное в заголовке соединение получают в соответствии с методикой, аналогичной методике получения соединения по Примеру 1, за исключением того, что для этой цели используют этилбензоилацетат и 4-трет-бутилфенилпиперазин.
1Н ЯМР (200 МГц, CDCl3) δ: 1.32 (с, 9Н), 2.82 (дд, 1Н), 3.08 (м, 5Н), 3.60 (м, 2Н) 3.76 (м, 2Н), 4.68 (широкий, 2Н), 6.18 (т, 1Н), 6.94 (м, 2Н), 7.35 (м, 7Н)
Пример 18: карбаминовой кислоты 3-[4-(4-гидроксифенил)-пиперазин-1-ил]-3-оксо-1-фенилпропиловый эфир
Указанное в заголовке соединение получают в соответствии с методикой, аналогичной методике получения соединения по Примеру 1, за исключением того, что для этой цели используют этилбензоилацетат и 4-гидроксифенилпиперазин.
1Н ЯМР (200 МГц, DMSO) δ: 2.82 (м, 6Н), 3.56 (м, 4Н), 5.93 (т, Ш), 6.51 (широкий, 2Н), 6.67 (д, 2Н), 6.78 (д, 2Н), 7.37 (м, 5Н), 8.88 (с, 1Н)
Пример 19: диметилкарбаминовой кислоты 3-[4-(4-метоксифенил)-пиперазин-ил]-3-оксо-1-фенилпропиловый эфир
Этилбензоилацетат (2 ммоль) и 4-метоксифенилпиперазин (2 ммоль) растворяют в толуоле и нагревают при температуре кипения с обратным холодильником в течение 24 часов. Полученную смесь концентрируют при пониженном давлении, чтобы получить сырое соединение, которое растворяют в метаноле и охлаждают до температуры 0°С. Затем к полученной смеси по каплям добавляют боргидрид натрия (2 ммоль). Смесь перемешивают при комнатной температуре в течение 2 часов, концентрируют при пониженном давлении, разбавляют водой и затем экстрагируют несколько раз этилацетатом, чтобы получить органическую фазу. Указанную органическую фазу сушат над сульфатом магния, фильтруют и затем концентрируют при пониженном давлении. Полученную гранулу очищают с помощью хроматографии на колонке (смесь гексан:этилацетат = 1:1), чтобы получить соединение. Полученное соединение растворяют в тетрагидрофуране (8 мл) и к полученной смеси добавляют 1,1'-карбодиимидазол (4 ммоль). Затем ее перемешивают при комнатной температуре в течение часа и к реакционной смеси добавляют избыточное количество диметиламина. Полученную реакционную смесь перемешивают при комнатной температуре в течение часа. Ее разбавляют водой и экстрагируют несколько раз этилацетатом, чтобы получить органическую фазу. Указанную органическую фазу сушат над сульфатом магния, фильтруют и затем концентрируют при пониженном давлении. Полученную гранулу очищают с помощью хроматографии на колонке (этилацетат), чтобы получить указанное в заголовке соединение.
1Н ЯМР (200 МГц, CDCl3) δ: 2.95 (м, 12Н), 3.60 (м, 2Н), 3.74 (м, 2Н), 3.78 (с, 3H), 6.18 (т, 1Н), 6.87 (м, 4Н), 7.39 (м, 5Н)
Пример 20: карбаминовой кислоты 3-[4-(3,4-диметилфенил)-пиперазин-1-ил]-3-оксо-1-фенилпропиловый эфир
Указанное в заголовке соединение получают в соответствии с методикой, аналогичной методике получения соединения по Примеру 1, за исключением того, что для этой цели используют этилбензоилацетат и 3,4-диметилфенилпиперазин.
1H ЯМР (200 МГц, CDCl3) δ: 2.21 (с, 3H), 2.26 (с, 3H), 2.8