Белково-полипептидный комплекс (бпк), обладающий тканеспецифическим репаративным и омолаживающим действием на кожную ткань, способ получения белково-полипептидного комплекса, обладающего тканеспецифическим репаративным и омолаживающим действием на кожную ткань, и фармацевтическая композиция на основе бпк, обладающая антигипоксическим, иммуномодулирующим, тканеспецифическим репаративным действием на кожную ткань и слизистые оболочки, с омолаживающим эффектом
Иллюстрации
Показать всеИзобретение относится к биохимии. Описан белково-полипептидный комплекс (БПК), обладающий тканеспецифическим репаративным и омолаживающим действием на кожную ткань, получаемый из экстрагированного гомогената нервной и кожной тканей эмбрионов копытных сельскохозяйственных животных, и способ его получения. Данный комплекс включает отрицательно заряженные слабо-кислые и нейтральные белки и полипептиды с молекулярной массой от 5 до 200 кДа. Комплекс используется в качестве активного действующего компонента в фармацевтических композициях, предназначенных для получения лечебных и косметологических средств. Изобретение позволяет получать препараты, предназначенные для лечения различных заболеваний кожи (сосудистых, аутоиммунных, травматических, токсических), в эстетической медицине, геронтологии и косметологии. 3 н. и 2 з.п. ф-лы, 4 ил., 10 пр.
Реферат
Изобретение относится к биологически активной субстанции - белково-полипептидного комплекса (БПК), получаемой из тканей кожи, головного и спинного мозга эмбрионов копытных сельскохозяйственных животных, и предназначена в качестве активного вещества для производства лекарственных препаратов, стимулирующих физиологическую и репаративную регенерацию, в лечении заболеваний и травматических поражений кожи, а также для применения в производстве лекарственных препаратов в эстетической медицине, косметологии и способу ее получения.
Принятые сокращения и условные обозначения:
БПК - белково-полипептидный комплекс;
I - ионная сила раствора;
Фармкомпозиция - фармацевтическая композиция.
В настоящее время, на фоне неуклонного роста кожных заболеваний аутоиммунного, сосудистого, токсического, инфекционного, травматического генеза, а также ятрогенных осложнений после применения «омолаживающих» препаратов, косметических средств и процедур, не существует препаратов группы прямых репарантов, специфичных для кожной ткани. Целью данного изобретения явилось создание биологически активной субстанции - прямого репаранта, обладающего тканеспецифическим регенеративным действием на кожную ткань.
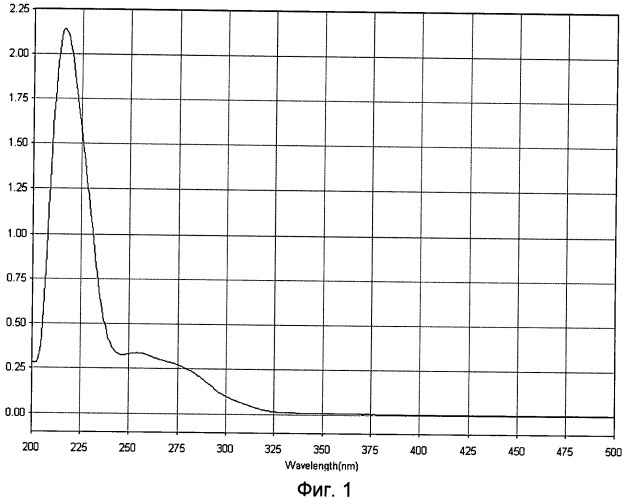
Биологически активная субстанция представляет собой БПК с молекулярной массой входящих в него белково-полипептидных компонентов в пределах от 5 до 200 кДа и содержанием среднемолекулярной фракции в пределах от 20 до 160 кДа не менее 70%, общей концентрацией белка 0,1-4,2 мг/мл, с максимумом поглощения ультрафиолетового спектра раствора при длине волны 215±5 нм в УФ-видимой области с интервалом длин волн 200-500 нм (фиг.1) и наличием специфических полос при денатурирующем гель-электрофорезе в 5%-ном полиакриламидном геле (фиг.2), а также фармацевтически приемлемый разбавитель, включающий буферный раствор и вспомогательные вещества - высокомолекулярные соединения, относящиеся к классу консервантов, детергентов и солюбилизаторов в достаточных концентрациях. БПК получен путем ионообменной хроматографии фильтрата экстрагированного гомогената нервной и кожной тканей эмбрионов копытных сельскохозяйственных животных сроком гестации от середины первой трети до середины последней в присутствии буферного раствора, детергентов и солюбилизаторов.
Известен целый ряд препаратов пептидной природы из сырья животного происхождения, обладающих регенеративной активностью, которые используются для лечения заболеваний кожи. Наиболее близкими по достигаемому эффекту являются:
- пептидный экстракт плаценты и способ его [1], заключающийся в солевой экстракции гомогената плаценты с 10 мМ Na-фосфатным буфером рН - 7,0 в присутствии 0,1 мМ ЭДТА и Тритона-100, предварительно выдержав 3 часа при температуре +4°С, с последующей фазой удаления гормонов из элюента после центрифугирования в присутствии полиглюкина и активированного угля, доведя температуру смеси до (+40)-(+45)°С и оставив на 4 часа при комнатной температуре. Полученный элюент из отцентрифугированной смеси содержит 5-35 мг/мл белка, 2-5 мг/мл гликопротеидов и 0,5-1 мг/мл Тритона Х100. Следует отметить достаточно высокий выход по количеству полученных белков. Однако полученные в экстракте белки не охарактеризованных стандартными физико-химическими методами (масса, оптическая плотность, форез и т.д.) белков, а наличие значительного количества гликопротеидов позволяет предполагать высокую иммуногенность и аллергенность экстракта;
- группа изобретений «Лекарственные средства на основе зародыша и способ их получения» [2], данный способ предполагает измельчение и гомогенизацию мягких тканей эмбрионов животных в смеси с физиологическим раствором. Данный способ не позволяет стандартизировать полученную смесь, а отсутствие четких физико-химических характеристик получаемого продукта - применение данного препарата парентерально, из-за присутствия компонентов клеточных стенок и мембран клеточных структур, что определяет его высокую иммуногенность;
- способ изготовления биологически активных препаратов на основе эмбриональных тканей [3], который предусматривает гидролиз гомогената от 2-х до 42 дней при температуре (+4)-(+45)°С с дальнейшей термообработкой при температуре (+60)-(+120)°С, отделением денатурированных веществ и выделение из гидролизата термостабильного целевого продукта неопределенного состава, со средней молекулярной массой менее 10 кДа с содержанием пептидов 1-3 мг/мл и сухим остатком 14-20 мг/мл. При данном способе изготовления получаемый целевой продукт содержит измененные, денатурированные продукты гидролиза с нарушенной четвертичной и третичной структурой, а также продукты распада многих активных молекул, что определяет его невысокую биологическую активность;
- способ биологического омоложения кожи [4], данный способ предлагает внутрикожное и подкожное введение диспергированного биоматериала «Аллоплант» [5], у которого выявлена способность привлечения клеток макрофагального ряда со стимуляцией их созревания, восстановления кислотно-щелочного баланса кожного покрова за счет нормализации работы потовых и сальных желез, со сдвигом обменных процессов в ткани кожи в сторону преобладания процессов, свойственных ткани физиологически более молодого возраста. За счет этого появляется возможность коррекции фиброзных и дегенеративно-дистрофических изменений в тканях (возможность селективного роста тканей на месте имплантированного биоматериала) с усилением обменных процессов, направленных на восстановление фиброархитектоники кожи. Однако отсутствие в препарате сбалансированных факторов роста и дифференцировки, специфичных для кожной ткани, не позволяет получить выраженный омолаживающий эффект, а также стимулировать физиологическую и репаративную регенерацию.
- косметическое средство для ухода за кожей «Гармония» [6], содержащее экстракт из эмбрионов млекопитающих (человека) и биологически активные добавки природного и химического происхождения (масло герани, масло кориандра, настойку подорожника, экстракт майских листьев березы, экстракт майских листьев черемухи, соки алоэ и чистотела, масло кукурузное, экстракт прополиса, пальмовое масло, облепиховое масло и желток куриного яйца, глицерин, неорганические соли, например соли Хенкса, двузамещенный фосфат натрия, лимонную кислоту, причем соотношение основы и биологически активных добавок природного и химического происхождения составляет (0,59-5,3):1,0. Экстракт из эмбрионов получают путем гомогенизации и экстракции в солевом растворе, ультрацентрифугированием с последующей фильтрацией надосадочной жидкости. Получаемый экстракт содержит разномолекулярные фракции не охарактеризованных стандартными физико-химическими методами водорастворимых денатурированных белков, пептидов, пептидгликанов, липопротеинов, не поддающихся стандартизации, наружное применение которых достаточно иммуногенно с невысоким биологическим эффектом;
- способ получения регенерирующего косметического крема для ухода за кожей [7], содержащего наряду с ростовыми факторами, включающими интерлейкин-2, эритропоэтин, эпидермальный фактор роста и лейкоцитарный гормон роста, продукты метаболизма клеток лейкоцитов человека и/или животных при следующем количественном содержании компонентов крема (мас.%): питательная среда с ростовыми факторами и продуктами метаболизма клеток лейкоцитов - 0,7-8,5; биологически активные вещества природного и химического происхождения - 7,0-27,0, полученные из питательной среды, в которой инкубировались клетки человека и/или животных (например, лейкоциты), в присутствии осматотропина. Данная композиция не содержит цитоплазматических, ядерных и мембранных белков и полипептидов, играющих важную сигнальную роль в механизмах регенерации и репарации клеток, концентрация выделенных лейкоцитами факторов роста и гормонов является не оптимальной, а является продуктом их жизнедеятельности и метаболизма, что значительно снижает биологическую активность композиции, вторично стимулируя физиологическую регенерацию и незначительно репарацию тканей, не имея в составе тканеспецифических факторов для кожи;
- известна композиция по уходу за кожей, содержащая следующие компоненты: ретиноид, выбранный из группы, состоящей из спиртовой формы витамина А, альдегидной формы витамина А, ретинилацетата, ретинилпальмитата и их смесей, масляную фазу, имеющую низкий уровень ненасыщенности, и стабилизирующую систему, выбранную из группы, состоящей по крайней мере из по меньшей мере одного антиоксиданта, растворимого в масле, хилатообразователя, экстракта солодки, гидрохинона, коиэвой кислоты, готулина А, микромерола, глютатиона, L-аскорбил-2 фосфата магния, арбутина, экстракта плаценты и их смесей [8]. Однако известная композиция при длительном применении может вызывать гипертензионнный синдром, не обладает достаточным регенерирующим и омолаживающим эффектом;
- косметическое средство для ухода за кожей на основе развивающихся эмбрионов млекопитающих, содержащее основу в виде геля и компоненты на основе экстракта развивающихся эмбрионов (зародышей) млекопитающих, например крупного рогатого скота [9]. Для экстрагирования используют не весь эмбрион животного, а только его зобную железу. Состав содержит (10-30)% экстракта эмбриона животного и (90-70)% основы в виде геля. Препарат наносят на кожу лица и тела для омоложения клеток кожи, защиты от морщин, повышения сопротивляемости кожи и замедления старения тканей. Однако данное косметическое средство оказывает системную гормональную активность воздействием на весь организм, что имеет противопоказания к применению, а также недостаточную эффективность регенерирующего действия на кожу, не имея в составе тканеспецифических факторов роста и факторов, связанных с предотвращением увядания и старения кожи, сохранением и увеличением ее эластичности и поддержанием хорошего состояния в течение длительного времени;
- средство, нормализующее обмен веществ в тканях кожи [10], включающее в себя помимо фракции низкомолекулярных, ассоциированной с белками РНК из ядер и цитоплазмы клеток любых эмбриональных тканей (взяты в качестве примера ткани мозга, печени, тимуса и селезенки поросят в различных соотношениях), пептидную фракцию из гомогената фетальных органов поросят, выделяемую кислым экстрагированием 0,15М HCl с нагреванием на кипящей водяной бане в течение 30 мин, с последующей нейтрализацией щелочью до рН 7,0 и отделением осадка центрифугированием, в результате чего концентрация пептидов достигает 8 мг/мл. Данный способ получения целевого продукта позволяет получать денатурированные низкомолекулярные фракции пептидов в связи с воздействием в процессе выделения кислотной экстракции и кипячения, что абсолютно меняет четвертичную, третичную структуру не охарактеризованных стандартными физико-химическими методами пептидов и, как следствие, снижает биологическую и физиологическую активность полученных продуктов.
Наиболее близким к заявленной группе изобретений, в том числе и по способу получения БПК, является способ получения биологически активного комплекса, обладающего нейрорегенеративным и нейропротективным действием [11]. Данный способ позволяет получить смесь белков и полипептидов из головного мозга эмбрионов сельскохозяйственных животных, взятого на определенной стадии гестации (от начала средней трети до середины последней трети), методом анионообменной хроматографии, используя для нанесения на уравновешенную колонку предварительно отфильтрованный супернатант гомогената ткани с буферным раствором рН 7,2-8,4, целевые фракции получают, разделяя связавшиеся с носителем белки и полипептиды, используя в качестве подвижной фазы 0.05М ТРИС-глициновый буфер, содержащий 0,1 мМ ЭДТА и 1М NaCl, повышая концентрацию ступенчатым градиентом с шагом 5%. Полученный вышеуказанным способом комплекс подвергают ультрафильтрации на мембране 5 кДа и обессоливают. Характеристику целевой белково-полипептидной фракции проверяют методами ультрафиолетовой спектрометрии, гель-хроматографии, денатурирующего электрофореза в полиакриламидном геле и аминокислотного анализа. Полученный вышеуказанным способом биологически активный комплекс имеет максимум поглощения ультрафиолетового спектра при длине волны 280±5 нм и содержанием входящих в него белков от 5 до 110 кДа не менее 95% от общего содержания белков. Использование при получении данного комплекса на этапе анионообменной хроматографии в составе подвижной фазы 1М NaCl создает слишком высокую ионную силу подвижной фазы, равную 1 моль/л, а включение в состав ЭДТА и ТРИС еще больше ее увеличивает. В связи с этим полученная целевая фракция содержит большое количество кислых высоко заряженных белков и полипептидов, имеющих в клетках мозговой ткани преимущественно мембранную локализацию, в основном выполняющих структурные функции и только в незначительной степени регуляторные, не имеющие не только тканеспецифической, но и выраженной биологической активности. Дальнейшее ступенчатое повышение концентрации соли с шагом 5% еще больше увеличивает присутствие данных белков, увеличивая биологическую инертность смеси, тем самым снижая ее активность. Использование при получении данного комплекса в качестве сырья эмбриональных головной мозг обусловливает наличие тканеспецифических белков, регулирующих физиологические и репаративные процессы преимущественно нервной ткани, оказывая невыраженное системное действие, поэтому спектр биологической активности направлен на коррекцию и лечение нарушенных функций и заболевания нервной системы.
Основной целью является создание эффективного природного белково-полипептидного комплекса, отвечающего современным международным требованиям безопасности, предъявляемым к фармацевтическим препаратам.
Основной, поставленной перед авторами задачей было получение биологически активного комплекса, стимулирующего физиологическую и репаративную регенерацию кожной ткани для лечения заболеваний и травматических поражений кожи, а также для применения в производстве лекарственных препаратов в эстетической медицине и косметологии и фармкомпозиции на основе полученного БПК.
Поставленная задача достигается заявленной группой изобретений при соблюдении всех условий получения БПК и фармкомпозиции.
В заявленную группу изобретений входит белково-полипептидный комплекс, способ его получения из эмбриональных нервной и кожной тканей копытных сельскохозяйственных животных на определенных сроках гестации и фармкомпозиция на основе этого белково-полипептидного комплекса.
Таким образом, поставленная задача достигается новым белково-полипептидным комплексом (БПК), обладающим тканеспецифическим репаративным действием на кожную ткань и слизистые оболочки с омолаживающим эффектом, получаемым из эмбриональных нервной и кожной тканей сельскохозяйственных копытных животных сроком гестации от середины первой до середины последней трети беременности, включающим тканеспецифические отрицательно заряженные слабо кислые, нейтральные белки и полипептиды, относящиеся к факторам роста, дифференцировки, сигнальным молекулам, определяющим его биологическую и фармакологическую активность, с молекулярными массами от 5 до 200 кДа, причем не менее 70% от общей массы белка имеет молекулярную массу в диапазоне от 20 до 160 кДа, имеющих характерный специфический набор полос при денатурирующем гель-электрофорезе («SDS-Page») в 5%-ном полиакриламидном геле по сравнению со стандартным набором маркерных белков с диапазоном молекулярных масс от 10 кДа до 250 кДа и максимумом поглощения при длине волны 215±5 нм, при снятии ультрафиолетового спектра в области длин волн от 200 до 500 нм.
Поставленная задача достигается также новым способом получения выше охарактеризованного белково-полипептидного комплекса, обладающего антигипоксическим, тканеспецифическим репаративным и омолаживающим действием на кожную ткань, заключающегося в том, что эмбриональные нервная и кожная ткани копытных сельскохозяйственных животных сроком гестации от середины первой трети до середины последней трети беременности поэтапно:
- гомогенизируют в буферном растворе, с одновременной экстракцией в присутствии неионных детергентов при рН не менее 5,2 и не выше 8,5 с последующим центрифугированием при значении g в интервале 10000-28000 в течение 90-30 мин;
- полученный супернатант фильтруют;
- фильтрат подвергают анионообменной хроматографии на колонке с анионообменным носителем и разделяя связавшиеся с носителем белки и полипептиды, используя в качестве подвижной фазы буферный раствор, первоначально имеющий ионную силу (I) не выше 0,1 ммоль/л, повышая ее плавно или ступенчато с шагом 0,025 ммоль/л и начиная сбор целевых фракций с ионной силой элюента от 0,125 до 0,15 ммоль/л при рН от 5,2 до 8,5;
- полученные фракции объединяют и подвергают стерилизующей фильтрации.
Еще одним изобретением заявленной группы является фармацевтическая композиция на основе БПК, обладающая антигипоксическим, иммуномодулирующим, тканеспецифическим репаративным действием на кожную ткань и слизистые оболочки, с омолаживающим эффектом, выполненная в виде раствора, содержащего в качестве активного ингредиента биологически активный белково-полипептидный комплекс по п.1 в концентрации 0,05-2,0 мг/мл, полученный способом по п.2, и фармацевтически приемлемый разбавитель.
В качестве фармацевтически приемлемого разбавителя фармацевтическая композиция может содержать фармакопейный буферный раствор и, возможно, вспомогательные вещества, включающие высокомолекулярные соединения, стабилизаторы, консерванты и солюбилизаторы.
Указанная фармацевтическая композиция предназначена для фармацевтической и косметической промышленности, например для применения парентерально (внутрикожно, подкожно), интраназально или апликационно на слизистые оболочки и кожу.
Ниже приводится краткое описание способа получения БПК и сам БПК.
Итак, белково-полипептидный комплекс получают следующим образом (некоторые операции описаны с указанием детализаций, которые не ограничивают способ):
- нервную и кожную ткани эмбрионов копытных сельскохозяйственных животных, сроком гестации от середины первой трети до середины последней трети беременности, размораживают;
- гомогенизируют в буферном растворе, с одновременной экстракцией в присутствии неионных детергентов при рН не менее 5,2 и не выше 8,5, в соотношениях не менее 1:0,5;
- гомогенат отделяют от балластных веществ фильтрованием через плотную ткань с последующим центрифугированием при значении g интервале 10000-28000 в течение 90-30 мин,
- надосадочную жидкость фильтруют через мембранный фильтр с диаметром пор 0,45 мкм;
- фильтрат наносят на уравновешенную хроматографическую колонку с анионообменным носителем, например - Toyopearl DEAE-650M;
- разделение связавшихся с носителем белков производят ступенчатым градиентом ионной силы раствора, используя в качестве подвижной фазы буферный раствор, имеющий ионную силу не выше 0,1 ммоль/л, повышая ее с шагом 0,025 ммоль/л и начиная сбор целевых фракций с помощью буферного раствора с ионной силой от 0,125 до 0,15 ммоль/л, в интервале рН от 5,2 до 8,5;
- целевые фракции объединяют и разводят буферным раствором, например 0,05М глицин-NaOH в интервале от рН 5,2 до 8,5 и общей концентрации белка 1,0-2,0 мг/мл;
- полученный раствор подвергают стерилизующей фильтрации, через мембранный фильтр с диаметром пор не более 0,22 мкм и определяют суммарную концентрацию белков.
Все предварительные процессы и процессы получения белково-полипептидной фракции желательно производить при температуре от +2 до +8°С.
Для идентификации полученного БПК используют методы ультрафиолетовой спектрофотометрии, гель-хроматографии и электрофореза в полиакриламидном геле. Ультрафиолетовый спектр раствора препарата снимают в области длин волн от 200 до 500 нм: максимум поглощения отмечается при длине волны 215±5 нм (фиг.1). Молекулярную массу белков, входящих в препарат, определяют методом денатурирующего гель-электрофореза («SDS-Page») в 5%-ном полиакриламидном геле в сравнении со стандартным набором маркерных белков с диапазоном молекулярных масс от 10 кДа до 250 кДа (фиг.2.). Значение изоэлектрической точки комплекса - от 4,2 до 8,4. В состав препарата входят белки с молекулярной массой от 5 кДа до 200 кДа, из которых не менее 70% имеют молекулярную массу в диапазоне от 20 до 160 кДа.
Для получения фармкомпозиции БПК разводят фармацевтически приемлемым буферным раствором, например 50 мМ глицин-фосфатным, содержащим при необходимости вспомогательные вещества, например, с концентрациями 0,5% маннитола, 0,0005% полисорбата-80 и двузамещенного фосфорнокислого натрия до рН не ниже 5,2 и не выше 8,5, с расчетом конечной концентрации общего белка (по методу Лоури) в полученном растворе в пределах 0,05-2,0 мг/мл. Проводят повторную идентификацию смеси и фильтрующую стерилизацию.
Для идентификации полученного белково-полипептидного комплекса используют методы ультрафиолетовой спектрофотометрии, гель-хроматографии и электрофореза в полиакриламидном геле. Ультрафиолетовый спектр раствора препарата снимают в области длин волн от 200 до 500 нм: максимум поглощения отмечается при длине волны 215±5 нм (фиг.1.). Молекулярную массу белков, входящих в препарат, определяют методом денатурирующего гель-электрофореза («SDS-Page») в 5%-ном полиакриламидном геле в сравнении со стандартным набором маркерных белков с диапазоном молекулярных масс от 10 кДа до 250 кДа (фиг.3.). В состав препарата входят белки с молекулярной массой от 5 кДа до 200 кДа, из которых не менее 70% имеют молекулярную массу в диапазоне от 20 до 160 кДа.
Таким образом, при выделении БПК важно, чтобы:
- в качестве сырья использовалась эмбриональная нервная и кожная ткань копытных сельскохозяйственных животных со сроком гестации от конца первой трети до середины последней трети беременности;
- присутствие в буферном растворе консервантов, детергентов и солюбилизаторов в достаточных концентрациях;
- на стадиях гомогенизации и анионообменной хроматографии рН буферных сред находился в диапазоне 5,2-8,5;
- при проведении анионообменной хроматографии ионная сила раствора (I) элюента при разделении связавшихся с носителем белков и полипептидов была не ниже 0,1 ммоль/л, а сбор целевых фракций производился элюентом, имеющим ионную силу не выше 0,15 ммоль/л;
- в описываемом БПК содержание белка с молекулярными массами от 20 кДа до 160 кДа было не менее 70% от общего содержания белка;
- при индентификации заявленного БПК и проведении денатурирующего гель-электрофореза («SDS-Page») в 5%-ном полиакриламидном геле в сравнении со стандартным набором маркерных белков отмечалось наличие характерных полос, подтверждающих и характеризующих спектр белково-полипептидных составляющих комплекса. При других параметрах получения состав белково-полипептидного компонента и концентрационные соотношения входящих в него компонентов будут иными.
Заявляемый биологически активный белково-полипептидный комплекс принципиально отличается от всех известных биологически активных субстанций, получаемых из сырья животного происхождения по:
- сырьевой основе - используется нервная и кожная эмбриональная ткань сельскохозяйственных животных на определенной стадии гестации от середины первой трети до середины последней;
- методике получения - присутствие в экстрагирующем буферного раствора, детергентов и солюбилизантов и отсутствие денатурирующих и деградирующих соединений - спиртов, щелочей, кислот и ферментов позволяет получить мембранные, межклеточные, цитоплазматические, ядерные белки и полипептиды с сохраненной третичной структурой;
- использование в составе подвижной фазы миллимолярных концентраций катиона для создания умеренной ионной силы, позволяя тем самым получить большое количество специфических для нервной ткани слабо заряженных белков и полипептидов, выполняющих регуляторные, сигнальные и ферментативные функции, определяющие выраженную регенеративно-репаративную биологическую тканеспецифическую активность;
- качественному составу, как определенной фракции тканевых (мембранных, клеточных, цитоплазматических, ядерных) гидрофильных, слабо заряженных отрицательных белков и полипептидов, с эволюционно закрепленным в онтогенезе концентрационным соотношением факторов роста, факторов дифференцировки и сигнальных молекул с молекулярной массой от 5 кДа до 200 кДа;
- по идентификации и стандартизации полученной целевой фракции - наличие специфических, характерных для данного комплекса полос при электрофорезе в 5%-ном полиакриламидном геле;
- по чистоте - полученный белково-полипептидный комплекс не содержит примесей в виде липидов, пептидгликанов, липополипротеидов, углеводов, полисахаридов и других соединений;
- по способу применения - парентерально (внутрикожно, подкожно), на слизистые оболочки (интраназально, субконъюнктивально) и кожу;
- по безопасности применения (отсутствие токсических, мутагенных, канцерогенных и аллергизирующих свойств);
- по биологической и фармакологической активности (репаративно-регенеративная) и ее специфичности (ткане- и органоспецифичная).
Заявленная фармкомпозиция в виде БПК с фармацевтически приемлемым разбавителем позволяет повысить стабильность раствора БПК и увеличить сроки его действия и хранения.
Изобретение иллюстрируется следующими примерами, не ограничивающими его объем.
Пример 1. Способ получения БПК.
Получение белково-полипептидного комплекса из эмбриональной нервной и кожной ткани овец.
440 г эмбриональной нервной и кожной ткани ягнят сроком гестации 16-18 недель размораживают и гомогенизируют в 1200 мл 0,05М ТРИС-глициново-фосфатного буфера рН 8,0, содержащего 1 мМ ЭДТА и 0,1% маннит, в течение 5 минут при +4°С, гомогенат отделяют от балластных веществ фильтрованием через плотную ткань с последующим центрифугированием при значении g 10000 в течение 90 мин, отделяя фугат. Надосадочную жидкость фильтруют через мембранный фильтр с диаметром пор 0,45 мкм, фильтрат наносят на уравновешенную 4 объемами 0,05М глициново-фосфатного буфера с рН 7,0 хроматографическую колонку объемом 200 мл с анионообменным носителем Toyopearl DEAE-650M, разделение связавшихся с носителем белков производят ступенчатым градиентом тем же буферным раствором, содержащим 0,05 М KCl (I=0,1 ммоль/л), повышая концентрацию соли с шагом 0,025М (I=0,025 ммоль/л) и начиная сбор целевых фракций с концентрациями соли от 0,075 М (I=0,125 ммоль/л) до 0,1 М (I=0,15 ммоль/л), целевые фракции объединяют, подвергают ультрафильтрации на установке при противодавлении не более 8,0 кгс/см2 через материалы с задерживающей способностью выше 200 кДа и разводят 0,05 М раствором глицин-NaOH рН 8,5 до общей концентрации белка 1,4 мг/мл, полученный раствор подвергают стерилизующей фильтрации, через мембранный фильтр с диаметром пор не более 0,22 мкм и определяют суммарную концентрацию белков.
Все предварительные процессы и процессы получения белково-пептидной фракции производятся при температурах от +2 до +8°С.
Характеристика полученного белково-полипептидного комплекса:
- ультрафиолетовый спектр раствора препарата снимают в области длин волн от 200 до 500 нм: максимум поглощения отмечается при длине волны 215±5 нм (Фиг.1);
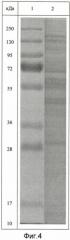
- молекулярную массу белков, входящих в препарат, определяют методом денатурирующего гель-электрофореза («SDS-Page») в 5%-ном полиакриламидном геле в сравнении со стандартным набором маркерных белков с диапазоном молекулярных масс от 10 кДа до 250 кДа, в состав фракции входят белки с молекулярной массой от 5 кДа до 200 кДа, из которых 76% имеют молекулярную массу в диапазоне от 20 до 160 кДа (Фиг.2);
- количественное определение белка методом Лоури (без предварительного осаждения) - 1,48 мг/мл.
Пример 2. Способ получения БПК.
Получение белково-полипептидного комплекса из эмбриональной нервной и кожной ткани свиней.
300 г эмбриональной нервной и кожной ткани поросят сроком гестации 16-18 недель размораживают и гомогенизируют в буферном растворе рН 5,2, содержащем 50 мМ Трис-малеата, 1 мМ (ЭДТА) и 0,1% маннита, в течение 5 минут при +2°С. Гомогенат отделяют от балластных веществ фильтрованием через плотную ткань с последующим центрифугированием при значении g 28000 в течение 30 мин. Супернатант фильтруют через мембранный фильтр с диаметром пор 0,45 мкм и наносят на уравновешенную 4 объемами малеатного буферного раствора рН 5,2 хроматографическую колонку объемом 250 мл с анионообменным носителем DEAE-Сефароза. Разделение связавшихся с носителем белков производят градиентом малеатного буферного раствора рН 5,2 содержащего 0,05М NaCl (I=0,1 ммоль/л), плавно повышая концентрацию соли до 0,1 М (I=0,15 ммоль/л), начиная сбор целевой фракции с концентрации соли 0,075 М (I=0,125 ммоль/л) до 0,1М (I=0,15 ммоль/л), целевую фракцию подвергают ультрафильтрации на установке при противодавлении не более 8,0 кгс/см2 через материалы с задерживающей способностью выше 200 кДа и подвергают стерилизующей фильтрации, через мембранный фильтр с диаметром пор не более 0,22 мкм.
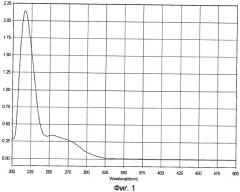
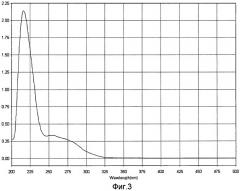
Для характеристики полученного белково-полипептидного комплекса используют методы ультрафиолетовой спектрофотометрии, гель-хроматографии, электрофореза в полиакриламидном геле и аминокислотного анализа. Ультрафиолетовый спектр раствора снимают в области длин волн от 200 до 500 нм - максимум поглощения отмечается при длине волны 215±5 нм (Фиг.3). Молекулярную массу белков и полипептидов, входящих в комплекс, определяют методом денатурирующего гель-электрофореза («SDS-Page») в 5%-ном полиакриламидном геле в сравнении со стандартным набором маркерных белков с диапазоном молекулярных масс от 10 кДа до 250 кДа (Фиг.4). В состав препарата входят белки с молекулярной массой от 5 кДа до 200 кДа, из которых 72% имеют молекулярную массу в диапазоне от 20 до 160 кДа. Количественное определение белка в полученном БПК методом Лоури (без предварительного осаждения) - 2,4 мг/мл.
Пример 3. Способ получения фармкомпозиции.
Берут полученный по примеру 1 раствор БПК и разводят 50 мМ глициново-фосфатным буферным раствором и добавляют вспомогательные вещества: детергенты, солюбилизаторы, консерванты и высокомолекулярные соединения до конечных концентраций БПК - 0,05 мг/мл, маннитол - 0,5%, полисорбат-80 - 0,0005%, двузамещенный фосфорнокислый натрий до рН 8,5 и нипагин - 0,03%. Полученную фармкомпозицию подвергают стерилизующей фильтрации через мембранный фильтр с диаметром пор не более 0,1 мкм, разливают в стерильные стеклянные флаконы и закупоривают.
Для характеристики полученной фармкомпозиции с БПК используют методы ультрафиолетовой спектрофотометрии, гель-хроматографии, электрофореза в полиакриламидном геле и аминокислотного анализа. Ультрафиолетовый спектр раствора снимают в области длин волн от 200 до 500 нм - максимум поглощения отмечается при длине волны 215±5 нм (Фиг.1). Молекулярную массу белков и полипептидов, входящих в комплекс, определяют методом денатурирующего гель-электрофореза («SDS-Page») в 5%-ном полиакриламидном геле в сравнении со стандартным набором маркерных белков с диапазоном молекулярных масс от 10 кДа до 250 кДа (Фиг.2). В состав препарата входят белки с молекулярной массой от 5 кДа до 200 кДа, из которых 72% имеют молекулярную массу в диапазоне от 20 до 160 кДа. Количественное определение белка в полученном БПК методом Лоури (без предварительного осаждения) - 1,55 мг/мл.
Пример 4. Способ получения фармкомпозиции.
Берут полученный по примеру 2 раствор БПК и разводят 50 мМ глициново-фосфатным буферным раствором и добавляют вспомогательные вещества: детергенты, солюбилизаторы, консерванты и высокомолекулярные соединения до конечных концентрации БПК - 2 мг/мл, манит - 0,5%, полисорбат-80 - 0,0005%, бензалкония хлорид - 0,005% и однозамещенный фосфорнокислый натрий до рН 5,2. Полученную фармкомпозицию подвергают стерилизующей фильтрации, через мембранный фильтр с диаметром пор не более 0,1 мкм, разливают в стерильные стеклянные флаконы и закупоривают.
Для характеристики полученной фармкомпозиции с БПК используют методы ультрафиолетовой спектрофотометрии, гель-хроматографии, электрофореза в полиакриламидном геле и аминокислотного анализа. Ультрафиолетовый спектр раствора снимают в области длин волн от 200 до 500 нм - максимум поглощения отмечается при длине волны 215±5 нм (Фиг.3). Молекулярную массу белков и полипептидов, входящих в комплекс, определяют методом денатурирующего гель-электрофореза («SDS-Page») в 5%-ном полиакриламидном геле в сравнении со стандартным набором маркерных белков с диапазоном молекулярных масс от 10 кДа до 250 кДа (Фиг.4). В состав препарата входят белки с молекулярной массой от 5 кДа до 200 кДа, из которых 72% имеют молекулярную массу в диапазоне от 20 до 160 кДа. Количественное определение белка в полученном БПК методом Лоури (без предварительного осаждения) - 2 мг/мл.
Пример 5. Исследование токсичности
Свойства полученной фармкомпозиции были изучены с помощью общепринятых методик по экспериментальному (доклиническому) изучению фармакологических веществ [11].
Проведены исследования токсичности в остром и субхроническом эксперименте оригинальной фармкомпозиции. Лекарственная форма: раствор для инъекций: 5 ампул по 1 мл (0,1 мг/мл), 5 ампул по 2 мл (0,1 мг/мл), 1 ампула по 2 мл (0,2 мг/мл). Максимальная рекомендуемая суточная доза 0,4 мг при эндолюмбальном введении и 0,1 мг при внутривенном введении.
Условия проведения эксперимента и методы исследований
Целью исследования явилось определение переносимых, токсических и летальных доз оригинальной фармкомпозиции. Исследование проводили на мышах обоего пола линии BALB/C массой 18-20 г при внутрибрюшинном, подкожном и внутрикожном способах введения. Срок наблюдения составил 14 дней. Животные получены из питомника, паспортизированы. Животных содержали в стандартных условиях, в пластмассовых клетках по 10 особей, количество в группе - 10. Для кормления использовали комбинированный корм, свежие овощи, творог. Доступ к воде и корму свободный. Освещение вивария искусственное. Температура воздуха (+18)-(+20)°С [14]. Максимально возможная для введения мышам доза готовой лекарственной формы 0,2 мл и составила 10 мг/кг, что превысило суточную терапевтическую дозу в 600 раз. Из эксперимента животных выводили эфирным наркозом, подвергали вскрытию и анализу состояния внутренних органов.
Результаты исследования острой токсичности.
Мыши. Масса животных составила от 18 до 20 г. Вводимая доза 0,2 мл, что составило 10 мг/кг. Количество животных в группе 10 голов. Всего две группы: внутрижелудочное и внутрибрюшинное введение. Срок наблюдения 14 суток.
Внешний вид. К концу эксперимента все животные выглядели здоровыми. Шерстяной покров густой, белого цвета. По внешнему виду животные между группами не отличались.
Поведение. Не отличалось между группами и от нормы.
Смертность. Во всех трех группах летальных исходов зафиксировано не было.
Масса животных. В течение всего срока наблюдения произведено шесть контрольных взвешиваний. Резкой потери или увеличения не выявлено.
Внутренние органы. По состоянию внутренних органов группы не отличались между собой. Изменения или увеличения внутренних органов не наблюдалось.
Исследование подострой (субхронической) токсичности
Условия проведения эксперимента и методы исследований
Исследования токсичности оригинальной фармкомпозиции в субхроническом эксперименте проводили на самцах и самках крыс линии Вистар массой от 200 до 250 г. Животные получены из питомника. Крыс содержали в стандартных условиях, в пластмассовых клетках по 5 особей. Для кормления использовали брикетированный корм, свежие овощи, творог. Доступ к воде и корму свободный. Освещение вивария искусственное. Температура воздуха (+18)-(+20)°С. До начала эксперимента животных выдерживали в карантине в течение 10 дней. В группе 10 животных (5 самцов и 5 самок). Группы разделены следующим образом:
1 группа (контроль) - интактные животные
2 группа - оригинальная фармкомпозиция т.д. внутрикожное введение (п/к)
3 группа - оригинальная фармкомпозиция ×10 п/к
4 группа - оригинальная фармкомпозиция внутрибрюшинное введение (в/в) т.д.;
5 группа - оригинальная фармкомпозиция в/в ×10.
Срок н