Тест-система ифа для серологической диагностики парвовирусной инфекции крупного рогатого скота и определения уровня поствакцинальных антител
Иллюстрации
Показать всеИзобретение относится к ветеринарной вирусологии и биотехнологии и касается тест-системы ИФА для серологической диагностики парвовирусной инфекции крупного рогатого скота и определения уровня поствакцинальных антител. Представленная тест-система содержит: специфический антиген парвовируса крупного рогатого скота типа I из штамма «Parvo 32459-ДЕП» в концентрации 3-5 мкг/см3, адсорбированный на поверхности лунок полистироловых планшет; парвовирусную (положительную и отрицательную) контрольные сыворотки в разведении 1:400-1:1600; конъюгат антивидовой; калий фосфорнокислый однозамещенный; калий фосфорнокислый двухзамещенный; натрий хлористый; хромоген (ортофенилендиамин); перекись водорода; стоп-реагент и панели для постановки реакции иммуноферментного анализа. Представленная тест-система позволяет выявлять наличие антител в пробах сывороток крови в одном разведении (1:400), а также определять количество антител к парвовирусу крупного рогатого скота первого типа у больных, переболевших и вакцинированных животных в четырех разведениях сыворотки крови (1:800, 1:1600, 1:3200 и 1:6400). 6 табл., 1 ил.
Реферат
Изобретение относится к ветеринарной вирусологии и биотехнологии, в частности созданию тест-системы ИФА для установления иммунного статуса поголовья скота в одном разведении и количественного определения антител в четырех разведениях сыворотки крови к парвовирусу крупного рогатого скота первого серотипа у больных, переболевших и вакцинированных животных.
В настоящее время учеными разных стран мира на основе результатов обширных исследований создано цельное представление о патогенных потенциях многочисленных вирусов, выделяемых от больных животных, и значимости их в этиопатогенезе респираторно-кишечных заболеваний новорожденных животных и патологии репродуктивных органов взрослого поголовья скота, связанных с ранней эмбриональной смертностью, абортами и мертворождением. В этом плане среди них наряду с герпесвирусом типа I (ИРТ), вирусом вирусной диареи - болезни слизистых, респираторно-синцитиальным вирусом, аденовирусами I-ой и II-ой подгруппы и реовирусами привлекает внимание исследователей малоизученные в РФ парвовирусы крупного рогатого скота, способные селективно реплицироваться в делящихся клетках, таких как клетки кишечника и эмбриональные клетки.
Этиологическим агентом парвовирусной инфекции крупного рогатого скота является мелкий, ДНК-содержащий вирус, относящийся к роду Bocavirus семейства Parvoviridae, вызывающий заболевание с разнообразными клиническими проявлениями, нанося существенный экономический ущерб животноводству многих стран.
Впервые о выделении парвовируса сообщили в 1959 году F.R.Abinanti и M.S.Warfield, которые изолировали его из фекалий больных телят с симптомокомплексом диареи и назвали его благодаря своим гемадсорбирующим свойствам, как HADEN-virus (HemADsorbingENterovirus). С тех пор этот штамм вируса считается референтным для парвовирусов крупного рогатого скота первого серотипа.
Парвовирусы, выделенные от крупного рогатого скота в США, Европе и Северной Америке, в антигенном отношении не различались между собой, оказались серологически родственными с прототипным штаммом «Haden» и были отнесены к парвовирусу крупного рогатого скота типа I.
Штамм С-134, выделенный в Японии, серологически отличался от Haden-вируса и его отнесли ко 2-му типу парвовируса крупного рогатого скота (Inaba et al., 1973).
В нашей стране парвовирус крупного рогатого скота (штамм В-2) впервые был выделен в 1972 году из носовой слизи больного теленка с респираторным синдромом, который отличался от референтного штамма «HADEN» по антигенной структуре и ряду биологических свойств. В частности, данный вирус не обладал гемагглютинирующей активностью в нативном состоянии. Поэтому он был отнесен к третьему типу парвовируса крупного рогатого скота (Зудилина З.Ф., Михайлов П.Н., Жидков С.А., 1976; Крюков Н.Н., Третьякова И.А., Зудилина З.Ф. и др., 1988, Орлянкин Б.Г с соавт., 1985, Storz I. et al., 1973).
Парвовирусная инфекция проявляется у молодняка крупного рогатого скота в основном в виде поражения органов пищеварения: диарея развивается через 24-48 часов после инфицирования (Spahn, G.J., et al., Characteristics of hemadsorbing enteric (HADEN) virus / Canad. J. Microbiol. - 1966. - V.12. - P.653-660.; Durham P.J.K. et al., Epidemiological studies of parvovirus infection in calves on endeinically infected properties / J. Res. Vet. Sci. - 1985. - V.38. - №2. - P.234-240; Sandals, W.C.D. Prevalence and seroepidemiology of bovine parvovirus / MSc Thesis, University of Guelph, 1989. - P.432-437).
В связи с тем что парвовирусы размножаются в активно делящихся клетках, пищеварительный тракт играет главную роль в репродукции вируса благодаря постоянному обновлению клеток слизистой. В литературе имеются данные, указывающие, что у телят парвовирусная инфекция может сопровождаться вначале респираторным синдромом, а затем расстройством пищеварительного тракта (Юров К.П., с соавт, 1994).
Известно также, что парвовирусы способны проникать через плацентарный барьер и могут обусловливать серьезные проблемы в патологии воспроизводительной функции у коров, при которой наблюдаются аборты и эмбриональная смертность (Юров К.П. с соавт. 1994; Bachman Р.А., 1971; Storz J. et. al., 1978; Bodine et. al., 1981; Athayde de Costa, Dreonde Albuquerque, 1986).
Эти вирусы устойчивы во внешней среде, в помещении могут сохраняться в течение 4-6 месяцев. Ведущий механизм передачи парвовирусной инфекции - фекально-оральный и аэрогенный. Однако нельзя исключить и возможный трансплацентарный путь передачи инфекции.
По данным зарубежных исследователей, лабораторная диагностика парвовирусной инфекции крупного рогатого скота осуществляется путем выделения вируса в культуре клеток, обнаружения вирусного антигена непосредственно в пробах патологического материала (кишечник, кал, абортированный плод) методом иммунофлуоресценции в срезах или отпечатках слизистой оболочки кишечника. Полученные результаты должны быть подтверждены обнаружением прироста вируснейтрализующих антител или антигемагглютининов в период реконвалесценции по сравнению с сыворотками крови, взятыми в острой стадии болезни (Tijssen Р., 1990; David Sandals W.C. et. al., 1994 и др.).
Однако до настоящего времени в РФ, как нам представляется, недостаточно были раскрыты особенности клинического проявления и распространения парвовирусной инфекции крупного рогатого скота, многие годы недооценивалась этиологическая роль парвовируса при респираторно-кишечных заболеваниях молодняка и нарушениях функций репродуктивных органов взрослого поголовья скота. Такие вопросы, как эпизоотология болезни, особенности постинфекционного иммунитета, задачи, связанные с разработкой методов и средств лабораторной диагностики и специфической профилактики, оставались без должного внимания.
С учетом этого положения с целью выявления степени распространения парвовирусной инфекции среди поголовья крупного рогатого скота в регионе Среднего Поволжья нами в 2006-2009 годах был осуществлен серомониторинг в отношении данной инфекции путем исследования в реакции торможения гемагглютинации (РТГА) 1117 проб сывороток крови животных, полученных из 35 хозяйств Республик Татарстан, Башкортостан, Чувашской Республики и Нижегородской области. Работа была выполнена согласно «Инструкции по применению набора препаратов для серодиагностики парвовирусной инфекции крупного рогатого скота в реакции торможения гемагглютинации (РТГА)», утвержденной руководством ФГУ «ФЦТРБ-ВНИВИ». При этом в качестве антигена был использован штамм парвовируса «Parvo 32459», относящийся к первому серотипу. Результаты исследований отражены в таблице 1.
| Таблица 1 | ||||
| Результаты серологических исследований крупного рогатого скота в ряде регионов Среднего Поволжья | ||||
| Регион | Кол-во хозяйств | Кол-во проб | Из них серопозитивных | |
| РТГА | ||||
| Кол-во | % | |||
| Республика Татарстан | 24 | 901 | 229 | 25,4 |
| Чувашская республика | 2 | 87 | 21 | 24 |
| Республика Башкортостан | 4 | 80 | 8 | 10 |
| Нижегородская область | 5 | 49 | 16 | 32,6 |
| Итого | 35 | 1117 | 403 | 36,1 |
Из данных таблицы 1 следует, что из 1117 проб сывороток крови крупного рогатого скота специфические антитела к парвовирусу крупного рогатого скота выявляются в РТГА у 403 (36,1%) животных. Причем титры антител достигали значительных величин: 1:160-1:1280. Следовательно, установлена серопозитивность значительного количества животных к антигену парвовируса крупного рогатого скота. Полученные результаты указывают на факты циркуляции этого возбудителя среди обследованного поголовья скота.
Учитывая полиэтиологичность повсеместно регистрируемых респираторно-кишечных вирусных инфекций телят и вызываемых ими патологий органов воспроизводства взрослого поголовья скота, заявителями о выдаче данного патента РФ создана «Ассоциированная инактивированная эмульсионная вакцина против парвовирусной, реовирусной, герпесвирусной типа I инфекций и вирусной диареи - болезни слизистых крупного рогатого скота», обладающая высокой антигенной и иммуногенной активностью.
В настоящее время ветеринарная служба РФ не располагает современными методами и средствами лабораторной диагностики, в том числе и наборами для серологического мониторинга таких малоизученных в РФ инфекционных болезней, как парвовирусная и реовирусная инфекции крупного рогатого скота, способные обуславливать различные формы патологии у этого вида животных и протекающие чаще всего в виде смешанных инфекций.
В настоящее время метод ИФА является основным тестом определения антител при диагностике многих вирусных инфекций, причем не только для установления иммунного статуса, но и количественной оценки содержащихся в сыворотке крови животных специфических антител.
Отечественными исследователями (Юров К.П., Щербакова Г.Б. 1993; Юров К.П. с соавт. 1994, Юров К.П., Третьякова И.А., Вечеркина А.С. - Парвовирусная инфекция крупного рогатого скота. / Ветеринария, 1994, №5, с.26-27) проводились научно-исследовательские работы по созданию иммуноферментных тест-систем, предназначенных для индикации антигена и выявления антител к парвовирусу крупного рогатого скота 3-го серотипа. Однако на сегодняшний день ни одна иммуноферментная тест-система не обрела завершенную форму и не была внедрена в ветеринарную практику.
Известна также тест-система ИФА (автореферат на соискание учен. степени к.в.н. Щербаковой Т.Б. «Иммуноферментная диагностика парвовирусной инфекции крупного рогатого скота» // Москва, 1993. - с.21»). Однако в указанной научной работе, наиболее близкой к предлагаемой, представлена лишь принципиальная возможность определения антигена парвовируса крупного рогатого скота 3-го типа (штамм В-2) в выделениях экспериментально зараженных телят, используя «сэндвич»-метод ИФА. В указанном автореферате антиген для ИФА изготовлен из штамма вируса «В-2», отнесенного к третьему серотипу. Серологическую идентификацию изолята авторы проводили с использованием моноспецифических сывороток овец, полученных к штаммам Haden и В-2 в реакциях ВН и РТГА. Как показали результаты перекрестных реакций, что эти штаммы в использованных тестах не имеют антигенного родства (Крюков Н.Н., Зудилина и др., 1988).
Следовательно, можно допустить, что получаемый антиген из штамма В-2 обладает более низкой специфичностью и активностью по отношению к парвовирусной инфекции, вызываемой преимущественно вирусом I-серотипа, о чем свидетельствует высокая серопозитивность поголовья скота в регионе Среднего Поволжья, в котором в течение последних 5-6 лет завезено более 30 тыс. голов племенного высокопродуктивного скота из стран Западной Европы, Северной Америки и Австралии.
Кроме того, изоляты парвовируса крупного рогатого скота, регистрированные в большинстве стран, кроме тех, которые были выделены в бывшем СССР и Японии, серологически идентичны с прототипным штаммом «Haden» и относятся к парвовирусу первого типа (Юров К.П. с соавт., 1994. - Парвовирусная инфекция крупного рогатого скота / Ветеринария, №5, 1994, стр.26-27).
Одним из характерных свойств парвовируса крупного рогатого скота является способность агглютинировать эритроциты. Различие гемагглютинирующей активности штаммов парвовируса может служить генетическим признаком и учитываться при их идентификации. Например, HADEN-вирус, по данным Abinanti, Warned, агглютинирует эритроциты морских свинок и человека. Штамм Andrewes №32459, выделенный из фекалий павшего 3-месячного теленка с признаками энтерита, был идентичен HADEN-вирусу в реакции нейтрализации и в РТГА (Крюков Н.Н. с соавт., 1988).
Во всех зарубежных странах ретроспективная диагностика парвовирусной инфекции крупного рогатого скота осуществляют в РТГА, предпочтительно используя антиген референтного штамма парвовируса типа I
Большинство выделенных штаммов серологически родственны со штаммом HADEN. Они относятся к парвовирусу крупного рогатого скота 1-го типа (Athayde de Costa, Dreon de Albuquerque - Rev. Cent. cienc. rurais, 1986, 3; Bates R.C., Storz J., Reed - J. infect. Dis., 1972, 126; Dirham Johnson - Veter. Microbiol., 1985, 10; Huck, Woods, Orr - Vet. Rec., 1975, 96; Inaba et al. - Jap. J. Microbiol., 1973, 17; Inaba et al - Arch. ges. Virusforsch., 1973, 42; Inaba et al. - Jap. J. Vet. Sci., 1971, 33; Spahn, Mohanty, Hetrick - Cnad. J. Microbiol., 1966, 12).
Поэтому в настоящее время стоит задача создания иммуноферментной тест-системы, предназначенной для серологической диагностики парвовирусной инфекции крупного рогатого скота на основе антигена парвовируса типа I, ее апробация в лабораторных и производственных условиях в сравнении с методами аналогичной направленности.
Поставленная цель достигается тем, что она содержит специфический антиген парвовируса крупного рогатого скота типа I из штамма «Parvo 32459-ДЕП», представляющий собой полипептидный комплекс в концентрации 3-5 мкг/мл адсорбированного на поверхности полистироловых лунок, парвовирусную (положительную) и нормальную (отрицательную) контрольную сыворотки в разведении 1:400-1:1600 в инкубационном буфере, конъюгат антивидовой, калий фосфорнокислый однозамещенный, калий фосфорнокислый двухзамещенный, натрий хлористый, хромоген (ортофенилендиамин), перекись водорода, стоп-реагент и панели для постановки реакции иммуноферментного анализа. Кроме того, выявление антител производят в одном разведении, а определение уровня антител - в четырех разведениях, при этом критерием дифференциации положительных и отрицательных результатов является позитивно-негативный порог, который находится в диапазоне <15-≥25%.
В состав предлагаемой тест-системы ИФА входят:
1. Планшеты для иммуноферментного анализа с адсорбированным антигеном парвовируса типа I крупного рогатого скота - 5 шт.
2. Контрольная положительная сыворотка, (K+), 0,5 см3 - 2 амп. №1.
3. Контрольная отрицательная сыворотка, (K-), 1 см3 - 2 фл. №2.
4. 10-кратный концентрат фосфатно-буферного раствора с Твином-20 для промывки планшетов (ФБР-Т), 100 см3 - 2 фл. №3.
5. Буфер для разведения конъюгата (БРК), 10 см3 - 1 фл. №4.
6. Антитела диагностические против иммуноглобулинов G (IgG) крупного - рогатого скота, меченные пероксидазой хрена (конъюгат), 0,2 см3 - 1 амп. №5.
7. Фосфатно-цитратный буфер (ФЦБ), 10 см3 - 5 фл. №6.
8. Хромоген, ортофенилендиамин (ОФД), 4 мг - 5 фл. №7.
9. Перекись водорода (H2O2) 3% p-p, 10 см3 - 1 фл. №8.
10. 0,1 М Серная кислота (Стоп-реагент), 50 см3 - 1 фл. №9.
Технический результат от использования предлагаемого изобретения заключается в расширении арсенала современных методов и средств, используемых для диагностики вирусных инфекций и повышении специфичности заявляемой тест-системы ИФА, предназначенной для выявления постинфекционных и поствакцинальных антител животных вследствие применения в качестве сорбирующего специфического вирусного антигена, полученного из штамма «Parvo 32459-ДЕП» парвовируса первого типа.
1. Штамм «Parvo 32459-ДЕЛ» парвовируса крупного рогатого скота был получен в 1979 году профессором Гаффаровым Х.З. из ЦВЛ МСХ Великобритании и принят заявителем в качестве производственного, является идентичным в РВИ и РТГА с референтным штаммом «Haden» типа I (Крюков Н.Н. с соавт., 1988), выделенным в 1959 году в США от павшего теленка с признаками энтерита (Abinanti F.R., Warfield M.S., 1961), обладает высокой биологической, антигенной и иммуногенной активностью, сохраняет свои нативные иммунобиологические свойства после инактивации, в нативном виде и после инактивации, отличается высокой продуктивностью в чувствительных биологических системах культивирования, признан пригодным для изготовления высокочувствительных и специфичных диагностикумов.
Парвовирус крупного рогатого скота - ДНК-содержащий вирус. Вирионы представляют собой безоболочечные частицы кубической симметрии диаметром 20-23 нм. Штамм «Parvo 32459-ДЕП» парвовируса типа I крупного рогатого скота устойчив к изменению pH от 3 до 8, эфиру, хлороформу и 1%-ному трипсину, а прогревание при 70°C в течение 2-х часов снижает инфекционную активность в 100 раз, термостабилен при 37 и 56°C, агглютинирует эритроциты морской свинки и человека 0-группы. В естественных условиях к вирусу восприимчив крупный рогатый скота. Парвовирус патогенен для телят, он проникает в ткани различных отделов кишечника и прилегающих лимфатических узлов, а также способен преодолевать плацентарный барьер, вызывая гибель эмбриона, обусловливая аборты у коров, и длительно персистировать в организме коровы.
Эффективной системой репродукции штамма «Parvo 32459-ДЕП» парвовируса типа I является первично-трипсинизированная культура клеток почек эмбриона коровы (ПЭК). Парвовирус активен в реакциях гемагглютинации (РГА), реакции торможения гемагглютинации (РТГА), в реакции нейтрализации (РН), иммуноферментном анализе (ИФА). Титр вируса в РГА с 1%-ными эритроцитами морской свинки - 1:512-1:1024, в РН 104,5-10-5,5 ТЦД50/мл.
Штамм «Parvo 32459-ДЕП» парвовируса типа I крупного рогатого скота депонирован в лаборатории музей штаммов микроорганизмов Особо опасных болезней (ООБ) ФГУ «ФЦТРБ-ВНИВИ» 9 декабря 2009 года, регистрационный номер 2. Местом хранения штамма определена «Лаборатория музей штаммов микроорганизмов ООБ ФГУ «ФЦТРБ-ВНИВИ»», 420075, г.Казань, Научный городок-2.
При изготовлении тест-системы ИФА, предназначенной для серологической диагностики парвовирусной инфекции крупного рогатого скота и количественного определения антител, в сыворотках крови инфицированных, переболевших и вакцинированных животных используют штамм «Parvo 32459-ДЕП» типа I парвовируса крупного рогатого скота, репродуцируют его в первично-трипсинизированной культуре клеток почек эмбриона коровы (ПЭК) до накопления вируса в титре 1:1024 ГАЕ, клеточную массу осаждают центрифугированием, разрушают ультразвуком с последующим центрифугированием для освобождения от клеточного дебриса, инактивируют 0,1%-ным раствором 1,2-аминоэтилазиридина. Последующую очистку антигена проводят ультрацентрифугированием через 20%-ную сахарозу. Для проведения непрямого твердофазного ИФА на поверхности лунок полистироловых планшет иммобилизируются очищенный антиген парвовируса крупного рогатого скота первого серотипа «Parvo 32459-ДЕП» и в лунки вносят разведенные образцы исследуемых сывороток крови и контрольные положительные и отрицательные сыворотки, инкубируют 2 ч при 37°C, после чего добавляют пероксидазный антивидовой конъюгат в разведении 1:5000, который также инкубируют при 37°C в течение 1 часа. На последнем этапе реакции вносят субстратный раствор, содержащий ортофенилдиамин (ОФД) и 3% перекись водорода. Читку реакции производят через 5-15 минут на спектрофотометре «Bio-Rad Model 680» при длине волны 490 нм.
Диагностические параметры и показатели качества разработанной тест-системы ИФА для серологической диагностики парвовирусной инфекции крупного рогатого скота соответствуют требованиям стандартов МЭБ (Руководство по диагностике и производству вакцин, издание МЭБ, 2004, с.21-29).
В процессе создания диагностической тест-системы оптимизированы условия проведения ИФА в одном разведении (1:400) для установления иммунного статуса поголовья скота и количественного определения антител в четырех разведениях (1:800, 1:1600, 1:3200, 1:6400) сывороток крови к парвовирусу крупного рогатого скота первого серотипа инфицированных, переболевших и вакцинированных животных.
При исследовании сывороток крови в одном разведении определен критерий дифференциации положительных и отрицательных результатов ИФА путем вычисления коэффициента связывания (Ксв.): если величина Ксв. менее 15%, пробу считают отрицательной, если величина Ксв. более 25%, пробу считают положительной.
С целью получения достоверных результатов установлены допустимые величины оптической плотности контрольных сывороток: в диапазоне от 0,5 до 0,709 для положительного контроля и от 0,05 до 0,08 для отрицательного контроля.
Основными показателями качества иммуноферментной тест-системы является чувствительность и специфичность. Эти параметры определены на основании корреляции результатов исследований сывороток крови в РТГА и РВН. Диагностическая чувствительность тест-системы по отношению к РВН составляет 96,07%, диагностическая специфичность - 93,82%, совпадаемость результатов - 95,1%.
При исследовании сывороток крови в ИФА и РТГА, полученных от заведомо негативных и позитивных животных, совпадаемость результатов составляет 100%.
Один комплект тест-системы рассчитан для проведения на одном планшете одновременного анализа 46 исследуемых проб сывороток крови в одном разведении (в двух повторах) и 2 контрольных сывороток (в двух повторах) или 20 исследуемых проб сывороток крови (в четырех разведениях) и 2 контрольных сывороток (в четырех разведениях). Одна тест-система рассчитана на исследование 230 проб сывороток крови в одном разведении и 100 проб в четырех разведениях.
Набор хранят при температуре от 2 до 8°C и относительной влажности не более 80%. Замораживание реагентов набора не допускается.
Срок годности набора - 12 месяцев с даты изготовления.
В заявляемой тест-системе ИФА, предназначенной для выявления и количественного определения антител к парвовирусу крупного рогатого скота, специфический антиген готовят, используя штамм «Parvo 32459-ДЕП» парвовируса крупного рогатого скота, адаптированный к первично-трипсинизированной культуре клеток почек эмбриона коровы (ПЭК).
Для заражения парвовирусом отбирают матрасы с полным монослоем клеток ПЭК, удаляют ростовую среду, вносят в каждый матрас по 5 см3 вирусного материала. Инкубируют в термостате при 37°C в течение часа. После этого, не удаляя вирусный материал, вносят поддерживающую среду в объеме 150-200 см и культуру помещают в термостат при 37°C. Характерность цитопатогенного действия парвовируса на культуру клеток ПЭК (зернистость, округление и разрушение клеток) контролируют путем микроскопии матров в течение 72-96 часов после заражения, трижды замораживают при минус 20°C, затем с каждого матраса отбирают пробы по 5 см3 для посева на стерильность и определения титра в РГА.
Концентрирование проводят путем осаждения клеточной массы центрифугированием (3000 об/мин в течение 15 мин). Инфицированные клетки разрушают на ультразвуковом дезинтеграторе «Bandelin GM 3100» при частоте 20 kHz±500 Гц импульсивно 6 раз по 30 сек с последующим центрифугированием (5000 об/мин в течение 30 мин) для освобождения от балластных белков. Инактивируют вирус 0,1%-ным раствором 1,2-аминоэтилазиридина. Последующую очистку антигена, выделенного из содержащих вирус клеток, проводят ультрацентрифугированием при 30000g на «подушке» 20%-ной сахарозы. Осадок ресуспендируют в карбонатно-бикарбонатном буфере (pH 9,6-9,8) и используют в качестве антигена парвовируса для сенсибилизации лунок полистироловых планшет. Оценку степени очистки и концентрирования антигена устанавливают по гемагглютинирующей активности, определяемой в РГА, и по показателям оптической плотности белка вирусного антигена (табл.2) на спектрофотометре СФ-46 ЛОМО при длинах волн 235 и 280 нм с поправкой на разведение в кювете по следующей формуле:
По формуле:
где - ОП235; ОП280 - оптическая плотность при длине волны 235 и 280 нм соответственно;
- 30 - разведение исследуемого образца в кювете (1:30).
| Таблица 2 | |||
| Активность парвовируса крупного рогатого скота, концентрированного ультрацентрифугированием на «подушке» 20%-ной сахарозы (n=3; P<0,05) | |||
| № п/п | Исследуемый материал | Активность в РГА, 1/n | Концентрация белка, мг/мл |
| 1 | Исходное вирусное сырье | 2048 | 1,2±0,03 |
| 2 | После обработки ультразвуком | 8192 | 1,1±0,02 |
| 3 | После инактивации | 2048 | 1,0±0,02 |
| 4 | После концентрирования | 16384 | 0,9±0,03 |
По результатам шахматного титрования антигена и контрольных сывороток устанавливают в ИФА оптимальную рабочую концентрацию парвовирусного антигена, которая в данном случае равняется 3-5 мкг/мл.
2. Изготовление контрольной положительной типоспецифической сыворотки против штамма «Parvo 32459-ДЕП» парвовируса типа I осуществляют путем гипериммунизации клинического здорового молодняка крупного рогатого скота 6-8-месячного возраста, концентрированной, очищенной и инактивироваиной вирусной суспензией с гемагглютинирующей активностью не ниже 1:1280-1:2560.
До начала иммунизации животных из яремной вены берут кровь и сыворотку, проверяют на наличие антигемагглютининов к парвовирусу крупного рогатого скота. В случаях отсутствия в них специфических антител животные считаются пригодными для гипериммунизации.
Для получения иммунных сывороток используют вирусный антиген, депонированный в неполном адъюванте Фрейнда, который готовят путем тщательного смешивания 15 см3 вазелинового масла и 5 мл обезвоженного ланолина. Полученную смесь подвергают дробной стерилизации в водяной бане 3 дня подряд по 60 минут. Смесь антигена с адъювантом (в равном объеме) подогревают в водяной бане до 37°C, тщательно перемешивают и вводят подкожно в дозе по 2 см3. В последующем гипериммунизацию животным проводят путем трехкратного внутривенного введения культуральной вирусной суспензии, очищенной от клеток, в возрастающих дозах 10 см3, 20 см3 и 30 см3 соответственно с интервалом между введениями 14-16 суток.
С целью предупреждения анафилактической реакции, начиная со второго цикла иммунизации, животному вводят по 2 см3 вируса подкожно за 40 минут до введения основной дозы вируса.
Через 14-16 дней после последнего введения вируса у животных из яремной вены берут пробы крови, получают сыворотку и ставят реакцию торможения гемагглютинации.
Производственное крововзятие допускается при наличии антител в сыворотке крови продуцента к парвовирусу крупного рогатого скота не ниже 1:1280 в РТГА или 1:256 в РН. Первое крововзятие от продуцентов по объему не должно превышать 0,6 литра крови на 100 кг массы животного, а в последующем - 1,6 литра на 100 кг массы.
Кровь из яремной вены в стерильные цилиндры, смоченные физиологическим раствором, ставят в термальную комнату на 30-40 минут при температуре +37-38°C, после чего сыворотки обводят и цилиндры оставляют на 18 часов при температуре +4-6°C для отстаивания сыворотки. Затем сыворотку отбирают, добавляют мертиолят в соотношении 1:10000, определяют титр антител в РТГА, РВН и ИФА с гомологичным антигеном.
Сыворотка с антигемагглютинирующим титром не ниже 1:1280 расфасовывают в ампулы по 0,5 мл и лиофилизируют.
Контрольные (отрицательные) сыворотки получают из крови клинически здоровых неиммунизированных животных, не содержащих при исследовании в РТГА и ИФА специфических антител к парвовирусу крупного рогатого скота первого серотипа, разливают в ампулы по 0,5 мл и лиофилизируют.
3. Приготовление буферов
Адсорбционный 0,01 М карбонатно-бикарбонатный буферный раствор (КББ pH 9,6) предназначен для растворения и сорбции антигена в лунке планшетов: 10,6 г Na2CO3 растворяют в 500 см3 дист. воды, 8,4 г NaHCO3 растворяют в 500 см3 дист. воды, полученные растворы смешивают 16 см3 0,2 М Na2CO3 и 34 см3 0,2 М NaHCO3 и получают 0,2 М КББ маточный раствор. Из маточного раствора берут 5 см3 и добавляют еще 95 см3 дист. воды. Этот раствор используют в реакцию (0,01 М КББ pH 9.6).
Фосфатно-буферный раствор с твином предназначен для разведения контрольных, исследуемых сывороток и антивидового конъюгата, а также для промывки панелей (ФБР/т pH 7,2-7,4): смешивают 10 г Na2HPO4×12 H2O и 1 г KH2PO4 в 1 литре дист. воды. Затем к 900 см3 0,85%-ного раствора NaCl добавляют 180 см3 основного р-ра ФБР, растворяют 0,5 г твина-20.
Фосфатно-цитратный буферный раствор pH 4.9 (ФЦБ): к 12,15 см3 0,01 М раствора лим. кислоты добавляют 12,85 см3 0,2 М раствора Na2HPO4×12 H2O и 25 см3 дист. воды.
Раствор субстрата готовят не ранее чем за 10 мин до внесения в лунки планшета. Для этого 4 мг ОФД растворяют в 10 см3 ФЦБ и вносят 0,14 см3 3% H2O2. Раствор должен быть прозрачным.
Раствор, останавливающий ферментативную реакцию - 0,1 М H2SO4. Для этого 9,8 мл концентрированной H2SO4 разводят до 1 л дистиллированной водой.
4. Стандартизация основных условий проведения исследований разработанной тест-системой ИФА.
Влияние концентрации антигена парвовируса крупного рогатого скота на результаты ИФА исследуют при содержании его 30, 15, 5, 3, мкг/мл. Результаты исследований показали, что максимальное значение коэффициента специфичности отмечается при адсорбции антигена парвовируса КРС в концентрации 3-5 мкг/мл. Использование других его концентраций приводит к снижению специфичности реакции.
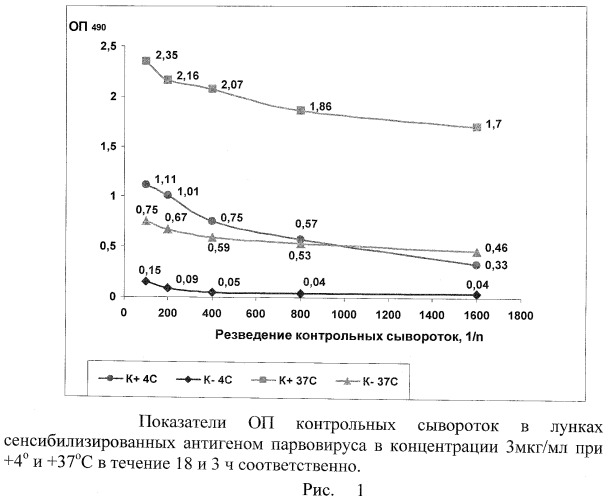
Влияние температурного и временного факторов на сенсибилизацию антигена в лунки иммунологических планшет определяют при +4 и +37°C при продолжительности контакта антигена с твердой фазой 18 и 3 ч соответственно. Результаты исследований показаны на чертеже.
При разработке иммуноферментных наборов, в которых для исследования используется одно разведение исследуемой сыворотки, важным является подбор условий сорбции иммунной сыворотки на сенсибилизированном антигеном планшете. Для этого в иммобилизированные антигеном лунки планшета вносят контрольные сыворотки в разведениях от 1:100 до 1:12800. Конъюгат используют в рабочем разведении 1:5000, которое было определено в предварительных экспериментах методом «шахматного» титрования. Результаты представлены в таблице 3.
| Таблица 3 | ||
| Подбор условий сорбции контрольных сывороток на иммобилизированный антигеном парвовируса планшет (n=3; P<0,05) | ||
| Продолжительность взаимодействия антиген-антитело, ч. | Титры антител 1/n | Ксп |
| 0,5 | 1600 | 2,71±0,03 |
| 1 | 6400 | 2,80±0,02 |
| 2 | 12800 | 3,53±0,07 |
| 3 | 3200 | 2,60±0,02 |
Оптимальной концентрацией антигена и рабочими разведениями компонентов иммуноферментной тест-системы считают их конечные значения, обеспечивающие в лунках с положительной контрольной сывороткой ОП490>0,650, а в лунках с отрицательным - ≤0,150. Из чертежа и таблицы 3 видно, что данным условиям отвечают следующие параметры реакции: концентрация антигена - 3-5 мкг/мл, разведения контролей - 1:400 и рабочее разведение конъюгата 1:5000. Оптимальным временем для адсорбции антигена была 18-часовая его инкубация при +4±1°C, для сывороток это время составляет 2 ч при +37±1°C.
Определение позитивно-негативного порога тест-системы ИФА и интерпретация результатов.
Для учета и интерпретации результатов, полученных тест-системой ИФА, необходимо определить позитивно-негативный порог тест-системы. С этой целью определяют закономерности распределения значений ОП490 и коэффициента связывания (Ксв.) вирусотрицательных и положительных сывороток, т.е. порогового значения («cut off» или позитивно-негативный порог - ПНП), разграничивающего положительную и отрицательную реакции.
В первом эксперименте было использовано 56 сывороток крови коров, не содержащих вируснейтрализующих антител к антигену парвовируса и 48 сывороток крови животных, иммунизированных ассоциированной вакциной против парво-, реовирусной, герпесвирусной типа I инфекций и вирусной диареи - болезни слизистых оболочек крупного рогатого скота инактивированной, эмульсионной, с различным уровнем специфических антител в РВН. Отрицательные и положительные сыворотки исследовали в четырех разведениях 1:100, 1:200, 1:400; 1:800 каждая сыворотка крови, взятая в определенном разведении, проверялась в трех параллельных лунках.
Перед учетом реакции по формуле, приведенной ниже, высчитывали среднее значение ОП490 для каждой испытуемой пробы. Относительное содержание вирусспецифических антител в положительных пробах определяли по: а) титру антител, т.е. по конечному разведению испытуемой пробы, превышающему ОП490 отрицательного контроля в 2,1 раза и б) коэффициенту связывания (Ксв.), отражающему содержание антител в испытуемой пробе по отношению к содержанию антител в положительном контроле. Математически это выражается следующей формулой:
где - ОП490ИПср, ОП490К- и ОП490К+ - средние арифметические значения оптической плотности в лунках с испытуемой пробой, отрицательным и положительным контролями соответственно.
Проведенные исследования показали, что для получения достоверных результатов в разработанной тест-системе испытуемые пробы сывороток крови КРС необходимо исследовать в разведении аналогичном контролям, т.е. 1:400.
Результаты проведенных экспериментов свидетельствуют о том, что при значении ОП490 положительного и отрицательного контролей 0,58-0,869 и 0,05-0,068 соответственно величина ОП490 всех заведомо отрицательных проб была в пределах 0,04-0,071, при этом значения Ксв. составляли от -2 до 15. В заведомо положительных сыворотках крови значение ОП490 превышало 0,53, а значения Ксв. были от 25 до 66.
При изучении зависимости значения Ксв. от титра вирусспецифических антител в положительных пробах была установлена положительная корреляция между двумя показателями (г=0,69, P<0,05).
Далее были проведены расширенные исследования по определению закономерности распределения значений Ксв. отрицательных (n=105) и положительных (n=123) по данным РВН сывороток. Постановку ИФА и учет полученных результатов проводили аналогично предыдущему эксперименту.
Анализ результатов проведенных экспериментов показал следующее: в большинстве случаев (93,3%) значение Ксв. отрицательных проб не превышало 15. Из них Ксв.<0 был в 52,4% сывороток, в 44,8% случаев данный показатель был в пределах от 0 до 15. Только в 3 пробах (2,8%) значение Ксв. находилось в пределах 15-32. В большинстве вирусспецифических сыворотках крови (95,1%) величина Ксв. составляла более 25. При этом в 73,2% проб Ксв. был более 60, в 13,0% случаев он колебался от 40 до 60 и в 8,1% - был в пределах 25-40. В 7 пробах (5,7%) значение Ксв. было ниже 25%.
Таким образом, анализируемые сыворотки, имеющие Ксв. менее 15, не содержат вирусспецифических антител. В вирусспецифических сыворотках в большинстве случаев (98%) значение ОП490 превышало аналогичный показатель отрицательного контроля в 2,1 раза, а Ксв. был более 25. Исходя из этого величина ПНП или «cut off» для Ксв., являющаяся критерием дифференциации положительных и отрицательных проб и при котором минимально количество ложноположительных и ложноотрицательных результатов, находится в диапазоне <15-≥25%. В дальнейшем все пробы, значение Ксв. для которых было меньше ПНП, считали отрицательными, а пробы со значением Ксв. равным или превышающим этот показатель - положительными.
В идеале диагностические тест-системы должны быть одновременно и чувствительным, и специфичным. На практике решение этих задач является достаточно сложным.
Для подтверждения достоверности диагностически значимых показателей нами проведен ряд статистических исследований по определению рабочего разведения сыворотки, которое обеспечивало бы максимальную чувствительность и специфичность разработанной тест-системы. Результаты исследований показаны в таблице 4.
| Таблица 4 | ||
| Рабочее разведение исследуемых сывороток, обеспечивающее максимальную чувствительность и специфичность тест-системы ИФА | ||
| Разведение сыворотки 1/n | Чувствительность, % | Специфичность, % |
| 100 | 97,4 | 83,2 |
| 200 | 97,8 | 86,0 |
| 400 | 96,07 | 93,8 |
| 800 | 87,3 | 94,2 |
| 1600 | 79,2 | 100 |
| 3200 | 75,3 | 100 |
Из таблицы 4 следует, что максимальные значения чувствительности (96,07%) и специфичности (93,8%) теста достигаются при условии использования в реакции сывороток в разведении 1:400, это определило дальнейшее использование сывороток в этом разведении.
Испытания диагностических характеристик тест-системы ИФА: специфичности, чувствительности и воспроизводимости.
Основными показателями качества иммуноферментной тест-системы является чувствительность и специфичность. Для получения достоверных результатов при тестировании сывороток по одному разведению определяли допустимые величины оптической плотности контрольных сывороток. Путем исследований 17 повторностей проб положительной и отрицательной контрольных сывороток в разведении 1:400 нами установлены оптимальные значения оптической плотности контрольных сывороток: в диапазоне от 0,5 до 0,709 для по