Иммунологически активные составы
Иллюстрации
Показать всеИзобретение описывает систему микрочастиц-носителей, содержащих один или более белков, пептидов, нуклеиновых кислот, углеводов, липидов или других биологически активных веществ с присоединенными нацеливающими молекулами или без них. В изобретении раскрыты иммуномодулирующие составы для индукции иммуномодулирующего эффекта - защитного иммунитета и толерантности. Иммунологически активный состав содержит ассоциированную с патогеном молекулярную структуру и носитель в виде микрочастиц агарозы. Молекулярная структура представляет по меньшей мере иммунологически активный антиген или эпитоп антигена, причем эпитоп антигена - это пептид, белок, рекомбинантный пептид или мультипептид, липид, углевод, нуклеиновая кислота или их комбинации. Описаны способы идентификации иммунологически активных пептидов для приготовления иммунологически активных составов и способы индукции толерантного иммунного ответа и обеспечения иммунитета с использованием описанных в изобретении составов. Изобретение обеспечивает стабильные составы с широким диапазоном иммуногенов и молекул-мишеней, позволяет стимулировать защитный иммунитет и толерантность как у инфицированных, так и у неинфицированных хозяев. 9 н. и 43 з.п. ф-лы, 5 ил., 4 табл., 34 пр.
Реферат
УРОВЕНЬ ТЕХНИКИ
[0001] Настоящее изобретение относится к иммунологически активным составам, которые могут стимулировать защитный иммунитет или толерантность. Состав, который стимулирует защитный иммунитет как у инфицированного, так и у неинфицированного хозяина, состоит из эпитопов антигенов, но не включает или не содержит эпитопы, которые участвуют в механизме ускользания от иммунологического контроля или стимулируют толерантность. Защитный иммунитет также можно стимулировать с помощью состава, который содержит ассоциированную с патогеном характерную молекулярную структуру (или структуры) и/или носитель с эпитопами антигенов или без них. Другой иммунологически активный состав, который стимулирует толерантность, включает эпитоп(ы) или молекулярную структуру (структуры), важные для ускользания патогена от иммунологического контроля, с носителем или без него. Кроме того, настоящее изобретение обеспечивает способы идентификации таких иммунологически активных молекул.
[0002] Прогресс в иммунобиологии обеспечил идентификацию иммунологических факторов, необходимых для разработки иммуномодуляторов, включая необходимость стимуляции врожденного и приобретенного иммунных ответов, которые подавляют патогены.
[0003] С появлением устойчивости к широкому спектру антибиотиков, применение иммуномодуляторов может быть наиболее эффективным подходом к обеспечению продолжительной защиты от микроорганизмов, включая внутриклеточные патогены. Современный интерес к иммуномодуляторам требует разработки новых векторов, эффективных носителей и систем адъювантов.
[0004] Понимание того, что патогены могут также вызывать ответ Тh2 и толерантность, можно использовать для разработки иммуномодуляторов для аутоиммунных заболеваний, трансплантации и других медицинских применений. Большинство патогенов попадает в организм через кожу и слизистые оболочки. Следовательно, эти пути введения наилучшим образом подходят для иммуномодуляции, направленной против инфекций, попадающих в организм через кожу, воздушные пути, желудочно-кишечный тракт или половые органы. Традиционные вакцины вводят парентерально, вдали от места локализации инфекции, и вызываемый ими ответ в слизистых менее выражен.
[0005] В настоящее время ясно, что помимо TLR-рецеторов (Toll-like receptors, TLR), существуют другие рецепторы и пути, которые играют важную роль в механизмах врожденного иммунного ответа. Примером являются белки, которые содержат домены олигомеризации нуклеотидов (NOD), которые распознают мотивы внутриклеточных микроорганизмов. Миндин, белок внеклеточного матрикса, также является медиатором воспалительного ответа на некоторые компоненты поверхности бактерий. Эти и другие исследования предполагают, что во врожденном иммунитете задействованы дополнительные факторы, не участвующие в передаче сигналов через рецепторы TLR, и что образования ядерного фактора каппа В (NFκB) или интерлейкина IL-1 может быть недостаточно для подавления инфекций.
[0006] Типичными элементами врожденного иммунитета, участвующими в подавлении инфекций, являются: (1) провоспалительный ответ: опосредуемый NFκB, активирует многихвозбудителей воспаления, повышенная стимуляция может привести к шоку; (2) катионные защитные белки хозяина: повышенная продукция пептидов, вызванная молекулярными структурами, ассоциированными с бактериальным патогеном (pathogen associated molecular fiatterns, PAMPs), и сигнальными молекулами; (3) активация фагоцитирующих клеток: повышенный внутриклеточный цитолиз в нейтрофилах и макрофагах (усиливаются как окислительный, так и не окислительный механизмы), повышенная продукция цитокинов; (4) хемтотаксис: повышенная адгезия фагоцитирующих клеток к эндотелию, миграция клеток к участку локализации инфекции, диапедез; (5) механизм внеклеточного цитолиза: активация комплемента, усиленное хелатирование железа, секреция противомикробных пептидов, продукция расщепляющих ферментов; (6) ограничение распространения инфекции: образование тромба через активацию фибриногена; (7) заживление раны: рост и адгезия фибробластов, ангиогенез; и (8) приобретенные иммунные ответы: активация В- и Т-клеток, часто опосредуемая дендритными клетками.
[0007] Стимуляции врожденного иммунитета можно достичь путем применения интерферонов, монофосфорил-липида А, имиквимода, нуклеотидов CpG или катионных пептидов. Однако врожденный иммунитет имеет лишь ограниченную возможность в предохранении от инфекций, и при таком сценарии основную роль играет приобретенный иммунный ответ.
[0008] Недавно обнаружили, что дендритные клетки необходимы для взаимодействия систем врожденного и приобретенного иммунитета, и это знание позволило иммунологам разработать стратегии иммуномодуляции против антигенов со слабой иммуногенностью. Дендритные клетки (ДК) образуются из предшественников миелоидной и лимфоидной линий, но являются основными антиген-презентирующими клетками (АПК). ДК присутствуют во всех тканях, и во время инфекции они являются ключевыми клетками иммунной системы, которые вступают в контакт с внедряющимся патогеном. Они представляют собой мостик между врожденными и приобретенными иммунными ответами.
[0009] Клетки эндотелия и эпителия, моноциты, макрофаги и другие клетки, включая незрелые ДК, экспрессируют рецепторы, распознающие характерные структуры патогенов (TLR-рецепторы, рецепторы с доменом лектина и другие рецепторы), которые связывают ассоциированные с патогенами консервативные молекулярные структуры (сокращенно РАМР), общие для патогенов, такие как липополисахарид из грамотрицательных бактерий, липотейхоевая кислота из грамположительных бактерий, пептидогликан, липопротеины ассоциированные с пептидогликаном, бактериальная ДНК и флагеллин из грамотрицательных и грамположительных бактерий, а также вирусная РНК. Различные клетки экспрессируют различные рецепторы, обеспечивая настройку ответа на патоген. После активации, незрелые антиген-захватывающие ДК дифференцируются в зрелые антиген-презентирующие ДК, способные презентировать антиген в составе основного комплекса гистосовместимости МНС II и I класса, а также повышать экспрессию костимулирующих молекул клеточной поверхности, таких как CD80 и CD86.
[0010] Зрелые и активированные ДК мигрируют во вторичные лимфоидные органы (лимфатические узлы, селезенку, Пейеровы бляшки), где они перемещаются в области скопления Т-клеток. Взаимодействие ДК с Т-клетками и стимуляция ими Т-клеток зависит от цитокинов, хемокинов и молекул адгезии, таких как внутриклеточные молекулы адгезии клеток (intracellular cell adhesion molecule, 1-CAM), функциональный лимфоцитарный антиген 1 типа (leukocyte function associated molecule, LFA-1) и специфичный для дендритных клеток I-CAM-связывающий неинтегринный рецептор DC-SIGN.
[0011] В зависимости от локального цитокинового окружения и самого антигена, запуск клеточного ответа Т-хелперов (Th1) и гуморального опосредуемого антителами, Th2- или Treg-ответа происходит в различной степени. Было показано, что доза антигена направляет дифференцировку Th1/Th2 клеток, при этом высокие дозы стимулируют в основном Th-1 ответ, а низкие - Th-2 ответ. Было показано, что искусственные носители, «представляющие» антигенные белки, и ДНК-вакцины, поглощаются незрелыми дендритными клетками и вызывают иммунный ответ. Следовательно, ДК представляют собой основную, но не единственную мишень для разработок средств модуляции иммунной системы.
[0012] В частности, ДК слизистых обеспечивают важную первичную защиту, поглощая внедряющиеся чужеродные агенты путем пиноцитоза и рецептор-опосредованного эндоцитоза. ДК играют решающую роль в иммунных свойствах слизистых оболочек, а слизистые оболочки тела действуют как барьер между внутренней средой организма и его окружением. ДК могут быть обнаружены в выстилке дыхательных путей и кишечника. Клетки Лангерганса представляют собой популяцию ДК, обнаруживаемых в коже и слизистой оболочке. ДК и М-клетки транспортируют антигены в лимфоидный фолликул, находящийся в толще слизистой оболочки, который представляет собой иммуноиндуцирующую область кишечника. В дыхательных путях были описаны аналогичные лимфоидные ткани, ассоциированные с носовой полостью и бронхами. В желудочно-кишечном тракте эта система играет важную роль, но в слизистой оболочке дыхательных путей сеть ДК может быть даже более важной.
В случае перорального введения иммуномодулятор должен пройти через желудок и верхние участки кишечного тракта неразрушенным. Такое разрушение маловероятно при назальном введении, введении через глаз или гениталии. Затем иммуномодулятор должен всосаться через эпителий кишечника, чтобы антиген-презентирующие клетки могли адсорбировать его и впоследствии представить иммунокомпетентным клеткам. Иммунокомпетентные клетки расположены в эпителии, в собственной пластинке слизистой оболочки (lamina propria) или под базальной мембраной. Следовательно, компоненты иммуномодулятора необходимо назначать совеместно с носителем, которой обеспечит их проникновение через указанный барьер. Считается, что когда молекулы связаны с носителями, представляющими собой частицы, они могут быть перенесены через указанный барьер М-клетками пейеровых бляшек.
[0013] Преждевременная деградация или высвобождение биоактивных молекул препятствовали разработке вакцин и способов доставки лекарственных средств на основе частиц. Это является возможным объяснением того, что согласно опубликованной литературе, для достижения эффекта, сравнимого с эффектом аналога, вводимого путем инъекции, необходима высокая доза антигена/лекарственного средства. Помимо плохой утилизации антигенов и лекарственных средств, в качестве основных недостатков указывают низкую способность М-клеток в пейровых бляшках (ПБ) транспортировать частицы и недостаточную стимуляцию иммунного и других ответов у человека. Известно, что М-клетки пейровых бляшек эпителия обеспечивают транспорт определенных бактерий, вирусов и простейших из кишечника. Некоторые исследования показали, что поглощение объекта, осуществляемое М-клетками, ДК и клетками Сасо-2, зависит от его размера, и максимальный диаметр поглощаемого объекта равен 10 мкм.
[0014] Новая информация по поглощению частиц М-клетками и различными типами дендритных клеток (ДК), присутствующих в ПБ и их окрестности, может обеспечить понимание задействованных в этом процессе механизмов. Веyеr с соавторами (Веyеr Т., et al; Bacterial carriers and virus-like-particles as antigen delivery devices: Role of dendritic cells in antigen presentation (Бактериальные носители и вирусоподобные частицы как средства доставки антигенов: Роль дендритных клеток в презентации антигенов). Curr. Drug Targets-Infect. Disord, 2001 1, 287-302) исследовали поглощение и кинетику клеток пекарских дрожжей (Saccharomyces cerevisiae) в ПБ, предполагая, что они представляют собой инертную модель транспорта через слизистую оболочку. Для распределения клеток дрожжей в М-клетках, межклеточном углублении под М-клетками и пространстве под базальной мембраной была обнаружена типичная временная зависимость, сходная с транспортом в различные типы фагоцитирующих, антигенпроцессирующих макрофагов или дендритных клеток. Обнаружили, что в зависимости от своего расположения, ДК имеют разные функции в микроокружении ПБ, продуцируя после активации Тh1- или Тh2-направляющие цитокины. Затем хемокиновое и цитокиновое микроокружение определит дифференцировку клеток-хелперов в субпопуляции Тh1 и Тh2 соответственно, а также влияет на выживание или апоптоз Т-клеток.
[0015] Кроме того, разные цитокины (IL-6 в дополнение к TGF-p, IL-4, IL-5 и IL-10) и специфический рецептор хоуминга a4b7, регулируют дифференцировку В-клеток и хоуминг плазматических клеток слизистой оболочки. Соответственно, можно заключить, что очевидно в слизистой оболочке существуют механизмы, через которые модуляция иммунной системы слизистой оболочкой может вызвать более дифференцированный иммунный ответ, лучше имитирующий ответ на природную инфекцию, чем полученный при применении других путей введения состава.
[0016] Несмотря на то, что многое известно о ДК, их предполагаемых предшественниках и субпопуляциях ДК, высокая степень функциональной сложности и пластичности ДК затрудняет предсказание действия конкретной вакцины на ДК и последующие Тh1, Тh2 и Treg ответы. Однако некоторые результаты, полученные для дифференцированных in vitro ДК, можно экстраполировать на зрелые ДК, выделенные из лимфоидных органов, поскольку они проявляют схожие свойства (Shortman K., et al; Mouse and human dentritic cell subtypes (Подтипы дендритных клеток мыши и человека). Nat. Rev. Immunol. 2002 Mar 2(3): 151-61). Например, in vitro была изучена способность липопептида микоплазмы MALP-2 модулировать ответ ДК (Weigt H., et al; Synthetic mycoplasma-derived lipopeptide MALP-2 induces maturation and function of dendritic cells (Синтетический липопептид MALP-2 микоплазменного происхождения стимулирует созревание и функцию дендритных клеток) Immunobiology 2003, 207(3): 223-33). Обработка дендритных клеток MALP-2 стимулировала экспрессию CD80, CD86 и высвобождение биоактивных TNF-α и IL-10, а также пролиферацию аутологичных лимфоцитов и продукцию последними IL-4, IL-5 и γ-интерферона. Эти признаки коррелируют со способностью стимулировать Т-клетки, и таким образом указывают на возможное действие MALP-2 на ДК in vivo.
[0017] Синтетические носители могут обеспечивать иммуностимулирующее действие антигенов аналогичное действию при презентации на молекулах комплекса гистосовместимости (МНС) класса I и II. На основе синтетических носителей можно разработать гибкую систему, которую можно адаптировать к разнообразным возможным приложениям. Характер этих носителей может существенно влиять на результат и эффективность иммунного ответа. Синтетические носители, такие как частицы, могут облегчить соответствие стандартам качества и сертификацию при разработке и производстве вакцин, и, соответственно, сократить время, необходимое для получения одобрения и выхода на рынок.
[0018] Для вакцинации можно применять различные стимулирующие иммунный ответ компоненты (пептиды, белки, липиды или полисахариды) различных инфекционных микроорганизмов. Эти компоненты могут быть синтезированы, выделены из микроорганизмов или получены по технологии рекомбинантных ДНК. Однако при их введении в свободной, растворимой форме перорально или парентеральнотребуются подходящие адъюванты.
[0019] В качестве носителей для различных антигенов и лекарственных средств исследовали несколько систем на основе частиц. Ранее в качестве систем-носителей лекарственных средств были описаны микрочастицы из хитозана, поли-DL-молочной кислоты или полиакрилового крахмала. Примеры таких систем описаны в Патентах США 5,603,960 и 6,521,431. В одном из источников сообщали, что микрочастицы из крахмала с ковалентно присоединенным сывороточным альбумином человека (HSA), который представлял собой модельный антиген, действовали как сильный адъювант при парентеральном введении мышам, а взятые отдельно микрочаскицы были неиммуногенны.
[0020] Необходимо отметить, что поглощение вероятнее всего зависит от структуры и также от возможных адгезивных свойств носителя. Агарозе и другим полисахаридам присущи мукоадгезивные свойства, которые могут улучшить их взаимодействие с различными слизистыми оболочками и облегчить поглощение.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0021] Согласно настоящему изобретению, описаны новые композиции для иммунологически активного состава или составов, которые могут стимулировать защитный иммунитет или толерантность. Состав для стимуляции защитного иммунитета у инфицированного или неинфицированного хозяина состоит из эпитопов антигенов, но в него не включены или из него удалены эпитопы, которые участвуют в «ускользании» от иммунной системы или стимулируют толерантность. Защитный иммунитет также можно стимулировать составом, который всодержит ассоциированную с патогеном молекулярную структуру/структуры и/или носитель с антигенными эпитопами или без них. Другой иммунологически активный состав, который стимулирует толерантность, содержит эпитоп(ы) ускользания или молекулярную структуру/структуры, важные для ускользания антигена, с носителем или без него. Кроме того, настоящее изобретение обеспечивает способы идентификации таких иммунологически активных молекул. Подходящим примером являются молекулы, распознающие ассоциированную с патогеном молекулярную структуру/структуры (PAMPs) с присоединенными модифицированными антигенами микоплазмы или без них. Как оказалось, такие молекулярные составы модулируют иммунные ответы против микоплазмы как у инфицированных, так и у неинфицированных хозяев. Некоторые из антигенов стимулировали толерантность или ускользание от иммунологического контроля.
[0022] Соответственно, в одном своем аспекте настоящее изобретение относится к иммунологически активному составу для стимуляции защитного иммунитета, который содержит:
(1) по меньшей мере одну ассоциированную с патогеном молекулярную структуру;
(2) возможно содержит по меньшей мере один иммунологически активный антиген или эпитоп антигена; и
(3) по меньшей мере один носитель, эффективно доставляющий состав в организм, что приводит к стимуляции защитного иммунитета.
[0023] Во многих случаях желательно включить по меньшей мере один активный антиген или эпитоп антигена. Подходящие примеры описаны ниже. Обычно указанный по меньшей мере один иммуннологически активный эпитоп антигена очищают от эпитопов ускользания. Это важно для предотвращения селективного отбора, который в противном случае привел бы к появлению патогенов, репликацию которых не блокирует не иммунный ответ. Примером патогенов, для которых важен селективный отбор, является вирус гриппа, который так быстро мутирует, что для каждого инфекционного сезона необходимо изготавливать новую вакцину, чтобы обеспечить иммунитет к конкретному штамму или штаммам гриппа, которые могут вызвать заболевание человека. Другой пример патогена, для которого, видимо, важенселективный отбора, - вирус иммунодефицита человека (ВИЧ), который также быстро мутирует.
[0024] В другом своем аспекте настоящее изобретение относится к иммунологически активному составу для стимуляции толерантности, который содержит:
(a) по меньшей мере одну ассоциированную с патогеном молекулярную структуру;
(b) по меньшей мере один иммунологически активный антиген или эпитоп антигена; и
(c) по меньшей мере один носитель, эффективно доставляющий состав в организм, что приводит к стимуляции толерантности.
[0025] Обычно иммунологически активный эпитоп антигена представляет собой пептид, белок, рекомбинантный пептид или мультипептид, рекомбинантный белок, липид, углевод, нуклеиновую кислоту или другую биологически активную молекулу, либо комбинацию любых из указанных молекул. Обычно, если иммунологически активный эпитоп антигена представляет собой пептид или белок, указанный пептид или белок имеет иммуномодулирующие посттранскрипционные модификации. Обычно посттранскрипционные модификации содержат фрагменты углеводов и/или липидов. Обычно посттранскрипционные модификации включают терминальное маннозилирование; в этом случае терминально маннозилированные иммуномодулирующие вещества обычно удаляют из иммунозащитного состава. Их можно удалить путем окисления, обработки ферментами или путем сахар-специфичного аффинного связывания. Альтернативно, если посттранскрипционные модификации включают фрагменты липидов, эти фрагменты липидов удаляют путем делипидизации.
[0026] Обычно иммунологически активные эпитопы антигенов представляют собой пептид или белок, причем указанный иммунологически активный пептид или белок не содержит иммуномодулирующих посттранскрипционных модификаций. Также иммунологически активный пептид или белок обычно не содержит последовательностей аминокислот, по которым может происходить N-гликозилирование и/или присоединение липида. В другом предпочтительном варианте иммунологически активный эпитоп антигена представляет собой пептид или белок, и указанный иммунологически активный пептид или белок содержит последовательность аминокислот, способную связываться с гликозаминогликанами (GAG) поверхности клетки. Обычно такие последовательности аминокислот имеют многоосновную природу и имеют общую формулу ХВВХВХ, ХВВВХХВХ, ВВХХВВВХХВВ, ВВВХХВ, ВХВХВ, ВВВ, ВХВХХХВХВ, или ВХВХХХХХВХВ, где В обозначает основную аминокислоту, а Х - любую другую аминокислоту. Обычно GAG-связывающие последовательности аминокислот применяют для получения антител к пептиду или белку, которые способны препятствовать связыванию патогена с поверхностью клетки. GAG может быть выбран из группы, состоящей из гепарина и его аналогов. Иммунологически активный пептид или белок может обладать комплементактивирующей активностью самостоятельно или в комбинации с антителами. Иммунологически активный эпитоп антигена может представлять собой множество пептидов, которые соединены в единый мультипептид. Иммунологически активные эпитопы антигенов могут включать как эпитопы Т-клеток, так и эпитопы В-клеток.
[0027] Обычно ассоциированную с патогеном молекулярную структуру выбирают из группы, включающей:
(1) агониста рецептора TLR 1;
(2) агониста рецептора TLR 2;
(3) агониста рецептора TLR 3;
(4) агониста рецептора TLR 4;
(5) агониста рецептора TLR 5;
(6) агониста рецептора TLR 6;
(7) агониста рецептора TLR 7;
(8) агониста рецептора TLR 8;
(9) агониста рецептора, TLR 9;
(10) агониста NOD-1;
(11) агониста NOD-2;
(12) DC-SIGN;
(13) L-SIGN; и
(14) рецептора маннозы.
[0028] Если ассоциированная с патогеном молекулярная структура представляет собой агонист NOD-1 или агонист NOD-2, такой агонист NOD-1 или агонист NOD-2 может быть выбран из группы, включающей бактериальный пептидогликан и производное бактериального пептидогликана.
[0029] В другом своем аспекте настоящее изобретение относится к способу идентификации иммунологически активных пептидов, способных препятствовать связыванию патогенов с гликозаминогликанами, включающему следующие этапы:
(1) проведение адсорбции гепарина;
(2) проведение иммуноаффинной селекции; и
(3) возможно, выполнение протеолитического расщепления белка или белков, выделенных путем иммуноаффинной селекции, для получения иммунологически активных пептидов. Иммуноаффинную селекцию можно осуществить способами, хорошо известными в данной области техники и описанными, например, у G.T. Hermanson et al., "Immobilized Affinity Ligand Techniques" («Способы с применением иммобилизованных аффинных лигандов» Academic Press, Inc., San Diego, 1992); в данной области известны также другие способы.
[0030] Еще один аспект настоящего изобретения относится к способу идентификации иммунологически активных пептидов, способных препятствовать связыванию патогенов с гликозаминогликанами, который включает стадию анализа информации о последовательности способом биоинформатики с использованием многоосновных линейных мотивов.
[0031] Еще один аспект настоящего изобретения относится к способу идентификации комплементактивирующих иммунологически активных пептидов, который включает следующие этапы:
(1) осуществление связывания комплементфиксирующих антител с белком комплемента;
(2) применение указанных антител для иммуноаффинной селекции белковых антигенов; и
(3) возможно, выполнение протеолитического расщепления выделенных белковых антигенов.
[0032] Полученные этими способами иммунологически активные пептиды также представляют собой аспекты настоящего изобретения. Кроме того, на основе идентифицированного иммунологически активного пептида можно создать защитное антитело для борьбы с заболеванием в организме хозяина.
[0033] В описанных выше составах молекулы могут присутствовать в смеси. В качестве альтернативы, молекулы могут быть химически связаны друг с другом. Носитель обычно представляет собой микрочастицу. Предпочтительно, микрочастицы имеют узкий диапазон распределения по размерам и являются пористыми. Обычно диаметр микрочастиц меньше 10 мкм, более предпочтительно диаметр микрочастиц меньше 5 мкм. Обычно частицы изготавливают из биополимера. В одном варианте иммунологически активные эпитопы антигенов нековалентно присоединены к микрочастицам. В другом варианте иммунологически активные эпитопы антигенов ковалентно присоединены к указанным микрочастицам. К микрочастицам можно присоединить более одного иммунологически активного эпитопа антигена и более одного агониста патогенраспознающего рецептора. К микрочастицам можно присоединить более одного патогенраспознающего рецептора.
[0034] В другом своем аспекте настоящее изобретение относится к способу индукции иммунного ответа у пациента, который включает этап введения иммунологически эффективной дозы состава, содержащего по меньшей мере один иммунологически активный эпитоп антигена и по меньшей мере один агонист патогенраспознающего (PR) рецептора, связанные с микрочастицами, причем микрочастицы имеют размер в том же диапазоне, что и патоген, или меньше. Состав может содержать более одного агониста патогенраспознающего рецептора.
[0035] Еще в одном своем аспекте настоящее изобретение относится к способу in vivo доставки иммунологически активного состава для индукции иммунного ответа у пациента, включающему этап введения иммунологически эффективного количества состава, содержащего по меньшей мере один агонист патогенраспознающего (PR) рецептора, связанный с микрочастицами, причем микрочастицы имеют размер в том же диапазоне, что и патоген, или меньше.
[0036] Еще в одном своем аспекте настоящее изобретение относится к способу in vivo доставки иммунологически активного состава для индукции иммунного ответа у пациента, включающему этап введения иммунологически эффективного количества состава, содержащего по меньшей мере один иммунологически активный эпитоп антигена и по меньшей мере один агонист патогенраспознающего (PR) рецептора, связанные с микрочастицами, причем микрочастицы имеют размер в том же диапазоне, что и патоген, или меньше.
[0037] В другом своем аспекте настоящее изобретение относится к способу индукции защитного иммунного ответа на по меньшей мере один патоген, включающему этап введения, в виде одной или нескольких доз, иммунологически эффективного количества состава, содержащего один или более иммунологически активный эпитоп антигена и комбинацию агонистов патогенраспознающих рецепторов, связанные с микрочастицами, причем микрочастицы имеют размер в том же диапазоне, что и патоген, или меньше, а иммунный ответ включает Тh1 или Th2 ответы, либо их комбинацию.
[0038] Еще в одном своем аспекте настоящее изобретение относится к способу индукции защитного иммунного ответа на по меньшей мере один патоген, включающему этап введения, в виде одной или нескольких доз, иммунологически эффективного количества состава, содержащего один или более иммунологически активный эпитоп антигена, но не содержащего антигены, которые участвуют в механизмах ускользания от иммунологического контроля, а также комбинацию агонистов патогенраспознающих рецепторов, связанные с микрочастицами, причем микрочастицы имеют размер в том же диапазоне, что и патоген, или меньше.
[0039] В способах введения или доставки согласно настоящему изобретению, введение состава можно осуществлять через слизистую оболочку, парентеральным путем, через кожу. В качестве альтернативы можно применять другие пути введения.
[0040] В способах индукции иммунитета согласно настоящему изобретению иммунный ответ обычно направлен на элементы патогенного микроорганизма, которые связывают гликозаминогликаны.
[0041] В качестве альтернативы, составы согласно настоящему изобретению можно применять в способах индукции иммунологической толерантности. Способ индукции толерантности к иммунологически активному агенту включает этап введения иммунологически эффективного количества состава, содержащего один или более иммунологически активный эпитоп антигена и комбинацию агонистов PRR, связанные с микрочастицами, причем микрочастицы имеют размер в том же диапазоне, что и патоген, или меньше, а иммунный ответ включает стимуляцию регуляторного ответа, или снижение иммунных функций, или ускользание от иммуннологического контроля. Состав может содержать иммунологически активный эпитоп антигена, имеющий липидсодержащий фрагмент. Иммунологически активный липидсодержащий фрагмент может быть присоединен к микрочастицам независимо от иммунологически активного эпитопа антигена. Иммунологически активный липидсодержащий фрагмент может иметь углеводные компоненты, углеводные компоненты могут являться результатом N-гликозилирования. Иммунологически активный эпитоп антигена может содержать мотивы, включающие по меньшей мере одну аминокислоту, выбранную из группы, состоящей из аспарагина, треонина и серина, при этом указанные мотивы представляют собой Asp-X-Ser или Asp-X-Thr мотивы, где Х может быть любой аминокислотой, кроме пролина.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
[0042] Настоящее изобретение будет более понятным, если обратиться к описанию, формуле и прилагающимся рисункам, где:
Фигура 1 представляет собой график, демонстрирующий распределение агарозных микрочастиц, подходящих для применения в составах, которые имеют микрочастицы в качестве носителя, согласно настоящему изобретению (Пример 1);
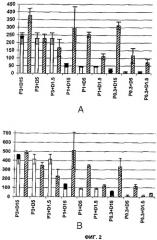
Фигура 2 представляет собой график, демонстрирующий секрецию TNF-α (фактор некроза опухолей альфа), мононуклеарами периферической крови (peripheral blood mononuclear cells, PBMC) - (А) или секрецию тканевого фактора - (В) после обработки пептидогликаном (PepG) (белый столбик) или бактериальной CpG-ДНК (bactDNA) (черный столбик) или обоими веществами одновременно в тех же концентрациях, в которых их вводили отдельно (заштрихованный столбик); числа после Р и D, соответственно, указывают концентрации пептидогликана и бактериальной ДНК в мкг/мл, соответственно; слева направо это P3+D15, P3+D5, P3+D1.5, P1+D15, P1+D5, P1+D1.5, P0.3+D15, P0.3+D5 и P0.3+D1.5;
Фигура 3 представляет собой график, демонстрирующий стимуляцию различных Th1 и Тh2 ответов частицами, приготовленными различными способами с очищенными Con А или обработанными перйодатом натрия антигенами, а также с различными комбинациям агонистов TLR2, TLR3, TLR4, и TLR9 (серый столбик, TNF-α×100, черный столбик, IL-10);
Фигура 4 представляет собой график, демонстрирующий соотношение TNF-α/IL-10 для моноцитов, обработанных частицами, приготовленными различными способами, как для Фигуры 3; и
Фигура 5 представляет собой график, демонстрирующий стимуляцию MHC-II и CD86 в дендритных клетках после воздействия на них препаратов микрочастиц.
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНОГО СПОСОБА РЕАЛИЗАЦИИ
[0043] Настоящее изобретение описывает иммунологически активные составы, способы нацеливания молекул на определенные популяции клеток и стимуляции ответов в организме модельных животных, а также способы получения предложенных составов.
[0044] Существует потребность в создании более эффективных иммуномодулирующих агентов и систем доставки препаратов для ряда заболеваний или патологических состояний, а также для защиты от патогенов, вакцин против которых в настоящее время не существует или они не эффективны.
[0045] Традиционные вакцины, содержащие ослабленные, убитые или генетически модифицированные патогены, являются ограниченными для иммунного ответа, который определяют молекулярная структура патогена и его взаимодействие с патогенраспознающими рецепторами (PRR) иммунной системы. Патогены, которые способны вызывать хронические инфекции, имеют молекулярные структуры, которые позволяют им избегать иммунного ответа организма, в то время как другие патогены, такие как вирус гриппа, используют для самоподдержания мутации (антигенную изменчивость), приводящие к ускользанию от иммунологического контроля благодаря продукции антител, способствующих усилению поглощения вируса.
[0046] В целом, патоген-специфические антитела играют важную роль в борьбе с инфекциями путем ряда способов. Однако в некоторых случаях присутствие специфических антител может быть выгодно для патогена. Такая активность известна как антителозависимое усиление (АЗУ) инфекции. АЗУ инфекции - это явление, при котором патоген-специфические антитела усиливают вторжение патогена, а в некоторых случаях и репликацию патогена, например, вируса, в моноциты/макрофаги и в гранулоциты посредством взаимодействия с Fc рецепторами. Этот феномен описан in vitro и in vivo для патогенов, представляющих разнообразные семейства и роды, имеющие значение для здравоохранения и ветеринарии. Эти патогены, такие как М. gallisepticum имеют некоторые общие свойства, такие как предпочтительная репликация в макрофагах, способность к перисистированию и антигенному разнообразию.
[0047] Для некоторых патогенов АЗУ инфекции стало большой проблемой, мешающей борьбе с заболеванием путем вакцинации. Соответственно, было предпринято множество попыток разработки вакцин с минимальным риском АЗУ или вообще без него. Для этого важно идентифицировать или нейтрализовать эпитопы патогенов, связанные с АЗУ. Кроме того, ясное понимание событий, происходящих в клетке после попадания в нее патогена по механизму АЗУ стало критическим для разработки эффективного вмешательства. Однако понимание механизмов АЗУ все еще далеко от полного. Это обуславливает сложность разработки эффективных вакцин против таких патогенов. Поэтому мы идентифицировали мотивы, играющие важную роль в защитном иммунитете путем нарушения механизмов связывания с клеткой, а также мотивы, которые необходимо исключить из состава, чтобы вызвать защитный иммунитет без эффекта ускользания. Мы также идентифицировали мотивы, которые вызывали ускользание или толерантность.
[0048] Мы исследовали возможность нацеливания иммунологически активных молекул на определенные клетки при помощи носителя, состоящего из полисахарида, такого как нативная агароза, которое позволяет достичь модуляции как врожденного, так и приобретенного иммунного ответа и защиты от инфекции. Настоящее изобретение очевидно можно применять также в других приложениях, в которых нацеливание происходит на другие рецепторы при помощи других частиц. Преимуществом агарозы является то, что она представляет собой природный полисахарид, полимер D-галактозы, который подвержен биодеградации и, как было доказано, совместим с клетками млекопитающих. Было обнаружено, что микрочастицы агарозы при парентеральном введении демонстрируют слабую способность активировать макрофаги и сравнимые с гидроксидом алюминия свойства адъюванта (Gronlund H. et al., Carbohydrate-based particles: a new adjuvant for allergen-specific immunotherapy (Частицы на основе углеводов: новый адъювант для аллерген-специфичной иммунотерапии). Immunology, 2002, 107, 523-529).
[0049] С точки зрения конечного пользователя, важно, чтобы вакцина не требовала хранения в холодильнике и в то же время обладала длительным сроком хранения. Агарозные частицы способны удовлетворить этим требованиям. Также важно, чтобы введение вакцины или системы доставки лекарственного средства было максимально простым. Поэтому не требующие инъекций, вводимые через слизистую оболочку, в частности, перорально, составы имеют преимущество перед составами, водимыми парентерально. Пероральное применение, однако, столкнулось с проблемами стабильности состава, являющимися следствием работы пищеварительной системы.
[0050] Мы обнаружили, что присоединение антигенов к пористой агарозной матрице может защитить их от разрушения внутри желудочно-кишечного тракта. Связь между лигандами и частицами гарантирует, что адъювант и антиген будут поглощены одними и теми же антиген-процессирующими клетками. Размер агарозных микрочастиц (<5 мкм) также может обеспечить попадание частиц в Пейеровы бляшки (ПБ).
[0051] Эффективность неметилированной CpG-ДНК, поли(I:С) или MALP-2 в качестве адъювантов позволяет предположить, что мотивы ассоциированных с патогеном молекулярных структур (РАМР), при совместной иммобилизации с антигенами, орбеспечили бы специфичное поглощение иммунологически активных составов на поверхности слизистых различными АПК, экспрессирующими соответствующие рецепторы РАМР.
[0052] Различные субпопуляции ДК и других иммунокомпетентных клеток имеют различные «структурораспознающие рецепторы». Применение комбина