Соединения
Иллюстрации
Показать всеИзобретение относится к новым производным пурина, обладающим свойствами ингибитора фермента CDK, выбранного из CDK1, CDK2, CDK3, CDK4, CDK6, CDK7, CDK8 и CDK9. В формуле (I):
R1 и R2, каждый независимо, представляет собой Н, C1-6-алкил или С1-6-галогеналкил; R3 и R4, каждый независимо, представляет собой Н, С1-6-алкил или С1-6-галогеналкил; R5 представляет собой C1-6-алкил или С3-12-циклоалкил, или С3-12-циклоалкил-С1-6-алкил, каждый из которых может быть необязательно замещен одной или более ОН группами; R6 представляет собой , где Y представляет собой N, X и Z представляют собой CR9; R7, R8 и каждый R9 независимо представляют собой Н, C1-6-алкил или C1-6-галогеналкил; где по меньшей мере один из R7, R8 и R9 не является Н. Изобретение также относится к фармацевтической композиции, содержащей указанные соединения, к применению соединений для лечения облысения, удара, пролиферативного заболевания, такого как рак, лейкемия, гломерулонефрит, ревматоидный артрит, псориаз, вирусного заболевания, такого как заболевание, вызванное человеческим цитомегаловирусом, вирусом простого герпеса типа 1, вирусом иммунодефицита человека типа 1, нейродегенеративного заболевания, заболевания ЦНС, такого как болезнь Альцгеймера. 13 н. и 17 з.п. ф-лы, 8 табл., 18 пр., 2 ил.
Реферат
2-ола,Область изобретения
Изобретение относится к новым 2,6,9-замещенным пуриновым производным и их биологическому применению. В частности, настоящее изобретение относится к пуриновым производным, обладающим антипролиферативными свойствами, которые пригодны для лечения пролиферативных заболеваний, таких как рак, лейкемия, псориаз и тому подобное.
Предпосылки создания изобретения
Инициация, развитие и завершение клеточного цикла млекопитающих регулируются различными циклинзависимыми киназными (CDK) комплексами, которые являются определяющими для клеточного роста. Такие комплексы включают по меньшей мере каталитическую (сама CDK) и регуляторную (циклин) субъединицу. Некоторые из более важных комплексов для регуляции клеточного цикла включают циклин А (CDK1 - известный также как cdc2 и CDK2), циклин В1-В3 (CDK1), циклин D1-D3 (CDK2, CDK4, CDK5, CDK6), циклин Е (CDK2). Каждый из таких комплексов участвует в конкретной фазе клеточного цикла. Однако не все представители семейства CDK участвуют исключительно в контроле клеточного цикла. Например, CDK 7, 8 и 9 вовлечены в регуляцию транскрипции, тогда как CDK5 играет свою роль в функции нейронных и секреторных клеток.
Активность CDK регулируется посттрансляционно путем временных связей с другими белками и путем изменений их внутриклеточной локализации. Развитие опухоли тесно связано с генетическим изменением и нарушением регуляции CDK и их регуляторов, что говорит о том, что ингибиторы CDK могут быть полезными противораковыми терапевтическими средствами. Разумеется, первоначальные результаты говорят о том, что трансформированные и нормальные клетки отличаются по их потребности в отношении, например, циклина А/CDK2, и что возможна разработка новых противоопухолевых средств, не обладающих общей токсичностью в отношении организма хозяина, наблюдаемой у общепринятых цитотоксических и цитостатических лекарственных средств. Хотя ингибирование связанных с клеточным циклом CDK явно важно, например, для применения в онкологии, это не может быть аргументом для ингибирования регулирующих РНК-полимеразу CDK. С другой стороны, ингибирование функции CDK9/циклина Т до недавнего времени связывали с предотвращением репликации ВИЧ, и открытие новой биологии CDK, таким образом, продолжает открывать новые терапевтические показания для ингибиторов CDK (Sausville, E.A. Trends Molec. Med. 2002, 8, S32-S37).
Функция CDK состоит в фосфорилировании и, таким образом, в активации или дезактивации определенных белков, включая, например, белки ретинобластомы, ламины, гистон Н1 и компоненты митотического веретена. Каталитическая стадия, опосредуемая CDK, включает реакцию фосфопереноса от АТФ к макромолекулярному субстрату фермента. Несколько групп соединений (рассмотренные, например, у Fischer, P.M. Curr. Opin. Drug Discovery Dev. 2001, 4, 623-634), как обнаружено, обладают антипролиферативными свойствами в силу CDK-специфического антагонизма АТФ.
В WO 98/05335 (CV Therapeutics Inc) описаны 2,6,9-трехзамещенные пуриновые производные, которые являются селективными ингибиторами киназ клеточного цикла. Такие соединения полезны при лечении аутоиммунных заболеваний, например, ревматоидного артрита, волчанки, диабета I типа, рассеянного склероза; лечении рака, сердечно-сосудистых заболеваний, таких как рестеноз, реакции организма хозяина против трансплантата, подагры, поликистозной болезни почек и других пролиферативных заболеваний, патогенез которых связан с аномальной клеточной пролиферацией.
В WO 99/07705 (The Regents of the university of California) описаны пуриновые аналоги, которые ингибируют, среди прочего, протеинкиназы, G-белки и полимеразы. Более конкретно, настоящее изобретение относится к способам применения таких пуриновых аналогов для лечения заболеваний с пролиферацией клеток и нейродегенеративных заболеваний.
В WO 97/20842 (CNRS) также описаны пуриновые производные, проявляющие антипролиферативные свойства, которые полезны при лечении рака, псориаза и нейродегенеративных нарушений. Дополнительные пуриновые производные описаны в WO 03/002565, WO 04/016613 и WO 04/016612.
Данным изобретением была предпринята попытка получения новых 2,6,9-замещенных пуриновых производных, особенно таких, которые обладают антипролиферативными свойствами.
Сущность изобретения
В первом аспекте настоящее изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли
где:
R1 и R2, каждый независимо, представляет собой Н, алкил или галогеналкил;
R3 и R4, каждый независимо, представляет собой Н, алкил, галогеналкил или арил;
R5 представляет собой алкил или циклоалкил, или циклоалкилалкил, каждый из которых может быть необязательно замещен одной или более ОН группами;
R6 выбран из циклопропиламино, циклопропилметиламино, циклобутиламино, циклобутилметиламино и
где один из Х, Y и Z представляет собой N, и остальные представляют собой CR9;
R7, R8 и каждый R9 независимо представляют собой Н, алкил или галогеналкил; где по меньшей мере один из R7, R8 и каждый R9 не является Н.
Во втором аспекте настоящее изобретение относится к соединению формулы II или его фармацевтически приемлемой соли,
где:
по меньшей мере один из R1', R2', R3' и R4' является галогеналкилом, и остальные, каждый независимо, представляет собой Н, алкил или галогеналкил;
R5' представляет собой алкил или циклоалкил, или циклоалкилалкил, каждый из которых может быть необязательно замещен одной или более OH группами;
R6' выбран из циклопропиламино, циклопропилметиламино, циклобутиламино, циклобутилметиламино и
где Х', Y' и Z', каждый независимо, представляет собой CR9', или один из Х', Y' и Z' является N, и остальные представляют собой CR9'; и
R7', R8' и каждый R9', каждый независимо, представляет собой Н, галоген, алкил или галогеналкил.
Третий аспект настоящего изобретения относится к фармацевтической композиции, содержащей соединение настоящего изобретения и фармацевтически приемлемый носитель, разбавитель или эксципиент.
Четвертый аспект настоящего изобретения относится к применению соединения настоящего изобретения для получения лекарственного средства для лечения одного или более следующих заболеваний:
пролиферативного заболевания;
вирусного заболевания;
удара;
облысения;
расстройства ЦНС;
нейродегенеративного расстройства и
различных типов диабета.
Пятый аспект настоящего изобретения относится к применению соединения настоящего изобретения в качестве антимитотического средства.
Шестой аспект настоящего изобретения относится к применению соединения настоящего изобретения для ингибирования протеинкиназы.
Седьмой аспект настоящего изобретения относится к способу лечения пролиферативного заболевания, где указанный способ включает введение млекопитающему терапевтически эффективного количества соединения настоящего изобретения.
Восьмой аспект настоящего изобретения относится к применению соединения настоящего изобретения для анализа по идентификации дополнительных кандидатов на соединения, которые влияют на активность одного или нескольких ферментов CDK.
Подробное описание изобретения
Как указано выше, первый аспект настоящего изобретения относится к соединению формулы (I), как определено выше.
Как использовано в данном описании, термин «алкил» включает алкильные группы как с прямой насыщенной цепью, так и с разветвленной. Предпочтительно, алкильная группа является С1-20алкильной группой, более предпочтительно, С1-15, еще более предпочтительно С1-12алкильной группой, и наиболее предпочтительно С1-6алкильной группой, более предпочтительно, С1-3алкильной группой. Особенно предпочтительные алкильные группы включают, например, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил и гексил.
Как использовано в данном описании, термин «циклоалкил» относится к циклической алкильной группе. Предпочтительно, циклоалкильная группа является С3-12циклоалкильной группой.
Как использовано в данном описании, термин «циклоалкилалкил» относится к группе, имеющей как циклоалкильную, так и функциональную алкильную группу.
Предпочтительно, один из R1 и R2 представляет собой Н, и другой является алкилом.
Более предпочтительно, один из R1 и R2 представляет собой Н, и другой является метилом, этилом или изопропилом.
В одном предпочтительном варианте осуществления R1 представляет собой этил, и R2 представляет собой Н.
В одном из предпочтительных вариантов осуществления настоящего изобретения R3 и R4, каждый независимо, представляет собой Н, алкил, галогеналкил или арил; и по меньшей мере один из R3 и R4 не является Н.
В одном из предпочтительных вариантов осуществления настоящего изобретения один из R3 и R4 представляет собой Н, и другой является алкилом или галогеналкилом.
В более предпочтительном варианте осуществления R3 представляет собой Н, и R5 представляет собой алкил или галогеналкил.
Более предпочтительно, R3 представляет собой Н, и R4 представляет собой метил.
В одном из предпочтительных вариантов осуществления настоящего изобретения R6 представляет собой
В одном из предпочтительных вариантов осуществления настоящего изобретения Y является N. Предпочтительно для данного варианта осуществления, Х является СН, Z представляет собой C-алкил, R7 является Н, и R8 представляет собой алкил. Более предпочтительно для данного варианта осуществления, Х является СН, Z представляет собой С-Ме, R7 является Н, и R8 представляет собой Ме. В альтернативном предпочтительном варианте осуществления Х является СН, Z представляет собой С-Ме, R7 и R8, оба являются Н. В еще одном альтернативном предпочтительном варианте осуществления Х является СН, Z представляет собой С-CF3, и R7 и R8, оба являются Н.
В одном из предпочтительных вариантов осуществления Х является N. Предпочтительно для данного варианта осуществления, Y является С-Ме, Z является СН, и R7 и R8, оба являются Н. В еще одном альтернативном предпочтительном варианте осуществления Y и Z представляют собой СН, R7 является Н, и R8 является Ме.
В одном из предпочтительных вариантов осуществления настоящего изобретения Z является N. Предпочтительно для данного варианта осуществления, Х является СН, Y представляет собой С-Ме, R7 является Ме, и R8 является Н.
В другом предпочтительном варианте осуществления настоящего изобретения R6 представляет собой циклопропиламино, циклопропилметиламино, циклобутиламино или циклобутилметиламино.
В другом предпочтительном варианте осуществления настоящего изобретения R5 является изопропилом.
В одном из самых предпочтительных вариантов осуществления соединение настоящего изобретения выбирают из следующего:
| [1] | (2R,3S-3-(6-((4,6-диметилпиридин-3-илметиламино)-9-изопропил-9Н-пурин-2-иламино)пентан-2-ол |
| [2] | 2R,3S-3-(9-изопропил-6-((6-метилпиридин-3-ил)метиламино)-9Н-пурин-2-иламино)пентан-2-ол |
| [6] | 2R,3S-3-(6-циклопропиламино)-9-изопропил-9Н-пурин-2-иламино)пентан-2-ол |
| [7] | 2R,3S-3-(6-(циклопропилметиламино)-9-изопропил-9Н-пурин-2-иламино)пентан-2-ол |
| [8] | 2R,3S-3-(6-(циклобутиламино)-9-изопропил-9Н-пурин-2-иламино)пентан-2-ол |
| [10] | 2R,3S-3-(9-изопропил-6-(2,6-диметилпиридин-4-илметиламино)-9Н-пурин-2-иламино)пентан-2-ол |
| [11] | 2R,3S-3-(9-изопропил-6-((6-трифторметил)пиридин-3-ил)метиламино)-9Н-пурин-2-иламино)пентан-2-ол |
| [12] | 2R,3S-3-(9-изопропил-6-((6-метилпиридин-2-ил)метиламино)-9Н-пурин-2-иламино)пентан-2-ол |
| [13] | 2R,3S-3-(9-изопропил-6-((3-метилпиридин-2-ил)метиламино)-9Н-пурин-2-иламино)пентан-2-ол |
| [15] | 1,1,1-трифтор-3-(9-изопропил-6-(пиридин-3-илметиламино)-9Н-пурин-2-иламино)пропан-2-ол |
| [16] | 1,1,1-трифтор-3-(9-изопропил-6-(пиридин-3-илметиламино)-9Н-пурин-2-иламино)пентан-2-ол |
| [17] | 1,1,1-трифтор-3-(9-изопропил-6-((6-(трифторметил)пиридин-3-ил)метиламино)-9Н-2-иламино)пентан-2-ол |
| [18] | 1,1,1,3,3,3-гексафтор-2-((9-изопропил-6-(пиридин-3-илметиламино)-9Н-пурин-2-иламино)метил)пропан-2-ол |
Другой аспект настоящего изобретения относится к соединению формулы II или его фармацевтически приемлемой соли
где:
по меньшей мере один из R1', R2', R3' и R4' является галогеналкилом, и остальные, каждый независимо, представляет собой Н, алкил или галогеналкил;
R5' представляет собой алкил или циклоалкил, или циклоалкилалкил, каждый из которых может быть необязательно замещен одной или более OH группами;
R6' выбран из циклопропиламино, циклопропилметиламино, циклобутиламино, циклобутилметиламино и
где Х', Y' и Z', каждый независимо, представляет собой CR9', или один из Х', Y' и Z' является N, и остальные представляют собой CR9'; и
R7', R8' и каждый R9' независимо представляют собой Н, галоген, алкил или галогеналкил.
Предпочтительно, в данном аспекте настоящего изобретения R5' представляет собой изопропил.
Предпочтительно, в данном аспекте настоящего изобретения R6' представляет собой
В одном из предпочтительных вариантов осуществления Y' является N, Х' и Z' представляют собой СН, и R7' и R8', оба являются Н.
В другом предпочтительном варианте осуществления настоящего изобретения один из R1' и R2' является Н, и другой является алкилом, или R1' и R2', оба являются Н.
В другом предпочтительном варианте осуществления настоящего изобретения один из R3' и R4' является Н, и другой является CF3.
В одном из самых предпочтительных вариантов осуществления соединение настоящего изобретения выбирают из следующего:
| [15] | 1,1,1-трифтор-3-(9-изопропил-6-(пиридин-3-илметиламино)-9Н-пурин-2-иламино)пропан-2-ол |
| [16] | 1,1,1-трифтор-3-(9-изопропил-6-(пиридин-3-илметиламино)-9Н-пурин-2-иламино)пентан-2-ол |
| [18] | 1,1,1,3,3,3-гексафтор-2-((9-изопропил-6-(пиридин-3-илметиламино)-9Н-пурин-2-иламино)метил)пропан-2-ол |
В дополнительном аспекте настоящее изобретение относится к соединению, выбранному из следующего:
| [1] | (2R,3S-3-(6-((4,6-диметилпиридин-3-илметиламино)-9-изопропил-9Н-пурин-2-иламино)пентан-2-ол |
| [2] | 2R,3S-3-(9-изопропил-6-((6-метилпиридин-3-ил)метиламино)-9Н-пурин-2-иламино)пентан-2-ол |
| [3] | (2R,3S-3-(6-(3-хлорбензиламино)-9-изопропил-9Н-пурин-2-иламино)пентан-2-ол |
| [4] | (2R,3S-3-(6-(3-фторбензиламино)-9-изопропил-9Н-пурин-2-иламино)пентан-2-ол |
| [5] | 2R,3S-3-(9-(циклопропилметил)-6-(пиридин-3-илметиламино)-9Н-пурин-2-иламино)пентан-2-ол |
| [6] | 2R,3S-3-(6-циклопропиламино)-9-изопропил-9Н-пурин-2-иламино)пентан-2-ол |
| [7] | 2R,3S-3-(6-(циклопропилметиламино)-9-изопропил-9Н-пурин-2-иламино)пентан-2-ол |
| [8] | 2R,3S-3-(6-(циклобутиламино)-9-изопропил-9Н-пурин-2-иламино)пентан-2-ол |
| [9] | 2R,3S-3-(9-изопропил-6-(пиридин-4-илметиламино)-9Н-пурин-2-иламино)пентан-2-ол |
| [10] | 2R,3S-3-(9-изопропил-6-(2,6-диметилпиридин-4-илметиламино)-9Н-пурин-2-иламино)пентан-2-ол |
| [11] | 2R,3S-3-(9-изопропил-6-((6-трифторметил)пиридин-3-ил)метиламино)-9Н-пурин-2-иламино)пентан-2-ол |
| [12] | 2R,3S-3-(9-изопропил-6-((6-метилпиридин-2-ил)метиламино)-9Н-пурин-2-иламино)пентан-2-ол |
| [13] | 2R,3S-3-(9-изопропил-6-((3-метилпиридин-2-ил)метиламино)-9Н-пурин-2-иламино)пентан-2-ол |
| [14] | (R)-1-(9-изопропил-6-(пиридин-3-илметиламино)-9Н-пурин-2-иламино)пропан-2-ол |
| [15] | 1,1,1-трифтор-3-(9-изопропил-6-(пиридин-3-илметиламино)-9Н-пурин-2-иламино)пропан-2-ол |
| [16] | 1,1,1-трифтор-3-(9-изопропил-6-(пиридин-3-илметиламино)-9Н-пурин-2-иламино)пентан-2-ол |
| [17] | 1,1,1-трифтор-3-(9-изопропил-6-((6-(трифторметил)пиридин-3-ил)метиламино)-9Н-2-иламино)пентан-2-ол |
| [18] | 1,1,1,3,3,3-гексафтор-2-((9-изопропил-6-(пиридин-3-илметиламино)-9Н-пурин-2-иламино)метил)пропан-2-ол |
В одном из особенно предпочтительных вариантов осуществления соединение настоящего изобретения выбирают из следующего:
| [3] | (2R,3S-3-(6-(3-хлорбензиламино)-9-изопропил-9Н-пурин-2-иламино)пентан-2-ол |
| [4] | (2R,3S-3-(6-(3-фторбензиламино)-9-изопропил-9Н-пурин-2-иламино)пентан-2-ол |
| [5] | 2R,3S-3-(9-(йиклопропилметил)-6-(пиридин-3-илметиламино)-9Н-пурин-2-иламино)пентан-2-ол |
| [9] | 2R,3S-3-(9-изопропил-6-(пиридин-4-илметиламино)-9Н-пурин-2-иламино)пентан-2-ол |
| [14] | (R)-1-(9-изопропил-6-(пиридин-3-илметиламино)-9Н-пурин-2-иламино)пропан-2-ол |
В одном особенно предпочтительном варианте осуществления настоящего изобретения соединение выбирают из соединений [1], [3], [4], [6], [7], [8], [9], [10] и [11]. Более предпочтительно, данное соединение выбирают из соединений [1], [3], [4], [6] и [11], еще более предпочтительно, когда данным соединением является соединение [1] или [11].
Предпочтительно, соединение настоящего изобретения проявляет по меньшей мере 3-кратное повышение активности по сравнению с селициклибом, более предпочтительно, по меньшей мере 4-кратное или 5-кратное повышение активности, еще более предпочтительно, по меньшей мере 8-кратное или 10-кратное повышение активности.
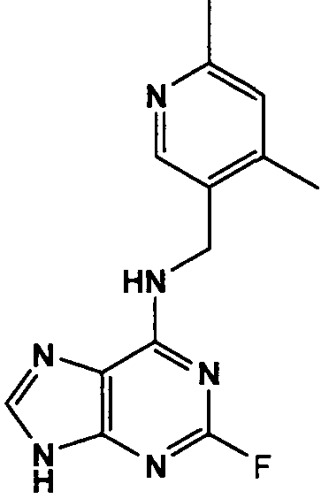
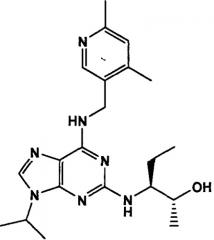
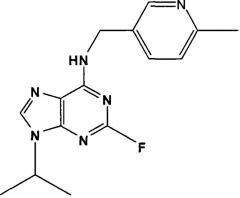
В одном особенно предпочтительном варианте осуществления настоящего изобретения данным соединением является (2R,3S-3-(6-((4,6-диметилпиридин-3-илметиламино)-9-изопропил-9Н-пурин-2-иламино)пентан-2-ол [1] или его фармацевтически приемлемые соль или сложный эфир.
Преимущественно, соединение [1] проявляет неожиданно высокую активность в анализах на клеточную токсичность в ряде различных клеточных линий по сравнению со структурно родственными соединениями, известными специалистам в данной области. Дополнительные детали данных анализов представлены в сопровождающих примерах (см., в частности, таблицу 8).
Кроме того, эксперименты показали, что в отличие от структурно родственных соединений, известных специалистам в данной области, соединение [1] не ингибирует значительно CYP3A4. А также, указанные анализы описаны более подробно в сопровождающих примерах (см., в частности, таблицу 5). Разумеется, соединение [1], как видно, не ингибирует CYP3A4 до концентраций более 20 мкМ, что составляет ~60-кратную его клеточную IC50. Так как значение IC50 для ингибирования CYP3A4 для ингибирования соединением [1] значительно выше его клеточной IC50 (см. таблицу 8), это показывает, что при цитотоксических концентрациях в данном случае не должно быть воздействия на активность CYP3A4. Это важно, так как CYP3A4 участвует в метаболизме большого числа лекарственных средств. Если CYP3A4 ингибируется одним лекарственным средством, это может привести к неожиданной токсичности из-за сниженного метаболизма субстратов CYP3A4, приводя, тем самым, к заметно повышенным уровням таких средств.
Подобным образом, дополнительные эксперименты показали, что в отличие от его структурно родственных аналогов соединение [1] не является субстратом для шести испытанных изоформ CYP (см., в частности, таблицу 6). Это различие вполне соответствует наблюдаемому различию в ингибировании CYP, обсужденному выше. Обычный механизм, приводящий к ингибированию CYP, проявляется, если данное соединение является также субстратом для данной CYP.
Соответственно, соединение [1] не является ни субстратом для CYP3A4, ни ингибитором CYP3A4, что придает важное, неожиданное полезное свойство, по сравнению с его структурно родственными аналогами.
Фармацевтические композиции
Второй аспект настоящего изобретения относится к фармацевтической композиции, содержащей соединение настоящего изобретения в смеси с фармацевтически приемлемым разбавителем, эксципиентом или носителем, или их смесью. Хотя соединения настоящего изобретения (включая их фармацевтически приемлемые соли, сложные эфиры и фармацевтически приемлемые сольваты) можно вводить отдельно, они будут обычно применяться в смеси с фармацевтическим носителем, эксципиентом или разбавителем, особенно для лечения людей. Фармацевтические композиции могут быть предназначены для применения на людях или животных в медицине или ветеринарии.
Примеры таких подходящих эксципиентов для различных форм фармацевтических композиций, описанных в данном описании, можно найти в «Handbook of Pharmaceutical Excipients», 2nd Edition, (1994), edited by A. Wade and P.J. Weller.
Приемлемые носители или разбавители для терапевтического применения хорошо известны специалистам в фармацевтической области и описаны, например, в Remington's Pharmaceutical Sciences, Mack Publishing Co. (A.R. Gennaro edit. 1985).
Примеры подходящих носителей включают лактозу, крахмал, глюкозу, метил, целлюлозу, стеарат магния, манит, сорбит и тому подобное. Примеры подходящих разбавителей включают этанол, глицерин и воду.
Выбор фармацевтического носителя, эксципиента или разбавителя может быть сделан в соответствии с предназначенным путем введения и единичной фармацевтической практикой. Фармацевтические композиции могут содержать в качестве носителя, эксципиента или разбавителя или в дополнение к ним любые подходящие связующее(ие) вещество(а), лубрикант(ы), суспендирующее(ие) вещество(а), вещество(а) для покрытия и солюбилизирующее(ие) вещество(а).
Примеры подходящих связующих веществ включают крахмал, желатин, природные сахара, такие как глюкоза, безводная лактоза, свободно текучая лактоза, бета-лактоза, сахаристые вещества из кукурузы, природные и синтетические камеди, такие как камедь акации, трагакант или альгинат натрия, карбоксиметилцеллюлозу и полиэтиленгликоль.
Примеры подходящих лубрикантов включают олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и тому подобное.
В фармацевтической композиции могут быть представлены консерванты, стабилизаторы, красители и маскирующие улучшающие вкус и запах вещества. Примеры консервантов включают бензоат натрия, сорбиновую кислоту и сложные эфиры п-гидроксибензойной кислоты. Могут также использоваться антиоксиданты и суспендирующие средства.
Соли/сложные эфиры
Соединения настоящего изобретения могут быть представлены в виде солей или сложных эфиров, в частности, фармацевтически приемлемых солей или сложных эфиров.
Фармацевтически приемлемые соли соединений настоящего изобретения включают их подходящие аддитивные соли кислот или оснований. Обзор подходящих фармацевтических солей можно найти у Berge et al., J. Pharm. Sci., 66, 1-19 (1977). Соли образуются, например, с сильными неорганическими кислотами, такими как минеральные кислоты, например, серная кислота, фосфорная кислота или галогенводородная кислота; с сильными органическими карбоновыми кислотами, такими как алканкарбоновые кислоты с 1-4 атомами углерода, которые являются незамещенными или замещены (например, галогеном), такими как уксусная кислота; с насыщенными или ненасыщенными дикарбоновыми кислотами, например, щавелевой, малоновой, янтарной, малеиновой, фумаровой, фталевой или тетрафталевой; с гидроксикарбоновыми кислотами, например, аскорбиновой, гликолевой, молочной, яблочной, винной или лимонной; с аминокислотами, например, аспарагиновой или глутаминовой; с бензойной кислотой или с органическими сульфоновыми кислотами, такими как (С1-С4)алкил- или арилсульфоновыми кислотами, которые являются незамещенными или замещены (например, галогеном), такими как метан- или п-толуолсульфоновая кислота. Сложные эфиры образуются или с использованием органических кислот, или спиртов/гидроксидов, в зависимости от функциональной группы, которую нужно этерифицировать. Органические кислоты включают карбоновые кислоты, такие как алканкарбоновые кислоты из 1-12 атомов углерода, которые являются незамещенными или замещены (например, галогеном), такие как уксусная кислота; с насыщенной или ненасыщенной дикарбоновой кислотой, например, щавелевой, малоновой, янтарной, малеиновой, фумаровой, фталевой или тетрафталевой; с гидроксикарбоновыми кислотами, например, аскорбиновой, гликолевой, молочной, яблочной, винной или лимонной кислотой; с аминокислотами, например, аспарагиновой или глутаминовой кислотой; с бензойной кислотой; или с органическими сульфоновыми кислотами, такими как (С1-С4)алкил- или арилсульфоновые кислоты, которые являются незамещенными или замещены (например, галогеном), такими как метан- или п-толуолсульфоновой кислотой. Подходящие гидроксиды включают неорганические гидроксиды, такие как гидроксид натрия, гидроксид калия, гидроксид кальция, гидроксид алюминия. Спирты включают алкановые спирты из 1-12 атомов углерода, которые могут быть незамещенными или замещены, например, галогеном.
Энантиомеры/таутомеры
Во всех аспектах настоящего изобретения, обсужденных выше, настоящее изобретение включает, где это приемлемо, все энантиомеры и таутомеры соединений настоящего изобретения. Специалист в данной области сможет распознать соединения, которые обладают оптическими свойствами (один или более хиральных атомов углерода) или таутомерными характеристиками. Соответствующие энантиомеры и/или таутомеры могут быть выделены или получены методами, известными специалистам в данной области.
Стерео и геометрические изомеры
Некоторые из соединений настоящего изобретения могут существовать в виде стереоизомеров и/или геометрических изомеров, например, они могут иметь один или более асимметрических и/или геометрических центров, и поэтому могут существовать в двух или более стереоизомерных и/или геометрических формах. Данным изобретением предполагается использование всех отдельных стереоизомеров и геометрических изомеров таких ингибирующих агентов и их смесей. Термины, использованные в формуле изобретения, охватывают все такие формы, при условии, что указанные формы сохраняют соответствующую функциональную активность (хотя необязательно в такой же степени).
Настоящее изобретение включает также все подходящие изотопные вариации данного вещества или его фармацевтически приемлемой соли. Изотопная вариация средства настоящего изобретения или его фармацевтически приемлемой соли определяется как вариация, в которой по меньшей мере один атом заменен атомом, имеющим тот же самый атомный номер, но атомную массу, отличающуюся от атомной массы, обычно обнаруживаемой в природе. Примеры изотопов, которые могут включаться в данное вещество и его фармацевтически приемлемые соли, включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора и хлора, такие как 2Н, 3Н, 13С, 14С, 15N, 17O, 18O, 31P, 32P, 35S, 18F и 36Cl, соответственно. Некоторые изотопные вариации данного средства и их фармацевтически приемлемых солей, например, которые включают радиоактивный изотоп, такой как 3Н или 14С, могут применяться в лекарственном средстве и/или для анализа распределения субстрата в тканях. Тритированные, т.е. 3Н, и с углеродом-14, т.е. 14С, изотопы особенно предпочтительны из-за их легкого получения и детектирования. Кроме того, замена изотопами, такими как дейтерий, т.е. 2Н, могут давать некоторые терапевтические преимущества в результате большей метаболической стабильности, например, повышенного периода полувыведения in vivo или сниженных требований к дозе, и следовательно могут быть предпочтительными в некоторых обстоятельствах. Изотопные вариации соединения настоящего изобретения и фармацевтически приемлемых солей настоящего изобретения обычно можно получить по общепринятым методикам с использованием соответствующих изотопных вариантов подходящих реагентов.
Сольваты
Настоящее изобретение включает также сольватированные формы соединений настоящего изобретения. Термины, использованные в формуле изобретения, охватывают все такие формы.
Полиморфы
Настоящее изобретение, кроме того, относится к соединениям настоящего изобретения в их различных кристаллических формах, полиморфных формах и (без)водных формах. В фармацевтической промышленности хорошо установлено, что химические соединения могут быть выделены в любой из таких форм путем небольшого изменения метода очистки и/или выделения из растворителей, используемых в синтетическом препарате таких соединений.
Пролекарства
Настоящее изобретение, кроме того, включает соединения настоящего изобретения в форме пролекарства. Такие пролекарства обычно являются соединениями настоящего изобретения, у которых одна или более соответствующих групп модифицированы таким образом, что модификация может быть обратима при введении человеку или млекопитающему. Такая обратимость обычно производится с помощью фермента, присутствующего у такого субъекта, хотя возможно введение второго средства вместе с таким пролекарством, чтобы произвести это превращение in vivo. Примеры таких модификаций включают сложный эфир (например, любой из тех, которые описаны выше), причем превращение может быть осуществлено эстеразой и т.д. Другие такие системы хорошо известны специалистам в данной области.
Введение
Фармацевтическая композиция настоящего изобретения может быть адаптирована для перорального, ректального, вагинального, парентерального, внутримышечного, внутрибрюшинного, интратекального, интрабронхиального, подкожного, внутрикожного, внутривенного, назального, защечного или подъязычного путей введения.
Для перорального введения, в частности, используют прессованные таблетки, пилюли, таблетки, пилюли с гелем, капли и капсулы. Предпочтительно, данные композиции содержат от 1 до 250 мг, и более предпочтительно, от 10 до 100 мг активного ингредиента на дозу.
Другие формы для введения включают растворы или эмульсии, которые можно вводить путем инъекции внутривенно, внутриартериально, интратекально, подкожно, внутрикожно, внутрибрюшинно или внутримышечно, и которые готовят из стерильных или стерилизованных растворов. Фармацевтические композиции настоящего изобретения также могут быть в форме суппозиториев, пессариев, суспензий, эмульсий, лосьонов, мазей, кремов, гелей, препаратов аэрозолей, растворов и присыпок.
Альтернативные средства трансдермального введения представлены использованием кожного пластыря. Например, активный ингредиент может быть включен в крем, состоящий из водной эмульсии полиэтиленгликолей или вазелинового масла. Активный ингредиент может быть также включен в концентрации от 1 до 10% по массе в мазь, состоящую из основы из отбеленного пчелиного воска или белого вазелина вместе с такими стабилизаторами и консервантами, которые могут быть необходимы.
Инъекционные формы могут содержать от 10 до 1000 мг, предпочтительно от 10 до 250 мг активного ингредиента на дозу.
Композиции могут быть изготовлены в единичной дозированной форме, например, в форме отдельных порций, содержащих единичную дозу, или в виде множественных или разделенных доз единичной дозы.
Дозировка
Специалист в данной области может легко определить соответствующую дозу одной из настоящих композиций для введения пациенту без ненужного экспериментирования. Обычно врач определяет действующую дозу, которая будет наиболее подходящей для конкретного пациента, и она будет зависеть от ряда факторов, включая активность конкретного применяемого соединения, метаболическую стабильность и продолжительность действия данного соединения, возраст, массу тела, общее состояние здоровья, пол, диету, способ и время введения, скорость выведения, комбинацию лекарственных средств, тяжесть конкретного состояния и индивидуальную применяемую терапию. Дозировки, описанные в данном описании, являются примерами для обычного случая. Разумеется, могут быть индивидуальные примеры, когда показаны более высокие или более низкие интервалы доз, и такие случаи охватываются объемом настоящего изобретения.
В зависимости от потребности средство можно вводить в дозе от 0,01 до 30 мг/кг массы тела, такой как от 0,1 до 10 мг/кг, более предпочтительно, от 0,1 до 1 мг/кг массы тела.
В конкретном примере варианта осуществления одна или более доз от 10 мг до 150 мг/сутки будут вводиться пациенту для лечения злокачественного новообразования.
Терапевтическое применение
Соединения настоящего изобретения, как обнаружено, обладают антипролиферативной активностью, и поэтому, как полагают, будут полезны при лечении пролиферативных заболеваний, таких как различные типы рака, лейкемии и другие заболевания, связанные с нерегулируемой клеточной пролиферацией, таких как псориаз и рестеноз.
Как определено в данном описании, антипролиферативный эффект в соответствии с объемом настоящего изобретения может быть продемонстрирован способностью ингибировать пролиферацию клеток анализом in vitro на целых клетках, например, с использованием любой из клеточных линий А549, HeLa, HT-29, MCF7, Saos-2, CCRF-CEM, H460, HL-60 и K-562, или путем демонстрации ингибирования киназы при соответствующем анализе. Такие анализы, включая способы их выполнения, описаны более подробно в сопровождающих примерах. Применением таких анализов можно определить, является ли соединение антипролиферативным в контексте настоящего изобретения.
Один предпочтительный вариант осуществления настоящего изобретения поэтому относится к применению одного или более соединений настоящего изобретения для получения лекарственного средства для лечения пролиферативного заболевания.
В соответствии с описанием фраза «получение лекарственного средства» включает применение соединения настоящего изобретения непосредственно в качестве лекарственного средства в дополнение к его применению в программе отбора на терапевтические средства в дальнейшем или на любой стадии производства такого лекарственного средства.
Термин «пролиферативное заболевание» использован в данном описании в широком смысле, так что включает любое заболевание, которое требует контроля над клеточным циклом, например, сердечно-сосудистые заболевания, такие как рестеноз и кардиомиопатия, аутоиммунные заболевания, такие как гломерулонефрит и ревматоидный артрит, дерматологические заболевания, такие как псориаз, грибковые, паразитарные заболевания, такие как малярия, эмфизема и облысение. При данных заболеваниях соединения настоящего изобретения могут вызывать апоптоз или поддерживать стаз в желаемых клетках, когда необходимо. Предпочтительно, пролиферативное заболевание представляет собой рак или лейкемию.
В другом предпочтительном варианте осуществления пролиферативным заболеванием является псориаз.
Соединения настоящего изобретения могут ингибировать любой из этапов или любых стадий в клеточном цикле, например, образование ядерной оболочки, выход из фазы покоя клеточного цикла (G0), G1 развитие, разрыхление хромосомы, разрыв ядерной оболочки, СТАРТ, инициация репликации ДНК, развитие репликации ДНК, терминация репликации ДНК, дупликация центросомы, развитие G2, активация митотических или мейтических функций, конденсация хромосомы, разделение центросомы, нуклеация микротрубочек, образование и функционирование веретена, взаимодействие с моторными белками микротрубочек, хроматидное разделение и расщепление, инактивация митотических функций, образование сократительного кольца и функций цитокинеза. В частности, соединения настоящего изобретения могут влиять на некоторые функции генов, такие как связывание хроматина, образование комплексов репликации, лицензирование репликации, фосфорилирование или другая активность вторичной модификации, протеолитическое разложение, связывание с микротрубочками, связывание актина, связывание септина, активность нуклеации организующего микротрубочки центра и связывание компонентов сигнальных путей клеточного цикла.
Д