Гуманизированные моноклональные антитела к фактору роста гепатоцитов
Иллюстрации
Показать всеНастоящее изобретение относится к иммунологии. Предложены варианты гуманизированного моноклонального антитела против фактора роста гепатоцитов. Описана клеточная линия, продуцирующая антитело. Предложены фармацевтическая композиция и способ лечения опухолей на основе антитела, а также применение антитела для производства лекарственного средства для лечения злокачественной опухоли. Использование изобретения обеспечивает новое нейтрализующее антитело против фактора роста гепатоцитов, что может найти применение в лечении рака человека. 5 н. и 3 з.п. ф-лы, 8 ил., 1 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Настоящая заявка является непредварительной заявкой USSN 60/788243, поданной 1 апреля 2006 года, которая включена в качестве ссылки в полном объеме для любых целей.
УКАЗАНИЕ НА ЗАИНТЕРЕСОВАННОСТЬ ПРАВИТЕЛЬСТВА
Работа, описанная в этой заявке, была частично финансирована по Гранту 2R44CA101283-02 Национальным Институтом здоровья. Правительство США имеет определенные права на данное изобретение.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится главным образом к сочетанию технологий моноклональных антител (mAb) и рекомбинантных ДНК для разработки новых биологических препаратов и, более конкретно, например, для получения гуманизированных моноклональных антител, которые связывают и нейтрализуют фактор роста гепатоцитов.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Фактор роста гепатоцитов человека (HGF) представляет собой многофункциональный гетеродимерный полипептид, продуцируемый мезенхимными клетками. Было показано, что HGF стимулирует ангиогенез, морфогенез и мотогенез, а также рост и распределение различных типов клеток (Bussolino et al., J. Cell. Biol. 119: 629, 1992; Zarnegar and Michalopoulos, J. Cell. Biol. 129:1177, 1995; Matsumoto et al., Ciba. Found. Symp. 212:198, 1997; Birchmeier and Gherardi, Trends Cell. Biol. 8:404, 1998; Xin et al. Am. J. Pathol. 158:1111, 2001). Плейотропные виды активности HGF опосредуются его рецептором, трансмембранной тирозинкиназой, кодируемой протоонкогеном cMet. Было показано, что в дополнение к регуляции множества нормальных клеточных функций HGF и его рецептор c-Met вовлечены в инициацию, инвазию и метастазирование опухолей (Jeffers et al., J. Mol. Med. 74:505, 1996; Comoglio и Trusolino, J. Clin. Invest. 109:857, 2002). HGF/cMet коэкспрессируются, часто сверхэкспрессируются, на различных солидных опухолях, включая опухоли, образованные из ткани легкого, толстого кишечника, прямой кишки, желудка, почки, яичника, кожи, множественной миеломы и щитовидной железы (Prat et al., Int. J. Cancer 49:323, 1991; Chan et al., Oncogene 2:593, 1988; Weidner et al., Am. J. Respir. Cell. Mol. Biol. 8:229, 1993; Derksen et al., Blood 99:1405, 2002). HGF действует в качестве аутокринного (Rong et al., Proc. Natl. Acad. Sci. USA 91 :4731, 1994; Koochekpour et al., Cancer Res. 57:5391, 1997) и паракринного фактора роста (Weidner et al., Am. J. Respir. Cell. Mol. Biol. 8:229, 1993) и антиапоптотического регулятора (Gao et al., J. Biol. Chem. 276:47257, 2001) для этих опухолей.
HGF представляет собой белок массой 102 кДа со сходством последовательности и структуры с плазминогеном и другими ферментами свертывания крови (Nakamura et al., Nature 342:440, 1989; Weidner et al., Am. J. Respir. Cell. Mol. Biol. 8:229, 1993). HGF человека синтезируется в качестве предшественника из 728 аминокислот (препроHGF), который подвергается внутриклеточному расщеплению до неактивной одноцепочечной формы (проHGF) (Nakamura et al., Nature 342:440, 1989; Rosen et al., J. Cell. Biol. 127:1783, 1994). При внеклеточной секреции проHGF расщепляется с образованием биологически активной связанной дисульфидной связью гетеродимерной молекулы, состоящей из α-субъединицы и β-субъединицы (Nakamura et al., Nature 342:440, 1989; Naldini et al., EMBO J. 11:4825, 1992). α-Субъединица содержит 440 остатков (69 кДа с гликозилированием), состоящих из N-концевого шпилечного домена и четырех kringle-доменов. β-Субъединица содержит 234 остатка (34 кДа) и обладает подобным сериновой протеазе доменом, который лишен протеолитической активности. HGF имеет два уникальных клеточно-специфичных участков связывания: высокоаффинный (Kd = 2 × 10-10 M) участок связывания для рецептора cMet и низкоаффинный (Kd = 10-9 M) участок связывания для гепаринсульфатных протеогликанов (HSPG), которые находятся на клеточной поверхности и во внеклеточном матриксе (Naldini et al., Oncogene 6:501, 1991; Bardelli et al., J. Biotechnol. 37:109, 1994; Sakata et al., J. Biol. Chem., 272:9457, 1997).
Рецептор cMet является членом IV класса семейства белковых тирозинкиназных рецепторов. Полноразмерный ген cMet был клонирован и идентифицирован в качестве протоонкогена cMet (Cooper et al., Nature 311:29, 1984; Park et al., Proc. Natl. Acad. Sci. USA 84:6379, 1987). NK2 (белок, охватывающий N-конец и первые два kringle-домена α-субъединицы) является достаточным для связывания с cMet и активации каскада передачи сигнала для подвижности, однако для митогенного ответа требуется полноразмерный белок (Weidner et al., Am. J. Respir. Cell. Mol. Biol. 8:229, 1993). HSPG связывается с HGF посредством взаимодействия с N-концом HGF.
Было описано, что HGF/cMet играют важную роль в нескольких аспектах развития злокачественной опухоли, таких как инициация, инвазия и метастазирование опухоли, регуляция апоптоза и ангиогенеза. Было исследовано несколько различных подходов для получения эффективной молекулы-антагониста: укороченные белки HGF, такие как NK1 (N-концевой домен плюс kringle-домен 1; Lokker et al., J. Biol. Chem. 268:17145, 1993), NK2 (N-концевой домен плюс kringle-домены 1 и 2; Chan et al., Science 254:1382, 1991) и NK4 (N-концевой домен плюс четыре kringle-домена; Kuba et al., Cancer Res. 60:6737, 2000), mAb против cMet (Dodge, Master's Thesis, San Francisco State University, 1998) и mAb против HGF (Cao et al., Proc. Natl. Acad. Sci. USA 98:7443, 2001, которая включена в настоящий документ в качестве ссылки).
NK1 и NK2 могут эффективно конкурировать за связывание HGF с его рецептором, однако было описано, что они обладают частичными агонистическими видами активности in vitro (Cioce et al., J. Biol. Chem. 271 :13110, 1996; Schwall et al., J. Cell Biol. 133:709, 1996), а не чисто антагонистическими видами активности, как желательно. Позднее Kuba et al., Cancer Res. 60:6737, 2000, описали, что NK4 может частично ингибировать первичный рост и метастазирование опухоли LLC легкого в модели на голых мышах (nude) при постоянной инфузии NK4. Однако тот факт, что NK4 необходимо вводить постоянно для достижения частичного ингибирования первичных опухолей, указывает на потенциально короткое время полужизни молекулы NK4 и/или отсутствие эффективности.
Cao et al., Proc. Natl. Acad. Sci. USA 98:7443, 2001, описали, что введение коктейля из трех mAb против HGF, которые были выбраны по их способности ингибировать активность HGF в отношении распространения in vitro, было способно ингибировать рост опухолей человека в модели ксенотрансплантации на мышах nude. Они предположили, что для ингибирования видов биологической активности HGF in vivo необходимо три mAb, распознающих три различных участка связывания на HGF: два mAb ингибировали связывание HGF с cMet, и одно mAb ингибировало связывание HGF с гепарином.
Недавно были описаны mAb человека, которые отдельно связывают и нейтрализуют HGF и которые разработаны с использованием технологии трансгенных мышей (Burgess et al., WO 2005/017107 A2 и Burgess et al., Cancer Res 66:1721, 2006, все из которых включены в настоящий документ в качестве ссылок для любых целей). Однако из них, по меньшей мере mAb 2.12.1, которое, очевидно, являлось наиболее эффективным в моделях ксенотрансплантатов опухолей, тем не менее, не ингибировало ангиогенез. Было разработано mAb мыши L2G7, которое нейтрализует все тестированные виды биологической активности HGF, включая ангиогенез (патентная заявка USSN 10/917915, поданная 13 августа 2004 года, и Kim et al. Clin Cancer Res 12:1292, 2006, все из которых включены в настоящий документ в качестве ссылок для любых целей).
Таким образом, существует необходимость в гуманизированном моноклональном антителе, которое блокирует биологическую активность HGF in vitro и in vivo. Настоящее изобретение удовлетворяет этой и другим потребностям.
СУЩНОСТЬ ЗАЯВЛЕННОГО ИЗОБРЕТЕНИЯ
В одном варианте осуществления данное изобретение относится к гуманизированному нейтрализующему mAb против фактора роста гепатоцитов человека (HGF). MAb ингибирует по меньшей мере один и предпочтительно несколько или все виды биологической активности HGF, включая связывание с его рецептором cMet, индукцию распространения клеток, таких как клетки почки собаки Madin-Darby, индукцию пролиферации эпителиальных клеток легкого норки Mv 1 Lu, и/или гепатоцитов, и/или HUVEC и стимуляцию ангиогенеза. Предпочтительное гуманизированное mAb против HGF ингибирует, наиболее предпочтительно полностью ингибирует рост ксенотрансплантата опухоли человека в мыши. В предпочтительном варианте осуществления гуманизированное mAb представляет собой гуманизированное mAb L2G7. В особенно предпочтительном варианте осуществления вариабельные области тяжелой и легкой цепей mAb имеют последовательности, представленные на строках, обозначенных HuL2G7 на фиг.2A и фиг.2B соответственно или последовательностями, которые по меньшей мере на 90% или более идентичны им. В другом варианте осуществления данное изобретение относится к гуманизированному моноклональному антителу (mAb), которое связывает и нейтрализует фактор роста гепатоцитов человека (HGF), при этом гуманизированное антитело содержит гуманизированные тяжелую и легкую цепи. Гуманизированная тяжелая цепь содержит CDR из L2G7 и каркасного участка вариабельной области тяжелой цепи человека, при условии, что по меньшей мере одно положение каркасного участка вариабельной области тяжелой цепи человека, выбранное из группы, состоящей из Н29, Н30, Н48, Н66, Н67, Н71, Н94, занимает аминокислота, занимающая соответствующее положение в тяжелой цепи L2G7. Гуманизированная легкая цепь содержит CDR из L2G7 и каркасный участок вариабельной области легкой цепи человека, при условии, что по меньшей мере одно положение, выбранное из группы, состоящей из L3 и L60, занято аминокислотой, занимающей соответствующее положение в легкой цепи L2G7.
Также предусмотрены клеточные линии, продуцирующие такие гуманизированные антитела. В другом варианте осуществления предусмотрена фармацевтическая композиция, содержащая гуманизированное mAb L2G7. В третьем варианте осуществления фармацевтическую композицию вводят пациенту (как правило, пациенту-человеку) для лечения злокачественной опухоли или другого заболевания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1. Аминокислотные последовательности зрелых вариабельных областей тяжелой цепи (A) (SEQ ID NO: 2) и легкой цепи (В) (SEQ ID NO: 3) L2G7, транслированные с клонированных кДНК. CDR подчеркнуты. Используется система нумерации Kabat.
Фигура 2. Показаны аминокислотные последовательности зрелых вариабельных областей тяжелой цепи (A) (SEQ ID NO: 5) и легкой цепи (В) (SEQ ID NO: 8) HuL2G7, выровненные с L2G7 (SEQ ID NO: 4 и 7) и акцепторными V-областями (SEQ ID NO: 6 и 9). CDR подчеркнуты в последовательностях L2G7, и аминокислоты, замещенные аминокислотами L2G7, подчеркнуты в последовательностях HuL2G7, при этом исходная аминокислота Н1Е подчеркнута двойной линией. Используется система нумерации Kabat.
Фигура 3. Аминокислотные последовательности полной тяжелой цепи (A) (SEQ ID NO: 10) и легкой цепи (В) (SEQ ID NO: 11) HuL2G7. Первые аминокислоты зрелых тяжелой и легкой цепей (т.е. после отщепления сигнальных последовательностей) подчеркнуты двойной линией и обозначены номером 1; эти аминокислоты также являются первыми аминокислотами зрелых V-областей. В тяжелой цепи первые аминокислоты областей СН1, шарнирной области, СН2 и СН3 подчеркнуты, и в легкой цепи первая аминокислота участка Ск подчеркнута.
Фигура 4. Конкурентный анализ связывания HuL2G7, ChL2G7 и L2G7 с HGF.
Фигура 5. Относительная способность HuL2G7, ChL2G7 и L2G7 блокировать связывание HGF с Met.
Фигура 6. Относительная способность HuL2G7 и L2G7 ингибировать индуцируемую HGF пролиферацию клеток Mv 1 Lu.
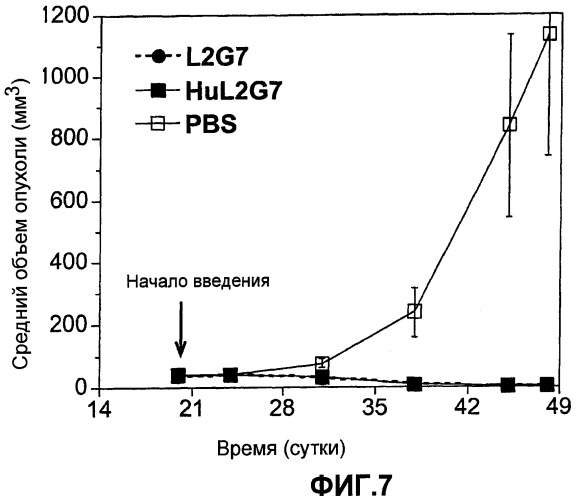
Фигура 7. Эффект лечения mAb HuL2G7 или L2G7 или контроля в виде PBS на рост подкожных ксенотрансплантатов U87 в группах мышей NIH III Beige/Nude. Стрелками указано начало инъекций, и планками погрешностей показаны стандартные ошибки среднего значения (s.e.m). Символы для L2G7 и HuL2G7 накладываются, и их нельзя отличить на фигуре.
Фигура 8. Эффект четырех различных уровней доз HuL2G7 на рост подкожных трансплантатов U87 в группах мышей NIH III Beige/Nude. Стрелкой указано начало инъекций, и планками погрешностей указано s.e.m.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Это изобретение относится к гуманизированным нейтрализующим моноклональным антителам против HGF, фармацевтическим композициям, содержащим их, и к способам их применения для лечения заболевания.
1. Антитела
Антитела представляют собой очень крупные комплексные молекулы (молекулярная масса ~150000 или приблизительно 1320 аминокислот) со сложной внутренней структурой. Природная молекула антитела содержит две идентичных пары полипептидных цепей, при этом каждая из цепей обладает одной легкой цепью и одной тяжелой цепью; таким образом, фундаментальная структурная единица антитела представляет собой тетрамер. Каждая легкая цепь и тяжелая цепь в свою очередь состоит из двух областей: вариабельной области ("V"), вовлеченной в связывание антигена-мишени, и константной области ("C"), которая взаимодействует с другими компонентами иммунной системы. Вариабельные области легкой и тяжелой цепей сворачиваются вместе в 3-мерном пространстве с образованием вариабельной области, которая связывает антиген (например, рецептор на поверхности клетки). В каждой вариабельной области легкой или тяжелой цепи существует три коротких сегмента (со средней длиной 10 аминокислот), называемых определяющими комплементарность областями ("CDR"). Шесть CDR в вариабельном домене антитела (три из легкой цепи и три из тяжелой цепи) сворачиваются вместе в 3-D-пространстве с образованием истинного антигенсвязывающего участка антитела, который захватывает антиген-мишень. Положение и длина CDR точно определены. См. Kabat, E. et al., Sequences of Proteins of Immunological Interest, U.S. Department of Health and Human Services, 1983, 1987, которые включены в настоящий документ в качестве ссылок. Часть вариабельной области, не находящуюся в CDR, называют каркасным участком, который образует окружение для CDR. В каждой цепи три CDR разделены четырьмя участками каркасных участков в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4.
Аминокислоты из вариабельных областей зрелой тяжелой и легкой цепей иммуноглобулинов обозначены Hx и Lx соответственно, где x представляет собой число, означающее положение аминокислоты в соответствии со схемой Kabat, представленной в цитируемой публикации. У Kabat приводится множество аминокислотных последовательностей для антител каждой подгруппы и указаны наиболее часто встречающиеся аминокислоты для каждого положения остатка в этой подгруппе, с образованием консенсусной последовательности. Kabat использует способ присвоения номера остатка каждой аминокислоте в приведенной последовательности, и этот способ присвоения номеров остатков стал стандартным в данной области. Схема Kabat распространяется и на другие, не включенные в его перечень, антитела путем выравнивания представляющего интерес антитела с одной из консенсусных последовательностей, указанных у Kabat, на основе консервативных аминокислот. Применение системы нумерации Kabat дает возможность легко идентифицировать аминокислоты в эквивалентных положениях в различных антителах. Например, аминокислота в положении L50 антитела человека занимает положение, эквивалентное положению аминокислоты L50 антитела мыши. Более того, любые две последовательности антител можно однозначно выравнивать, например для определения процентной идентичности, с использованием системы нумерации Kabat, так что каждая аминокислота в одной последовательности антитела выравнивается с аминокислотой другой последовательности с тем же номером, указанным у Kabat. После выравнивания область представляющего интерес антитела (например, полной зрелой вариабельной области тяжелой или легкой цепи) сравнивают с той же областью эталонного антитела, процентная идентичность последовательностей между областями представляющего интерес и эталонного антитела представляет собой количество положений, занятых одинаковыми аминокислотами в областях как представляющего интерес, так и эталонного антитела, деленное на общее количество выровненных положений двух областей, без подсчета разрывов, умноженное на 100 для преобразования в процентное количество.
Моноклональные антитело (mAb) представляет собой один молекулярный тип антитела и, таким образом, не включает в себя поликлональные антитела, получаемые путем инъекции животному (такому как грызуны, кролик или коза) антигена и извлечением сыворотки из организма животного. Гуманизированное антитело представляет собой полученное способами генетической инженерии (моноклональное) антитело, в котором CDR из мышиного антитела ("донорного антитела", которое также может представлять собой антитело крысы, хомяка или другого сходного вида) пересаживают в человеческое антитело ("акцепторное антитело"). Также гуманизированные антитела можно получать менее чем с полными CDR из мышиного антитела (например, Pascalis et al., J. Immunol. 169:3076, 2002). Наиболее часто в гуманизированное антитело из донорного антитела также переносят первую гипервариабельную петлю H1 тяжелой цепи, определяемую Chothia & Lesk, J. Mol. Biol. 196:901-917, 1987. Таким образом, гуманизированное антитело представляет собой антитело, имеющее CDR из донорного антитела и каркасные участки вариабельных областей и константные области из антител человека. Акцепторные каркасные участки легкой и тяжелой цепей могут быть из одинаковых или различных антител человека, и каждое из них может представлять собой составную структуру из двух или более каркасных участков антитела человека; или, альтернативно, они могут представлять собой консенсусную последовательность каркасных участков человека (например, подгруппа антител человека, как определено выше у Kabat et al., в цитируемой публикации), т.е. последовательность, имеющую наиболее часто встречающуюся аминокислоту в группе в каждом положении. Кроме того, для сохранения высокой аффинности связывания можно использовать по меньшей мере один из двух дополнительных структурных элементов. См., Queen et al., патенты США No. 5530101 и 5585089, каждый из которых включен в настоящий документ в качестве ссылки, в которых представлены подробные инструкции для конструирования гуманизированных антител.
В первом структурном элементе каркасный участок вариабельной области тяжелой цепи гуманизированного антитела выбирают так, чтобы она обладала высокой идентичностью последовательности (по меньшей мере 65%) с каркасным участком вариабельной области тяжелой цепи донорного антитела, посредством выбора пригодным образом акцепторного антитела среди множества известных антител человека. Во втором структурном элементе при конструировании гуманизированного антитела выбранные аминокислоты в каркасном участке акцепторного антитела человека (вне CDR) заменяют соответствующими аминокислотами из донорного антитела, в соответствии с указанными правилами. Конкретно, аминокислоты, подлежащие замене в каркасном участке, как правило, выбирают, исходя из их способности взаимодействовать с CDR. Например, замененные аминокислоты в гуманизированном антителе могут быть соседними с CDR в последовательности донорного антитела, или они могут находиться в пределах 4-6 ангстрем от CDR, при определении в 3-мерном пространстве.
С другой стороны, поскольку гуманизированные mAb должны быть образованы не-человеческим донорным mAb, гуманизированные mAb, по существу не включают в себя человеческих mAb, полученных путем выделения нуклеиновых кислот, кодирующих вариабельные области, из человека и их селекции с использованием способов фагового дисплея (см., например, Dower et al., WO 91/17271; McCafferty et al., WO 92/001047; Winter, WO 92/20791; и Winter, FEBS Lett. 23:92, 1998) или с использованием трансгенных мышей (см., например, Lonberg et al., WO 93/12227; Kucherlapati WO91/10741, и Burgess et al. WO 2005/027107 A2).
Эпитоп mAb представляет собой область в соответствующем ей антигене, с которым связывается mAb. Два антитела связываются с одним и тем же или перекрывающимся эпитопом, если каждое из них полностью ингибирует (блокирует) связывание другого с антигеном. Таким образом, 1x, 5x, 10x, 20x или 100x избыток одного антитела ингибирует связывание другого по меньшей мере на 50%, но предпочтительно на 75%, 90% или даже 99%, при измерении в конкурентном анализе связывания (см., например, Junghans et al., Cancer Res. 50:1495, 1990). Альтернативно, два антитела обладают одним эпитопом, если все аминокислотные мутации в антигене, которые снижают или предотвращают связывание одного антитела, снижают или предотвращают связывание другого. Два антитела имеют перекрывающиеся эпитопы, если мутации некоторых аминокислот, которые снижают или предотвращают связывание антитела, снижают или предотвращают связывание другого.
2. Гуманизированные нейтрализующие антитела против HGF
Говорят, что моноклональное антитело (mAb), которое связывает HGF (т.е. mAb против HGF), нейтрализует HGF или является нейтрализующим, если связывание частично или полностью ингибирует один или несколько видов биологической активности HGF (т.е. когда mAb используют в качестве единственного средства). К биологическим свойствам HGF, которые может ингибировать нейтрализующее антитело, относятся способность HGF связываться с его рецептором cMet, вызывать распространение определенных клеточных линий, таких как клетки почки собаки Madin-Darby (MDCK); стимулировать пролиферацию (т.е. быть митогон для) определенных видов клеток, включая гепатоциты, эпителиальные клетки легкого норки Mv 1 Lu и различные опухолевые клетки человека; или стимулировать ангиогенез, например, при измерении посредством стимуляции пролиферации эндотелиальных клеток сосудов пуповины человека (HUVEC) или образования сосудов или посредством индукции кровеносных сосудов при нанесении на хориоаллантоисную мембрану куриного эмбриона (CAM). Антитела согласно изобретению предпочтительно связываются с HGF человека, т.е. с белком, кодируемым последовательностью GenBank с регистрационным номером D90334.
Гуманизированное нейтрализующее mAb согласно изобретению в концентрации, например, 0,01, 0,1, 0,5, 1, 2, 5, 10, 20 или 50 мкг/мл будет ингибировать биологическую функцию HGF (например, стимуляцию пролиферации или рассеивания) приблизительно по меньшей мере на 50%, но предпочтительно на 75%, более предпочтительно на 90% или 95% или даже 99% и наиболее предпочтительно приблизительно на 100% (по существу полностью) при анализе способами, описанными в примерах или известными в данной области. Как правило, степень ингибирования измеряют, когда количество используемого HGF является достаточным только для полной стимуляции биологической активности или составляет 0,01, 0,02, 0,05, 0,1, 0,5, 1, 3 или 10 мкг/мл. Предпочтительно, по меньшей мере 25%, 50%, 75%, 90% или 95% или по существу полного ингибирования будут достигать, когда молярное соотношение антитела и HGF составляет 0,1x, 0,5x, 1x, 2x, 3x, 5x или 10x. Наиболее предпочтительно, mAb будет нейтрализовывать не только один, а несколько видов биологической активности, приведенных выше; для целей, представленных в настоящем документе, mAb против HGF, которое нейтрализует все виды биологической активности HGF, будет называться "полностью нейтрализующим", и такие mAb являются наиболее предпочтительными. MAb согласно изобретению предпочтительно специфически связывается с HGF, т.е. они не будут связывать или будут связывать только в значительно меньшей степени, белки, которые сходны с HGF, такие как фактор роста фибробластов (FGF) и фактор роста сосудистого эндотелия (VEGF). MAb согласно изобретению, как правило, обладают аффинностью связывания (Ka) с HGF по меньшей мере 107 M-1, а предпочтительно 108 M-1 или выше и наиболее предпочтительно 109 M-1 или выше или даже 1010 M-1 или выше.
Гуманизированные mAb согласно изобретению включают в себя антитела против HGF в их природной тетрамерной форме (2 легких цепи и 2 тяжелых цепи), и они могут представлять собой любой из известных изотипов IgG, IgA, IgM, IgD и IgE и их субтипов, т.е. IgG1, IgG2, IgG3, IgG4, и могут содержать легкую цепь каппа и лямбда. Также mAb согласно изобретению включают в себя фрагменты антител, такие как Fv, Fab и F(ab')2; бифункциональные гибридные антитела (например, Lanzavecchia et al., Eur. J. Immunol. 17:105, 1987), одноцепочечные антитела (Huston et al., Proc. Natl. Acad. Sci. USA 85:5879, 1988; Bird et al., Science 242:423, 1988); и антитела с измененными константными областями (см., например, патент США No. 5624821). Источником CDR в mAb может быть животное (например, мышь, крыса, хомяк или курица), или его можно получать, используя способы генетической инженерии. mAb крысы получают стандартными способами, хорошо известными в данной области, включая множественную иммунизацию посредством HGF в пригодном адъюванте внутрибрюшинно, внутривенно или в подушку лапы, с последующим извлечением клеток селезенки или лимфатических узлов и слиянием с пригодной иммортализованной клеточной линией и с последующей селекцией гибридом, которые продуцируют антитело, связывающееся с HGF.
Это изобретение относится к гуманизированным формам mAb L2G7 мыши. Последовательности зрелых вариабельных областей тяжелой и легкой цепей mAb L2G7 мыши представлены на фиг.1A и 1B соответственно. Таким образом, гуманизированные формы mAb L2G7 включают в себя большинство или все аминокислоты CDR из этих последовательностей в каркасных участках вариабельной области человека (включая каркасные участки человека с единичной, составной или консенсусной последовательностью). Например, некоторые гуманизированные антитела включают в себя три интактных CDR из тяжелой цепи L2G7 и три интактных CDR из легкой цепи. Другие гуманизированные антитела включают в себя по меньшей мере один интактный CDR из тяжелой цепи L2G7 и по меньшей мере один интактный CDR из легкой цепи L2G7. Некоторые гуманизированные антитела включают в себя по меньшей мере один CDR, в котором источником некоторых остатков является соответствующий CDR L2G7, и источником других является CDR антитела человека, предпочтительно того же антитела человека, которое является источником каркасного участка вариабельной области, содержащего CDR.
В некоторых гуманизированных антителах согласно изобретению по меньшей мере 1, 3, 5 или все положения, выбранные из группы H29, H30, H48, H66, H67, H71, H94, L3 и L60, заняты аминокислотой, представленной в соответствующем положении в нумерации Kabat в антителе L2G7 мыши. В акцепторных каркасных участках вариабельной области человека, используемых в примерах, все из этих положений заняты аминокислотными остатками человека, отличающимися от аминокислоты, представленной в соответствующем положении в антителе L2G7 мыши. Таким образом, замещение всех или большинства положений, выбранных из данной группы, является предпочтительным. Если используют другие каркасные участки вариабельной области человека, некоторые из положений могут быть заняты аминокислотами, которые являются одинаковыми в каркасном участке вариабельной области человека и антитела L2G7 мыши. Таким образом, в таких положениях замещение не проводят, но его можно проводить в других положениях, отличающихся между каркасным участком вариабельной области человека и антителом L2G7 мыши в соответствиями с правилами Queen, US 5530101 и US 5585089. Независимо от выбора каркасного участка вариабельной области человека замена других аминокислот, помимо аминокислот, указанных в приведенной выше группе, также является возможной, как рассмотрено ниже. Однако, как правило, ни каркасный участок вариабельной области тяжелой цепи, ни каркасный участок вариабельной области легкой цепи гуманизированного антитела не включают более десяти или двенадцати замен, что приводит к остаткам, не представленным в акцепторном каркасном участке вариабельной области человека (включая консесусные каркасные участки вариабельных областей человека и составные каркасные участки вариабельных областей человека, как рассмотрено выше).
Любые константные области, представленные в гуманизированных антителах согласно изобретению, являются человеческими или по существу человеческими, имеющими не более десяти и предпочтительно две или несколько замен относительно природной константной области человека. Некоторые замены являются преимущественными в отношении повышения времени полужизни антитела и/или его аффинности к FcγRn, как рассмотрено ниже. Другие замены, как правило, консервативные замены, как рассмотрено ниже, обладают нейтральным эффектом.
Иллюстративные гуманизированные формы L2G7 включают в себя зрелые вариабельные области тяжелой и легкой цепей, имеющие последовательности, показанные на фиг. 2A и 2B соответственно. Другие предпочтительные формы гуманизированного L2G7 включают в себя зрелые вариабельные области тяжелой и легкой цепей, имеющие последовательности, по меньшей мере на 90%, 95%, 98% или 99% идентичные этим последовательностям (при выравнивании в соответствии с нумерацией Kabat, выше), и/или отличаются от них на небольшое количество (как правило, включающее не более 5 или 10 аминокислот) функционально несущественных замен, делеций и/или вставок. Например, первая аминокислота тяжелой цепи может представлять собой либо Glu, либо Gln. Замены, как правило, являются консервативными, т.е. заменами аминокислот аминокислотами, которые являются химически сходными. В целях классификации аминокислотных замен в качестве консервативных или неконсервативных аминокислоты можно группировать следующим образом: Группа I (гидрофобные боковые цепи): Met, Ala, Val, Leu, Ile; Группа II (нейтральные гидрофильные боковые цепи): Cys, Ser, Thr; Группа III (кислые боковые цепи): Asp, Glu; Группа IV (основные боковые цепи): Asn, Gln, His, Lys, Arg; Группа V (остатки, влияющие на ориентацию цепи): Gly, Pro; и Группа VI (ароматические боковые цепи): Trp, Tyr, Phe. Консервативные замены представляют собой замены, которые вовлекают замены между аминокислотами в одной и той же группе. Предпочтительно избегают замен, связанных с V-областями на фиг. 2A и 2B, в положениях H29, H30, H48, H66, H67, H71, H94, L3 и L60, где аминокислоты из L2G7 мыши были включены вследствие взаимодействия этих положений с CDR, как рассмотрено в примерах. Замены предпочтительно встречаются в положениях каркасного участка вариабельной области, но они также встречаются и в областях CDR. Если область CDR замещена, предпочтительной является замена аминокислоты мыши аминокислотой соответствующего положения (нумерация Kabat) в антителе человека, предпочтительно в том же антителе человека, которое является источником акцепторных каркасных участков вариабельных областей.
Как правило, гуманизированные mAb L2G7 относятся к изотипу IgG1, IgG2, IgG3 или IgG4 с легкой цепью каппа. mAb IgG1, имеющее вариабельные области, представленные на фиг. 2A и 2B соответственно, комбинированные с полной константной областью человека гамма-1 и каппа, обозначаются HuL2G7. Полные тяжелая и легкая цепи HuL2G7 представлены соответственно, на фиг. 3A и 3B. Только зрелые части этих последовательностей, начинающиеся в положениях, указанных номером 1, в действительности являются частью HuL2G7, поскольку предшествующие сигнальные пептиды отщепляются до или в процессе секреции антитела.
Варианты HuL2G7, сохраняющие сходные с HuL2G7 характеристики связывания, можно получать путем мутагенеза с последующей массовой селекцией с использованием способов фагового дисплея, рассмотренных выше. Варианты исходно отбирают по специфическому связыванию с HGF, необязательно конкурентному с HuL2G7 или L2G7 мыши. Затем варианты, обладающие такими же или сходными характеристиками связывания, как и приведенное в качестве примера антитело, можно функционально тестировать.
Предпочтительные mAb L2G7 являются нейтрализующими или полностью нейтрализующими для HGF, как определено выше. Предпочтительно, для некоторых, большинства или всех определенных биологических свойств HGF (например, связывания с Met, стимуляции пролиферации клеток Mv 1 Lu или HUVEC) нейтрализующая активность гуманизированного mAb отличается в пределах 3 раз, более предпочтительно в пределах 2 раз или 1,5 раз и наиболее предпочтительно не отличается (т.е. находится в пределах экспериментальной ошибки) от нейтрализующей активности самого L2G7. Значит, для достижения той же степени ингибирования биологического свойства (например, при измерении посредством IC50) требуется не более чем 3-кратное, 2-кратное, 1,5-кратное или такое же количество гуманизированного mAb относительно L2G7. Предпочтительно аффинность к HGF гуманизированных mAb также отличается в пределах 3 раз, 2 раз или по существу не отличается от аффинности L2G7. Аналогично, в моделях ксенотрансплантации на мышах (например, с использованием клеточной линии глиомы человека, такой как U87) гуманизированные mAb предпочтительно ингибируют рост опухоли в пределах 3 раз, 2 раз или неотличимо от mAb L2G7 мыши. В действительности предпочтительно, чтобы доза только в 40, 20 или даже 10 мкг гуманизированного mAb, вводимого два раза в неделю, полностью ингибировала рост ксенотрансплантатов опухоли U87.
Гуманизированные mAb можно экспрессировать множеством известных в данной области способов. Например, сначала можно синтезировать гены, кодирующие их V-области легкой и тяжелой цепи, из перекрывающихся олигонуклеотидов или посредством мутагенеза с помощью ПЦР ранее полученного варианта требуемого гена. Вследствие вырожденности генетического кода каждую аминокислотную последовательность антитела кодирует несколько последовательностей ДНК. Все последовательности ДНК, кодирующие антитела, описанные в этой заявке, прямо относятся к этому изобретению. Однако после получения гены, кодирующие легкую и тяжелую цепи гуманизированного mAb, встраивают совместно с C-областями в экспрессирующие векторы (например, коммерчески доступные от Invitrogen), которые обеспечивают требуемые регуляторные участки, например, промоторы, энхансеры, участки полиA и т.д. Применение промотора-энхансера CMV является предпочтительным. Гены для C-участков в настоящее время широко доступны или их можно легко клонировать посредством ПЦР из антителопродуцирующих клеток человека. Гены легкой и тяжелой цепей можно встраивать совместно в один вектор, или их можно встраивать в различные векторы. Затем экспрессирующие векторы можно трансфицировать с использованием различных известных в данной области способов, таких как липофекция или электропорация, в различные клеточные линии млекопитающих, такие как CHO или 293, или непродуцирующие миеломы, включая Sp2/0 и NSO, и клетки, экспрессирующие антитела, выбранные методом селекции на соответствующем антибиотике. См., например, патент США No. 5530101. Большие количества антитела можно получать путем выращивания клеток в коммерчески доступных биореакторах.
После экспрессии гуманизированные mAb согласно изобретению можно очищать в соответствии со стандартными в данной области способами, такими как микрофильтрация, ультрафильтрация, аффинная хроматография с белком A или G, гель-фильтрация, анионообменная хроматография, катионообменная хроматография и/или другие формы аффинной хроматографии на основе органических красителей и пр. По существу чистые антитела с гомогенностью по меньшей мере приблизительно 90 или 95% являются предпочтительными, и антитела с гомогенностью 98% или 99% или более являются наиболее предпочтительными для фармацевтического применения.
3. Терапевтические способы
В предпочтительном варианте осуществления настоящее изобретение относится к фармацевтическому составу, содержащему гуманизированные антитела, описанные в настоящем документе. Фармацевтические составы антител содержат mAb в физиологически приемлемом носителе, необязательно с эксципиентами или стабилизаторами, в форме лиофилизированных или водных растворов. Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными для реципиентов в применяемых дозировках и концентрациях и включают в себя буферы, такие как фосфат, цитрат или ацетат, при pH, как правило, от 5,0 до 8,0, наиболее часто от 6,0 до 7,0; соли, такие как хлорид натрия, хлорид калия и т.д., для обеспечения изотоничности; антиоксиданты, консерванты, низкомолекулярные полипептиды, белки, гидрофильные полимеры, такие как полисорбат 80, аминокислоты, углеводы, хелатирующие агенты, сахара и другие стандартные ингредиенты, известные специалистам в данной области (см. Remington's Pharmaceutical Science 16th edition, Osol, A. Ed. 1980). Как правило, mAb представлено в концентрации 1-100 мг/мл, например 10 мг/мл.
В другом предпочтительном варианте осуществления изобретение относится к способу лечения пациента с использованием гуманизированного mAb против HGF, такого как гуманизированное L2G7, например, HuL2G7, в составе фармацевтической композиции. MAb, полученное в составе фармацевтической композиции, можно вводить пациенту любым пригодным способом, особенно парентерально путем внутривенной инфузии или болюсной инъекции, внутримышечно или подкожно. Внутривенную инфузию можно проводить в течение 15 минут, однако чаще в течение 30 минут или более 1, 2 или даже 3 часов. Также mAb можно инъецировать непосредственно в область локализации заболевания (например, опухоль) или инкапсулировать в носители, такие как липосомы. Вводимая доза является достаточной для смягчения состояния, подлежащего лечению ("терапевтически эффективная доза"), и, вероятно, будет составлять от 0,1 до 5 мг/кг массы тела, например, 1, 2, 3 или 4 мг/кг, однако она может составлять до 10 мг/кг или даже 15 или 20 мг/кг. Также можно вводить фиксированную единичную дозу, наприме