Способ определения способности микроорганизмов формировать биопленки на поверхности твердой фазы
Иллюстрации
Показать всеИзобретение относится к боихимии и касается способов определения способности микроорганизмов формировать биопленки на поверхности твердой фазы, что имеет большое значение в урологии для лечения мочекаменной болезни. Для получения объективных данных о способности микроорганизмов формировать биопленки на поверхности биологических субстратов в качестве твердой фазы использовали предварительно измельченные и простерилизованные натуральные почечные камни. В процессе культивирования бактерии адгезировались к поверхности почечных камней и формировали на них биопленки разной интенсивности. После культивирования осуществляют окрашивание сформировавшихся биопленок красителем с последующим экстрагированием связавшегося с биопленками красителя этиловым спиртом и оценкой интенсивности окрашивания спиртового раствора на фотометре. Изобретение позволяет повысить эффективность определения способности микроорганизмов формировать биопленки. 2 ил., 2 пр.
Реферат
Изобретение относится к области медицины, а именно к микробиологии для определения способности микроорганизмов формировать биопленки на биологических субстратах.
Известен способ определения способности микроорганизмов формировать биопленки, заключающийся в культивировании бактерий в лунках полистироловых микротитровальных планшет с последующей окраской адгезировавшихся к твердой фазе (полистиролу) и сформировавших биопленку бактерий. Оценка интенсивности сформировавшихся биопленок проводится на фотометре по степени окраски спиртового экстракта красителя в каждой лунке (O'Tool G.A., Mol. Microbiol., 1998, v.28, №3; Jackson D.W., J.Bacteriol., 2002, v.184, №1).
Однако этот способ не позволяет объективно оценивать способность микроорганизмов формировать биопленки на биологических субстратах, т.к. в качестве твердой фазы используют синтетический материал (полистирол), сильно отличающийся по своему химическому составу от биологических объектов. Особенно это важно в урологии, где объективная оценка инфицированности почечных камней микроорганизмами, находящимися в составе биопленок, необходима для проведения адекватного лечения больных мочекаменной болезнью.
Цель изобретения - разработка способа определения способности микроорганизмов формировать биопленки на биологическом субстрате.
Сущностью изобретения является использование в качестве твердой фазы биологического субстрата - натуральных почечных камней различной химической природы, что позволяет более эффективно определять способность микроорганизмов формировать биопленки на данном биологическом субстрате.
Пример 1. Несколько натуральных почечных камней разной химической природы, полученных в ходе операций по удалению камней из почек, помещают в 70% этиловый спирт и стерилизуют в течение 24 ч, затем их подсушивают и тщательно измельчают в стерильной фарфоровой ступке до относительно гомогенного состояния (песка). Одинаковые навески почечного песка по 10 мг помещают в стерильные пробирки (V - 10 мл). В эти пробирки добавляют по 0,5 мл суспензий нескольких штаммов Е.coli (№№3, 38, 55, 136, 1068), выделенных из мочи больных циститами или из почечных камней, в концентрации n×106 КОЕ/мл. В качестве контроля фона используют стандартную навеску песка с 0,5 мл стерильной питательной среды.
Пробирки инкубируют, плавно покачивая, в течение 48 ч при температуре 37°С. Осадок почечного песка в культуральной жидкости отбирают и переносят в микроцентрифужные пробирки (V - 1,5 мл). Затем песок отделяют от культуральной жидкости центрифугированием (15 сек при 5000 об/мин) и трижды промывают физиологическим раствором, избегая резкого встряхивания пробирок. К отмытому почечному песку, содержащему лишь прикрепившиеся бактериальные клетки биопленок, добавляют 0,5 мл 0,1% раствора красителя кристалл виолет. Окрашивание биопленок проводят в течение 30 мин при комнатной температуре, а затем песок осаждают центрифугированием и 3-4 раза промывают стерильной водой (до тех пор, пока надосадочная жидкость не становится бесцветной). Связавшийся с клетками биопленки краситель экстрагируют с окрашенного почечного песка этиловым спиртом (0.5 мл) в течение часа. Интенсивность окрашивания этилового спирта оценивают на фотометре при длине волны 540 нм.
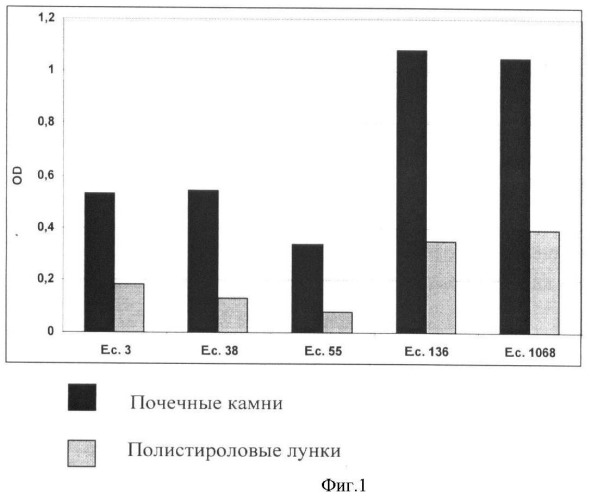
Параллельно проводят такой же опыт в лунках полистироловых микротитровальных планшет. Суспензии данных штаммов Е.coli в концентрации n×106 КОЕ/мл вносят по 100 мкл в лунки, инкубируют также в течение 48 ч при 37°С. В качестве контроля фона используют полистироловые лунки, заполненные стерильной питательной средой. После инкубирования культуральную жидкость удаляют, лунки промывают 3 раза физиологическим раствором и вносят по 100 мкл раствора красителя в каждую лунку и оставляют на 30 мин при комнатной температуре. После этого лунки промывают 3 раза дистиллированной водой и вносят по 100 мкл этилового спирта для экстрагирования красителя, связавшегося с клетками биопленок на стенках полистироловых лунок. Интенсивность окрашивания спиртового раствора также оценивают на фотометре при длине волны 540 нм. Результаты сравнения двух параллельных опытов представлены в виде фиг.1. В каждом опыте уже вычтены фоновые значения.
Из приведенных на фиг.1 данных видно, что способность бактерий E.coli прикрепляться к поверхности полистирола и формировать на нем биопленки значительно ниже, чем при использовании натуральных почечных камней.
Таким образом, предлагаемый способ определения способности микроорганизмов формировать биопленки на поверхности твердой фазы позволяет в 2-4 раза повысить эффективность теста для уропатогенных E.coli при использовании адекватного биологического субстрата (почечных камней).
Пример 2. Одинаковые навески по 10 мг предварительно подготовленного почечного песка (как описано выше) помещают в стерильные пробирки (V - 10 мл) и добавляют в эти пробирки по 0,5 мл суспензий микроорганизмов разных видов, выделенных из мочи больных циститами или из почечных камней, в концентрации n×106 КОЕ/мл: E.coli 38, Kl.pneumoniae 153, Pr.mirabilis 71, Ps.aeruginosa 32, St.haemoliticus 159, St.epidermis 83, E.faecalis 6, M.morgani 166. В качестве контроля фона используют стандартную навеску песка с 0,5 мл стерильной питательной среды. Пробирки инкубируют при плавном покачивании в течение 48 часов при температуре 37°С. Осадок почечного песка в культуральной жидкости отбирают и переносят в микроцентрифужные пробирки (V - 1,5 мл). Затем песок отделяют от культуральной жидкости центрифугированием (15 сек при 5000 об/мин) и трижды промывают физиологическим раствором, избегая резкого встряхивания пробирок. К отмытому почечному песку, содержащему лишь прикрепившиеся бактериальные клетки биопленок, добавляют 0,5 мл 0,1% раствора красителя кристалл виолет. Окрашивание биопленок проводят в течение 30 мин при комнатной температуре, а затем песок осаждают центрифугированием и 3-4 раза промывают стерильной водой (до тех пор, пока надосадочная жидкость не становится бесцветной). Связавшийся с клетками биопленки краситель экстрагируют с окрашенного почечного песка этиловым спиртом (0.5 мл) в течение часа. Интенсивность окрашивания этилового спирта оценивают на фотометре при длине волны 540 нм.
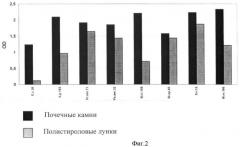
Параллельно проводят такой же опыт в лунках полистироловых микротитровальных планшет. Суспензии данных видов микроорганизмов в концентрации n×106 КОЕ/мл вносят по 100 мкл в лунки, инкубируют также в течение 48 ч при 37°С. В качестве контроля фона используют полистироловые лунки, заполненные стерильной питательной средой. После инкубирования культуральную жидкость удаляют, лунки промывают 3 раза физиологическим раствором и вносят по 100 мкл раствора красителя в каждую лунку и оставляют на 30 мин при комнатной температуре. После этого лунки промывают 3 раза дистиллированной водой и вносят по 100 мкл этилового спирта для экстрагирования красителя, связавшегося с клетками биопленок на стенках полистироловых лунок. Интенсивность окрашивания спиртового раствора также оценивают на фотометре при длине волны 540 нм. Результаты сравнения двух параллельных опытов представлены в виде фиг.2. В каждом опыте также уже вычтены фоновые значения.
Из данных фиг.2 видно, что предлагаемый способ позволяет более эффективно определять способность разных видов микроорганизмов формировать биопленки на биологическом субстрате, в то время как способность данных видов микроорганизмов прикрепляться к поверхности полистирола и формировать на нем биопленки была значительно ниже, чем при использовании натуральных почечных камней.
Таким образом, предлагаемый способ позволяет объективно оценивать способность микроорганизмов формировать биопленки на биологическом субстрате - почечных камнях и наглядно доказывает более высокую эффективность предлагаемого способа, в отличие от способа, использующего полистироловые лунки. Объективная оценка инфицированности почечных камней микроорганизмами, формирующими биопленки на поверхностях этого биологического субстрата, очень важна для проведения адекватного лечения больных мочекаменной болезнью.
Способ определения способности микроорганизмов формировать биопленки на поверхности твердой фазы, включающий окрашивание сформировавшихся биопленок красителем с последующим экстрагированием связавшегося с биопленками красителя этиловым спиртом и оценкой интенсивности окрашивания спиртового раствора на фотометре, отличающийся тем, что в качестве твердой фазы используют биологический субстрат - измельченные и простерилизованные натуральные почечные камни различной химической природы.