Неиммуносупрессорный циклоспорин для лечения врожденной миопатии ульриха
Иллюстрации
Показать всеИзобретение относится к медицине и касается применения неиммуносупрессорного производного циклоспорина А для уменьшения митохондриальной дисфункции и степени апоптоза в клетках пациентов, имеющих диагноз врожденная миопатия Ульриха или миопатия Бетлема. Изобретение обеспечивает существенное снижение степени апоптоза и существенное снижение митохондриальной дисфункции. 4 н. и 1 з.п. ф-лы, 5 пр., 6 ил., 1 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение касается применения неиммуносупрессорного производного циклоспорина А для снижения митохондриальной дисфункции и скорости апоптоза мышечных клеток у пациентов, имеющих диагноз врожденная миопатия Ульриха или миопатия Бетлема.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Наследственные мутации генов коллагена VI являются причиной двух основных заболеваний скелетных мышц: миопатия Бетлема (ВМ, Online Mendelian Inheritance in Man (он-лайн каталог «Менделевская наследственность у человека») [ОМIМ] 158810) и врожденная миопатия Ульриха (UCMD, OMIM 254090).
ВМ является аутосомным доминантным заболеванием, которое характеризуется медленно прогрессирующей слабостью аксиальных и проксимальных мышц в совокупности со сгибательной контрактурой пальцев (Bethlem and Wijngaarden. Brain 1976; 99: 91-100; Merlini et al. Neuromuscul Disord 1994; 4: 503-11). Это заболевание имеет внутрисемейную вариабельность и различные моменты клинического проявления у пациентов от пренатального периода до средне-зрелого возраста. Пренатальные проявления характеризуются сниженной двигательной активностью плода; клинические проявления у новорожденных - гипотонией или кривошеей; проявления в раннем детстве - отставанием в прохождении основных фаз моторного развития (delayed motor milestones), мышечной слабостью и контрактурами; и проявления в зрелом возрасте - проксимальной слабостью, а также контрактурами пяточного сухожилия и пальцев. Обычно это умеренное и медленно прогрессирующее состояние, за исключением отдельных случаев, когда пациентам старше 50 лет требуются вспомогательные средства для передвижения вне дома (Рере et al. Biochem Biophys Res Commun 1999; 258: 802-07. DeVisser et al. Muscle Nerve 1992; 15: 591-96). Сердечная функция обычно в норме.
UCMD является аутосомным рецессивным заболеванием, которое характеризуется врожденной мышечной слабостью и контрактурами суставов и сосуществующей гипермобильностью дистальных суставов (Ullrich. Z. Ges. Neurol. Psychiatr. 1930; 126: 171-201. Camacho Vanegas et al. Proc Natl Acad Sci USA 2001; 98: 7516-21). Проявления наблюдаются обычно с рождения в виде гипотонии, врожденного вывиха бедра, прогиба пяточной кости (prominent calcanei) и временной кифотической деформации. Моторное развитие протекает с задержкой, и большинство детей никогда не обретает способность ходить самостоятельно. Часто наблюдается фолликулярный гиперкератоз над разгибательными поверхностями верхних и нижних конечностей, а также образование келоидных рубцов и шрамов в виде «папиросной бумаги». Поражение аксиальных мышц имеет серьезный характер, что приводит к прогрессирующему сколиозу в совокупности с ригидностью позвоночника. При ранних и тяжелых респираторных проявлениях может возникнуть необходимость во вспомогательной искусственной вентиляции легких в первой или второй декаде жизни. Лица, страдающие UCMD, имеют нормальные умственные способности, а данные магнитно-резонансной томографии (MRI) свидетельствуют о нормальном развитии мозга. Пациенты с рецессивными или de novo гетерозиготными мутациями обычно имеют классический тяжелый фенотип, хотя иногда они могут иметь и более мягкую форму заболевания типа Бетлема (Pan et al. Am J Hum Genet 2003; 73: 355-69. Baker et al. Hum Mol Genet 2005; 14: 279-93. Demir et al. Am J Hum Genet 2002; 70: 1446-58). У некоторых пациентов с фенотипом UCMD мутации генов коллагена VI были исключены, что может говорить о генетической гетерогенности даже для такого состояния (Pan et al. Am J Hum Genet 2003; 73: 355-69).
Недавно было показано, что мыши, у которых отсутствует коллаген VI в результате целенаправленной инактивации гена Col6a1, имеют скрытый митохондриальный дефект, вызванный несоответствующим открыванием митохондриальных пор (permeability transition pore, PTP), внутреннего мембранного канала, который имеет значение при некоторых формах клеточной гибели и который можно десенсибилизировать с помощью циклоспорина A (Irwin et al. Nat Genet 2003; 35: 267-71. Bernardi et al. FEBS J 2006; 273: 2077-99.) Это открытие было далее применено in vivo и привело к успешному терапевтическому воздействию на мышиных моделях. Установление того факта, участвуют ли митохондрии в патогенезе врожденной миопатии Ульриха, генетически и клинически гетерогенного заболевания, представляло собой большую проблему, которая являлась основным препятствием для терапевтического применения к людям тех режимов, которые были определены на мышиных моделях. Сейчас эта проблема уже решена. Более того, авторы настоящего изобретения смогли показать, что скрытые митохондриальные дефекты присутствуют в клетках пациентов с диагнозом UCMD и что вызванная этим повышенная степень апоптоза может быть снижена с помощью неиммуносупрессорных производных циклоспорина А, например [D-MeAla]3-[EtVal]4-CsA. Следовательно, данное изобретение предоставляет новый способ подавления апоптоза в мышечных клетках у пациентов, страдающих UCMD, и новый способ лечения этого заболевания с использованием неиммуносупрессорного производного циклоспорина А, предпочтительно [D-MeAla]3-[EtVal]4-CsA. В настоящее время не существует эффективного способа лечения UCMD. Следовательно, нужны новые терапевтические подходы, такие как описаны здесь. Авторам настоящего изобретения удалось также обнаружить аналогичный митохондриальный дефект у пациентов с ВМ, который оказался чувствительным к циклоспорину А. Таким образом, новый способ лечения, раскрытый здесь для пациентов с UCMD, может также применяться и для лечения пациентов с ВМ.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано на данных о том, что ключевой проблемой при UCMD является повышенная скорость апоптоза клеток скелетных мышц. Авторам изобретения удалось показать, что в данном случае повышенная скорость является следствием скрытой (латентной) митохондриальной дисфункции, которая может быть скорректирована путем воздействия на клетки циклоспорина А. Важно, что неиммуносупрессорное производное циклоспорина А [D-MeAla]3-[EtVal]4-CsA было столь же эффективным в снижении митохондриальной дисфункции и подавлении избыточного апоптоза, как и исходное соединение. Следовательно, настоящее изобретение касается применения неиммуносупрессорного производного циклоспорина A (CsA) формулы I, предпочтительнее неиммуносупрессорного производного циклоспорина А формулы II и наиболее предпочтительно неиммуносупрессорного производного циклоспорина A [D-MeAla]3-[EtVal]4-CsA формулы III для снижения митохондриальной дисфункции и уровня апоптоза у пациентов, страдающих UCMD. Неиммуносупрессорные производные циклоспорина А, пригодные для использования согласно данному изобретению, были описаны в международной заявке РСТ/ЕР2004/009804, заявитель Новартис АГ (Novartis AG) (WO 2005/021028), на с.3-6. [D-MeAla]3-[EtVal]4-CsA был описан в патенте США № 6927208.
Формула I
где
W - это MeBmt, дигидро-MeBmt, 8'-гидрокси-MeBmt или О-ацетил-MeBmt;
Х - это αAbu, Val, Thr, Nva или O-метилтреонин (MeOThr);
R - это Pro, Sar, (D)-MeSer, (D)-MeAla или (D)-MeSer(О-ацетил);
Y - это MeLeu, тио-MeLeu, γ-гидрокси-MeLeu, Melle, MeVal, MeThr, MeAla, MeaIle или MeaThr; N-этил-Val (EtVal), N-этил-Ile, N-этил-Thr, N-этил-Phe, N-этил-Tyr или N-этил-Thr(O-ацетил), причем Y не может быть MeLeu, если R - это Sar;
Z - это Val, Leu, MeVal или MeLeu;
Q - это MeLeu, γ-гидрокси-MeLeu, MeAla или Pro;
Т1 - это (D)Ala или Lys;
Т2 - это MeLeu или γ-гидрокси-MeLeu, и
Т3 - это MeLeu или MeAla.
Формула II
где
W' - это MeBmt, дигидро-MeBmt или 8'-гидрокси-MeBmt;
Х - это αAbu, Val, Thr, Nva или O-метилтреонин (MeOThr);
R' - это Sar, (D)-MeSer, (D)-MeAla или (D)-MeSer(O-ацетил);
Y' - это MeLeu, γ-гидрокси-MeLeu, Melle, MeVal, MeThr, MeAla, MeaIle или MeaThr; N-этил-Val (EtVal), N-этил-Ile, N-этил-Thr, N-этил-Phe, N-этил-Tyr или N-этил-Thr(О-ацетил), причем Y не может быть MeLeu, если R - это Sar;
Z - это Val, Leu, MeVal или MeLeu;
Q' - это MeLeu, γ-гидрокси-MeLeu или MeAla.
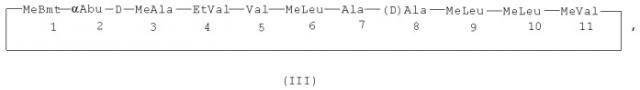
Формула III
где MeBmt - это N-метил-(4R)-4-бут-2Е-ен-1-ил-4-метил-(L)треонин, αAbu - L-α-аминомасляная кислота, D-MeAla - N-метил-D-аланин, EtVal - N-этил-L-валин, Val - L-валин, MeLeu - N-метил-L-лейцин, Ala - L-аланин, (D)Ala - D-аланин и MeVal - N-метил-L-валин.
В другом воплощении изобретение касается применения неиммуносупрессорного производного циклоспорина А формулы I, предпочтительнее неиммуносупрессорного производного циклоспорина А формулы II и наиболее предпочтительно неиммуносупрессорного производного циклоспорина A [D-MeAla]3-[EtVal]4-CsA формулы III в изготовлении лекарства, предназначенного для лечения UCMD.
В дальнейшем воплощении данное изобретение касается способа лечения UCMD у пациентов, при котором пациентам вводят эффективное количество неиммуносупрессорного производного циклоспорина А формулы I, предпочтительнее неиммуносупрессорного производного циклоспорина А формулы II и наиболее предпочтительно неиммуносупрессорного производного циклоспорина A [D-MeAla]3-[EtVal]4-CsA формулы III. Под эффективным количеством неиммуносупрессорного производного циклоспорина А понимают такое его количество, которое при многократном введении пациентам с UCMD в ходе лечебной схемы приводит к объективным клиническим эффектам, таким как улучшение, стабилизация или замедление прогрессирования болезни. При оральном введении эффективное количество для ежедневного введения или введения трижды в неделю находится в пределах приблизительно от 1 мг/кг до 100 мг/кг, предпочтительно в пределах примерно от 1 мг/кг до 20 мг/кг. При внутривенном способе введения указанная соответствующая доза может находиться в пределах приблизительно от 1 мг/кг до 50 мг/кг, предпочтительно в пределах примерно от 1 мг/кг до 25 мг/кг.
Кроме того, данное изобретение касается фармацевтической композиции для лечения UCMD, включающей эффективное количество неиммуносупрессорного производного циклоспорина А формулы I, предпочтительнее неиммуносупрессорного производного циклоспорина А формулы II и наиболее предпочтительно неиммуносупрессорного производного циклоспорина A [D-MeAla]3-[EtVal]4-CsA формулы III, фармацевтически приемлемый носитель и, возможно, эксципиент и разбавитель. Обычно разбавителем является вода. Наполнители, которые обычно добавляют в парентеральные композиции, включают изотонический агент, буфер или иной рН-контролирующий агент, а также консервант. Композиции могут включать и другие активные компоненты, например антибиотик.
Далее, настоящее изобретение касается применения неиммуносупрессорного производного циклоспорина А формулы I, предпочтительнее неиммуносупрессорного производного цикпоспорина А формулы II и наиболее предпочтительно неиммуносупрессорного производного циклоспорина A [D-MeAla]3-[EtVal]4-CsA формулы III для снижения митохондриальной дисфункции и степени апоптоза в клетках пациентов, страдающих миопатией Бетлема. Кроме того, данное изобретение касается также способа лечения ВМ у пациентов, при котором пациентам вводят эффективное количество неиммуносупрессорного производного циклоспорина А формулы I, предпочтительнее неиммуносупрессорного производного циклоспорина А формулы II и наиболее предпочтительно неиммуносупрессорного производного циклоспорина A [D-MeAla]3-[EtVal]4-CsA формулы III. Далее, изобретение также касается применения неиммуносупрессорного производного циклоспорина А формулы I, II или III в изготовлении лекарства, предназначенного для лечения ВМ. Наконец, данное изобретение касается фармацевтической композиции для лечения ВМ, включающей эффективное количество неиммуносупрессорного производного циклоспорина А формулы I, II или III, фармацевтически приемлемый носитель и, возможно, эксципиент и разбавитель.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг.1 изображено: на графиках А и В - мембранный потенциал митохондрий миобластов (полученных из биопсий мышц пациентов с UCMD), подвергавшихся воздействию олигомицина; и на графике С - степень апоптоза миобластов, взятых у пациентов с UCMD и здоровых лиц.
Фиг.2. Показательный эксперимент, в ходе которого проверяется эффект [D-MeAla]3-[EtVal]4-CsA на кальциевую емкость (calcium retention capacity, CRC) митохондрий печени и мышц, выделенных из мышей Col6a(1)-/-. Где указано стрелками, добавляли в импульсном режиме 10 мкМ Са2+. Митохондрии, исследованные на графиках АI и ВI, были выделены из мышей, которым вводили плацебо, через 5 ч после последнего введения; а исследованные на графиках АII и BII - из мышей, которым вводили [D-MeAla]3-[EtVal]4-CsA. Кривые a-d: без добавления; кривые a-d': в инкубационную среду добавляли [D-MeAla]3-[EtVal]4-CsA (0,8 мкМ). Данные представляют результат четырех повторных экспериментов.
Фиг.3. Обобщающие данные по определению кальциевой емкости (CRC) митохондрий, выделенных из печени и мышц мышей Соl6а1-/-, после лечения с помощью плацебо или [D-MeAla]3-[EtVal]4-CsA. Эксперименты проводили, как описано в Фиг.2. Величина CRCmax определена как значение CRC, которое наблюдалось после добавления 0,8 мкМ [D-MeAla]3-[EtVal]4-CsA в инкубационную среду. График А: каждая точка представляет одну мышь. Мышам 24-27 вводили композицию, содержащую [D-MeAla]3-[EtVal]4-CsA, а мышам 28-31 - композицию с плацебо.
Фиг.4. Влияние олигомицина на митохондриальную флюоресценцию TMRM в волокнах FDB, выделенных из мышей Соl6а1-/-, которых лечили с помощью плацебо или [D-MeAla]3-[EtVal]4-CsA. TMRM-анализы проводили, как описано в Примере 4 (Методы). Где отмечено, добавляли 5 мкМ олигомицина (Oligo) или 4 мкМ карбонилцианид-п-трифторметоксифенилгидразона (FCCP). Каждая кривая представляет значения флюоресценции для отдельного волокна. На рисунке также отображено число волокон, деполяризующихся после добавления олигомицина, по отношению к пороговому значению, произвольным образом установленному на уровне 90% флюоресценции.
Фиг.5. Степень апоптоза в срезах диафрагмы, взятых из мышей Col6a1-/-, леченных с помощью [D-MeAla]3-[EtVal]4-CsA или плацебо. Указано число апоптотических ядер на мм2 среза диафрагмы каждой из мышей Соl6а1-/-, которых лечили с помощью [D-MeAla]3-[EtVal]4-CsA (группа 1, мыши №№24-27) или плацебо (группа 2, мыши №№28-31). Столбики диаграммы показывают среднее из 20-30 срезов на одну мышь +/- ст. откл. Данные для нелеченых животных (базовый уровень) и леченных CsA (циклоспорином А) взяты из архивных материалов.
Фиг.6. Оценка числа волокон с измененными митохондриями из диафрагм мышей Соl6а1-/-, леченных с помощью [D-MeAla]3-[EtVal]4-CsA или плацебо. На диаграмме А показана доля мышечных волокон с измененными митохондриями, выявленными с помощью электронной микроскопии в образцах, взятых у отдельных животных. На диаграмме В показаны средние величины для двух групп с разными режимами лечения. Столбики диаграммы отражают среднее процентное содержание +/- ст. откл. Значимость вычисляли с помощью теста Манна-Уитни (Mann-Whitney test).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для того чтобы определить, присутствует ли повышенный уровень апоптоза и скрытая митохондриальная дисфункция у пациентов с UCMD, были изучены пять пациентов с диагнозом UCMD в сравнении со здоровыми лицами. Пациенты 1 и 5 имели генетически доказанную UCMD (Demir et al. Mutations in COL6A3 cause severe and mild phenotypes of Ullrich congenital muscular dystrophy. Am J Hum Genet 2002; 70: 1446-58. Giusti et al. Dominant and recessive COL6A1 mutations in Ullrich scleroatonic muscular dystrophy. Ann Neurol 2005; 58: 400-10.) У пациента 2 анализ последовательности 9-го экзона гена COL6A1 выявил наличие 15-нуклеотидной делеции (охватывающей нуклеотиды 35 374-35 388 в последовательности с регистрационным номером в базе данных (accession number) AJ 011932, что соответствует геномному клону, включающему экзоны 1-20 гена COL6A1; нуклеотиды (nt) 921-936 в последовательности с регистрационным номером NM_001848, соответствующие транскрипту COL6A1), которая встречается при гетерозиготности. У пациента 4 анализ последовательности 9-го экзона гена COL6A1 выявил наличие вариации G→A, которая встречается при гетерозиготности (нуклеотид 35 400 в последовательности с регистрационным номером AJ 011932; нуклеотид 850 в последовательности с регистрационным номером NM_001848). Отсутствовали данные генетического анализа для пациента 3, у которого были выявлены типичные клинические и иммунохимические признаки UCMD.
Эти пять пациентов в совокупности представляли собой весь спектр тяжести UCMD: все они имели врожденные проявления болезни; трое (пациенты 2, 3 и 5) так и не приобрели способность стоять и ходить; один (пациент 4) мог стоять только с поддержкой; и один (пациент 1) был способен ходить. Уменьшение содержания коллагена VI варьировало от умеренного (пациенты 1 и 4) до выраженного (пациенты 2 и 3) и вплоть до полного отсутствия (пациент 5). Мутация затронула ген COL6A1 в трех случаях (пациенты 2, 4 и 5), ген COL6A3 в одном случае (пациент 1) и была не определена в одном случае (пациент 3).
Биопсии из четырехглавой мышцы от пяти пациентов и одного здорового добровольца были взяты после получения информированного согласия пациентов и разрешения этического комитета (ethics committee). Скорость апоптоза оценивали с помощью метода TUNEL (terminal deoxynucleotidyl transferase-mediated dUTP nick end labeling). Из биопсий мышечной ткани получали замороженные срезы толщиной 7 мкм и фиксировали их в 50% ацетоне-50% метаноле. TUNEL проводили с помощью набора для in situ определения апоптоза Apoptag (Chemicon). Образцы окрашивали с помощью пероксидазы-диаминобензидина для выявления TUNEL-положительных ядер и докрашивали с помощью Hoechst 33258 (Sigma), чтобы пометить все ядра. Общее число всех ядер и количество TUNEL-положительных ядер определяли в выбранных случайным образом полях, с использованием микроскопа Zeiss Axioplan (увеличение 40х), оснащенного цифровой фотокамерой. Данные выражали как среднее ± ст. откл. Данные анализировали с помощью непарного t-теста Стьюдента, и величины с Р<0,01 рассматривались как значимые. Результаты показали, что частота обнаружения апоптотических ядер была намного выше во всех образцах, взятых от пациентов, по сравнению со здоровым донором, при этом величины варьировались от примерно 10-кратного увеличения в случае пациентов 1, 2 и 3 до более чем 200-кратного увеличения для пациентов 4 и 5. Повышенная степень апоптоза соответствовала значительному снижению экспрессии коллагена VI в биопсиях мышечной ткани всех пациентов, что было подтверждено окрашиванием с помощью селективных антител против коллагена VI.
Были проведены опыты, чтобы экспериментально проверить наличие причинной связи между недостатком коллагена VI и апоптозом. Были получены культуры миобластов из биопсий мышечной ткани от двух здоровых лиц, выбранных в качестве контроля, и от пациентов 1, 2, 3 и 4 путем энзиматической и химической обработки и посева в модифицированной по Дюльбекко среде Игла (DMEM), содержащей 20% фетальную сыворотку коровы (FCS), пенициллин, стрептомицин и амфотерицин В (Sigma). Для проведения тестов на апоптоз клетки фиксировали в 50% ацетоне-50% метаноле и осуществляли TUNEL-анализ с помощью системы Dead End Fluorescence TUNEL System (Promega). Визуализацию всех ядер осуществляли окрашиванием с помощью Hoechst 33258. Для культур, полученных от всех пациентов, была характерна более высокая степень апоптоза, по сравнению со здоровыми донорами. В результате посева на коллагене VI или обработки циклоспорином А происходила полная нормализация степени апоптоза в образцах, взятых от пациентов. В культурах мышечных клеток от пациентов 2, 3 и 4, согласно ожиданиям, был обнаружен низкий уровень коллагена VI, практически вплоть до его отсутствия, как уже было показано ранее для пациентов 1 и 5 (Demir et al. 2002. Giusti et al. 2005).
Для того чтобы установить, можно ли антиапоптотические эффекты коллагена VI и CsA отнести на счет митохондрий, было изучено функционирование митохондрий в культурах живых мышечных клеток. Как и ожидалось, добавление олигомицина к культурам, полученным от здоровых доноров, не вызывало митохондриальную деполяризацию, которую можно было наблюдать сразу же после добавления протонофора карбонилцианид-п-трифторметоксифенилгидразона. Наоборот, добавление олигомицина сопровождалось митохондриальной деполяризацией в клетках от всех пациентов с UCMD. Удивительно, что такая реакция на олигомицин была полностью нормализована в результате обработки с помощью циклоспорина А или внутриклеточного хелатора ионов Са2+ ВАРТА-АМ или же при посеве клеток на коллагене VI, что могло говорить о вовлеченности РТР в патогенез UCMD. Мембранный потенциал митохондрий оценивали по накоплению тетраметилродаминметилового эфира (TMRM). Отмечено, что согласно ожиданиям олигомицин должен был вызывать гиперполяризацию в здоровых дышащих клетках, в которых мембранный потенциал митохондрий поддерживается путем перекачивания протонов по дыхательной цепи, а протонный электрохимический градиент служит для стимулирования синтеза АТФ. Следовательно, вызываемая олигомицином деполяризация митохондрий в культурах миобластов от пациентов с UCMD являлась аномальной реакцией, которая указывала на то, что мембранный потенциал здесь обеспечивался не дыханием, а митохондриальной АТФ-синтазой, работающей «в обратном направлении», перекачивая протоны из матрикса в межмембранное пространство, потребляя при этом гликолитическую АТФ.
Культуры мышечных клеток, полученных от здоровых доноров и от пациентов 1, 2 и 3, были изучены с помощью электронной микроскопии. В образцах UCMD соотношение площадь/периметр митохондрий было значительно увеличено и имело значения на 62,5, 75 и 50% выше, чем аналогичные величины у здоровых доноров, для пациентов 1, 2 и 3, соответственно (р<0,05). Эти данные указывают на то, что в мышечных клетках UCMD митохондрий были значительно менее вытянуты, чем в контрольных образцах. Было также обнаружено, что от 4 до 8% митохондрий пациентов имеют увеличенную короткую ось (>400 нм), по сравнению с контролем (<300 нм). Все вместе эти данные говорят о наличии в клетках UCMD фракции митохондрий увеличенного размера. Небольшая часть клеток от пациентов с UCMD (в пределах 4-5%, по сравнению с 1% для клеток от здоровых доноров) содержала также набухшие митохондрии, в которых была снижена плотность матрикса и отсутствовали кристы. Удивительно, что в результате посева клеток UCMD на коллагене VI соотношение площадь/периметр и величина короткой оси становились такими же, как у здоровых доноров; а посев на коллагене VI или обработка циклоспорином А снижали число клеток с набухшими митохондриями до значений, наблюдавшихся в культурах от здоровых доноров.
Обработка культур клеток ингибитором F1FO АТФ-синтазы - олигомицином - приводила к увеличению доли клеток с набухшими митохондриями до 4% в контроле и до более чем 40% для пациентов с UCMD, и эти данные указывают на существование скрытой митохондриальной дисфункции, которую можно избирательно усилить олигомицином, как было показано ранее на мышиной модели с дефицитом коллагена VI. Такой эффект олигомицина можно было предотвратить с помощью обработки циклоспорином А, при этом доля клеток, несущих набухшие митохондрии, нормализовалась до величин, идентичных базовым, во всех культурах клеток. Неиммуносупрессорное производное циклоспорина A [D-MeAla]3-[EtVal]4-CsA было столь же эффективным, как и сам циклоспорин А, в предотвращении олигомицинзависимой деполяризации митохондрий в клетках от пациентов с UCMD, а также корректировало степень апоптоза до уровня, свойственного клеткам от здоровых доноров. Эксперименты, в ходе которых были получены эти данные, обсуждаются в Примере 1.
Удивительно, что митохондриальный дефект можно выявить в первичных культурах клеток от пациентов с клиническими признаками UCMD независимо от того, присутствует ли первичный генетический дефект в гене COL6A1 или COL6A3; а также то, что скрытая митохондриальная аномалия не может быть предсказана на основании тяжести клинического синдрома. Эти данные позволяют считать, что митохондрии участвуют в патогенезе во всех случаях UCMD и что дополнительные генетические факторы и/или факторы окружающей среды имеют значение в индивидуальной подверженности мышечных волокон к гибели и регенерации. Все виды митохондриальной аномалии и последующий апоптоз можно было скорректировать путем посева клеток UCMD на коллагене VI или путем воздействия на них циклоспорина А. Эти данные показывают, что существует принципиальная возможность прервать патогенетическую цепь событий, следующую за генетическим нарушением, с помощью подходящего лекарства, по крайней мере, на ранних стадиях. Хорошо известно, что циклоспорин А вызывает иммуносупрессию, и это может стать основным недостатком при длительном лечении пациентов. Ключевое наблюдение, сделанное авторами настоящего изобретения, состоит в том, что неиммуносупрессорное производное циклоспорина A [D-MeAla]3-[EtVal]4-CsA является столь же эффективным, как и сам циклоспорин А, в снижении митохондриальной дисфункции и степени апоптоза в клетках UCMD. Эти данные показывают, что иммуносупрессорная активность циклоспорина не сопряжена с его цитопротекторным эффектом, и предоставляют новый фармакологический способ лечения пациентов, страдающих заболеваниями, связанными с коллагеном VI.
Основываясь на этих данных, настоящее изобретение касается применения неиммуносупрессорного производного циклоспорина А формулы I, предпочтительнее неиммуносупрессорного производного циклоспорина А формулы II и наиболее предпочтительно неиммуносупрессорного производного циклоспорина A [D-MeAla]3-[EtVal]4-CsA формулы III для снижения митохондриальной дисфункции и степени апоптоза в клетках пациентов, страдающих UCMD.
Формула I
где
W - это MeBmt, дигидро-MeBmt, 8'-гидрокси-MeBmt или О-ацетил-MeBmt;
Х - это αAbu, Val, Thr, Nva или O-метилтреонин (MeOThr);
R - это Pro, Sar, (D)-MeSer, (D)-MeAla или (D)-MeSer(О-ацетил);
Y - это MeLeu, тио-MeLeu, γ-гидрокси-MeLeu, Melle, MeVal, MeThr, MeAla, MeaIle или MeaThr; N-этил-Val (EtVal), N-этил-Ile, N-этил-Thr, N-этил-Phe, N-этил-Tyr или N-этил-Thr(О-ацетил), причем Y не может быть MeLeu, если R - это Sar;
Z - это Val, Leu, MeVal или MeLeu;
Q - это MeLeu, γ-гидрокси-MeLeu, MeAla или Pro;
Т1 - это (D)Ala или Lys;
Т2 - это MeLeu или γ-гидрокси-MeLeu, и
Т3 - это MeLeu или MeAla.
Формула II
где
W' - это MeBmt, дигидро-MeBmt или 8'-гидрокси-MeBmt;
Х - это αAbu, Val, Thr, Nva или O-метилтреонин (MeOThr);
R' - это Sar, (D)-MeSer, (D)-MeAla или (D)-MeSer(О-ацетил);
Y' - это MeLeu, γ-гидрокси-MeLeu, Melle, MeVal, MeThr, MeAla, MeaIle или MeaThr; N-этил-Val (EtVal), N-этил-Ilе, N-этил-Thr, N-этил-Phe, N-этил-Tyr или N-этил-Thr(О-ацетил), причем Y не может быть MeLeu, если R - это Sar;
Z - это Val, Leu, MeVal или MeLeu;
Q' - это MeLeu, γ-гидрокси-MeLeu или MeAla.
Формула III
где MeBmt - это N-метил-(4R)-4-бут-2Е-ен-1-ил-4-метил-(L)треонин, αAbu - L-α-аминомасляная кислота, D-MeAla - N-метил-D-аланин, EtVal - N-этил-L-валин, Val - L-валин, MeLeu - N-метил-L-пейцин, Ala - L-аланин, (D)Ala - D-аланин и MeVal - N-метил-L-валин.
Неиммуносупрессорное производное циклоспорина А может применяться для ингибирования апоптоза in vitro в клетках мышечного происхождения, полученных из биопсий, взятых от пациентов с UCMD. Данные об ингибировании апоптоза послужат индикатором того, что лечение пациентов с помощью неиммуносупрессороного циклоспорина А будет эффективным в уменьшении тяжести заболевания.
Изобретение касается также использования неиммуносупрессорного производного циклоспорина А формулы I, предпочтительнее неиммуносупрессорного производного циклоспорина А формулы II и наиболее предпочтительно неиммуносупрессорного производного циклоспорина A [D-MeAla]3-[EtVal]4-CsA формулы III для лечения пациентов, страдающих UCMD. Активное вещество, т.е. неиммуносупрессорное производное циклоспорина А, может быть введено любым из общепринятых способов. Его можно вводить парентерально, например, в форме растворов или суспензий для инъекций, или же в форме инъецируемого препарата для создания депо. Предпочтительнее вводить его орально в форме растворов или суспензий для питья, таблеток или капсул. Фармацевтические композиции для орального введения, включающие неиммуносупрессорное производное циклоспорина A [D-MeAla]3-[EtVal]4-CsA, описаны в Примерах. Как показано на примерах, подобные фармацевтические композиции обычно включают одно из неиммуносупрессорных производных циклоспорина А по выбору и одно или несколько фармацевтически приемлемых веществ-носителей. Подходящие фармацевтические носители описаны, например, в Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, PA (1990), который представляет собой стандартный текст, на который ссылаются в данной области. Иногда эти композиции являются концентрированными, и их перед введением необходимо объединять с подходящим разбавителем, например с водой. Фармацевтическая композиция для парентерального введения обычно содержит также один или более эксципиент. Возможные эксципиенты включают изотонический агент, буфер или иной рН-контролирующий агент, а также консервант. Эти эксципиенты могут быть добавлены для сохранности композиции, а также для достижения желаемого уровня рН (около 6,5-7,5) и осмолярности (около 300 мосм/л).
Дополнительные примеры композиций с циклоспорином для орального введения можно найти в патентах США 5525590 и 5639724, а также в заявке на патент США 2003/0104992. При оральном способе введения указанная дозировка неиммуносупрессорного производного циклоспорина А для введения с частотой от ежедневно до трижды в неделю может быть приблизительно в пределах от 1 мг/кг до 100 мг/кг, предпочтительно в пределах примерно от 1 мг/кг до 20 мг/кг. При внутривенном способе указанная соответствующая дозировка может быть приблизительно в пределах от 1 мг/кг до 50 мг/кг, предпочтительно в пределах примерно от 1 мг/кг до 25 мг/кг. Под эффективным количеством неиммуносупрессорного производного циклоспорина А понимают такое его количество, которое при многократном введении в ходе курса лечения пациентам с UCMD вызывает объективный клинический эффект, такой как улучшение, стабилизация или замедление прогрессирования заболевания. Подобные клинические эффекты можно оценить, например, с помощью количественного изометрического анализа силы (Quantitative Isometric Strength, QIS). QIS позволяет произвести оценку мышечной силы объективным образом с помощью оборудования, включающего датчик давления и записывающее устройство. В качестве альтернативы нормализацию степени апоптоза можно оценить в биопсиях мышечной ткани с помощью биохимических и иммунохимических методов, хорошо известных специалистам в данной области. Наконец, можно применять электромиографию, отображающую мышечные, а не нейрогенные характеристики, которые можно оценить количественно.
На первоначальном этапе I были проведены клинические исследования с целью оценки безопасности оральных доз [D-MeAla]3-[EtVal]4-CsA и определения фармакокинетического профиля и профиля безопасности этого лекарственного вещества. Исследования показали, что дозы в количестве от 50 до 1600 мг в виде водной микроэмульсии переносились хорошо. Наблюдались умеренные кратковременные побочные эффекты, включающие тошноту, рвоту, боли в животе и умеренную головную боль. Эти побочные эффекты не были дозозависимыми.
Клиницистам следует учесть многочисленные факторы при определении пробных доз для проверки эффективности фармацевтической композиции по изобретению, включающей неиммуносупрессорное производное циклоспорина А формулы I, II или III. На первом месте среди них стоят токсичность и период полужизни неиммуносупрессорного производного циклоспорина А. Дополнительные факторы включают размер пациента, возраст пациента, общее состояние пациента (в т.ч. искусственную вентиляцию, клиническую стадию заболевания, степень тяжести симптомов), назначение пациенту других лекарств и т.п. Курс лечения требует многократного введения фармацевтической композиции по изобретению. Как правило, соответствующую дозу вводят один раз в день. Из-за генетической природы заболевания лечение, возможно, потребуется проводить в течение длительного периода времени, возможно в течение жизни пациента.
В настоящее время эффективный фармакологический способ лечения UCMD не известен. Пациентов поддерживают с помощью вакцинации против гриппа и пневмококковой инфекции, а также проводят жесткое лечение любой инфекции с помощью антибиотиков. Поэтому фармацевтическая композиция по настоящему изобретению может содержать другие активные компоненты (один или более), помимо неиммуносупрессорного производного циклоспорина А, такие как, например, один и более антибиотик. Неиммуносупрессорное производное циклоспорина А и другие подобные активные компоненты могут быть введены вместе как части одной и той же фармацевтической композиции или же раздельно как части подходящей схемы приема лекарств, с тем чтобы получить максимальный полезный эффект от всех активных ингредиентов. Подходящая схема приема лекарства, величина каждой вводимой дозы и специфические интервалы между приемами каждого активного вещества зависят от конкретной комбинации задействованных активных веществ, состояния пациента, проходящего курс лечения и других факторов, которые обсуждались в предыдущем абзаце. Подобные дополнительные активные ингредиенты обычно вводят в таких же количествах, в которых, как уже известно, они активны в виде отдельно взятых терапевтических средств. Одобренные FDA дозировки для подобных активных агентов, которые разрешены FDA для назначения их людям, доступны широкому кругу лиц.
Настоящее изобретение касается также использования неиммуносупрессорного производного циклоспорина А формулы I, предпочтительнее неиммуносупрессорного производного циклоспорина А формулы II и наиболее предпочтительно неиммуносупрессорного производного циклоспорина A [D-MeAla]3-[EtVal]4-CsA формулы III для снижения митохондриальной дисфункции и степени апоптоза в клетках пациентов, страдающих ВМ. Кроме того, данное изобретение касается также способа лечения ВМ у пациентов, при котором пациенту вводят эффективное количество неиммуносупрессорного производного циклоспорина А формулы I, предпочтительнее неиммуносупрессорного производного циклоспорина А формулы II и наиболее предпочтительно неиммуносупрессорного производного циклоспорина A [D-MeAla]3-[EtVal]4-CsA формулы III. Далее, изобретение также касается применения неиммуносупрессорного производного циклоспорина А формулы I, II или III в изготовлении лекарства, предназначенного для лечения ВМ. Наконец, изобретение касается фармацевтической композиции для лечения ВМ, включающей эффективное количество неиммуносупрессорного производного циклоспорина А формулы I, II или III, фармацевтически приемлемый носитель и, возможно, эксципиент и разбавитель.
Подразумевается, что все патенты, заявки на патенты и публикации, процитированные здесь, включены в данное описание во всей полноте путем ссылки на них.
Изобретение далее раскрывается в следующих примерах. Примеры приведены с целью иллюстрации для специалистов в данной области, а не предназначены для ограничения изобретения, как описано в формуле изобретения. Таким образом, данное изобретение не следует толковать как ограниченное приведенными примерами, но следует толковать включающим в себя всевозможные вариации, которые становятся очевидными в результате представленного здесь раскрытия изобретения.
ПРИМЕРЫ
Пример 1: Эффекты циклоспорина А и неиммуносупрессорного производного циклоспорина A [D-MeAla]3-[EtVal]4-CsA на митохондриальную флюоресценцию TMRM (мера мембранного потенциала митохондрий) и степень апоптоза в культурах миобластов от пациентов с UCMD
Графики А и В на Фиг.1 показывают мембранный потенциал митохондрий в миобластах от страдающих UCMD пациентов 1 (А) и 4 (В) как функцию времени. Мембранный потенциал митохондрий измеряли на основании накопления тетраметилродаминметилового эфира (TMRM). Миобласты высевали на круглых покровных стеклах диаметром 24 мм и выращивали в течение двух дней в DMEM, содержащей 20% FCS. На величину загруженности клеток и, соответственно, митохондрий потенциометрическими зондами влияет активность насоса множественной лекарственной устойчивости плазматической мембраны (plasma membrane multidrug resistance pump), который ингибируется циклоспорином А. Поэтому обработка циклоспоринами может вызвать повышенную митохондриальную флюоресценцию, что может быть ошибочно трактовано как возрастание мембранного потенциала митохондрий. Для предотвращения подобного артефакта и стандартизации условий загрузки эксперименты проводили в присутствии 1,6 мкМ циклоспорина Н, который ингибирует насос множественной лекарственной устойчивости, но не влияет на РТР. Для измерения мембранного потенциала митохондрий клетки однократно про