Система, способ, машиночитаемый носитель и их применение для визуализации ткани в анатомической структуре
Иллюстрации
Показать всеИзобретение относится к области медицинской визуализации. Система для визуализации рака предстательной железы состоит из источника электромагнитного излучения и детектирующего блока, формирующих множество траекторий электромагнитного излучения. Источник электромагнитного излучения содержится в уретральном блоке, расположенном поблизости от предстательной железы. Детектирующий блок содержится в трансректальном блоке, также расположенном поблизости от предстательной железы. В системе имеется блок реконструкции изображений диффузионной оптической томографии и блок распознавания для распознавания здоровой и пораженной ткани на основании информации, содержащейся в указанном наборе данных изображений. Способ визуализации осуществляется с использованием системы. Машиночитаемый носитель системы содержит сегменты кода, упорядоченные для осуществления всех этапов способа. Система применяется для локализации и диагностирования поражения ткани в анатомической структуре in vivo или для контроля направления при биопсии поражения ткани в анатомической структуре in vivo. Использование изобретения позволяет улучшить разрешение и детектирование пораженной ткани, увеличить глубину проникновения при визуализации и уменьшить нагрузки на обследуемых объектов. 5 н. и 11 з.п. ф-лы, 4 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение в общем относится к области медицинской визуализации. Конкретнее настоящее изобретение относится к визуализации рака предстательной железы in vivo.
УРОВЕНЬ ТЕХНИКИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Рак предстательной железы представляет собой наиболее распространенный рак, за исключением рака кожи, у мужчин. По оценке Американского общества по борьбе с раком, ACS, в Соединенных штатах будет выявлено приблизительно 232090 новых случаев рака предстательной железы, и 30350 мужчин умрут от этого заболевания в 2005. ACS оценивает риск развития рака предстательной железы в течение жизни для мужчин в США как 1 к 6.
Существует несколько тестов для детектирования рака предстательной железы, таких как анализ крови на простатический специфический антиген (PSA), пальцевое ректальное исследование (DRE), трансректальная ультрасонография (TRUS) и пункционная биопсия иглой. PSA, DRE и TRUS обладают ограниченной чувствительностью и/или специфичностью к раку предстательной железы. PSA применяют главным образом, чтобы определить риск наличия рака предстательной железы, а с помощью DRE можно детектировать только пальпируемые поражения, расположенные вблизи ректальной стенки, в зависимости от их размера, формы и т.д. Диагностику рака предстательной железы обычно осуществляют с помощью биопсии, при которой небольшой образец ткани предстательной железы удаляют и исследуют под микроскопом. Основным способом взятия биопсии предстательной железы является пункционная биопсия иглой с использованием TRUS для контроля направления. Биопсия необходима, для того чтобы диагностировать рак предстательной железы и определить его стадию. Если биопсию берут из опухоли, патолог может диагностировать рак с очень высокой точностью. Сложность, однако, заключается в том, чтобы взять биопсию из нужного объема ткани. В этот момент используют TRUS в качестве метода визуализации, чтобы визуализировать пораженную ткань. Системы TRUS также можно использовать для контроля направления при биопсии из объема пораженной ткани. В некоторых случаях существует возможность распознать поражения с помощью TRUS, однако во многих случаях поражения невидимы, и в этих случаях TRUS можно использовать только для того, чтобы определить положение и размер предстательной железы. Поскольку местоположение поражения не известно, случайным образом берут несколько биопсий, как правило, от 6 до 13, пытаясь обнаружить по меньшей мере одно из имеющихся опухолевых поражений. Очевидно, данный способ ведет к многочисленным ложноотрицательным результатам.
Патент США 2004/0030255 А1 раскрывает способ визуализации объектов в сильно рассеивающей мутной среде с помощью группы источников и детекторов. Источники и детекторы могут быть расположены параллельно для геометрии пропускания и/или обратного рассеяния или в цилиндрической геометрии. Детектируемые показатели интенсивности обрабатывают с помощью алгоритма реконструкции изображений.
Патент США 6091983 описывает способ и систему визуализации объекта в мутной среде. Объект делают люминесцентным, и люминесцентный объект возбуждают поляризованным излучением, так чтобы вызвать испускание люминесцентного света люминесцентным объектом. Изображение объекта формируют, используя поляризованные составляющие когерентных или квазикогерентных фотонов. Описан трансректальный зонд визуализации.
Патент США 6280386 В1 раскрывает визуализацию объектов внутри ткани, улучшенную путем применения контрастного вещества к визуализируемому образцу, чтобы увеличить излучение объекта, посредством этого формируя светящийся объект. Два сигнала изображения, соответствующие различным длинам волн, вычитают, чтобы существенно минимизировать составляющую изображения от ткани и усилить составляющую изображения от светящегося объекта.
Патент США 2005/240107 А1 описывает спектральную оптическую визуализацию с помощью основных длин волн поглощения воды. Описано спектральное поляризационное устройство для визуализации с зондом в виде оптического ректального когерентного световода для детектирования опухолей предстательной железы.
EP 1559363 A2 описывает систему, сочетающую технологии оптической визуализации с технологиями анатомической визуализации (например, МРТ, ультрасонографией). Данную систему можно применять для визуального контроля направления, который может включать в себя контроль направления при биопсии. Недостатком данной системы является то, что представленная технология оптической визуализации, т.е. флуоресцентная визуализация, имеет глубину проникновения в исследуемую ткань только приблизительно 1-2 мм, ограниченную сильным рассеянием света. Следовательно, поражения, расположенные глубже 1 мм от поверхности исследуемой ткани, нельзя детектировать с помощью EP 1559363 A2.
Следовательно, улучшенные система, способ, машиночитаемый носитель и их применение были бы полезны, принимая во внимание улучшенное разрешение визуализации, лучшее детектирование пораженной ткани, глубину проникновения при визуализации, гибкость, экономическую эффективность и меньшую нагрузку на обследуемых субъектов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Соответственно, настоящее изобретение предпочтительно добивается уменьшения, смягчения или устранения одного или более из указанных выше недостатков в данной области техники по одному или в любом сочетании и решает по меньшей мере вышеупомянутые проблемы, предлагая систему, способ, машиночитаемый носитель и их применение в соответствии с прилагаемой формулой изобретения.
В соответствии с одним аспектом настоящего изобретения предлагается система для визуализации рака предстательной железы в предстательной железе in vivo. Данная система включает в себя по меньшей мере три блока, выбранные из источника электромагнитного излучения и детектирующего блока, формирующих множество траекторий электромагнитного излучения, при этом по меньшей мере один источник электромагнитного излучения содержится в уретральном блоке, причем указанный уретральный блок выполнен с возможностью введения через уретру и при использовании располагается поблизости от предстательной железы, по меньшей мере один детектирующий блок содержится в трансректальном блоке, причем указанный трансректальный блок выполнен с возможностью ректального введения через прямую кишку и при использовании располагается поблизости от предстательной железы, и где источник электромагнитного излучения настроен так, чтобы испускать электромагнитное излучение, падающее на предстательную железу, и детектирующий блок настроен так, чтобы принимать электромагнитное излучение, при этом электромагнитное излучение несколько раз претерпевало рассеяние в предстательной железе, и система, кроме того, включает в себя: блок реконструкции изображений для реконструирования набора данных изображений диффузионной оптической томографии (DOT) предстательной железы на основании принятого рассеянного электромагнитного излучения по меньшей мере одним детектирующим блоком; и блок распознавания для распознавания здоровой и пораженной ткани на основании информации, содержащейся в наборе данных изображений.
В соответствии с другим аспектом настоящего изобретения предлагается способ визуализации рака предстательной железы в предстательной железе in vivo. Данный способ включает в себя испускание электромагнитного излучения, падающего на предстательную железу, по меньшей мере одним источником электромагнитного излучения уретрального блока, причем указанный уретральный блок располагают поблизости от предстательной железы; прием электромагнитного излучения с помощью по меньшей мере одного детектирующего блока трансректального блока, причем указанный трансректальный блок располагают поблизости от предстательной железы, при этом электромагнитное излучение несколько раз претерпевало рассеяние в предстательной железе, и испускание падающего электромагнитного излучения и прием электромагнитного излучения формируют множество траекторий электромагнитного излучения, при этом способ, кроме того, включает в себя реконструирование набора данных изображений диффузионной оптической томографии предстательной железы на основании принятого рассеянного электромагнитного излучения и распознавание здоровой и пораженной ткани на основании информации, содержащейся в наборе данных изображений.
В соответствии с еще одним аспектом настоящего изобретения предлагается машиночитаемый носитель, содержащий компьютерную программу для обработки данных на компьютере для визуализации рака предстательной железы в предстательной железе in vivo. Компьютерная программа содержит сегмент кода испускания для испускания электромагнитного излучения, падающего на предстательную железу, по меньшей мере одним источником электромагнитного излучения уретрального блока, сегмент кода приема для приема электромагнитного излучения с помощью по меньшей мере одного детектирующего блока трансректального блока, при этом электромагнитное излучение несколько раз претерпевало рассеяние в предстательной железе, и испускание падающего электромагнитного излучения и прием электромагнитного излучения формируют множество траекторий электромагнитного излучения, при этом компьютерная программа, кроме того, содержит сегмент кода реконструирования для реконструирования набора данных изображений диффузионной оптической томографии предстательной железы на основании принятого рассеянного электромагнитного излучения и сегмент кода распознавания для распознавания здоровой и пораженной ткани на основании информации, содержащейся в наборе данных изображений.
В соответствии с другим аспектом настоящего изобретения предлагается применение системы в соответствии с любым из пунктов 1-9 формулы изобретения для локализации и диагностирования поражения ткани в анатомической структуре in vivo.
В соответствии со следующим аспектом настоящего изобретения предлагается применение системы в соответствии с любым из пунктов 1-9 формулы изобретения для контроля направления при биопсии поражения в ткани в анатомической структуре in vivo.
В соответствии с еще одним аспектом настоящего изобретения предлагается применение DOT для диагностирования рака предстательной железы in vivo.
Варианты осуществления настоящего изобретения имеют отношение к применению диффузионной оптической томографии (DOT) для создания 3D изображения для детектирования вызывающей подозрение ткани предстательной железы. Изображение DOT можно применять для контроля направления при биопсии, уменьшая посредством этого число ложноотрицательных результатов.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Указанные и другие аспекты, признаки и преимущества, которые доступны для настоящего изобретения, станут очевидны и понятны из следующего описания вариантов осуществления настоящего изобретения, причем будут даны ссылки на прилагаемые чертежи, на которых:
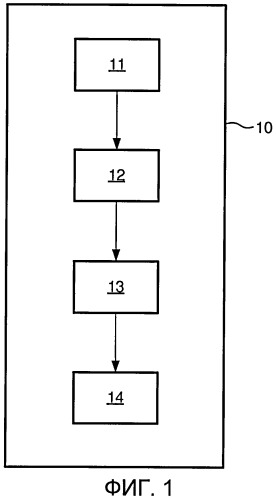
Фиг.1 представляет собой схематическое изображение системы в соответствии с одним вариантом осуществления;
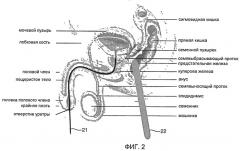
Фиг.2 представляет собой иллюстрацию, изображающую систему в соответствии с одним вариантом осуществления;
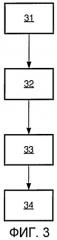
Фиг.3 представляет собой схематическое изображение способа в соответствии с одним вариантом осуществления; и
Фиг.4 представляет собой схематическое изображение машиночитаемого носителя в соответствии с одним вариантом осуществления.
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Несколько вариантов осуществления настоящего изобретения будут более подробно описаны ниже со ссылкой на прилагаемые чертежи, для того чтобы специалисты в данной области техники были способны осуществить настоящее изобретение. Настоящее изобретение может быть, однако, воплощено во множестве различных форм и не должно быть истолковано как ограниченное вариантами осуществления, изложенными в настоящем описании. Точнее, данные варианты осуществления предоставляются, для того чтобы данное описание было обстоятельным и полным, и полностью выражают объем настоящего изобретения для специалистов в данной области техники. Данные варианты осуществления не ограничивают настоящее изобретение, но настоящее изобретение ограничено только прилагаемой формулой изобретения. Более того, не предполагается, что терминология, используемая в подробном описании определенных вариантов осуществления, иллюстрированных на прилагаемых чертежах, ограничивает настоящее изобретение.
Следующее описание сфокусировано на вариантах осуществления настоящего изобретения, применимых для системы визуализации и, в частности, для системы визуализации для контроля направления при биопсии ткани.
Диффузионная оптическая томография (DOT) представляет собой метод оптической визуализации, который может применяться для визуализации внутри сильно рассеивающих объектов, таких как ткань. В связи с сильным рассеянием и поглощением не представляется возможным получить непосредственное оптическое изображение внутренней части органа. Для решения данной проблемы ткань или орган освещают из одного или более мест и детектируют диффузионное прошедшее или отраженное электромагнитное излучение в одном или более местах. Из ослабления между различными парами источник-детектор вычисляют оптические параметры внутри органа. Часто используют излучение в ближней инфракрасной области (NIR), поскольку оно обладает относительно большой глубиной проникновения в биологическую ткань. При DOT визуализации предпочтительным является измерение множества траекторий электромагнитного излучения, а для этого необходимо множество источников электромагнитного излучения и/или множество детекторов.
Настоящее изобретение использует метод, называемый диффузионной оптической томографией, DOT, для получения изображения ткани in vivo, такой как предстательная железа. В диффузионной оптической томографии могут быть определены истинные параметры поглощения и рассеяния в ткани. В ближней инфракрасной области параметры поглощения определяются в основном кровью, водой и липидами. Поэтому в DOT поглощения могут быть получены набором данных 3D изображений содержания крови, насыщения кислородом и концентрации липидов в воде.
Дополнительно может быть получена серия 3D изображений параметров рассеяния. Поскольку параметры поглощения и рассеяния в ткани различны для злокачествленной и здоровой ткани, оказывается возможным различить злокачествленную и здоровую ткань на полученной 3D карте.
В варианте осуществления в соответствии с Фиг.1 предлагается система для визуализации ткани в анатомической структуре in vivo. Данная система включает в себя по меньшей мере два источника 11 электромагнитного излучения для испускания электромагнитного излучения, падающего на анатомическую структуру. Когда электромагнитное излучение распространяется сквозь анатомическую структуру, оно рассеивается и частично поглощается в ткани вследствие оптических характеристик ткани. Различные ткани имеют различные оптические характеристики, и, следовательно, электромагнитное излучение рассеивается различным образом в зависимости от типа ткани. Данная система, кроме того, включает в себя по меньшей мере два детектирующих блока 12 для приема рассеянного электромагнитного излучения.
В настоящем описании система включает в себя по меньшей мере один источник и два или более детектора, или система включает в себя по меньшей мере один детектор и два или более источника. Таким способом оказывается возможным осуществить измерение по меньшей мере двух различных траекторий электромагнитного излучения через ткань.
Кроме того, принято, что один источник электромагнитного излучения, который применяют, чтобы испускать электромагнитное излучение в различных местах, например втягиваемый световод, считают множественными источниками электромагнитного излучения.
Кроме того, блок 13 реконструкции изображений входит в состав системы для реконструирования 3D изображения диффузионной оптической томографии ткани на основании принятого рассеянного электромагнитного излучения, принятого двумя детектирующими блоками 12. Данное изображение содержит информацию из различных типов ткани, и из данного изображения может быть вычислено местоположение различных типов ткани. Соответственно, данную систему можно применять, чтобы различить здоровую и пораженную ткань in vivo. В варианте осуществления детектируемый тип ткани характеризуют как здоровую и пораженную ткань, как, например, здоровые клетки предстательной железы и злокачественные клетки предстательной железы соответственно.
РЕЖИМЫ ДИФФУЗИОННОЙ ОПТИЧЕСКОЙ ВИЗУАЛИЗАЦИИ
Следующий раздел описывает различные варианты проведения DOT. Все способы требуют специализированных аппаратных средств, программного обеспечения и алгоритмов реконструкции изображений.
В варианте осуществления система работает, используя стационарную область, т.е. измерения, вычисления и реконструкцию в системе производят в стационарной области, что также называют DOT непрерывного излучения. Преимуществом стационарного метода является простая и довольно недорогая детектирующая система и то, что электронную детектирующую аппаратуру с малым шумом можно использовать при ограниченной стоимости. Однако при использовании одной длины волны с помощью стационарной области можно определить только затухание, которое является функцией результата поглощения и рассеяния.
В варианте осуществления система работает, используя временную область, т.е. измерения, вычисления и реконструкцию в системе производят во временной области. Преимуществом временной области является то, что могут быть разделены параметры поглощения и рассеяния ткани.
В варианте осуществления система работает, используя частотную область, т.е. измерения, вычисления и реконструкцию в системе производят в частотной области, что также называют волнами плотности диффузионных фотонов. Преимуществом частотной области, аналогично временной области, является то, что могут быть разделены параметры поглощения и рассеяния ткани.
Каждый из методов визуализации может применяться в двух режимах, режиме поглощения, который также называют режимом затухания, и режиме флуоресценции. В режиме поглощения длины волн падающего электромагнитного излучения и детектируемого электромагнитного излучения равны. С помощью режима поглощения можно определить параметры поглощения и рассеяния ткани, например, посредством измерения затухания между всеми парами источник-детектор и использования реконструкции изображений.
В варианте осуществления с использованием режима поглощения источники электромагнитного излучения испускают электромагнитное излучение, содержащее множество длин волн, и детекторы обладают способностью приема множества длин волн. Блок реконструкции изображений использует спектральную информацию, полученную детекторами, для реконструирования соответствующего 3D изображения. С помощью DOT на разных длинах волн, которую также называют спектроскопической DOT, могут быть определены концентрации четырех хромофоров близкой инфракрасной области в ткани: оксигемоглобина, дезоксигемоглобина, воды и липидов.
Альтернативно, источники электромагнитного излучения могут испускать электромагнитное излучение, которое возбуждает электроны в атомах ткани до более высокого энергетического состояния. Когда электроны возвращаются в низкоэнергетическое состояние, избыток энергии получает форму флуоресцентного света. Следовательно, детектирующий блок можно применять в режиме флуоресценции. В этом случае применяют фильтры, чтобы заблокировать возбуждающий свет. Детектируемая флуоресценция может представлять собой аутофлуоресценцию ткани или флуоресценцию экзогенного контрастного вещества. Детектируемый флуоресцентный сигнал зависит от концентрации и распределения флуорофоров и от параметров рассеяния и поглощения ткани. Преимущества измерений флуоресценции по отношению к измерениям поглощения включают: более низкий уровень фона и более высокий контраст.
В варианте осуществления источник электромагнитного излучения испускает электромагнитное излучение одной длины волны, т.е. это источник электромагнитного излучения с узким спектром длин волн, такой как лазер.
В варианте осуществления для визуализации ткани применяют аутофлуоресценцию. При использовании аутофлуоресценции контрастное вещество не вводят и визуализируемую ткань, такую как предстательная железа, освещают электромагнитным излучением определенной возбуждающей длины волны. Детектируют флуоресцентный свет в форме аутофлуоресценции, а возбуждающий свет подавляют фильтрами на траекториях детектирования.
В варианте осуществления вводят флуоресцентное контрастное вещество и визуализируемую ткань, такую как предстательная железа, освещают электромагнитным излучением определенной возбуждающей длины волны. Детектируют флуоресцентный свет, а возбуждающий свет подавляют фильтрами на траекториях детектирования.
РЕКОНСТРУКЦИЯ ИЗОБРАЖЕНИЙ
В варианте осуществления для обсчета изображений применяют алгоритм реконструкции изображений для получения результирующего 3D изображения ткани. Можно применить несколько известных алгоритмов реконструкции изображений, таких как, без ограничения, (с фильтрацией) обратная проекция и моделирование по методу конечных элементов (FEM).
Блок реконструкции изображений может представлять собой любой блок, обычно используемый для исполнения данных задач, например аппаратные средства, такие как процессор с памятью. Процессор может представлять собой любой из множества процессоров, таких как процессоры Intel или AMD, ЦП, микропроцессоры, программируемые интеллектуальные компьютерные (PIC) микроконтроллеры, цифровые сигнальные процессоры (DSP) и т.д. Однако объем настоящего изобретения не ограничен указанными конкретными процессорами. Память может представлять собой любую память, подходящую для хранения информации, такую как модули памяти с произвольной выборкой (RAM), такие как RAM двойной плотности (DDR, DDR2), RAM одинарной плотности (SDRAM), статические RAM (SRAM), динамические RAM (DRAM), видео RAM (VRAM) и т.д. Память также может представлять собой FLASH память, такую как USB, Compact Flash, SmartMedia, память MMC, MemoryStick, карта SD, MiniSD, MicroSD, карта xD, TransFlash, и память MicroDrive и т.д. Однако объем настоящего изобретения не ограничен указанными конкретными модулями памяти.
В варианте осуществления аппарат входит в состав медицинской рабочей станции или медицинской системы, такой как система компьютерной томографии (КТ), система магнитно-резонансной визуализации (MRI) или система ультрасонографической визуализации (US).
ДЕТЕКТИРУЮЩИЙ БЛОК
В варианте осуществления детектирующий блок представляет собой фотодетектор, способный детектировать общее количество электромагнитного излучения, падающего на детектор. Примером такого детектора является кремниевый фотодиод.
В варианте осуществления детектирующий блок представляет собой спектрофотометр, способный детектировать множество длин волн принимаемого рассеянного электромагнитного излучения.
В другом варианте осуществления детектирующий блок включает в себя одну или более детекторных матриц.
В следующем варианте осуществления детектор включает в себя комбинацию оптических устройств и детектирующей интегральной схемы. Если детектирующая интегральная схема представляет собой монохромную детектирующую интегральную схему, она не обладает способностью идентифицировать длины волн принимаемого электромагнитного излучения. В таком случае оптические устройства могут, например, представлять собой систему линз, решетку или призму, чтобы обеспечить рефракцию принимаемого электромагнитного излучения до его попадания на детектирующую интегральную схему, для того чтобы было возможным определить спектр длин волн принимаемого электромагнитного излучения и таким образом предоставить в блок реконструкции изображений информацию относительно возможного типа ткани и т.д.
Могут применяться несколько детектирующих интегральных схем, такие как, без ограничения, интегральные схемы на приборе с зарядовой связью CCD или интегральные схемы с комплементарной логикой на транзисторах металл-оксид-полупроводник CMOS. Цветные интегральные схемы CCD и CMOS в равной мере приемлемы в пределах объема настоящего изобретения. Альтернативный вариант осуществления получения спектральной информации заключается в том, чтобы использовать спектрально независимый детектор (кремниевый фотодиод) и освещать ткань последовательно электромагнитным излучением различных длин волн.
ИСТОЧНИК ЭЛЕКТРОМАГНИТНОГО ИЗЛУЧЕНИЯ
В варианте осуществления источник электромагнитного излучения испускает электромагнитное излучение, имеющее одну длину волны или электромагнитное излучение из небольшого диапазона длин волны с центром в одной длине волны.
Можно также использовать источник электромагнитного излучения с широким диапазоном и измерять принимаемое широкополосное электромагнитное излучение с помощью детектирующего блока. В варианте осуществления источник электромагнитного излучения испускает электромагнитное излучение, содержащее множество длин волн. Примерами таких источников электромагнитного излучения являются, без ограничения: лампы накаливания, которые испускают только приблизительно 10% своей энергии в виде видимого света, а остальное в виде инфракрасного света, светоизлучающие диоды, газоразрядные лампы, такие как неоновые лампы и неоновые знаки, ртутные лампы и лазеры и т.д.
ЗОНДЫ
Система включает в себя как трансректальный зонд, так и трансуретральный зонд. Трансуретральный зонд включает в себя один или более источников электромагнитного излучения. При использовании трансуретральный зонд помещают в уретру поблизости от предстательной железы. Трансректальный зонд включает в себя один или более детекторов для приема электромагнитного излучения от источников электромагнитного излучения трансуретрального зонда. При использовании трансректальный зонд помещают в прямую кишку поблизости от предстательной железы. На Фиг.2 показано положение трансуретрального зонда 21 и трансректального зонда 22 при использовании в соответствии с одним вариантом осуществления.
В некоторых вариантах осуществления трансректальный и трансуретральный зонды располагают таким образом, что предстательная железа расположена между зондами. Более конкретно, зонды располагают таким образом, что испускаемое уретральным зондом электромагнитное излучение распространяется сквозь предстательную железу, а детекторы трансректального зонда располагают так, чтобы принимать рассеянное электромагнитное излучение. При использовании данного расположения система чувствительна к параметрам ткани в предстательной железе, и, следовательно, помехи от окружающей ткани минимальны.
В варианте осуществления трансректальный зонд, кроме того, включает в себя источники электромагнитного излучения для испускания электромагнитного излучения, рассеиваемого в предстательной железе.
В варианте осуществления трансуретральный зонд, кроме того, включает в себя по меньшей мере один детектирующий блок для приема электромагнитного излучения, рассеиваемого в предстательной железе.
В варианте осуществления система содержит зонд, размещаемый в мочевом пузыре. Зонд, размещаемый в мочевом пузыре, имеет форму зонта, который может быть раскрыт внутри мочевого пузыря. Мочевой пузырь может содержать источники электромагнитного излучения и/или детекторы. При использовании зонт касается нижней части мочевого пузыря, чтобы располагаться настолько близко к области предстательной железы, насколько возможно.
В другом варианте осуществления в системе содержится седловидный зонд. Седловидный зонд имеет форму седла и при использовании касается области гениталий и включает в себя источники и/или детекторы.
В варианте осуществления для визуализации предстательной железы применяют комбинацию трансректального, трансуретрального зондов, зонда для мочевого пузыря или седловидного зонда, причем каждый зонд может включать в себя ноль, один или более источников электромагнитного излучения и ноль, один или более детекторов.
В варианте осуществления по меньшей мере один из зондов включает в себя по меньшей мере один источник, и по меньшей мере один из зондов включает в себя по меньшей мере один из детекторов.
В варианте осуществления блок реконструкции изображений использует DOT в качестве единственного метода визуализации.
В варианте осуществления трансуретральный зонд представляет собой трансуретральный эндоскоп.
В другом варианте осуществления трансуретральный зонд представляет собой световод, в котором источник электромагнитного излучения расположен ex vivo.
В варианте осуществления трансректальный зонд представляет собой трансректальный эндоскоп.
В варианте осуществления трансректальный и/или трансуретральный зонд включает в себя ультрасонографический блок. Тогда как DOT чувствительна в большей степени к концентрации крови и оксигенации крови, ультрасонографический блок предоставляет топографические подробности, такие как границы предстательной железы, ректальной стенки и иглы для биопсии. Следовательно, данный вариант осуществления можно использовать для контроля направления при биопсии, после того как представляющие интерес пораженные области локализованы с помощью изображения из блока реконструкции изображений. Для реконструкции изображений должно быть известно расположение источников электромагнитного излучения и детектирующих блоков по отношению друг к другу. Это особенно сложно, когда используют комбинацию двух эндоскопов. Ультрасонографический блок можно использовать, чтобы определить расположение и ориентацию зонда или зондов по отношению друг к другу. Если ультрасонографический блок внедрен в трансректальный зонд, трансуретральный эндоскоп ясно виден, и наоборот. Сочетание с ультрасонографией улучшит результирующее изображение из блока реконструкции изображений путем совмещения обоих изображений или путем использования анатомической информации, полученной с помощью УЗИ, для реконструкции оптического изображения.
В варианте осуществления трансректальный и/или трансуретральный зонд включают в себя блок для биопсии, настроенный на взятие биопсии предстательной железы. Блок для биопсии получает информацию от блока визуализации относительно точного местоположения представляющего интерес типа ткани, такого как пораженная ткань. Данный вариант осуществления обладает тем преимуществом, что можно проводить биопсию во время визуализации ткани. Тем самым устраняется проблема изменения положения между инструментами для визуализации и для биопсии. В варианте осуществления блок реконструкции изображений настраивают так, чтобы непрерывно создавать изображение на основании как информации детектирующего блока, так и информации ультрасонографического блока.
В варианте осуществления расстояние между каждым источником электромагнитного излучения и каждым детектором составляет от 2 мм до 10 см. Это означает, что все детектируемое электромагнитное излучение несколько раз претерпевало рассеяние, и, следовательно, в алгоритме реконструкции изображений можно применять диффузионную аппроксимацию. Преимущество диффузионной оптической томографии над непосредственной визуализацией заключается в том, что глубина визуализации возрастает вплоть до 10 см по сравнению с 1 мм при непосредственной визуализации. Следовательно, при помощи данного варианта осуществления становится возможным детектировать типы ткани, расположенные глубже 1 мм.
При практическом осуществлении трансуретральный и трансректальный эндоскопы в соответствии с вариантами осуществления применяют для контроля направления при биопсии вызывающей подозрение злокачественной ткани предстательной железы. Уретральный эндоскоп содержит один или более источников и может представлять собой втягиваемый световод. Ректальный эндоскоп объединяет один или более детекторов для DOT и ультразвуковой зонд. УЗИ используют, чтобы определить положение уретрального зонда по отношению к ректальному зонду.
Систему в соответствии с некоторыми вариантами осуществления настоящего изобретения можно применять для локализации и диагностирования поражения в организме человека in vivo. В некоторых применениях, если определено точное местоположение поражения, можно взять биопсию из поражения с помощью, например, ультразвукового метода контроля направления иглы для биопсии. Применение системы существенно уменьшает количество отрицательных биопатов по сравнению с применяемыми в настоящее время «слепыми» методами. Тем самым уменьшается дискомфорт пациента и минимизируются инфекции, поскольку уменьшается количество биопатов. Затем биопсия может быть подвергнута анализу, чтобы определить тяжесть поражения. После того как биопсия будет проанализирована, может производиться лечение области поражения, чтобы вылечить пациента. В других применениях может производиться лечение без необходимости в биопсии. Лечение поражения может производиться с помощью лучевой терапии, химиотерапии и т.д.
В варианте осуществления в соответствии с Фиг.1 предлагается система 10 для визуализации рака предстательной железы в предстательной железе in vivo. Система включает в себя по меньшей мере три блока, выбранные из источника 11 электромагнитного излучения 11 и детектирующего блока 12, формирующих множество траекторий электромагнитного излучения, где источник электромагнитного излучения настроен так, чтобы испускать электромагнитное излучение, падающее на предстательную железу, и детектирующий блок настроен так, чтобы принимать электромагнитное излучение, причем электромагнитное излучение несколько раз претерпевало рассеяние в предстательной железе, при этом система, кроме того, включает в себя: блок 13 реконструкции изображений для реконструирования набора данных изображений диффузионной оптической томографии предстательной железы на основании принятого рассеянного электромагнитного излучения по меньшей мере одним детектирующим блоком; блок 14 распознавания для распознавания здоровой и пораженной ткани на основании информации, содержащейся в наборе данных изображений.
Блок распознавания может состоять из процессора и памяти того же типа, как упомянутые выше по отношению к варианту осуществления блока реконструкции изображений, способных осуществить анализ изображений набора данных изображений диффузионной оптической томографии, чтобы различить здоровую и пораженную ткань.
В варианте осуществления в соответствии с Фиг.3 предлагается способ визуализации ткани в анатомической структуре. Способ включает испускание 31 электромагнитного излучения, падающего на предстательную железу, прием 32 электромагнитного излучения, причем электромагнитное излучение несколько раз претерпевало рассеяние в предстательной железе, где испускание падающего электромагнитного излучения и прием электромагнитного излучения формируют множество траекторий электромагнитного излучения, причем способ, кроме того, включает реконструирование 33 серии изображений диффузионной оптической томографии предстательной железы на основании принятого рассеянного электромагнитного излучения и распознавание 34 здоровой и пораженной ткани на основании информации, содержащейся в наборе данных изображений.
В варианте осуществления способ включает в себя испускание падающего электромагнитного излучения из трансуретрального зонда на предстательную железу человека, где трансуретральный зонд расположен поблизости от предстательной железы, прием электромагнитного излучения, которое претерпело рассеяние в предстательной железе, детекторами, расположенными на трансректальном зонде, вычисление набора данных изображений ткани на основании принятого