Способ получения средства для стимуляции репаративной регенерации кожного покрова
Иллюстрации
Показать всеИзобретение относится к области медицины и фармакологии и представляет собой способ получения средства для стимуляции репаративной регенерации кожного покрова, включающий использование компонентов предварительно фракционированной и лиофилизированной плазмы аутокрови, отличающийся тем, что после фракционирования компоненты плазмы крови подвергают анионообменной хроматографии, выделяют сорбирующиеся на анионообменнике компоненты с Мм 20-30 кД, подвергают их диализу, лиофилизируют, а затем в соотношении 6:1000 вводят в имеющий консистенцию мази состав и в виде аппликаций накладывают его на поверхность кожи в зоне повреждения. Изобретение обеспечивает быстрое восстановление органотипичности кожного покрова. 4 ил.
Реферат
Изобретение относится к области медицины и может быть использовано для ускорения восстановления кожных покровов после их механической травмы или операционного вмешательства.
Известно использование компонентов крови для лечения заболеваний животных (Киселева Р.Е., Бояркина Е.Ю. Исследование крови убойных животных для получения белковых препаратов // Фундаментальные исследования, №6, 2004 г., с.66).
Однако неизвестно влияние этих компонентов на репаративные процессы при заживлении кожных ран.
Известны препараты, включающие компоненты донорской крови или крови животных, например солкосерил, которые используются местно в виде аппликаций или орошений (Справочник ВИДАЛЬ "Лекарственные препараты в России". - М.: АстраФармСервис, 1996, с.624-625).
Однако данные препараты в ряде случаев вызывают реакции, связанные с иммунной несовместимостью.
Известен препарат «Фибролан», содержащий плазмин и дезоксирибонуклеазу - гидролитические ферменты, выделенные из плазмы крови и поджелудочной железы крупного рогатого скота.
При использовании предложенного препарата возможно развитие аллергических реакций. Препарат показан преимущественно при лечении осложненных некротическим процессом повреждений покровных тканей и слабо эффективен при лечении их на стадии образования грануляций. Кроме того, использование препарата предусматривает его многократное наложение в течение суток, что обусловлено характером действия (Справочник ВИДАЛЬ "Лекарственные препараты в России", М.: АстраФармСервис, 1996, с.731-732). Использование медикаментозных препаратов не всегда эффективно, что затягивает сроки восстановления структуры кожных покровов.
Известно средство для стимуляции эпителизации раны, содержащее компоненты аутоплазмы. Средство получено путем фракционирования плазмы аутокрови на криопреципитат и супернатант, высаливания последнего 30-50%-м насыщением сульфата аммония, выделения из образовавшегося осадка составляющих с Мм 10 кД, а из них - компонентов кислой природы с их последующим лиофилизированием. При появлении признаков начала процесса эпителизации раны на ее поверхность наносят средство в виде 0,1%-го раствора один раз в сутки до полной эпителизации раны (патент РФ 2222317, опубл. 27.01.2004, бюл. №3).
Однако данное средство применимо уже при начавшемся процессе эпителизации, включает процедуры отделения криопреципитата и выделения составляющих с Мм 10 кД.
Задачей изобретения является разработка средства для стимуляции репаративной регенерации кожных покровов, обеспечивающей быстрое восстановление органотипичности кожного покрова.
Указанная задача решается тем, что в способе получения средства для стимуляции репаративной регенерации кожных покровов используют компоненты плазмы крови доноров с текущим процессом репаративного остео- и/или дермогенеза, которую предварительно последовательно фракционируют высаливанием сульфатом аммония в диапазоне насыщения 30-50%, гельпроникающей хроматографией с выделением компонентов с Мм 20-30 кД, анионообменной хроматографией с выделением сорбирующихся компонентов, после фракционирования компоненты плазмы крови подвергают диализу и лиофилизируют, а затем в соотношении 6:1000 вводят в имеющий консистенцию мази состав и в виде аппликаций накладывают его на поверхность кожи в зоне регенерации.
Способ иллюстрируется описанием, экспериментальными данными, подтверждающими эффективность его применения, и иллюстрациями, на которых изображено:
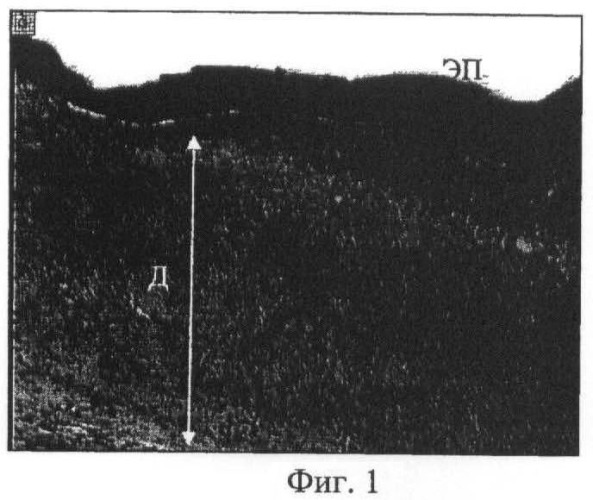
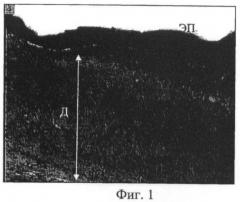
Фиг.1 - микрофотогистологический препарат. Участок регенерата кожного покрова в области создания дефекта кожи экспериментального животного контрольной серии; утолщенный эпидермис с уплощенным рельефом (ЭП), слабо васкуляризированная дерма (Д), представленная рыхлой волокнистой тканью с очагами грануляций. Парафиновый срез. Окраска гематоксилином и эозином. Об. ×2,5, ок. ×10;
Фиг.2 - микрофотогистологический препарат. Клеточный состав дермального слоя кожного регенерата, представленного активными фибробластами (ФБ), макрофагами (МФ), тучными клетками (ТК), гранулоцитами (ГЦ). Контрольная серия. Парафиновый срез. Окраска гематоксилином и эозином. Об. ×40, ок. ×10.
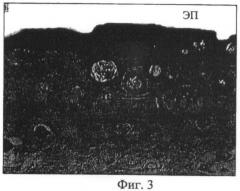
Фиг.3 - микрофотогистологический препарат. Участок регенерата кожного покрова в области создания дефекта кожи экспериментального животного опытной серии; утолщенный эпидермис с рельефной поверхностью (ЭП), дерма с наличием дериватов (ДВ) и микрососудов (МС). Парафиновый срез. Окраска гематоксилином и эозином. Об. ×2,5, ок. ×10;
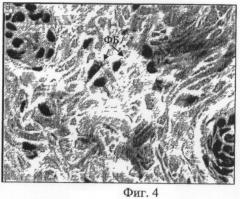
Фиг.4 - микрофотогистологический препарат. Клеточный состав дермального слоя кожного регенерата, представленного преимущественно фибробластами (ФБ). Опытная серия. Парафиновый срез. Окраска гематоксилином и эозином. Об. ×40, ок. ×10.
Способ используют следующим образом.
У донора с текущим процессом репаративного остео- и/или дермогенеза забирают кровь и известным способом получают аутоплазму. Полученную плазму фракционируют до получения компонентов, высаливаемых при концентрации сульфата аммония больше 30 и менее 50% от насыщения, обладающих относительной молекулярной массой 20-30 кД, в отличие от известного способа, когда из образовавшегося осадка выделяют составляющие с Мм 10 кД. Полученные компоненты подвергают анионообменной хроматографии до выделения компонентов, обладающих сродством к анионообменнику, диализуют и лиофильно высушивают. Выделенную композицию в соотношении 6:1000 вводят в имеющий консистенцию мази состав (например, на основе мазевого носителя «Тизоль»). Предложенный способ получения средства принципиально отличается от известного, когда выделенный компонент растворяли в физиологическом растворе 1:1000.
Полученный таким образом состав наносят на стерильные салфетки и в виде аппликаций накладывают на поверхность тела реципиента в области повреждения кожных покровов (на открытую рану). Частота и продолжительность наложения аппликаций зависит от визуально определяемого состояния регенерирующей кожи.
Предложенный способ используют с момента начала лечения в отличие от известного средства, применяемого только при начавшемся процессе эпителизации.
Пример экспериментально-морфологического исследования.
На 24 мышах, массой 23-28 г, которым производили разрез кожи и до момента выведения животных из опыта (на 10-е сутки) ежедневно один раз в сутки производили аппликации состава, содержащего компоненты плазмы крови доноров с активным процессом остео/дермогенеза и мазевого носителя «Тизоль» в соотношении 6: 1000.
В качестве контрольного материала использовали 10 мышей, которым проводили такую же операцию, но в послеоперационном периоде использовали аппликации плацебо.
При гистологическом исследовании кожного покрова в области травмы у животных контрольной серии с наружным наложением чистого мазевого носителя «Тизоль» (контрольная серия эксперимента) обнаружены эпителизация, формирование в области повреждения слабо васкуляризованного соединительнотканного регенерата и отсутствие в нем зачатков дериватов (Фиг.1). Дерма была представлена грубыми пучками коллагеновых волокон, ориентированными в основном параллельно поверхности кожи. Клеточный состав в области повреждения кожного покрова был представлен активными фибробластами периваскулоцитами, макрофагами, тучными клетками, локализованными вблизи микрососудов, встречались очаги скоплений гранулоцитов (Фиг.2).
У животных опытной группы кожный покров, сформированный в области повреждения, был наиболее приближен к норме, о чем свидетельствовало строение эпидермиса и дермы (Фиг.3). Пучки коллагеновых волокон формировали сетчатое сплетение, наблюдалось формирование значительного количества дериватов кожи. Эпидермис приобретал специфический рельефный рисунок. Клеточный состав в области повреждения был представлен преимущественно фибробластами (Фиг.4).
Полученные результаты свидетельствуют, что заявленный способ позволяет получить средство, оказывающее стимулирующее воздействие на заживление кожной раны, способствуя более быстрому восстановлению органотипичности кожного покрова.
Применение заявленного способа получения средства в РНЦ «ВТО» им. акад. Г.А.Илизарова показало, что его применение оказывает стимулирующее воздействие на заживление кожной раны и способствует быстрому восстановлению органотипичности кожного покрова. Предложенный способ легко воспроизводим и прост в применении, может использоваться в ветеринарии, при решении экспериментальных задач, а также в случае использования компонентов аутоплазмы при лечении пациентов с повреждением кожных покровов.
Способ получения средства для стимуляции репаративной регенерации кожного покрова, включающий использование компонентов предварительно фракционированной и лиофилизированной плазмы аутокрови, отличающийся тем, что после фракционирования компоненты плазмы крови подвергают анионообменной хроматографии, выделяют сорбирующиеся на анионообменнике компоненты с Мм 20-30 кД, подвергают их диализу, лиофилизируют, а затем в соотношении 6:1000 вводят в имеющий консистенцию мази состав и в виде аппликаций накладывают его на поверхность кожи в зоне повреждения.