Способ получения гексахлорфлуоресцеин-меченых олигодезоксирибонуклеотидов
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и касается способа получения гексахлорфлуоресцеин-меченых олигодезоксирибонуклеотидов. Охарактеризованный способ предусматривает один из стандартных методов синтеза олигодезоксирибонуклеотидной последовательности, введение в нее гексахлорфлуоресцеинсодержащего модификатора, последующее удаление защитных групп концентрированным водным раствором аммиака, содержащего трет-бутиламин в объемном соотношении от 2:1 до 5:1, при комнатной температуре в течение 21-24 часов и выделение целевого продукта одним из стандартных методов. Представленный способ позволяет получить более высокий выход гексахлорфлуоресцеин-меченых олигонуклеотидов в отсутствии в полученных образцах примесей акридин-производных независимо от способа выделения целевых олигомеров. 7 ил., 4 пр.
Реферат
Предлагаемое изобретение относится к области синтеза флуоресцентно-меченых олигонуклеотидов. Последние находят применение в молекулярной биологии и медицинской диагностике, в частности в ДНК-анализах, где используется полимеразная цепная реакция в режиме реального времени (РВ-ПЦР, или Real Time PCR). Разработка доступного и эффективного метода получения особо чистых гексахлорфлуоресцеин-меченых олигонуклеотидов важна для количественной РВ-ПЦР, а также для ее мультиплексного варианта, когда в ходе одной ПЦР детектируеся наличие нескольких участков ДНК.
Уровень технического состояния.
Флуоресцентно-меченые олигонуклеотиды в настоящее время повсеместно используются в молекулярной биологии и медицинской диагностике [1, 2]. Большинство методов их синтеза предусматривает введение меток в процессе сборки нуклеотидной цепи на твердой фазе. При этом флуорофор должен подвергаться всем последующим процедурам, а именно окислению и деблокированию, и может быть модифицирован в ходе этих процессов.
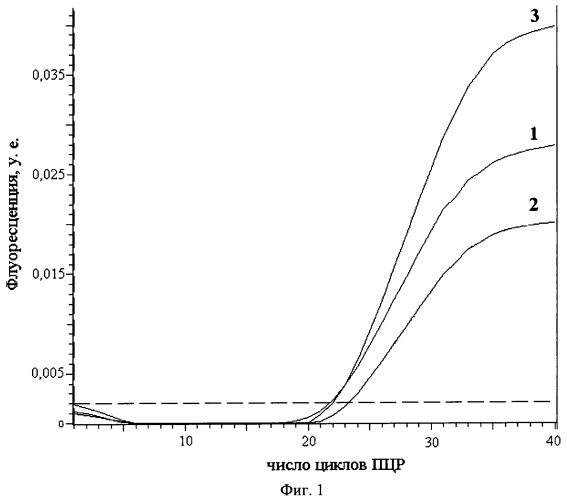
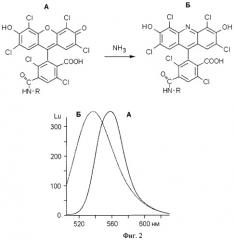
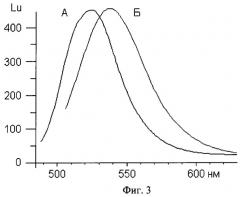
Существует широко принятое мнение, что тщательно синтезированные ДНК-зонды для РВ-ПЦР не нуждаются в серьезной очистке [3]. Гексахлорфлуоресцеиновая (HEX-) метка широко используется в ПЦР-анализах, включая количественные и мультиплексные. Результаты РВ-ПЦР регистрируются в виде кривых накопления флуоресцентного сигнала, по которым рассчитывается наличие и количество наработанного в ходе ПЦР ампликона и, следовательно, наличие и содержание в тестируемом образце искомого участка ДНК. Известно, на примере одного из НЕХ-зондов строения HEX-38-мep-BHQ2, далее обозначенного как Н38В, что форма и результирующая интенсивность флуоресценции ("end point") кривых накопления существенно зависят от способа очистки зонда (гель-электрофорез, обращенно-фазовый картридж или ВЭЖХ) (Фиг.1, [4]). Известно, что в ходе выполнения стандартного протокола синтеза олигонуклеотидов, а именно на стадии аммонолиза (обработки концентрированным водным аммиаком) НЕХ-метка, в зависимости от температуры и продолжительности процесса, на 20-60% трансформируется в остаток замещенного акридина, что изменяет флуоресцентные свойства зонда (Фиг.2, [5]). Примесь акридинпроизводного полноразмерного олигонуклеотида существенно снижает чувствительность РВ-ПЦР-анализа и может в мультиплексном варианте давать ложноположительные результаты по флуоресцеин- (например, (6)-FAM-) содержащему зонду из-за существенного перекрывания областей флуоресценции этих меток (Фиг.3). Известно, что наибольшие выходы НЕХ-олигонуклеотидов, полученных твердофазным синтезом, достигались после удаления защитных групп действием концентрированного раствора аммиака при комнатной температуре за 24 ч или при 50°С за 5 ч, с последующим ВЭЖХ-выделением целевых олигомеров [5], см. также Фиг.4, профили А.
Однако методом ВЭЖХ не всегда успешно можно отделить примеси акридинсодержащих олигонуклеотидов. В ряде случаев не удается подобрать идеальные параметры ВЭЖХ, пики целевого и побочного олигонуклеотидов перекрываются (Фиг.5, профиль А). В результате или целевой НЕХ-олигонуклеотид содержит значительное количество примеси, или его выход снижается на величины вплоть до 50%.
Иногда используются так называемые вырожденные ПЦР-зонды, т.е. содержащие смесь нуклеотидов, от двух до четырех, по одному или нескольким положениям в последовательности. Понятно, что в таких случаях целевой продукт на хроматограмме проявляется в виде нескольких пиков и отделение акридинсодержащей примеси практически невозможно.
Необходимо отметить, что наличие упомянутой примеси в НЕХ-меченом олигонуклеотиде трудно оценить с помощью электрофореза в ПААГ. Из-за разницы в молекулярных массах всего в 1 Да это практически невозможно осуществить и масс-спектрометрическими методами.
Для синтеза меченых олигонуклеотидов авторы использовали твердофазный фосфорамидитный метод, требующий наименьших временных затрат. Тем не менее, очевидно, что при наращивании олигонуклеотидной последовательности другими методами (фосфодиэфирным или Н-фосфонатным), предусматривающими аммонолиз на последней химической стадии процесса, неизбежно образование акридиновых производных.
В научной литературе до публикации [5] трансформация НЕХ-метки водным аммиаком описана не была и, соответственно, не было никаких рекомендаций по ее устранению.
Раскрытие изобретения и технический результат
Техническим результатом настоящего изобретения является разработка способа получения гексахлорфлуоресцеин-меченых олигодезоксирибонуклеотидов, предусматривающего на стадии деблокирования практически полное устранение образования акридинсодержащих примесей. Это существенно облегчает отбор фракций при ВЭЖХ-очистке НЕХ-меченых олигонуклеотидов.
Использование предлагаемого способа приводит к увеличению выходов целевых НЕХ-олигонуклеотидов не менее чем на 25% и к гарантированному отсутствию примесей акридинпроизводных в полученных образцах. Все это обеспечивает максимально точные и воспроизводимые результаты РВ-ПЦР, в том числе и ее мультиплексных вариантов.
Технический результат достигается тем, что для постсинтетической обработки НЕХ-производных олигонуклеотидов вместо концентрированного водного аммиака применяются смеси концентрированного водного аммиака с трет-бутиламином в объемном соотношении от 2:1 до 5:1.
Удаление защитных групп концентрированным водным раствором аммиака проводят при комнатной температуре в течение 21-24 ч.
Описание чертежей
На Фиг.1. показана зависимость формы кривых накопления флуоресцентного сигнала в процессе проведения РВ-ПЦР анализа - с использованием олигонуклеотидного зонда Н38В - от способа очистки последнего. Очевидно преимущество зонда, выделенного с помощью ВЭЖХ.
На Фиг.2. приведена химическая схема трансформации гексахлорфлуоресцеиновой группировки в производное акридина водным аммиаком и различия во флуоресцентных свойствах соответствующих олигонуклеотидов.
Фиг.3. иллюстрирует перекрывание спектров флуоресценции негалогенированной флуоресцеиновой и гексахлоракридиновой меток на примере модельных олигонуклеотидов.
На Фиг.4. показаны фрагменты ВЭЖХ-профилей препаративного выделения зондов Н38В и Н37В после стандартного аммонолиза и после деблокирования по заявляемому способу. Очевидно, что заявляемый способ обеспечивает более высокие выходы НЕХ-содержащих зондов.
На Фиг.5. фрагменты ВЭЖХ-профилей препаративной хроматографии иллюстрируют неэффективное разделение реакционных смесей синтеза НЕХ-содержащих олигонуклеотидов Н23В и Н24, полученных после удаления защитных групп по стандартной методике. Заявляемый способ обеспечивает существенно более высокие выходы зондов за счет отсутствия акридиновых производных.
Фиг.6. доказывает с помощью аналитической ВЭЖХ, что зонд Н38В, полученный по заявляемому способу, не уступает по качеству зонду, полученному по стандартной методике.
Фиг.7. иллюстрирует, что в процессе РВ-ПЦР зонд Н37В, полученный по заявляемому способу, не уступает по качеству зонду, полученному по стандартной методике.
Ниже приведены примеры реализации изобретения.
Примеры 1-2 описывают получение модельного олигонуклеотида состава 5′-НЕХ-Т10 по стандартному протоколу и заявляемому способу и подтверждают увеличение выхода этого олигонуклеотида при реализации изобретения.
Примеры 3.1 и 3.2 описывают получение олигонуклеотидов Н38В и Н37В, хорошо отделяемых с помощью ВЭЖХ от примесей акридиновых производных, по стандартному протоколу и заявляемому способу.
Примеры 4.1 и 4.2 описывают получение олигонуклеотидов Н24 и Н23В составов 5′-НЕХ-24-мер и 5′-HEX-23-мep-BHQ2 соответственно, плохо отделяемых с помощью ВЭЖХ от примесей акридиновых производных, по стандартному протоколу и заявляемому способу.
В итоге Примеры 1-4 подтверждают увеличение выходов НЕХ-меченых олигонуклеотидов при реализации изобретения на 25-55%.
Аналитическая ВЭЖХ показала, что полученные по заявляемому способу препараты НЕХ-меченых олигонуклеотидов не уступают по чистоте препаратам тех же олигомеров, полученных по стандартному протоколу (Фиг.6).
Калибровочные опыты РВ-ПЦР показали, что зонды Н38В и Н37В, полученные по заявляемому способу, дают нормальные и хорошо воспроизводимые кривые накопления с фоновыми величинами флуоресценции даже несколько меньшими, чем при использовании этих же зондов, полученных по стандартному протоколу (Фиг.7).
Следовательно, в заявляемом способе предлагается технологически несложный способ получения гексахлорфлуоресцеинсодержащих олигонуклеотидов, обеспечивающий их существенно более высокие выходы и более надежные результаты при их использовании в качестве зондов для ПЦР в режиме реального времени, по сравнению с теми же олигонуклеотидами, полученными по стандартному протоколу.
Примеры реализации изобретения
Олигонуклеотиды были получены твердофазным амидофосфитным методом на автоматическом синтезаторе ДНК АСМ 800 ("Биоссет", Россия) с использованием стандартных коммерческих нуклеозид-амидофосфитов, флуорофорсодержащего амидофосфита 5′-HEX-amidite, стандартных нуклеозидсодержащих носителей и гасительсодержащего носителя 3′-BHQ-2 CPG (все реагенты - Glen Research, США). Количества носителей составляли 9±0,5 мг/синтез.
ВЭЖХ проводили на хроматографе Agilent Chemstation 1100 Series на колонке Macherey-Nagel Nucleosil 300 С18, 4.6×250 мм, вымывая олигонуклеотиды градиентом ацетонитрила в 0,1 М ацетате аммония при 45-50°С. Детекцию осуществляли при 260 нм в аналитическом режиме и при 285 нм в препаративном режиме.
Спектры флуоресцентной эмиссии получали в процессе ВЭЖХ, используя матричный флуоресцентный детектор Agilent 1100 Series G1321A.
УФ-спектры записывали на УФ-спектрофотометре ND-1000 (NanoDrop Technologies, США), а в процессе ВЭЖХ - с помощью матричного UV-VIS детектора Agilent 1100 Series G1315B.
Количество олигонуклеотидов выражали общепринятым способом, в оптических единицах (о.е.), измеренных по величине поглощения при 260 нм.
Масс-спектры получены на MALDI TOF масс-спектрометрах UltraFlex и MicroFlex (Bruker, Германия), с использованием стандартной мишени - MSP target polished steel (Bruker, Германия). Для приготовления матрицы применяли 3-гидроксипиколиновую кислоту (Fluka, США).
РВ-ПЦР образцов ДНК проводили по методике [4].
Пример 1. Синтез олигонуклеотида 5′-НЕХ-Т10 по стандартному протоколу.
Олигонуклеотид состава 5′-НЕХ-Т10 синтезировали в автоматическом режиме. По окончании синтеза носитель промывали ацетонитрилом, высушивали в токе воздуха, заливали концентрированным раствором аммиака и выдерживали в герметично закрытой пробирке, в соответствии с рекомендациями производителя 5′-HEX-amidite, 24 ч при комнатной температуре. Постаммонолизную смесь после удаления аммиака в вакууме разделяли методом ВЭЖХ. Усредненные на один синтез (всего - 4 синтеза) выходы составили: 6.64 о.е. для 5′-НЕХ-Т10 и 1,47 о.е. для акридиновой примеси.
Пример 2. Синтез олигонуклеотида 5′-НЕХ-Т10 по заявляемому способу.
Протокол отличается от описанного в Примере 1 тем, что носитель после высушивания заливали смесью концентрированного раствора аммиака и трет-бутиламина (2:1 по объемам) и выдерживали 24 ч здесь и далее при комнатной температуре. После ВЭЖХ-очистки усредненный на один синтез (всего - 8 синтезов) выход 5′-НЕХ-Т10 составил 8.4 о.е. или 126% от выхода 5′-НЕХ-Т10, полученного согласно Примеру 1.
Пример 3. Синтез олигонуклеотиов Н38В и Н37В.
Пример 3.1. Синтез по стандартному протоколу.
Олигонуклеотиды Н38В и Н37В составов НЕХ-38мер-ВНQ2 и HEX-37мep-BHQ2 соответственно получали в условиях Примера 1. После ВЭЖХ-очистки (Фиг.4А) усредненный на один синтез (всего - 16 синтезов) выход Н38В составил 5,7 о.е., выход Н37В, усредненный на 1 синтез из 8, составил 5,8 о.е. Выходы побочных полноразмерных акридиновых производных на один синтез для Н38В и Н37В составили около 1,7 о.е.
Пример 3.2. Синтез по заявляемому способу.
Олигонуклеотиды Н38В и Н37В получали в условиях Примера 2, используя смесь концентрированного раствора аммиака и трет-бутиламина (3:1 по объемам для Н38В и 4:1 по объемам для Н37В, 22 ч). После ВЭЖХ-очистки (Фиг.4Б) усредненный на один синтез (всего - 24 синтеза) выход Н38В составил 7,7 о.е. или 135% от выхода Н38В, полученного согласно Примеру 3.1. Выход Н37В, усредненный на 1 синтез из 8, составил 7,9 о.е. или 136% от выхода Н38В, полученного согласно Примеру 3.1.
Пример 4. Синтез олигонуклеотиов Н24 и Н23В.
Чистоту отбираемых фракций контролировали, наблюдая УФ-спектры элюата (Фиг.5).
Пример 4.1. Синтез по стандартному протоколу.
Олигонуклеотиды Н23В и Н24 составов HEX-23мep-BHQ2 и НЕХ-24мер соответственно получали в условиях Примера 1. После ВЭЖХ-очистки (Фиг.5А) усредненный на один синтез (всего - 4 синтеза) выход Н24 составил 7,0 о.е., выход Н23В, усредненный на 1 синтез из 4, составил 4,8 о.е. Акридиновые производные не удалось получить в чистом виде, поэтому их выходы не определялись.
Пример 4.2. Синтез по заявляемому способу.
Олигонуклеотиды Н24 и Н23В получали в условиях Примера 2, используя смесь концентрированного раствора аммиака и трет-бутиламина (5:1 по объемам, 21 ч). После ВЭЖХ-очистки (Фиг.5Б) усредненный на один синтез (всего - 4 синтеза) выход Н24 составил 11.1 о.е. или 159% от выхода Н24, полученного согласно Примеру 4.1. Выход Н23В, усредненный на 1 синтез из 4, составил 7,3 о.е. или 152% от выхода Н23В, полученного согласно Примеру 4.1.
ЛИТЕРАТУРА
1. Li Y., Zhou X., and Ye D. Molecular beacons: an optimal multifunctional biological probe // Biochem. Biophys. Res. Communs. 2008. V. 373. P.457-61.
2. Marras S. A., Tyagi S., and Kramer F. R. Real-time assays with molecular beacons and other fluorescent nucleic acid hybridization probes // Clin. Chim. Acta. 2006. V.363. P.48-60.
3. Yeung А.Т., Holloway В.P., Adams P.S., and Shipley G.L. Evaluation of dual-labeled fluorescent DNA probe purity versus performance in real-time PCR // Biotechniques. 2004. V.36. P.266-270, 272, 274-276.
4. Татаринова О.Н., Лукьянова Т.Н., Зайцева М.А, Веремеев К.Ю., Карпов В.А., Чувилин А.Н., Петрунин Д.Д., Позмогова Г.Е. Влияние способов очистки олигодезоксирибонуклеотидных зондов на эффективность генодиагностики методом PCR в режиме реального времени // Бюлл. эксперим. биол. и мед. 2008. Т.145. №3. С.275-280.
5. Chuvilin A.N., Serebryakova M.V., Smimov I.P., Pozmogova G.E. Byproduct with Altered Fluorescent Properties Is Formed during Standard Deprotection Step of Hexachlorofluorescein Labeled Oligonucleotides // Bioconjugate Chem. 2009. V.20. N 8. P.1441-1443.
Подписи к чертежам
Фиг.1. Зависимость формы кривых накопления флуоресцентного сигнала зонда Н38В от способа очистки последнего. Зонд был очищен с помощью: 1 - электрофореза, 2 - обращенно-фазового картриджа, 3 - ВЭЖХ (взято из [4]).
Фиг.2. Схема трансформации гексахлорфлуоресцеиновой группировки (А) в производное акридина (Б) водным аммиаком (вверху). Флуоресцентные спектры эмиссии соответствующих производных на примере зонда Н38В (внизу). В данном случае R=-(СН2)6-ОР(O)(ОН)-O-олигонуклеотид.
Фиг.3. Спектры флуоресценции (6)-FAM и НЕХ-меток олигонуклеотидов (6)-FAM-T10 (А) и акридинового производного Т10, побочного продукта аммонолиза при получении HEX-T10 (Б).
Фиг.4. Фрагменты ВЭЖХ-профилей препаративного выделения зондов Н38В (панель 1) и Н37В (панель 2):
А) после стандартного аммонолиза;
Б) по заявляемому способу действием смеси концентрированного водного аммиака с трет-бутиламином (при объемных соотношениях 2:1 для Н38В и 3:1 для Н37В).
Здесь и далее пометкой "HEX" обозначены зоны собираемых фракций чистых НЕХ-производных. Зоны здесь и на Фиг.5 размечены на основании УФ-спектров, снимаемых в процессе ВЭЖХ.
Фиг.5. Фрагменты ВЭЖХ-профилей препаративной ВЭЖХ плохо отделяемых НЕХ-содержащих олигонуклеотидов Н23В состава HEX-23мep-BHQ2 (панель 1) и Н24 состава НЕХ-24 мер (панель 2), полученных после удаления защитных групп по стандартной методике (А) и заявляемому способу (Б). "Acr" - зона, где присутствует акридинпроизводное, "BHQ2" - зона, где преобладают нефлуоресцентные производные гасителя.
Фиг.6. Аналитическая ВЭЖХ хроматографически очищенных препаратов зонда Н38В, полученных по стандартной методике (А) и заявляемому способу (Б).
Фиг.7. Кривые накопления, записанные в процессе РВ-ПЦР с использованием ВЭЖХ-очищенного зонда Н37В, полученного по стандартному протоколу (А) и по заявляемому способу (Б).
Способ получения гексахлорфлуоресцеин-меченых олигодезоксирибонуклеотидов, предусматривающий один из стандартных методов синтеза олигодезоксирибонуклеотидной последовательности, введение в нее гексахлорфлуоресцеинсодержащего модификатора, последующее удаление защитных групп концентрированным водным раствором аммиака при комнатной температуре в течение 21-24 ч и выделение целевого продукта одним из стандартных методов, отличающийся тем, что водный раствор аммиака содержит трет-бутиламин в объемном соотношении от 2:1 до 5:1.