Способ моделирования остеоартроза височно-нижнечелюстного сустава
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к экспериментальной стоматологии, и касается способа моделирования остеоартроза височно-нижнечелюстного сустава. Для этого используют антитиреоидный препарат мерказолил (тиамазол) в виде водно-крахмальной суспензии. Препарат вводят энтерально через зонд в дозе 10,0-15,0 мг/кг массы тела крысы 1 раз в день. Введение осуществляют ежедневно в течение 90 дней. Способ обеспечивает создание оптимальной модели дегенеративно-дистрофического поражения сустава без компонента воспаления и позволяет отработать методики исследования, профилактики и лечения этого заболевания. 1 табл., 2 пр., 2 ил.
Реферат
Изобретение относится к медицине, а именно к экспериментальной стоматологии, и касается способа моделирования остеоартроза височно-нижнечелюстного сустава (ВНЧС).
Интерес исследователей к патологии ВНЧС, прежде всего, обоснован значительным количеством таких больных, недостаточной изученностью этого вопроса и противоречивостью результатов исследований [1]. По распространенности, остеоартроз - одна из наиболее часто встречаемых суставных патологий, по различным данным им страдают до 20% населения. Начальные признаки остеоартроза обнаруживаются на рентгенограммах более чем у 60% людей в возрасте старше 40 лет [2]. Недостаточное знание механизмов возникновения этого заболевания является одной из основных причин малой эффективности используемых методов лечения [3]. Заболевание имеет хроническое течение с постепенным нарастанием тяжести клинических проявлений [4]. Со временем клиническая картина остеоартроза нарастает, появляется нарушение контуров сустава, его деформация, боли и хруст, крепитация при движении. Возникают вальгусные деформации, подвывихи суставов. В прилежащих мышцах образуются болезненные мелкие узелки миофиброза [5].
Известен способ моделирования воспалительного поражения суставов в эксперименте [6]. Инициацию адъювантного артрита производят на фоне предварительного охлаждения суставов. Вначале конечности подопытных беспородных крыс помещают в лоток со смесью льда и воды при температуре 2-6°С в течение 13-15 минут ежедневно в течение 1-3 дней. Затем через 1-2 часа после последнего охлаждения проводят инъекции адъюванта в подушечки задних лап. Через 35-40 дней на фоне хронизации процесса начинают производить требуемые исследования. Однако данный способ предназначен для моделирования воспалительного поражения суставов и не позволяет оценить нарушения не воспалительного, дегенеративно-дистрофического характера.
Известен способ моделирования деструктивных процессов в изолированном суставе у животных [7]. Изолированные участки суставных поверхностей укрепляют с помощью акрил-цемента в металлических оправках и помещают в испытательную ячейку вибротрибометра «Optimol-SRV», где в роли разрушительной силы выступает трение. В качестве смазки между трущимися поверхностями фрагментов сустава используют индифферентную жидкость - проточную (дистиллированную) воду. Изобретение позволяет создать модель, при которой трение выступает в качестве разрушительной силы, учитывает силу давления, облегчает стандартизацию проводимых исследований, сокращает время осуществляемого способа. Однако невозможно изучение изменений в суставе после проведенного лечения данной патологии, так как метод является девитальным.
Известен способ моделирования диспластического коксартроза у экспериментального животного, включающий выполнение внесуставной остеотомии подвздошной кости [8]. Внесуставную остеотомию проводят до уровня центра вертлужной впадины с формированием подвижного костно-хрящевого отдела крыши вертлужной впадины. Данная модель позволит исследовать развитие и протекание дегенеративно-дистрофических изменений в диспластическом тазобедренном суставе. Инвазивное внедрение в полость сустава влечет за собой высокую травматичность и воспалительные изменения околосуставных тканей, что является существенным недостатком данного метода.
Известен способ моделирования у животных внутрисуставного дистрофического процесса, включающий в себя внутрисуставное введение преднизалона [9]. Инъекции преднизолона в дозе 15-25 мл 1-2 раза в 2 недели в течение месяца обеспечивают достижение устойчивой клинической картины остеоартроза. Однако недостатком данного способа является травматичность. Внутрисуставное введение препарата способствует разрушению капсулы сустава и приводит к изменениям деструктивно-вспалительного характера.
Известен способ моделирования хронического полнослойного локального дефекта гиалинового хряща коленного сустава в эксперименте на собаках [10]. Способ отличается тем, что после выполнения артротомии в центре нагружаемой зоны мыщелка бедренной кости полой фрезой диаметром 5 мм с ограничителем формируют локальный круглый дефект только на толщину гиалинового хряща без повреждения подлежащей субхондральной кости. Недостатками данного способа являются инвазивное вмешательство и повреждение тканей, в частности нарушение гиалиновой выстилки сустава. Данные повреждения влекут за собой изменения воспалительного характера и нарушения процессов энхондрального остеогенеза. Что не позволяет в полной мере оценить морфологические изменения в тканях элементов сустава.
Известен способ моделирования остеопороза височно-нижнечелюстного сустава [11], взятый в качестве прототипа. Для этого лабораторному животному проводят двустороннюю овариэктомию. Затем вводят омепразол в дозе 0,3-0,4 мг/кг перорально в течение 6 месяцев. Способ обеспечивает повышение точности моделирования остеопороза, возникающего при воздействии ингибиторов протонного насоса. Недостатками данного метода являются травматичность и наличие возможных осложнений, возникающих в послеоперационный период. Кроме того, данный способ не позволяет воспроизвести остеосклеротические процессы в тканях височно-нижнечелюстного сустава, сопровождающие остеоартроз.
Для создания оптимальной модели экспериментального остеоартроза ВНЧС крысам ежедневно энтерально вводят мерказолил (тиамазол) в виде водно-крахмальной суспензии в дозе 5,0-15,0 мг/кг массы тела в течение 90 дней.
Мерказолил относится к группе лекарственных средств, тормозящих образование гормонов щитовидной железы; блокирует фермент пероксидазу, участвующую в йодировании тиронина в щитовидной железе с образованием моно- и дийодтиронина, а затем трийод- и тетрайодтиронина, снижает внутреннюю секрецию Т4. В связи с чем угнетается функция остеобластов, а также снижается захват кальция клетками костной ткани и уменьшается концентрация ц-АМФ, что приводит к нарушению оссификации костей. Препарат снижает основной обмен, ускоряет выведение из щитовидной железы йодидов, повышает реципрокную активацию синтеза и выделения гипофизом ТТГ.
Препарат назначается при тиреотоксикозе, предоперационном периоде, для предварительного и промежуточного лечения дополнительно к радиойодтерапии, послеоперационные рецидивы тиреотоксикоза, узловой зоб.
Способ осуществляют следующим образом. Половозрелым крысам, которые содержатся на стандартном пищевом рационе, вводят мерказолил энтерально через пищевой зонд, в дозе 5,0-15,0 мг/кг массы тела крысы, в виде водно-крахмальной суспензии, 1 раз в день, ежедневно, в течение 90 дней. При использовании суточной дозы мерказолила менее 5,0 мг/кг массы тела животного сроки моделирования остеоартроза увеличиваются. Для предотвращения собственных органотоксических эффектов мерказолила (что может отразиться на чистоте эксперимента) не рекомендуется использовать дозу мерказолила выше 15,0 мг/кг.
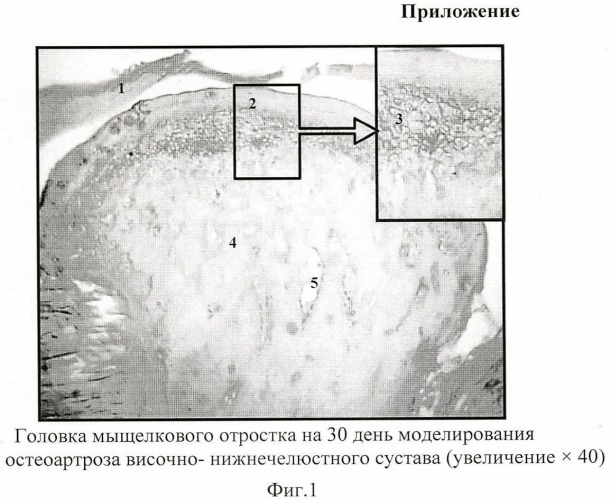
На 30 день со стороны костной ткани сустава прослеживается ряд морфологических изменений (фиг.1). «Аналог суставного диска» (1) ВНЧС гомогенизирован с неравномерным восприятием красителей. Контуры суставных поверхностей приобретают слоистый шероховатый вид с «наползанием» слоев друг на друга; имеются зоны истончения, а так же участки утолщения эластических и коллагеновых волокон. Слой гиалиновой хрящевой ткани (2) существенно увеличивается. В поверхностной зоне хряща появляются участки аппозиционного роста с пролиферацией хондробластов. В зоне зрелого хряща - вакуольная дистрофия пузырчатых хондроцитов (3). В стенках сосудов (5) и периваскулярно обнаруживаются скопления зерен пигмента гемосидерина, что обуславливает повышенную проницаемость сосудистой стенки и косвенно подтверждает отек тканей. Костные трабекулы (4) существенно утолщаются, образуют грубопетлистую сеть. Количество и диаметр кровеносных сосудов уменьшается, их просвет, большей частью, спадется.
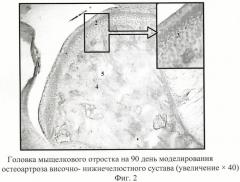
Через 90 дней ремоделирование костной ткани мыщелкового отростка значительно изменяется (фиг.2). Очевидны нарушения процессов энхондрального костеобразования с развитием остеосклеротических процессов. Головка мыщелкового отростка нижней челюсти деформируется (уплощается), поверхность ее не ровная. Поперечный размер мыщелка значительно увеличивается. «Аналог суставного диска» (1) истончается в 2 раза за счет атрофии и гомогенизации, слабой структурности эластических и коллагеновых волокон, их фрагментации и разволокнения. Слой гиалиновой хрящевой ткани (2) резко истончается. В поверхностной зоне - уровень аппозиционного роста снижается, несмотря на то что количество хондробластов увеличивается. Промежуточный слой хряща также источается на фоне уменьшения размеров зрелых хондроцитов, которые приобретают более упорядоченное расположение. Количество изогенных групп (3) уменьшается в сочетании с их диффузной вакуолизацией и умеренным расширением лакун. Базальная зона истончается, кальцинированный слой значительно шире некальцинированного. Костные трабекулы (4) атрофичного вида, расширяются и практически сливаются между собой. Количество и диаметр сосудов (5), толщина сосудистой стенки уменьшаются. Данные изменения позволяют судить о развитии остеоартроза ВНЧС [1].
Результаты исследований представлены в таблице.
Пример 1. Крыса №56 - самец половозрелый, возраст 150 дней. К началу эксперимента вес животного 197 грамм. Содержащийся в стандартных условиях вивария, на стандартном пищевом рационе, в 12-часовом дневном и 12-часовом ночном режиме. К 30 дню эксперимента поведение животного активное, рефлекторные реакции в пределах незначительно снижены. Аппетит хороший, предпочтение отдает как грубой, так и мягкой пище, потребляет умеренное количество жидкости, в дневное время животное активное с перерывами на сон. Отмечена незначительная прибавка в весе - 203 грамма. После эфтаназии животного с применением эфирного наркоза проведена декапитация, получены гистологические исследования препаратов в трансверзальной плоскости. Окраска проведена гематоксилин-эозином. При гистологическом и морфометрическом исследовании тканей сустава выявлено компенсаторное изменение тканей элементов ВНЧС, связанное с пролиферацией хондробластов, увеличением и вакуолизацией хондроцитов, повышением проницаемости сосудистой стенки, отечности подлежащих тканей.
Пример 2. Крыса №78 - самец половозрелый, возраст 210 дней. Вес животного к началу эксперимента 190 грамм. Содержащийся в стандартных условиях вивария на стандартном пищевом рационе, в 12-часовом дневном и 12-часовом ночном режиме. К 90 дню эксперимента поведение животного «вялое», рефлекторные реакции снижены. Масса тела увеличена до 221 грамма. Аппетит снижен, предпочтение отдает мягкой пище, потребляет умеренное количество жидкости, все основное время животное спит. На спинке симметрично от позвоночника определяются очаги аллопеции диаметром 1 см. При гистологическом и морфометрическом исследовании тканей сустава выявлено уменьшение числа сосудистых элементов, утолщение костных балок, которые сливаются между собой, образуя грубопетлистую сеть, что сопровождается деформацией головки мыщелкового отростка и соответствует признакам III стадии остеоартроза ВНЧС [1, 5].
| Таблица | |||
| Изменения морфометрических параметров элементов височно-нижнечелюстного сустава в динамике экспериментального остеоартроза (M±SD) | |||
| Морфометрические параметры (мкм) | Контрольная группа (n=20) | 30-е сутки (n=25) | 90-е сутки (n=25) |
| Диаметр суставной головки ВНЧС | 1078,12±6,48 | 1116,30±7,79* | 1143±7,53*** p1<0,05 |
| Толщина «аналога суставного диска» ВНЧС | 113,25±2,67 | 82,53±3,61*** | 57,54±0,73*** p1<0,001 |
| Толщина гиалинового хрящевого покрытия суставной головки | 136,62±2,30 | 152,50±3,18** | 125,8±1,16*** p1<0,01 |
| Диаметр хондроцитов | 12,65±1,38 | 17,82±0,96*** | 11,63±1,62*** p1<0,001 |
| Толщина костных балок | 112,19±7,05 | 139,11±8,26* | 152,7±2,78 p1<0,001 |
| Диаметр кровеносных сосудов костной ткани | 196,80±7,84 | 127,53±9,49*** | 130,7±8,41*** |
| Толщина сосудистой стенки костной ткани | 16,58±0,65 | 12,76±0,55* | 9,96±0,38** p1<0,01 |
| Примечание. * - степень достоверности различий параметров с данными контроля; где * - р<0,05; **- р<0,01; *** - р<0,001; р - степень достоверности различий между параметрами в динамике эксперимента |
Таким образом, способ моделирования остеоартроза височно-нижнечелюстного сустава позволяет создать модель для изучения механизмов развития дегенеративно-дистрофических заболеваний височно-нижнечелюстного сустава, что дает возможность отработать методики исследования, профилактики и лечения остеоартроза.
Источники информации
1. Есим А.Ж. Морфофункциональные и клинико-лабораторные особенности височно-нижнечелюстного сустава в норме и патологии / А.Ж.Есим, С.К.Зыкеева, С.Х.Испулаева, Д.Н.Касымов, Б.И.Жаугашаров // Проблемы стоматологии. - 2001, №1 - С.32.
2. Фоломеева О.М., Дубинина Т.В., Логинова Е.Ю. и др. Заболеваемость населения России ревматическими заболеваниями в начале нового столетия // Терапевтический архив. 2003; 75(5): С.5-9.
3. Зоткин Е.Г. Рациональная терапия остеоартроза // Научно-практическая ревматология. 2005(5): С.48-51.
4. Верткин А.Л., Наумов А.В. (2007) Деформирующий остеоартроз: стратегия ведения пациентов при соматической патологии. РМЖ, 15(4): С.319-324 (http://www.rmj.ru/articles_4449.htm).
5. Артеменко Н.А., Чвамания М.А. Особенности прогрессирования и лечения остеоартроза. // РМЖ. 2005; 13(7): С.403-406.
6. Евсеева С.Н. Способ моделирования воспалительного поражения суставов в эксперименте / С.Н.Евсеева, Ю.М.Гринзайд, Н.И.Демешко, Ж.А.Скворцова, В.И.Мельникова, Л.А.Пигунова // Пятигорск: ФГУ "Пятигорский ГНИИК Росздрава", патент Российской Федерации №2345424 С1, 2007.
7. Капустин Р.Ф. Способ моделирования деструктивных процессов в изолированном суставе у животных / Р.Ф.Капустин // Белгород: Белгородская государственная сельскохозяйственная академия, патент Российской Федерации №2240602 С2, 2004.
8. Жаденов И.И. Способ моделирования диспластического коксартроза / И.И.Жаденов, А.Б.Петров, И.Д.Ковалева, В.И.Рузанов // Саратов: Саратовский научно-исследовательский институт травматологии и ортопедии Министерства здравоохранения РФ, патент Российской Федерации №2258960 С2, 2003.
9. Слесаренко Н.А. Способ моделирования у животных внутрисуставного дистрофического процесса / Н.А.Слесаренко, И.А.Бубакар, Н.В.Бабичев, Р.Ф.Капустин // Москва: Московская государственная академия ветеринарной медицины и биотехнологии им.К.И.Скрябина, патент Российской Федерации №2117997 C1, 1998.
10. Корнилов Н.Н. Способ моделирования хронического полнослойного локального дефекта гиалинового хряща коленного сустава в эксперименте на собаках / Н.Н.Корнилов, Т.А.Куляба, К.А.Новоселов // СПб.: ФГУ "РНИИТО им.P.P.Вредена Росздрава", патент Российской Федерации №2307399 С1, 2006.
11. Лазебник Л.Б. Способ моделирования остеопороза / Л.Б.Лазебник, А.Э.Лычкова, А.В.Петраков // Москва, патент Российской Федерации №2384894 С1, 2008.
Способ моделирования остеоартроза височно-нижнечелюстного сустава, включающий введение лекарственного препарата, отличающийся тем, что в качестве препарата используют мерказолил в виде водно-крахмальной суспензии, ежедневно, в суточной дозе 10,0-15,0 мг/кг, в течение 90 дней.