Способ выбора артериального доступа для выполнения рентгенэндоваскулярных вмешательств на коронарных артериях
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к кардиологии. Определяют диаметр лучевой и локтевой артерий по данным ультразвукового исследования. Проводят тест Аллена. При определении артерии с диаметром не менее 1,6 мм, а также положительном тесте Аллена выбирают оперативный доступ для проведения процедуры. При выявлении лучевой артерии диаметром более 1,6 мм и большей, чем локтевая артерия, а также положительном прямом тесте Аллена выбирают лучевой доступ. При наличии локтевой артерии диаметром более 1,6 мм и большей, чем лучевая артерия, а также положительном обратном тесте Аллена выбирают локтевой доступ. При одинаковом диаметре лучевой и локтевой артерий, а также положительном тесте Аллена для доступа выбирают артерию с наилучшей пульсацией. При невозможности выполнить лучевой или локтевой доступ используют бедренный доступ. Способ позволяет выбрать оптимальный артериальный доступ для выполнения рентгенэндоваскулярных вмешательств на коронарных артериях, а также снизить количество осложнений со стороны артериального доступа. 4 табл., 5 ил., 3 пр.
Реферат
Изобретение относится к области медицины и может быть рекомендовано для внедрения в клиническую практику ангиографических лабораторий и кардиологических отделений.
Сердечно-сосудистые заболевания занимают в России первое место среди причин смертности и потери трудоспособности лиц зрелого и пожилого возраста. Наиболее распространенными методами лечения атеросклеротического поражения коронарных артерий, помимо медикаментозной терапии, являются аортокоронарное шунтирование (АКШ) и рентгенэндоваскулярное лечение (1, 2). Учитывая высокую заболеваемость ишемической болезнью сердца (ИБС), ежегодно в нашей стране увеличивается число проводимых эндоваскулярных диагностических и лечебных процедур, включающих коронарную ангиографию (КАГ) и транслюминальную баллонную коронарную ангиопластику (ТБКА) со стентированием. Основная задача врача, выполняющего эндоваскулярное вмешательство, - обеспечить максимальную диагностическую ценность, безопасность инвазивного исследования и эффективность лечебной процедуры. Традиционно диагностическая КАГ и ТБКА проводятся через бедренный артериальный доступ. Однако эта методика имеет ряд недостатков: после процедуры в течение 18-24 ч необходимо соблюдать строгий постельный режим, у 4-9% больных после процедуры возникают осложнения со стороны места пункции в виде кровотечений, гематом, ложных аневризм бедренной артерии, артериовенозных фистул, ретроперитонеальных гематом и др., что требует дополнительного лечения, приводит к задержке выписки пациента из стационара, а также удорожанию процедуры (3-5).
Длительное время альтернативой традиционному доступу через бедренную артерию (в случае выраженной извитости подвздошно-бедренного сегмента, его окклюзирующего поражения) являлось использование подмышечной либо плечевой артерии. Однако оба эти метода обладают рядом существенных недостатков, ограничивающих их применение. Доступ через подмышечную артерию можно осуществить с помощью пункции или путем хирургического выделения. Данная методика может быть связана со значительными техническими трудностями и повышенной травматичностью. Это обусловлено анатомическими особенностями, - сосудистый и нервный пучки в подмышечной области не отделены друг от друга соединительнотканной перегородкой, в отличие от бедренной области. В связи с этим при пункции артерии часто отмечаются механические повреждения периферических нервов, сдавление нервов возникшими гематомами, что может приводить к периферическим неврологическим расстройствам. При использовании доступа через плечевую артерию необходимо ее хирургическое выделение, так как сосуд находится в глубине тканей, что исключает возможность использования пункционного способа.
Технический прогресс в области разработки медицинских инструментов привел к появлению новых эндоваскулярных инструментов, обладающих улучшенными техническими характеристиками в сочетании с меньшими размерами. Это привело к значительному снижению частоты осложнений в месте пункции при использовании традиционного бедренного доступа и открыло новые возможности при использовании доступа через другие периферические артерии. В 1989 г. для проведения эндоваскулярного вмешательства впервые использован лучевой артериальный доступ (ЛуАД) (6). Метод получил широкое распространение в клинической практике, так как обладает рядом преимуществ: возможность проведения эффективного гемостаза даже на фоне приема антикоагулянтов и ингибиторов рецепторов гликопротеида IIb/IIIa тромбоцитов ввиду поверхностного расположения лучевой артерии (7, 8). Результатом этого является очень низкая частота геморрагических осложнений (<1/1000), отсутствие необходимости в постельном режиме после исследования и более низкая стоимость процедуры по сравнению с трансфеморальным доступом из-за низкой частоты периферических осложнений и возможности проведения исследования в амбулаторных условиях (3, 4, 9, 10). В некоторых клиниках более 50% вмешательств проводится через лучевой артериальный доступ.
Однако у 15-20% пациентов процедуру не удается проводить через ЛуАД ввиду ряда клинико-анатомических причин: отрицательный тест Аллена, гипоплазия лучевой артерии, аберрантная артерия, стеноз, выраженная извитость, артериовенозные фистулы, выраженный спазм лучевой артерии, перенесенные травмы верхних конечностей, операция мастэктомии, лимфостаз, сложности пункции лучевой артерии (11). Кроме того, лучевая артерия широко используется в качестве аутоартериального кондуита при операции АКШ, а ее катетеризация при интервенционных вмешательствах делает артерию непригодной для этих целей.
С 2001 г.в литературе появляются сообщения по использованию локтевого артериального доступа (ЛоАД) при интервенционных вмешательствах на различных артериальных бассейнах (12-16), который применяется как альтернатива лучевому доступу. Представленные сообщения основаны на небольшом количестве наблюдений, вероятно, вследствие большей технической сложности методики.
Часто диаметр лучевой (ЛуА) или локтевой артерии (ЛоА) бывает небольшим. Малый диаметр артерии создает значительные трудности при пункции, проведении и извлечении инструментария, значительно повышает риск спазмирования артерии и возникновения окклюзии артерии доступа впоследствии.
Ввиду этого сотрудниками лаборатории рентгенэндоваскулярных методов диагностики и лечения в амбулаторных условиях Научно-диспансерного отдела НИИ кардиологии им. А.Л.Мясникова первыми в России разработана и внедрена в клиническую практику методика проведения эндоваскулярных вмешательств посредством пункции локтевой артерии. Данная методика, объединенная с методикой лучевого доступа, получила общее название «Оперативный доступ через артерии предплечья». Указанный метод зарекомендовал себя как удобный, безопасный и малотравматичный, с небольшой частотой периферических сосудистых осложнений. Указанный метод не требует строго постельного режима после исследования больного, как при бедренном доступе, что позволяет раньше активизировать больного и сократить сроки его пребывания в стационаре. Доступ через артерии предплечья выполняется пункционным способом, что исключает необходимость хирургического выделения сосуда.
Благодаря возможности ранней активизации больного данный метод в большинстве случаев позволяет проводить инвазивные диагностические исследования амбулаторно, а лечебные эндоваскулярные вмешательства с краткосрочной госпитализацией в стационар. Кроме того, в некоторых клинических ситуациях данной методике отдается предпочтение благодаря вышеописанным его преимуществам по сравнению с другими методами.
В настоящее время не существует четких рекомендаций по выбору того или иного артериального доступа для выполнения интервенционных вмешательств на различных сосудистых бассейнах.
Задачей изобретения было создание методики выбора наилучшего артериального доступа для выполнения диагностических и лечебных эндоваскулярных вмешательств на коронарных артериях.
Достигаемый технический результат заключается в возможности использования оптимального артериального доступа для выполнения рентгенэндоваскулярных вмешательств на коронарных артериях, а также в снижении количества осложнений со стороны артериального доступа (с 4-10% до 0,3-0,5%).
Осуществление способа.
Правильный выбор артериального доступа для выполнения интервенционных вмешательств должен базироваться на оценке ряда диагностически значимых показателей, полученных при обследовании пациента:
- диаметр лучевой артерии и локтевой артерии,
- результаты теста Аллена.
Тест Аллена - наиболее простой и достоверный способ оценки функционирования поверхностной (образованной преимущественно локтевой артерией) и глубокой (образованной преимущественно лучевой артерией) ладонных дуг. При использовании в качестве оперативного доступа одной из артерий предплечья, наличие функционирующих коллатералей к ней является обязательным, т.к. это защитит руку от ишемии в случае развития окклюзии артерии доступа, которая возникает в 3-10% случаев (19-24).
Методика проведения теста Аллена: одновременно пережимаются ЛуА и ЛоА, пациент несколько раз сжимает кисть до возникновения бледности кожи (ишемия), после чего снимается компрессия с локтевой (прямой тест) или лучевой (обратный тест) артерии. При восстановлении нормального цвета кисти в течение 8-10 сек, вследствие «включения» коллатерального кровотока, проба считается положительной (нормальной), при сохранении бледности кожи (ишемии) - проба отрицательная.
Техника пункции лучевой артерии.
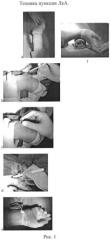
Рука отводится в сторону на 30-45°, под запястье подкладывается валик, кисть находится в положении разгибания (70-90°) и приведения (15°). Выполняется инфильтрационная анестезия кожи 1-3 мл 2% раствора лидокаина над пальпируемой артерией на 1-2 сантиметра проксимальнее шиловидного отростка лучевой кости. Пункция артерии осуществляется иглой открытого типа диаметром 21G до появления пульсирующей струи крови, затем через иглу вводится проводник диаметром 0.021'' длиной 45 см, по игле выполняется надрез кожи и устанавливается интродъюсер диаметром 5-6 Fr длиной 23 см (рис.1). Для профилактики спазма артерии интраартериально через интродъюсер вводится 250 мкг нитроглицерина. Гепарин вводится в интродъюсер из расчета 70 МЕ/кг массы тела пациента при КАГ и 100 МЕ/кг - при ТБКА. Во время процедуры, учитывая показатели активированного времени свертывания, осуществляется дополнительное внутривенное введение гепарина. По окончании процедуры интродъюсер удаляется сразу и накладывается асептическая давящая повязка.
Особенности пункции локтевой артерии (рис.2).
Методика пункции ЛоА во многом схожа с техникой пункции ЛуА, различия заключаются в следующем:
- при пункции ЛоА кисть находится в положении разгибания (70°) и отведения (15-30°),
- зона пункции артерии на 1-2 сантиметра проксимальнее гороховидной кости запястья,
- игла при пункции должна быть направлена от медиального края запястья к латеральному, во избежание травматизации локтевого нерва, который располагается в одном сосудисто-нервном пучке с локтевой артерией, медиальное последней.
Для пункции и катетеризации ЛоА и ЛуА используются специальные наборы "Transradial Kit" компании "Cordis Jonson&Jonson" (США) и "Radiofocus" компании "Terumo" (Япония).
Рис.№1 и №2. На рисунках показана техника пункции локтевой и лучевой артерий: а - положение предплечья и кисти (вид сверху), b -проведение анестезии тонкой иглой и малым количеством анестетика, с - пункция артерии, d - надрез кожи по игле, установка интродъюсера, окончательный вид, f - положение предплечья и кисти (вид сбоку).
Пункция бедренной артерии производится по общепринятой методике Сельдингера (Seldinger).
Ведение пациентов после процедуры. В течение 2 часов после окончания процедуры осуществлялось наблюдение за состоянием повязки врачом или медсестрой с осмотром места пункции каждые 10-15 мин. При проведении диагностической КАГ на амбулаторной основе пациенты выписывались в тот же день через 2-3 часа после окончания процедуры, пациенты, которым проводилась ТБКА выписывались через 1-3 дня. Утром на следующий день всем пациентам проводился осмотр места пункции с пальпацией артерии доступа и выполнением ультразвукового дуплексного сканирования (УЗДС) артерии при подозрении на наличие осложнений.
Доминантной считается артерия предплечья, превосходящая по диаметру вторую артерию более чем на 0,33 мм (IF), что позволяет использовать интродъюсер на 1 размер больше.
Временем пункции артерии считается время от выполнения анестезии до установки интродъюсера.
Общим временем исследования считается время от начала анестезии до удаления интродъюсера и наложения давящей повязки.
Выбор доступа
1. Лучевой доступ (для выбора доступа необходимо выявить одновременное наличие указанных ниже показателей):
- диаметр лучевой артерии более 1,6 мм и больше, чем диаметр локтевой артерии;
- положительный (нормальный) прямой тест Аллена.
2. Локтевой доступ (для выбора доступа необходимо выявить одновременное наличие указанных ниже показателей):
- диаметр локтевой артерии более 1,6 мм и больше, чем диаметр лучевой артерии);
- положительный (нормальный) обратный тест Аллена.
3. При одинаковом диаметре лучевой и локтевой артерий, а также положительном тесте Аллена для доступа выбирают артерию с наилучшей пульсацией и более благоприятной анатомией.
4. Бедренный доступ - при невозможности использования ЛуАд и ЛоАД.
В случаях, когда диаметры ЛуА и ЛоА примерно одинаковы, а тест Аллена положителен как в прямом, так и в обратном направлении для выбора оптимального оперативного доступа необходимо учитывать ряд дополнительных критериев:
- доступность ЛуА и ЛоА для пальпации, хорошая пульсация артерии,
- наличие аномалий развития ЛуА и ЛоА,
- нормальный уровень бифуркации артерии верхней конечности (в области локтевого сгиба),
- наличие выраженных изгибов и бляшек в ЛуА и ЛоА,
- наличие выраженных изгибов плечевой и/или подключичной артерий,
- наличие гемодинамически значимых стенозов подключичной артерии,
- необходимость использования инструментария диаметром более 7F.
В исследование включили 1600 пациентов с ИБС, которым с марта 2009 по май 2011 г. на базе лаборатории рентгенэндоваскулярных методов диагностики и лечения НДО РКНПК были выполнены диагностическая КАГ и ТБКА со стентированием коронарных артерий с использованием различных артериальных доступов. Клиническая характеристика больных представлена в таблице 1.
| Таблица 1. | |||
| Клиническая характеристика пациентов, включенных в исследование, n=1600 | |||
| Показатель | ЛоАДn=400 | ЛуАДn=1200 | p |
| Возраст(лет) | 58±9 | 57±9 | |
| Мужчины (%) | 299 (75) | 936 (78) | 0,2 |
| Факторы риска ИБС (%) | |||
| Сахарный диабет | 66 (16,5) | 160 (13,3) | 0,1 |
| Артериальная гипертония | 309 (77,3) | 908 (75,7) | 0,5 |
| Гиперлипидемия | 149 (37,3) | 484 (40,3) | 0,3 |
| Курение | 117 (29,3) | 334 (27,8) | 0,6 |
| Перенесенный ИМ в предшествующие 2 мес (%) | 40 (10) | 96 (8) | 0,3 |
| Постинфарктный кардиосклероз (%) | 124 (31) | 496 (31,3) | 0,9 |
| Нестабильная стенокардия (%) | 13 (3,3) | 24 (2) | 0,2 |
| Стабильная стенокардия (%) | |||
| I-II ФК | 301 (75,3) | 912 (76) | 0,8 |
| III-IV ФК | 48 (12) | 128 (10,7) | 0,5 |
| Безболевая ишемия миокарда (%) | 37 (9,3) | 136 (11,3) | 0,3 |
| ТБКА в анамнезе (%) | 72 (18) | 168 (14) | 0,1 |
| АКШ в анамнезе (%) | 24 (6) | 36 (3) | 0,1 |
В группу ЛоАД вошли 299 (75%) мужчин, в группу ЛуАД - 936 (78%). Средний возраст больных составил 58±9 лет в группе ЛоАД и 57±9 лет в группе ЛуАД (p=0,2). Распределение основных факторов риска ИБС по группам достоверно не отличалось. Диагностическая КАГ и эндоваскулярное лечение коронарных артерий проводились по общепринятым показаниям (17, 18).
Диагностическая КАГ проводилась 331 (82,8%) пациентам в группе ЛоАД и 1048 (87,3%) в группе ЛуАД, ТБКА - 176 (44%) и 480 (40%) пациентам, соответственно. В группе ЛоАД процедура проводилась амбулаторно в 224 (56%) случаях, в группе ЛуАД в 720 (60%) случаях. У 224 (56%) пациентов в группе ЛоАД процедуры выполнялись через интродъюсер 5F, у 176 (44%) через 6F, в группе ЛуАД у 708 (59%) и 492 (41%), соответственно. Время пункции в группе ЛоАД составило 2,6±1,1 мин против 2,6±1,2 мин в группе ЛуАД, время флюороскопии - 5,5±5,2 мин против 6,0±4,6 мин и общее время исследования - 29,5±17,4 мин против 30,9±16,8 мин соответственно (табл.2).
| Таблица №2. | |||
| Результаты проведения диагностической КАГ и ТБКА через локтевой и лучевой артериальные доступы, n=1600 | |||
| Показатель | ЛоАДn=400 | ЛуАДn=1200 | p |
| Количество КАГ | 331 (82,8%) | 1048 (87,3%) | 0,03 |
| Количество ТБКА | 176 (44%) | 492 (41%) | 0,3 |
| Амбулаторные процедуры | 224 (56%) | 708 (59%) | 0,3 |
| Успех процедуры | 394 (98,5%) | 1185 (98,8%) | 0,8 |
| Переход к альтернативному доступу | 6 (1,5%) | 15 (1,2%) | 0,8 |
| Время пункции (мин) | 2,6±1,1 | 2,6±1,2 | 1 |
| Время процедуры (мин) | 29,5±17,4 | 30,9±16,8 | 0,2 |
| Время рентгеновского облучения (мин) | 5,5±5,2 | 6,0±4,6 | 0,1 |
Успешное завершение процедуры через планируемый доступ имело место у 394 (98,5%) в группе ЛоАД и у 1185 (98,8%) больных в группе ЛуАД. В группе ЛоАД у 369 (92,3%) пациентов КАГ была проведена с использованием правостороннего доступа, 31 (7,7%) пациенту КАГ выполнялась через левую локтевую артерию, в группе ЛуАД 1074 (89,5%) и 126 (10,5%), соответственно. Пункция локтевой артерии была безуспешной у 6 (1,5%) пациентов: в 4 (1%) случаях вследствие развития выраженного спазма ЛоА, в 1 (0,3%) случае из-за невозможности проведения проводника через выраженный изгиб, в 1 (0,3%) случае не удалось пунктировать артерию. Во всех случаях процедуры были завершены альтернативными доступами: левым лучевым у 3 (0,8%) пациентов, левым локтевым у 2 (0,5%) пациентов и правым бедренным у 1 (0,3%) пациента. В группе ЛуАД пункция оказалась безуспешной у 15 (1,2%) пациентов: в 10 (0,8%) случаях из-за спазма ЛуА, в 2 (0,2%) случаях вследствие выраженного изгиба, в 3 (0,3%) случаях из-за невозможности пунктировать артерию. Процедуры были завершены у 9 (0,8%) пациентов через левый лучевой доступ, у 4 (0,3%) пациентов через левый локтевой и у 2 (0,2%) пациентов через правый бедренный доступы.
Осложнения и нежелательные эффекты. Окклюзия ЛоА выявлена в нашем исследовании у 1 (0,25%) пациентки. На третьи сутки после КАГ при контрольном УЗДС, выполненном по поводу жалоб на боль в области предплечья, онемение 4-5 пальцев и слабость кисти до уровня бифуркации плечевой артерии. Пациентке проводилась симптоматическая терапия. На контрольном УЗДС через 1,5 месяца определялись признаки частичной реканализации тромба, при УЗДС через 3 месяца выявлено полное восстановление кровотока. Окклюзия ЛуА выявлена у 8 (0,67%) пациентов (p=0,6). Во всех случаях окклюзии были документированы посредством УЗДС. У 7 (0,6%) пациентов клинические проявления отсутствовали, в 1 (0,08%) случае имели место боль, парестезия на протяжении всей верхней конечности и слабость руки. Проводилась симптоматическая терапия. Через 6 недель клинические проявления отсутствовали, при УЗДС сохранялась окклюзия ЛуА с адекватным кровотоком дистальнее места окклюзии. У 1 (0,25%) пациента в группе ЛоАД и у 1 (0,08%) в группе ЛуАД развилась пульсирующая гематома (p=0,9).
Спазм ЛоА возникал значительно реже, чем спазм ЛуА: у 12 (3%) пациентов против 164 (13,7%), соответственно (p<0,0005). У 21 (5,3%) пациента в группе ЛоАД отмечалось онемение 4-5 пальцев кисти, прошедшее в течение 2 часов после окончания процедуры, в группе ЛуАД онемение 1-2 пальцев было у 55 (4,6%) пациентов (p=0,7). 3 (0,8%) пациента в группе ЛоАД и 14 (1,2%) в группе ЛуАД предъявляли жалобы на неинтенсивную боль в предплечье (p=0,7), у 9 (2,3%) пациентов в группе ЛоАД и у 31 (2,6%) пациента в группе ЛуАД отмечались кровоподтеки по внутренней поверхности предплечья размерами 3-4×15-20 см (p=0,9). У 6 (1,5%) пациентов в группе ЛоАД и 25 (2,1%) пациентов в группе ЛуАД при выполнении доступа отмечалась ваготоническая реакция в виде брадикардии и гипотонии (p=0,6) (табл.№4).
Достоверной зависимости осложнений и нежелательных эффектов от диаметра интродъюсера и типа процедуры выявлено не было.
| Таблица №4. | |||
| Осложнения и нежелательные эффекты при выполнении эндоваскулярных вмешательств через артерии предплечья | |||
| Осложнения | Локтевой доступn=400 | Лучевой доступn=1200 | p |
| Отсутствие осложнений | 398 (99,5%) | 1191 (99,3%) | 0,9 |
| Окклюзия артерии доступа | 1 (0,25%) | 8 (0,67%) | 0,6 |
| Пульсирующая гематома | 1 (0,25%) | 1 (0,08%) | 0,9 |
| Артериовенозная фистула | 0 | 0 | |
| Инфицирование места пункции | 0 | 0 | |
| Общее количество осложнений | 2 (0,5%) | 9 (0,75%) | 0,9 |
| Спазм артерии доступа | 12 (3%) | 164 (13,7%) | <0,0005 |
| Ваготоническая реакция | 6 (1,5%) | 25 (2,1%) | 0,6 |
| Онемение 3-5-го пальцев руки | 21 (5,3%) | - | p=0,7 |
| Онемение 1-2-го пальцев руки | - | 55 (4,6%) | |
| Гематомы поверхностные/ кровоподтек | 9 (2,3%) | 31 (2,6%) | 0,9 |
| Боль в предплечье | 3 (0,8%) | 14 (1,2%) | 0,7 |
| Общее количество нежелательных эффектов | 51 (12,7%) | 289 (24,1%) | <0,0005 |
Клинический пример №1
Пациентка Л., 70 лет с диагнозом ИБС, стенокардия напряжения III ФК, постинфарктный кардиосклероз, атеросклероз коронарных артерий, артериальная гипертензия II ст. С целью уточнения степени поражения коронарного русла планировалось выполнение коронарографии. Пальпаторно ощущалась хорошая пульсация правой и левой лучевых артерий, локтевые артерии пальпировались слабо. Прямой и обратный тесты Аллена были положительными на обеих руках. УЗДС артерий верхних конечностей выполнено не было. В качестве артериального доступа была выбрана правая лучевая артерия как наиболее часто используемый доступ.
После пункции правой лучевой артерии провести длинный (23 см) интродъюсер до конца не удалось. На контрольной ангиограмме выявлено высокое отхождение лучевой артерии (вероятно от подмышечной артерии) и наличие спастического элемента. После интраартериального введения 250 мкг нитроглицерина и 2,5 мг изоптина был установлен короткий интродъюсер (11 см). После окончания КАГ, при извлечении интродъюсера повторно развился спазм, препятствующий его удалению. После повторных интраартериальных введений нитроглицерина в общей дозе 500 мг и изоптина 5 мг на фоне выраженных болевых ощущений интродъюсер был извлечен, однако, как оказалось, вместе с интимой артерии, плотно обхватившей интродъюсер (рис.3). Интима была срезана скальпелем. На рану наложена асептическая давящая повязка. Пульсация в дистальных отделах лучевой артерии сохранена.
При контрольном УЗДС через 18 часов выявлен окклюзирующий тромб в дистальной трети правой лучевой артерии, отмечается высокая бифуркация артерий правой верхней конечности на уровне подмышечной впадины.
Диаметр правой лучевой артерии составляет 1,3-1,6 мм. Дистальнее места пункции лучевая артерия анастомозирует с крупной коллатеральной ветвью из бассейна локтевой артерии, чем и была обусловлена хорошая пульсация лучевой артерии в зоне пункции до процедуры. При этом уровень бифуркации артерий левой верхней конечности расположен в области локтевого сгиба и диаметр левой лучевой артерии составляет 2,2 мм.
Диаметр артерии (см) по данным дуплексного сканирования артерий плечевого пояса и верхних конечностей:
Правая лучевая 0,13-0,15
Правая локтевая 0,14-0,15
Левая лучевая 0,22
Левая локтевая 0,15
Следовательно, при выборе в качестве оперативного доступа левой лучевой артерии описанных сложностей и осложнения в виде окклюзированной артерии можно было бы избежать.
Клинический пример №2.
Пациентка С., 56 лет с диагнозом ИБС, стенокардия напряжения III ФК, постинфарктный кардиосклероз, артериальная гипертензия III ст. С целью уточнения степени поражения коронарного русла планировалось выполнение коронарографии. При пальпации определялась хорошая пульсация правой лучевой артерии. Пульсация правой локтевой артерии также была выраженной. Прямой и обратный тесты Аллена были положительными на обеих руках. В заключении УЗДС артерий верхних конечностей описан диаметр только лучевой артерии, равный 3,5 мм, и отмечена высокая бифуркация артерий правой верхней конечности. Учитывая большой диаметр правой лучевой артерии, оператором был проигнорирован факт высокой бифуркации артерий и в качестве оперативного доступа выбрана правая лучевая артерия.
Во время извлечения катетера после проведения селективной коронарографии левой коронарной артерии развилась выраженная болевая реакция в правой руке. На контрольной ангиограмме выявлены высокая бифуркация артерий на уровне подмышечной впадины и резко выраженный спазм абберантной лучевой артерии, которая, плотно обхватывая диагностический катетер, не пропускала контраст в дистальный отдел лучевой артерии (рис. 4а). После повторных интраартериальных введений нитроглицерина в общей дозе 500 мг на фоне болевых ощущений диагностический катетер был извлечен из артерии. При контрольной ангиографии через интродъюсер визуализируется лучевая артерия с явлениями резко выраженного спазма на большом протяжении (рис. 4b). От проведения правого диагностического катетера через лучевую артерию было решено воздержаться. Селективная коронарография правой коронарной артерии выполнена через дополнительный правый бедренный доступ.
Обращает на себя внимание тот факт, что на обеих ангиограммах визуализируется локтевая артерия, крупного калибра и без наличия элементов спазма (рис. 4). Это позволяет предположить, что при выборе в качестве оперативного доступа для проведении исследования правой локтевой артерии можно было бы избежать описанных технических сложностей, травматизации артерии и выраженной болевой реакции у пациента. Кроме того, не пришлось бы использовать второй оперативный доступ через бедренную артерию для завершения исследования в полном объеме.
Клинический пример №3
Пациент К., 69 лет с диагнозом ИБС, стенокардия напряжения II Ф.К, артериальная гипертензия III ст. С целью уточнения степени поражения коронарного русла планировалось выполнение коронарографии. При пальпации определялась хорошая пульсация правой лучевой артерии локально в зоне предполагаемой пункции, но проксимальнее пульсация резко ослабевала. Пульсация локтевой артерии была менее выраженной, однако достаточной для пункции. Прямой и обратный тесты Аллена были положительными на обеих руках. УЗДС артерий верхних конечностей (диаметр артерий, см):
Правая лучевая 0,17
Правая локтевая 0,17
Левая лучевая 0,13
Левая локтевая 0,15;
в качестве артериального доступа была выбрана правая локтевая артерия.
После проведения коронарографии через локтевой артериальный доступ выполнена ангиограмма артерий предплечья, при которой выявлен редуцированный участок лучевой артерии в дистальной трети с минимальным диаметром, равным 0,60-0,75 мм, проксимальнее и дистальнее редуцированного участка диаметр артерии составлял 1,74 мм (рис. 5).
Таким образом, были предотвращены технические сложности, травма аномальной артерии и возможные осложнения.
Литература
Способ выбора артериального доступа для выполнения рентгенэндоваскулярных вмешательств на коронарных артериях, заключающийся в том, что определяют диаметр лучевой и локтевой артерий по данным ультразвукового исследования и проводят тест Аллена, при определении артерии с диаметром не менее 1,6 мм, а также положительном тесте Аллена выбирают оперативный доступ для проведения процедуры: при выявлении лучевой артерии диаметром более 1,6 мм и большей, чем локтевая артерия, а также положительном прямом тесте Аллена выбирают лучевой доступ; при наличии локтевой артерии диаметром более 1,6 мм и большей, чем лучевая артерия, а также положительном обратном тесте Аллена выбирают локтевой доступ; при одинаковом диаметре лучевой и локтевой артерий, а также положительном тесте Аллена для доступа выбирают артерию с наилучшей пульсацией и более благоприятной анатомией; при невозможности выполнить лучевой или локтевой доступ используют бедренный доступ.