Пептидные вакцины для раков, экспрессирующих опухолеспецифические антигены
Иллюстрации
Показать всеИзобретение относится к биохимии. Описаны выделенные пептиды, обладающие способностью индуцировать цитотоксическую Т-клетку, имеющие аминокислотные последовательности, показанные в SEQ ID NO: SEQ ID NO: SEQ ID NO: 19, 22, 30, 34, 344, 358, 41, 44, 46, 48, 78, 80, 100, 101, 110, 111, 387, 112, 394, 395, 133, 135, 137, 426, 174, 178, 186, 194, 196, 202, 210, 213, 214, 217, 223, 376, 379, 114, 116, 117, 121, 227, 228, 233, 254, 271, 272 или 288, а также пептиды, имеющие вышеупомянутые аминокислотные последовательности, в которых заменены, делегированы или в которые добавлены 1 или 2 аминокислоты при условии, что пептиды обладают способностью к индукции цитотоксических Т-клеток, и способ отбора таких пептидов. Настоящим изобретением также обеспечиваются лекарственные средства для лечения или предупреждения заболевания, тесно связанного со сверхэкспрессией CDH3, ЕРНА4, ЕСТ2, HIG2, INHBB, KIF20A, KNTC2, TTK и/или URLC10, например раков, содержащие в качестве активного ингредиента один или несколько этих пептидов. Представлены способы индукции цитотоксической Т-клетки, антигенпрезентирующей клетки, ингибирования пролиферации клетки. Также представлены цитотоксическая Т-клетка и антигенпрезентирующая клетка. 14 н. и 4 з.п. ф-лы, 9 ил., 10 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящая заявка заявляет приоритет предварительной заявки на патент США № 60/902949, поданной 21 февраля 2007, полное содержание которой, таким образом, включено сюда посредством ссылки для всех целей.
Настоящее изобретение относится к области биологии, конкретнее, к области терапии рака. В частности, настоящее изобретение относится к новым иммуногенным пептидам, которые служат в качестве очень эффективных вакцин против рака, и содержащим такие пептиды лекарственным средствам для лечения и предупреждения опухолей.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Было показано, что CD8+ цитотоксические T-лимфоциты (CTL) распознают пептидные эпитопы, происходящие из опухолеспецифических антигенов (TAA), представленные на молекулах MHC (главного комплекса гистосовместимости) класса I, и впоследствии лизируют опухолевые клетки. Со времени открытия семейства MAGE в качестве первого примера TAA были открыты многие другие TAA, используя иммунологические подходы (Boon T. (1993) Int. J. Cancer 54: 177-180; Boon T. et al., (1996) J. Exp. Med. 183: 725-729; van der Bruggen P. et al., (1991) Science 254: 1643-1647; Brichard V. et al., (1993) J. Exp. Med. 178: 489-495; Kawakami Y. et al., (1994) J. Exp. Med. 180: 347-352). Некоторые из них в настоящее время клинически разрабатываются в качестве мишеней для иммунотерапии. Открытые на данное число TAA включают MAGE (van der Bruggen P. et al., (1991) Science 254: 1643-1647), gp100 (Kawakami Y. et al., (1994) J. Exp. Med. 180: 347-352), SART (Shichijo S. et al., (1998) J. Exp. Med. 187: 277-288) и NY-ESO-1 (Chen Y.T. et al., (1997) Proc. Natl. Acad. Sci. USA, 94: 1914-1918). С другой стороны, было установлено, что продукты некоторых генов, которые, как показано, до некоторой степени специфическим образом сверхэкспрессированы в опухолевых клетках, распознаются в качестве мишеней для индукции клеточных иммунных ответов. Такие продукты генов включают p53 (Umano Y. et al., (2001) Br. J. Cancer, 84: 1052-1057), HER2/neu (Tanaka H. et al., (2001) Br. J Cancer, 84: 94-99), CEA (Nukaya I. et al., (1999) Int. J. Cancer 80, 92-97) и т.п.
Несмотря на значительный прогресс в основном и клиническом исследовании, касающемся TAA (Rosenberg S.A. et al., (1998) Nature Med, 4: 321-327; Mukherji B. et al., (1995) Proc. Natl. Acad. Sci. USA, 92: 8078-8082; Hu X. et al., (1996) Cancer Res, 56: 2479-2483), в настоящее время имеется только очень ограниченное число TAA-кандидатов, подходящих для лечения раков. TAA, которые очень экспрессированы в раковых клетках и экспрессия которых ограничена раковыми клетками, могли бы быть многообещающими кандидатами на иммунотерапевтические мишени.
И HLA-A24, и HLA-A0201 являются обычными аллелями HLA (главного комплекса гистосовместимости человека) в популяциях японцев и европейцев (Date Y. et al., (1996) Tissue Antigens 47: 93-101; Kondo A. et al., (1995) J. Immunol. 155: 4307-4312; Kubo RT et al., (1994) J. Immunol. 152: 3913-3924; Imanishi et al., Proceeding of the eleventh International Histocompatibility Workshop and Conference Oxford University Press, Oxford, 1065 (1992); Williams F. et al., (1997) Tissue Antigen 49: 129-33.). Таким образом, антигенные пептиды раков, презентируемые этими аллелями HLA, могут найти конкретное применение для лечения раков среди японских и европейских пациентов. Кроме того, известно, что индукция CTL с небольшой аффинностью in vitro обычно является следствием воздействия высоких концентраций пептидов, порождающих высокий уровень комплексов специфический пептид/MHC на антигенпрезентирующих клетках (APC), которые будут эффективно активировать эти CTL (Alexander-Miller et al., (1996) Proc. Natl. Acad. Sci. USA 93: 4102-4107).
В последнее время последовательность пептида, связывающегося с молекулой HLA класса I, можно предположить, используя алгоритмы (Jounal of Immunological Methods, (1995), Vol. 185, p. 181-190, J. Immunol., (1994), Vol.152, p. 163-175, Protein Science, (2000), Vol.9, p. 1838-1846). Однако трудно сказать, что предполагаемый пептидный эпитоп может быть урезан до определенного размера, экспрессирован на поверхности клетки-мишени с молекулой HLA и распознан CTL. Более того, с помощью алгоритма, например BIMAS (http://bimas.dcrt.nih.gov/cgi-bin/molbio/ken_parker_comboform) (Parker K.C. et al., (1994) J. Immunol.; 152(1): 163-175; Kuzushima K. et al., (2001) Blood; 98(6): 1872-1881), можно предположить пептид, связывающийся с молекулой HLA, но предполагаемый пептид не является очень точным (Bachinsky M.M. et. al., Cancer Immun. 2005 Mar 22; 5:6). Следовательно, при отборе TAA все еще остается много проблем и трудностей.
Недавние разработки технологий ранжированных микрорядов кДНК сделали возможным построение полных профилей экспрессии генов в раковых клетках по сравнению с нормальными клетками (Okabe H. et al., (2001) Cancer Res., 61, 2129-2137; Lin Y.M. et al., (2002) Oncogene, 21: 4120-4128; Hasegawa S. et al., (2002) Cancer Res. 62: 7012-7017). Этот подход делает возможным более всестороннее понимание сложной природы раковых клеток и механизмов канцерогенеза и способствует идентификации генов, экспрессия которых дерегулирована в опухолях (Bienz M. et al., (2000) Cell 103, 311-320). Среди транскриптов, экспрессия которых, как установлено, увеличена в раках, в последнее время были открыты CDH3 (входящий № в GenBank NM_001793; SEQ ID NO: 1, 2), EPHA4 (входящий № в GenBank L36645; SEQ ID NO: 3, 4), ECT2 (входящий № в GenBank AY376439; SEQ ID NO: 5, 6), HIG2 (входящий № в GenBank NM_013332; SEQ ID NO: 7, 8) INHBB (входящий № в GenBank NM_002193; SEQ ID NO: 9, 10), KIF20A (входящий № в GenBank NM_005733; SEQ ID NO: 11, 12), KNTC2 (входящий № в GenBank AF017790; SEQ ID NO: 13, 14), TTK (входящий № в GenBank NM_003318; SEQ ID NO: 15, 16) и URLC10 (входящий № в GenBank NM_017527; SEQ ID NO: 17, 18). Полное содержание ссылок включено сюда посредством ссылки. Эти гены, экспрессия которых специфическим образом увеличена в опухолевых клетках различных раковых тканей проанализированных случаев, представляют особый интерес для авторов настоящего изобретения (см. ниже). Таким образом, иммуногенные пептиды, происходящие из CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK и URLC10, могут найти применение для избирательного уничтожения опухолевых клеток, экспрессирующих такие антигены. Настоящее изобретение обращено к этим и другим потребностям.
Поскольку цитотоксические лекарственные средства, такие как M-VAC, часто вызывают тяжелые побочные реакции, очевидно, что отбор новых молекул мишеней, обдуманный на основе хорошо охарактеризованных механизмов действия, должен быть очень полезен при разработке эффективных противораковых лекарственных средств, имеющих минимизированный риск побочных эффектов. С этой целью были ранее выполнены анализы профилей экспрессии на различных раках и нормальной ткани человека. Такие исследования привели к открытию множества генов, которые специфическим образом сверхэкспрессированы в раках (Lin Y.M. et al., Oncogene. 2002 Jun 13; 21: 4120-4128; Kitahara O. et al., Cancer Res. 2001 May 1; 61: 3544-3549; Suzuki C. et al., Cancer Res. 2003 Nov 1; 63: 7038-7041; Ashida S., Cancer Res. 2004 Sep 1; 64: 5963-5972; Ochi K. et al., Int. J. Oncol. 2004 Mar; 24(3): 647-655; Kaneta Y. et al., Int. J. Oncol. 2003 Sep; 23: 681-691; Obama K., Hepatology. 2005 Jun; 41: 1339-1348; Kato T. et al., Cancer Res. 2005 Jul 1; 65: 5638-5646; Kitahara O. et al., Neoplasia. 2002 Jul-Aug; 4: 295-303; Saito-Hisaminato A. et al., DNA Res. 2002, 9: 35-45). Примеры таких генов, которые, как установлено, являются сверхэкспрессируемыми в различных раках, включают, но без ограничения, CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK и URLC10. Ранее установлено, что CDH3 сверхэкспрессирован в раке мочевого пузыря, раке шейки матки, холангиоцеллюлярном раке, раке ободочной и прямой кишок, эндометриозе, раке желудка, диффузном раке желудка, немелкоклеточном раке легкого (NSCLC), раке поджелудочной железы, мягкотканевой опухоли и опухоли яичка. EPHA4 был идентифицирован в раке мочевого пузыря, раке шейки матки, холангиоцеллюлярном раке, эндометриозе, диффузном раке желудка, раке яичника, раке поджелудочной железы, раке предстательной железы и мягкотканевой опухоли. ECT2 был идентифицирован в раке мочевого пузыря, раке молочной железы, раке шейки матки, холангиоцеллюлярном раке, хроническом миелоидном лейкозе (CML), раке ободочной и прямой кишок, раке пищевода, NSCLC, лимфоме, раке предстательной железы, раке почки и мелкоклеточном раке легкого (SCLC). HIG2 был идентифицирован в раке почки и SCLC. INHBB был идентифицирован в холангиоцеллюлярном раке, раке пищевода, NSCLC, раке почки, SCLC и мягкотканевой опухоли. KIF20A был идентифицирован в раке мочевого пузыря, раке молочной железы, холангиоцеллюлярном раке, раке пищевода, NSCLC, раке поджелудочной железы, раке предстательной железы, раке почки и SCLC. KNTC2 был идентифицирован в раке мочевого пузыря, раке молочной железы, раке шейки матки, холангиоцеллюлярном раке, CML, раке ободочной и прямой кишок, раке пищевода, NSCLC, лимфоме, остеосаркоме, раке яичника, раке поджелудочной железы, раке предстательной железы, раке почки, SCLC и мягкотканевой опухоли. TTK был идентифицирован в раке мочевого пузыря, раке молочной железы, раке шейки матки, холангиоцеллюлярном раке, CML, раке ободочной и прямой кишок, раке пищевода, раке печени, NSCLC, лимфоме, остеосаркоме, раке предстательной железы, SCLC и мягкотканевой опухоли. URLC10 был идентифицирован в раке мочевого пузыря, раке шейки матки, холангиоцеллюлярном раке, раке пищевода, раке желудка, NSCLC, остеосаркоме, раке поджелудочной железы и SCLC.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
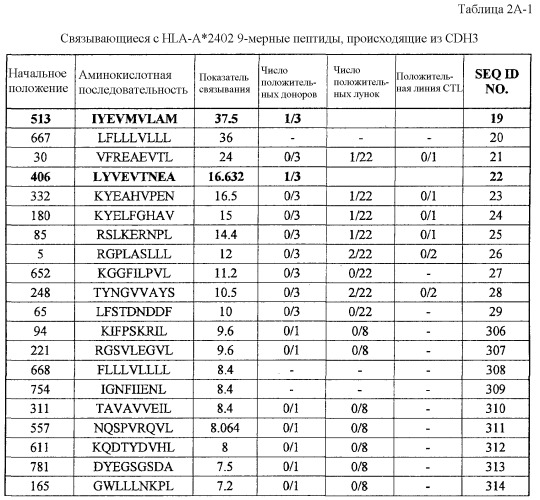
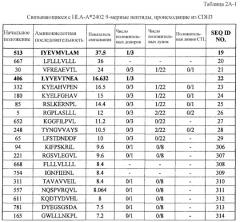
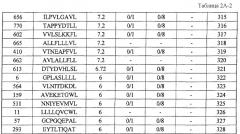
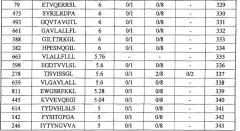
Настоящее изобретение основано отчасти на открытии подходящих для иммунотерапии мишеней. Поскольку TAA часто не обладают иммуногенностью, открытие подходящих мишеней имеет чрезвычайное значение. Как отмечено выше, было установлено, что экспрессия CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK и URLC10 увеличена в различных раках. Конкретнее, эти гены были идентифицированы, используя анализ профиля экспрессии генов с использованием ранжированного микроряда кДНК всего генома. Как обсуждалось выше, было установлено, что экспрессия CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK и URLC10 специфическим образом увеличена в различных опухолевых клетках, от клеток рака поджелудочной железы до клеток рака почки. Как изображено в таблице 1, экспрессия CDH3 действительно увеличена в 26 из 34 раков мочевого пузыря, в 17 из 19 раков шейки матки, во всех 19 холангиоцеллюлярных раках, в 30 из 34 раков ободочной и прямой кишок, в 20 из 21 эндометриоза, в 13 из 20 раков желудка, в 7 из 8 диффузных раков желудка, в 36 из 37 NSCLC, во всех 16 раках поджелудочной железы, во всех 21 мягкотканевых опухолях и во всех 10 опухолях яичка.
В таблице 1, кроме того, демонстрируется, что:
экспрессия EPHA4 действительно увеличена в 14 из 34 раков мочевого пузыря, в 8 из 14 раков шейки матки, в 10 из 25 холангиоцеллюлярных раков, в 5 из 15 эндометриозов, в 5 из 8 диффузных раков желудка, во всех 5 раках яичника, во всех 14 раках поджелудочной железы, в 20 из 51 рака предстательной железы и в 14 из 23 мягкотканевых опухолей;
экспрессия ECT2 действительно увеличена в 17 из 19 раков мочевого пузыря, в 5 из 12 раков молочной железы, во всех 14 раках шейки матки, во всех 13 холангиоцеллюлярных раках, во всех 5 CML, в 7 из 8 раков ободочной и прямой кишки, в 12 из 16 раков пищевода, в 6 из 16 NSCLC, в 8 из 10 лимфом, в 1 из 1 рака поджелудочной железы, в 10 из 13 раков предстательной железы, в 3 из 6 раков почки и в 12 из 13 SCLC;
экспрессия HIG2 действительно увеличена в 19 из 20 раков почки и в 7 из 9 мягкотканевых опухолей;
экспрессия INHBB действительно увеличена в 10 из 21 холангиоцеллюлярного рака, во всех 12 раках пищевода, в 10 из 13 NSCLC, в 22 из 24 раков почки, в 8 из 14 SCLC и 45 из 49 мягкотканевых опухолей;
экспрессия KIF20A действительно увеличена во всех 31 раках мочевого пузыря, в 38 из 61 рака молочной железы, в 10 из 11 холангиоцеллюлярных раков, в 7 из 19 раков пищевода, в 21 из 22 NSCLC, во всех 6 раках яичника, в 17 из 36 раков предстательной железы, в 6 из 11 раков почки и во всех 15 SCLC;
экспрессия KNTC2 действительно увеличена в 30 из 32 раков мочевого пузыря, в 47 из 56 раков молочной железы, во всех 10 раках шейки матки, в 16 из 22 холангиоцеллюлярных раков, в 17 из 37 CML, в 3 из 10 раков ободочной и прямой кишок, в 11 из 46 раков пищевода, в 15 из 19 NSCLC, в 7 из 8 лимфом, в 20 из 24 остеосарком, в 3 из 5 раков яичника, во всех 2 раках поджелудочной железы, в 15 из 37 раков предстательной железы, в 14 из 19 раков почки, во всех 15 SCLC и в 40 из 59 мягкотканевых опухолей;
экспрессия TTK действительно увеличена во всех 27 раках мочевого пузыря, в 25 из 30 раков молочной железы, в 15 из 16 раков шейки матки, во всех 10 холангиоцеллюлярных раках, в 5 из 7 CML, в 6 из 10 раков ободочной и прямой кишок, в 24 из 44 раков пищевода, в 8 из 15 раков печени, во всех 12 NSCLC, во всех 6 лимфомах, в 13 из 16 остеобластом, в 12 из 17 раков предстательной железы, во всех 15 SCLC и в 16 из 33 мягкотканевых опухолей;
экспрессия URLC10 действительно увеличена во всех 29 раках мочевого пузыря, в 15 из 16 раков шейки матки, во всех 7 холангиоцеллюлярных раках, в 7 из 19 раков пищевода, во всех 3 раках желудка, в 24 из 27 NSCLC, в 15 из 19 остеосарком, в 4 из 5 раков поджелудочной железы, в 33 из 43 мягкотканевых опухолей.
Настоящее изобретение основано, по крайней мере отчасти, на идентификации специфических пептидных эпитопов продуктов этих генов (CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK и URLC10), которые обладают способностью индуцировать цитотоксические T-лимфоциты (CTL), специфичные в отношении соответствующих молекул. Как обсуждается подробно ниже, мононуклеарные клетки периферической крови (PBMC) здорового донора были подвергнуты стимуляции, используя связывающиеся с HLA-A*2402 или HLA-A*0201 пептиды-кандидаты, происходящие из CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK или URLC10. Затем были созданы клоны и/или линии CTL со специфической цитотоксичностью в отношении HLA-A24- или HLA-A2-положительных клеток-мишеней, подвергнутых в импульсном режиме воздействию каждого из пептидов-кандидатов. Эти результаты демонстрируют, что эти пептиды являются рестрицированными по HLA-A24 или HLA-A2 пептидными эпитопами, которые могут вызывать сильные и специфические иммунные ответы против клеток, экспрессирующих CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK или URLC10.
Соответственно, настоящим изобретением обеспечиваются способы лечения или предупреждения заболевания, тесно связанного со сверхэкспрессией CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK или URLC10, например рака. Такие способы включают стадию введения нуждающемуся в этом субъекту полипептидов настоящего изобретения CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK и/или URLC10. Введение такого пептида(ов) приводит к индукции противоопухолевого иммунитета. Таким образом, настоящим изобретением обеспечиваются способы индукции противоопухолевого иммунитета у субъекта, включающие стадию введения субъекту полипептидов CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK и/или URLC10, а также фармацевтические композиции для лечения или предупреждения заболевания, тесно связанного со сверхэкспрессией CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK и/рака URLC10, например рака, которые включают полипептиды CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK и URLC10. Примеры таких раков включают, но без ограничения, рак мочевого пузыря, рак молочной железы, рак шейки матки, холангиоцеллюлярный рак, CML, рак ободочной и прямой кишок, эндометриоз, рак пищевода, рак желудка, диффузный рак желудка, рак печени, NSCLC,
лимфому, остеосаркому, рак яичника, рак поджелудочной железы, рак предстательной железы, рак почки, SCLC, мягкотканевую опухоль и опухоль яичка.
Настоящим изобретением, кроме того, обеспечиваются способы предупреждения рецидива после хирургического вмешательства упомянутого выше заболевания.
В отношении конкретных целей и задач, изложенных выше, квалифицированным в данной области техники специалистам будет понятно, что один или несколько аспектов этого изобретения могут соответствовать некоторым целям, в то время как один или несколько других аспектов могут соответствовать некоторым другим целям. Каждая цель может не применяться одинаково, во всех ее отношениях, к каждому аспекту этого изобретения. Как таковые объекты настоящего изобретения можно рассматривать попеременно по отношению к любому аспекту этого изобретения.
Дополнительные объекты и признаки настоящего изобретения проявятся более полно при прочтении следующего подробного описания в соединении с сопроводительными фигурами и примерами. Однако следует понимать, что как предшествующее краткое изложение сущности изобретения, так и следующее подробное описание являются предпочтительными вариантами осуществления и не ограничивают настоящее изобретение или другие альтернативные варианты осуществления настоящего изобретения. В частности, хотя настоящее изобретение описывается здесь относительно ряда конкретных вариантов осуществления, будет понятно, что описание является иллюстрацией настоящего изобретения и не толкуется как ограничение настоящего изобретения. Различные модификации и применения могут приходить на ум квалифицированным в данной области техники специалистам без отступления от сущности и объема настоящего изобретения, характеризуемого прилагаемой формулой изобретения. Подобным образом, другие объекты, признаки, эффекты и преимущества настоящего изобретения будут очевидны из этого краткого изложения сущности изобретения и некоторых вариантов осуществления, описанных ниже, и они будут быстро очевидны квалифицированным в данной области техники специалистам. Такие объекты, признаки, эффекты и преимущества будут очевидны из вышеприведенного описания в соединении с сопроводительными примерами, данными, фигурами и всеми приемлемыми выводами, которые будут сделаны из них, отдельно или с учетом включенных сюда ссылок.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Различные аспекты и применения настоящего изобретения станут очевидными квалифицированному специалисту при учете следующих краткого описания чертежей и подробного описания настоящего изобретения и его предпочтительных вариантов осуществления.
Фиг.1-1. На фиг.1 изображены результаты отбора пептидных эпитопов, которые, в свою очередь, демонстрируют, что для CDH3-A24-10-332 (SEQ ID NO: 34), CDH3-A24-10-470 (SEQ ID NO: 358), CDH3-A24-9-513 (SEQ ID NO: 19), CDH3-A24-9-406 (SEQ ID NO: 22), CDH3-A24-10-807 (SEQ ID NO: 30) и CDH3-A24-10-655 (SEQ ID NO: 344) обнаруживается мощная продукция IFN-гамма. В «a» изображен пример отрицательных пептидов, у которых не могла быть выявлена способность к индукции CTL несмотря на возможную активность связывания с HLA-A*2402. В «b» изображена способность CDH3-A24-10-332 (SEQ ID NO: 34) индуцировать CTL. Для CDH3-A24-10-332 (SEQ ID NO: 34) продемонстрирована мощная продукция IFN-гамма по сравнению с контролем с помощью анализа ELISPOT на IFN-гамма, и линия CTL, которая была создана из положительной лунки #4, показанной в рамке, продемонстрировала специфическую реакцию против клеток-мишеней, подвергнутых в импульсном режиме воздействию пептидного эпитопа. В «c» изображена способность CDH3-A24-10-470 (SEQ ID NO: 358) индуцировать CTL. Для CDH3-A24-10-470 (SEQ ID NO: 358) продемонстрирована мощная продукция IFN-гамма по сравнению с контролем с помощью анализа ELISPOT на IFN-гамма, и линия CTL, которая была создана из положительной лунки #4, показанной в рамке, продемонстрировала специфическую реакцию против клеток-мишеней, подвергнутых в импульсном режиме воздействию пептидного эпитопа. В «d» изображена способность CDH3-A24-9-513 (SEQ ID NO: 19) индуцировать CTL. Для CDH3-A24-9-513 (SEQ ID NO: 19) продемонстрирована мощная продукция IFN-гамма по сравнению с контролем с помощью анализа ELISPOT на IFN-гамма. В лунке #6, показанной в рамке в левой панели, продемонстрирована специфическая реакция против клеток-мишеней, подвергнутых в импульсном режиме воздействию пептидного эпитопа. Кроме того, линия CTL, которая была создана из положительной лунки #5, показанной в рамке в срединной панели, продемонстрировала специфическую реакцию против клеток-мишеней, подвергнутых в импульсном режиме воздействию пептидного эпитопа. В «e» изображена способность CDH3-A24-9-406 (SEQ ID NO: 22) индуцировать CTL. Для CDH3-A24-9-406 (SEQ ID NO: 22) продемонстрирована мощная продукция IFN-гамма по сравнению с контролем с помощью анализа ELISPOT
на IFN-гамма, и линия CTL, которая была создана из положительной лунки #2, показанной в рамке, продемонстрировала специфическую реакцию против клеток-мишеней, подвергнутых в импульсном режиме воздействию пептидного эпитопа.
Фиг.1-2. На фиг.1 изображены результаты отбора пептидных эпитопов, которые, в свою очередь, демонстрируют, что для CDH3-A24-10-332 (SEQ ID NO: 34), CDH3-A24-10-470 (SEQ ID NO: 358), CDH3-A24-9-513 (SEQ ID NO: 19), CDH3-A24-9-406 (SEQ ID NO: 22), CDH3-A24-10-807 (SEQ ID NO: 30) и CDH3-A24-10-655 (SEQ ID NO: 344) обнаруживается мощная продукция IFN-гамма. В «f» изображена способность CDH3-A24-10-807 (SEQ ID NO: 30) индуцировать CTL. Для CDH3-A24-10-807 (SEQ ID NO: 30) продемонстрирована мощная продукция IFN-гамма по сравнению с контролем с помощью анализа ELISPOT на IFN-гамма, и линия и клон CTL были созданы из положительной лунки #5, показанной в рамке. Созданный клон CTL, индуцированный против этого пептида, продемонстрировал специфическую активность CTL в отношении клеток COS7, трансфицированных и полноразмерным геном CDH3, и молекулой HLA-A24 (нижний график справа). С другой стороны, COS7, трансфицированные полноразмерным CDH3, но не HLA-A24, и COS7, трансфицированные HLA-A24, но не полноразмерным CDH3, готовили в качестве отрицательного контроля. Клон CTL продемонстрировал высокую специфическую активность CTL в отношении COS7, которые трансфицированы и CDH3, и HLA-A24. В «g» изображена способность CDH3-A24-10-655 (SEQ ID NO: 344) индуцировать CTL. Для CDH3-A24-10-655 (SEQ ID NO: 344) продемонстрирована мощная продукция IFN-гамма по сравнению с контролем с помощью анализа ELISPOT на IFN-гамма, и линия и клон CTL были созданы из положительной лунки #1, показанной в рамке. Созданный клон CTL, индуцированный против этого пептида, продемонстрировал специфическую активность CTL в отношении клеток COS7, трансфицированных и полноразмерным геном CDH3, и молекулой HLA-A24 (нижний график справа). С другой стороны, COS7, трансфицированные полноразмерным CDH3, но не HLA-A24, и COS7, трансфицированные HLA-A24, но не полноразмерным CDH3, готовили в качестве отрицательного контроля. Клон CTL продемонстрировал высокую специфическую активность CTL в отношении COS7, которые трансфицированы и CDH3, и HLA-A24.
Фиг.2. На фиг.2 изображены результаты отбора пептидных эпитопов, которые, в свою очередь, демонстрируют, что для Epha4-A24-9-453 (SEQ ID NO: 41), Epha4-A24-9-5 (SEQ ID NO: 44), Epha4-A24-9-420 (SEQ ID NO: 48), Epha4-A24-9-869 (SEQ ID NO: 46), Epha4-A24-10-24 (SEQ ID NO: 78), Epha4-A02-9-501 (SEQ ID NO: 376) и Epha4-A02-9-165 (SEQ ID NO: 379) обнаруживается мощная продукция IFN-гамма. В «a» изображен пример отрицательных пептидов, у которых не могла быть выявлена способность к индукции CTL, несмотря на возможную активность связывания с HLA. В «b» изображена способность Epha4-A24-9-453 (SEQ ID NO: 41) индуцировать CTL. Для Epha4-A24-9-453 (SEQ ID NO: 41) продемонстрирована мощная продукция IFN-гамма по сравнению с контролем с помощью анализа ELISPOT на IFN-гамма, и линия CTL, которая была создана из положительной лунки #3, показанной в рамке, продемонстрировала специфическую реакцию против клеток-мишеней, подвергнутых в импульсном режиме воздействию пептидного эпитопа. В «c» изображена способность Epha4-A24-9-5 (SEQ ID NO: 44) индуцировать CTL. Для Epha4-A24-9-5 (SEQ ID NO: 44) продемонстрирована мощная продукция IFN-гамма по сравнению с контролем с помощью анализа ELISPOT на IFN-гамма, и линия CTL, которая была создана из положительной лунки #2, показанной в рамке, продемонстрировала специфическую реакцию против клеток-мишеней, подвергнутых в импульсном режиме воздействию пептидного эпитопа. В «d» изображена способность Epha4-A24-9-420 (SEQ ID NO: 48) индуцировать CTL. Для Epha4-A24-9-420 (SEQ ID NO: 48) продемонстрирована мощная продукция IFN-гамма по сравнению с контролем с помощью анализа ELISPOT на IFN-гамма. В лунке #6, показанной в рамке в верхней панели, продемонстрирована специфическая реакция против клеток-мишеней, подвергнутых в импульсном режиме воздействию пептидного эпитопа. Кроме того, линия CTL, которая была создана из положительной лунки #6, показанной в рамке в срединной панели, продемонстрировала специфическую реакцию против клеток-мишеней, подвергнутых в импульсном режиме воздействию пептидного эпитопа. В «e» изображена способность Epha4-A24-9-869 (SEQ ID NO: 46) индуцировать CTL. Для Epha4-A24-9-869 (SEQ ID NO: 46) продемонстрирована мощная продукция IFN-гамма по сравнению с контролем с помощью анализа ELISPOT на IFN-гамма, и линия CTL, которая была создана из положительной лунки #5, показанной в рамке, продемонстрировала специфическую реакцию против клеток-мишеней, подвергнутых в импульсном режиме воздействию пептидного эпитопа. В «f» изображена способность Epha4-A24-10-24 (SEQ ID NO: 78) индуцировать CTL. Для Epha4-A24-10-24 (SEQ ID NO: 78) продемонстрирована мощная продукция IFN-гамма по сравнению с контролем с помощью анализа ELISPOT на IFN-гамма, и линия CTL, которая была создана из положительной лунки #4, показанной в рамке, продемонстрировала специфическую реакцию против клеток-мишеней, подвергнутых в импульсном режиме воздействию пептидного эпитопа. В «g» изображена способность Epha4-A02-9-501 (SEQ ID NO: 376) индуцировать CTL. Для Epha4-A02-9-501 (SEQ ID NO: 376) продемонстрирована мощная продукция IFN-гамма по сравнению с контролем с помощью анализа ELISPOT на IFN-гамма, и линия и клон CTL были созданы из положительной лунки #8, показанной в рамке. Цитотоксическую активность созданной линии CTL в отношении клеток-мишеней, подвергнутых в импульсном режиме воздействию пептида, определяли с помощью анализа высвобождения Cr (CRA) (нижний график), и линия CTL обладала очень сильной специфической цитотоксической активностью в отношении клеток-мишеней, подвергнутых в импульсном режиме воздействию пептидов. В «h» изображена способность Epha4-A02-9-165 (SEQ ID NO: 379) индуцировать CTL. Для Epha4-A02-9-165 (SEQ ID NO: 379) продемонстрирована мощная продукция IFN-гамма по сравнению с контролем с помощью анализа ELISPOT на IFN-гамма, и линия CTL была создана из положительной лунки #3, показанной в рамке. Цитотоксическую активность созданной линии CTL в отношении клеток-мишеней, подвергнутых в импульсном режиме воздействию пептида, определяли с помощью анализа высвобождения Cr (CRA) (правый график), и линия CTL обладала очень сильной специфической цитотоксической активностью в отношении клеток-мишеней, подвергнутых в импульсном режиме воздействию пептидов.
Фиг.3. На фиг.3 изображены результаты отбора пептидных эпитопов, которые, в свою очередь, демонстрируют, что для ECT2-A24-9-515 (SEQ ID NO: 80), ECT2-A24-10-40 (SEQ ID NO: 100) и ECT2-A24-10-101 (SEQ ID NO: 101) обнаруживается мощная продукция IFN-гамма. В «a» изображен пример отрицательных пептидов, у которых не могла быть выявлена способность к индукции CTL несмотря на возможную активность связывания с HLA. В «b» изображена способность ECT2-A24-9-515 (SEQ ID NO: 80) индуцировать CTL. Для ECT2-A24-9-515 (SEQ ID NO: 80) продемонстрирована мощная продукция IFN-гамма по сравнению с контролем с помощью анализа ELISPOT
на IFN-гамма. В лунках #5 и #7, показанных в рамке в левой панели, продемонстрирована специфическая реакция против клеток-мишеней, подвергнутых в импульсном режиме воздействию пептидного эпитопа. Кроме того, линия CTL, которая была создана из положительной лунки #7, показанной в рамке во второй панели, продемонстрировала специфическую реакцию против клеток-мишеней, подвергнутых в импульсном режиме воздействию пептидного эпитопа. Цитотоксическую активность линии CTL в отношении линии раковых клеток ТЕ6, эндогенно экспрессирующей ECT2 и HLA-A24, определяли с помощью анализа высвобождения Cr (CRA), и клон CTL обладал очень сильной цитотоксической активностью в отношении ТЕ6. С другой стороны, цитотоксическая активность линии CTL в отношении линии раковых клеток TE5, экспрессирующей только ECT2, не была выявлена. В «c» изображена способность ECT2-A24-10-40 (SEQ ID NO: 100) индуцировать CTL. Для ECT2-A24-10-40 (SEQ ID NO: 100) продемонстрирована мощная продукция IFN-гамма по сравнению с контролем с помощью анализа ELISPOT на IFN-гамма, и линия и клон CTL были созданы из положительной лунки #2, показанной в рамке. Созданный клон CTL, индуцированный против этого пептида, продемонстрировал специфическую активность CTL в отношении клеток COS7, трансфицированных и полноразмерным геном ECT2, и молекулой HLA-A24. С другой стороны, COS7, трансфицированные полноразмерным ECT2, но не HLA-A24, COS7, трансфицированные HLA-A24 и геном URLC10 в качестве замены полноразмерного гена ECT2, и COS7, трансфицированные HLA-A24 и подвергнутые в импульсном режиме воздействию ECT2-10-101, готовили в качестве отрицательного контроля. Клон CTL продемонстрировал высокую специфическую активность CTL в отношении COS7, которые трансфицированы и ECT2, и HLA-A24. В «d» изображена способность ECT2-A24-10-101 (SEQ ID NO: 101) индуцировать CTL. Для ECT2-A24-10-101 (SEQ ID NO: 101) продемонстрирована мощная продукция IFN-гамма по сравнению с контролем с помощью анализа ELISPOT на IFN-гамма, и линия CTL была создана из положительной лунки #1, показанной в рамке. Созданная линия CTL, индуцированная против этого пептида, продемонстрировала специфическую активность CTL в отношении клеток COS7, трансфицированных и полноразмерным геном ECT2, и молекулой HLA-A24. COS7, трансфицированные полноразмерным ECT2,
но не HLA-A24, COS7, трансфицированные HLA-A24 и геном URLC10 в качестве замены полноразмерного гена ECT2, и COS7, трансфицированные HLA-A24 и подвергнутые в импульсном режиме воздействию ECT2-10-40, готовили в качестве отрицательного контроля. Клон CTL продемонстрировал высокую специфическую активность CTL в отношении COS7, которые трансфицированы и ECT2, и HLA-A24.
Фиг.4-1. На фиг.4 изображены результаты отбора пептидных эпитопов, которые, в свою очередь, демонстрируют, что для HIG2-A24-9-19 (SEQ ID NO: 110), HIG2-A24-9-22 (SEQ ID NO: 111), HIG2-A24-9-8 (SEQ ID NO: 387), HIG2-A24-10-7 (SEQ ID NO: 112), HIG2-A24-10-18 (SEQ ID NO: 394), HIG2-A02-9-15 (SEQ ID NO: 116), HIG2-A02-9-4 (SEQ ID NO: 117) и HIG2-A02-10-8 (SEQ ID NO: 121) обнаруживается мощная продукция IFN-гамма. В «a» изображен пример отрицательных пептидов, у которых не могла быть выявлена способность к индукции CTL несмотря на возможную активность связывания с HLA. В «b» изображена способность HIG2-A24-9-19 (SEQ ID NO: 110) индуцировать CTL. Для HIG2-A24-9-19 (SEQ ID NO: 110) продемонстрирована мощная продукция IFN-гамма по сравнению с контролем с помощью анализа ELISPOT на IFN-гамма, и линия CTL, которая была создана из положительной лунки #6, показанной в рамке, продемонстрировала специфическую реакцию против клеток-мишеней, подвергнутых в импульсном режиме воздействию пептидного эпитопа. В «c» изображена способность HIG2-A24-9-22 (SEQ ID NO: 111) индуцировать CTL. Для HIG2-A24-9-22 (SEQ ID NO: 111) продемонстрирована мощная продукция IFN-гамма по сравнению с контролем с помощью анализа ELISPOT на IFN-гамма, и линия и клон CTL, которые были созданы из положительной лунки #7, показанной в рамке, продемонстрировали специфическую реакцию против клеток-мишеней, подвергнутых в импульсном режиме воздействию пептидного эпитопа. В «d» изображена способность HIG2-A24-9-8 (SEQ ID NO: 387) индуцировать CTL. Для HIG2-A24-9-8 (SEQ ID NO: 387) продемонстрирована мощная продукция IFN-гамма по сравнению с контролем с помощью анализа ELISPOT на IFN-гамма, и линия и клон CTL, которые были созданы из положительной лунки #5, показанной в рамке, продемонстрировали специфическую реакцию против клеток-мишеней, подвергнутых в импульсном режиме воздействию пептидного эпитопа. В «e» изображена способность HIG2-A02-9-8 (SEQ ID NO: 114) индуцировать CTL. Для HIG2-A02-9-8 (SEQ ID NO: 114) продемонстрирована мощная продукция IFN-гамма по сравнению с контролем с помощью анализа ELISPOT
на IFN-гамма, и линия CTL была создана из положительной лунки #10, показанной в рамке. Созданная линия CTL, индуцированная против этого пептида, продемонстрировала специфическую активность CTL в отношении клеток 293Т, трансфицированных и полноразмерным геном HIG2, и молекулой HLA-A02. 293Т, трансфицированные полноразмерным HIG2, но не HLA-A02, 293Т, трансфицированные HLA-A02 и геном FoxP3 в качестве замены полноразмерного гена HIG2, и 293Т, трансфицированные HLA-A02 и подвергнутые в импульсном режиме воздействию HIG2-9-15, готовили в качестве отрицательного контроля. Линия CTL продемонстрировала высокую специфическую активность CTL в отношении 293Т, которые трансфицированы и HIG2, и HLA-A02.
Фиг.4-2. На фиг.4 изображены результаты отбора пептидных эпитопов, которые, в свою очередь, демонстрируют, что для HIG2-A24-9-19 (SEQ ID NO: 110), HIG2-A24-9-22 (SEQ ID NO: 111), HIG2-A24-9-8 (SEQ ID NO: 387), HIG2-A24-10-7 (SEQ ID NO: 112), HIG2-A24-10-18 (SEQ ID NO: 394), HIG2-A02-9-15 (SEQ ID NO: 116), HIG2-A02-9-4 (SEQ ID NO: 117) и HIG2-A02-10-8 (SEQ ID NO: 121) обнаруживается мощная продукция IFN-гамма. В «f» изображена способность HIG2-A24-10-7 (SEQ ID NO: 112) индуцировать CTL. Для HIG2-A24-10-7 (SEQ ID NO: 112) продемонстрирована мощная продукция IFN-гамма по сравнению с контролем с помощью анализа ELISPOT на IFN-гамма, и линии и клон CTL, которые были созданы из положительных лунок #1 и #7, показанных в рамке, продемонстрировали специфическую реакцию против клеток-мишеней, подвергнутых в импульсном режиме воздействию пептидного эпитопа. В «g» изображена способность HIG2-A24-10-18 (SEQ ID NO: 394) индуцировать CTL. Для HIG2-A24-10-18 (SEQ ID NO: 394) продемонстрирована мощная продукция IFN-гамма по сравнению с контролем с помощью анализа ELISPOT на IFN-гамма, и линия и клон CTL, которые были созданы из положительной лунки #7, показанной в рамке, продемонстрировали специфическую реакцию против клеток-мишеней, подвергнутых в импульсном режиме воздействию пептидного эпитопа. В «h» изображена способность HIG2-A02-9-15 (SEQ ID NO: 116) индуцировать CTL. Для HIG2-A02-9-15 (SEQ ID NO: 116) продемонстрирована мощная продукция IFN-гамма по сравнению с контролем с помощью анализа ELISPOT на IFN-гамма, и линия CTL была создана из положительной лунки #10, показанной в рамке. Созданная линия CTL, индуцированная против этого пептида, продемонстрировала специфическую активность CTL в отношении клеток COS7, трансфицированных и полноразмерным геном HIG2, и молекулой HLA-A02. COS7, трансфицированные полноразмерным HIG2, но не HLA-A02, и COS7, трансфицированные HLA-A02 и подвергнутые в импульсном режиме воздействию пептида HIG2-9-8, готовили в качестве отрицательного контроля. Линия CTL продемонстрировала высокую специфическую активность CTL в отношении COS7, которые трансфицированы и HIG2, и HLA-A02.
Фиг.4-3. На фиг.4 изображены результаты отбора пептидных эпитопов, которые, в свою очередь, демонстрируют, что для HIG2-A24-9-19 (SEQ ID NO: 110), HIG2-A24-9-22 (SEQ ID NO: 111), HIG2-A24-9-8 (SEQ ID NO: 387), HIG2-A24-10-7 (SEQ ID NO: 112), HIG2-A24-10-18 (SEQ ID NO: 394), HIG2-A02-9-15 (SEQ ID NO: 116), HIG2-A02-9-4 (SEQ ID NO: 117) и HIG2-A02-10-8 (SEQ ID NO: 121) обнаруживается мощная продукция IFN-гамма. В «i» изображена способность HIG2-A02-9-4 (SEQ ID NO: 117) индуцировать CTL. Для HIG2-A02-9-4 (SEQ ID NO: 117) продемонстрирована мощная продукция IFN-гамма по сравнению с контролем с помощью анализа ELISPOT на IFN-гамма, и линия и клон CTL были созданы из положительной лунки #10, показанной в рамке. Созданная линия CTL, индуцированная против этого пептида, продемонстрировала специфическую активность CTL в отношении клеток COS7, трансфицированных и полноразмерным геном HIG2, и молекулой HLA-A02 (срединный график). Также готовили COS7, трансфицированные полноразмерным HIG2, но не HLA-A02, COS7, трансфицированные HLA-A02 и геном TTK в качестве замены полноразмерного гена HIG2, и COS7, трансфицированные HLA-A02 и подвергнутые в импульсном режиме воздействию HIG2-9-8, ради отрицательного контроля. Цитотоксическую активность клона CTL в отношении клеток 293Т, трансфицированных и полноразмерным геном HIG2, и молекулой HLA-A02, и линии раковых клеток Caki-1, эндогенно экспрессирующей HIG2 и HLA-A02, определяли с помощью анализа высвобождения Cr (CRA) (нижние графики), и клон CTL обладал очень сильной цитотоксической активностью в отношении клеток, трансфицированных и HIG2, и HLA-A02, и Caki-1. С другой стороны, цитотоксическая активность линии CTL в отношении 293T, трансфицированных только HIG2 или только HLA-A02, и линии раковых клеток A498, экспрессирующей только HIG2, не была выявлена. В «j» изображена способность HIG2-A02-10-8 (SEQ ID NO: 121) индуцировать CTL. Для HIG2-A02-10-8 (SEQ ID NO: 121) продемонстрирована мощная продукция IFN-гамма по сравнению с контролем с помощью анализа ELISPOT на IFN-гамма, и линия CTL, которая была создана из положительной лунки #9, показанной в рамке, продемонстрировала специфическую реакцию против клеток-мишеней, подвергнутых в импульсном режиме воздействию пептидного эпитопа.
Фиг.5-1. На фиг.5 изображены результаты отбора пептидных эпитопов, которые, в свою очередь, демонстрируют, что для INHBB-A24-9-180 (SEQ ID NO: 395), INHBB-A24-10-180 (SEQ ID NO: 133), INHBB-A24-10-305 (SEQ ID NO: 135), INHBB-A24-10-7 (SEQ ID NO: 137) и INHBB-A24-10-212 (SEQ ID NO: 426) обнаруживается мощная продукция IFN-гамма. В «a» изображен пример отрицательных пептидов, у которых не могла быть выявлена способность к индукции CTL несмотря на возможную активность связывания с HLA. В «b» изображена способность INHBB-A24-9-180 (SEQ ID NO: 395) индуцировать CTL. Для INHBB-A24-9-180 (SEQ ID NO: 395) продемонстрирована мощная продукция IFN-гамма по сравнению с контролем с помощью анализа ELISPOT на IFN-гамма, и линия и клон CTL были созданы из положительной лунки #7, показанной в рамке. Цитотоксическую активность созданного клона CTL в отношении опухолевых клеток Miapaca2, экспрессирующих и INHBB, и HLA-A02, определяли с помощью анализа высвобождения Cr (CRA), и клетки-эффекторы продемонстрировали высокую специфическую цитотоксическую активность в отношении Miapaca2. С другой стороны, не была продемонстрирована значительная специфическая цитотоксическая активность в отношении Caki-1, экспрессирующих INHBB, но не экспрессирующих HLA-A02. В «c» изображена способность INHBB-A24-10-180 (SEQ ID NO: 133) индуцировать CTL. Для INHBB-A24-10-180 (SEQ ID NO: 133) продемонстрирована мощная продукция IFN-гамма по сравнению с контролем с помощью анализа ELISPOT на IFN-гамма, и линия CTL была создана из положительной лунки #3, показанной в рамке. Созданная линия CTL, индуцированная против этого пептида, продемонстрировала высокую специфическую активность CTL в отношении клеток 293Т, трансфицированных и полноразмерным геном INHBB, и молекулой HLA-A24. Также готовили 293Т, трансфицированные полноразмерным INHBB, но не HLA-A24, и 293Т, трансфицированные HLA-A24 и подвергнутые в импульсном режиме воздействию пептида INHBB-10-305, ради отрицательного контроля.
Фиг.5-2. На фиг.5 изображены результаты отбора пептидных эпитопов, которые, в свою очередь, демонстрируют, что для INHBB-A24-9-180 (SEQ ID NO: 395), INHBB-A24-10-180 (SEQ ID NO: 133), INHBB-A24-10-305 (SEQ ID NO: 135), INHBB-A24-10-7 (SEQ ID NO: 137) и INHBB-A24-10-212 (SEQ ID NO: 426) обнаруживается мощная продукция IFN-гамма. В «d» изображена способно