Способ определения функционального состояния миелопероксидазы в плазме крови
Иллюстрации
Показать всеИзобретение относится к медицине, а именно медицинской биохимии, и может быть использовано для определения функционального состояния фермента миелопероксидазы в плазме крови. Способ включает внесение субстрата о-дианизидина в разбавленную буферным раствором плазму крови, спектрофотометрическое определение скорости его окисления после добавления пероксида водорода и определение пероксидазной активности миелопероксидазы по разности скоростей окисления о-дианизидина в отсутствие и в присутствии гидразида 4-аминобензойной кислоты. Дополнительно определяют концентрацию миелопероксидазы в плазме крови путем внесения в лунки планшета аффинных антител крыс против миелопероксидазы, последующего добавления образцов плазмы и стандарта миелопероксидазы. Затем добавляют антитела кроликов против миелопероксидазы и конъюгированные с пероксидазой хрена антитела коз против IgG кролика. Далее вычисляют коэффициент удельной активации миелопероксидазы Куа как отношение активности фермента к его концентрации. При значениях Куа выше 1,65 ед.опт.пл./пг/мин констатируют нарушение функционального состояния миелопероксидазы. Изобретение позволяет быстро и достоверно определить функциональное состояние миелопероксидазы в плазме крови, что дает возможность прогнозировать развитие ряда заболеваний, уточнять диагнозы и своевременно принимать меры, направленные на регулирование активности фермента. 2 пр., 3 ил.
Реферат
Изобретение относится к медицине, а именно медицинской биохимии, и может быть использовано для определения функционального состояния фермента миелопероксидазы (МПО) в плазме крови путем одновременного измерения ее концентрации и активности.
Миелопероксидаза (МПО) - фермент, содержащийся в лейкоцитах - секретируется во внеклеточное пространство в очагах воспаления. Этот фермент катализирует образование окислителей (HOCl, HOBr), которые являются не только основой антимикробного потенциала нейтрофилов, но и способны вызывать повреждение собственных тканей организма в очагах воспаления и последующее развитие окислительного стресса. Таким образом, активность фермента определяет не только эффективность клеточного ответа в отношении патогена, но и степень повреждающего действия окислителей в отношении клеток и тканей организма-хозяина.
Активность МПО может регулироваться различными факторами, присутствующими в плазме крови. Так показано, что церулоплазмин, связываясь с МПО, ингибирует ее пероксидазную и хлорирующую активности, претендуя на роль эндогенного ингибитора активности фермента [1, 2]. Важным регулятором активности МПО является также pH среды [3]. Определение функционального состояния МПО позволит прогнозировать развитие ряда заболеваний, ассоциированных с окислительным стрессом и воспалением.
Известен иммунохимический способ определения количества МПО в биологических жидкостях, основанный на иммуноферментном методе анализа (ИФА) с применением моноклональных антител к этому ферменту [4]. Однако данный метод не дает возможности оценить функциональную активность МПО, от которой, в первую очередь, зависит, насколько интенсивна продукция этим ферментом реакционных окислителей, и которая, в конечном итоге, определяет степень повреждения биологически важных молекул, а вместе с тем - степень тяжести течения заболевания и развитие его осложнений.
Известен способ определения пероксидазной активности МПО в сыворотке (плазме) крови, который заключается в том, что в 50 мМ фосфатный буфер (pH 6,0) вносят сыворотку крови, затем добавляют пероксид водорода и o-дианизидин, являющийся субстратом пероксидаз, после чего в течение 5 мин измеряют оптическую плотность реакционной смеси при 460 нм, регистрируя скорость окисления о-дианизидина, которая и является мерой пероксидазной активности и функционального состояния МПО [5]. Однако данный метод имеет существенные недостатки, поскольку, во-первых, не учитывает возможного присутствия в сыворотке (плазме), помимо МПО, соединений, обладающих пероксидазной активностью, например, гемоглобина и/или его производных, а во-вторых, не позволяет оценивать удельную активность фермента, а следовательно, и его функциональное состояние, так как остается не ясным, какое количество МПО содержится в образце плазмы и обладает измеряемой активностью.
Наиболее близким техническим решением к заявляемому является способ определения пероксидазной активности МПО плазмы, включающий внесение субстрата о-дианизидина в разбавленную фосфат-цитратным буферным раствором (pH 4,5) плазму крови в отсутствие и в присутствии ингибитора МПО-гидразида 4-аминобензойной кислоты. Пероксидазную активность МПО в плазме крови определяют по разности скоростей окисления субстрата о-дианизидина в отсутствие и в присутствии гидразида 4-аминобензойной кислоты [6]. Этот способ дает возможность исключить вклад гемоглобина и других пероксидаз в получаемый результат. Однако данный способ, как и предыдущий, не позволяет определить удельную активность фермента и функциональное состояние МПО, так как не учитывает количество МПО, присутствующее в исследуемом образце плазмы.
Задачей изобретения является создание способа определения функционального состояния МПО в плазме крови, позволяющего повысить информативность, точность и диагностические возможности.
Техническим результатом заявленного изобретения является оптимизация, повышение информативности и расширение диагностических возможностей способа, что дает возможность прогнозировать развитие ряда заболеваний, уточнять диагнозы и своевременно принимать меры, направленные на регулирование активности фермента.
Поставленная задача достигается тем, что в способе определения функционального состояния МПО в плазме крови, включающем внесение субстрата о-дианизидина в разбавленную буферным раствором плазму крови, спектрофотометрическое определение скорости его окисления после добавления пероксида водорода в концентрации 100-200 мкМ, определение пероксидазной активности миелопероксидазы в плазме крови по разности скоростей окисления о-дианизидина в отсутствие и в присутствии гидразида 4-аминобензойной кислоты в фосфатно-цитратном буфере с pH 4,5, дополнительно определяют концентрацию миелопероксидазы в плазме крови путем внесения в лунки планшета аффинных антител крыс против миелопероксидазы, последующего добавления образцов плазмы и стандарта миелопероксидазы, затем добавляют антитела кроликов против миелопероксидазы и конъюгированные с пероксидазой хрена антитела коз против IgG кролика, количество миелопероксидазы в образцах плазмы определяют, сравнивая интенсивность развития хромогенной реакции в лунках со стандартом, далее вычисляют коэффициент удельной активации миелопероксидазы Куа, равный отношению активности фермента к его концентрации, и при значениях коэффициента удельной активности миелопероксидазы выше 1,65 ед.опт.пл./пг/мин констатируют нарушение функционального состояния миелопероксидазы.
Сущность изобретения состоит в том, что субстрат о-дианизидина вносят в разбавленную буферным раствором плазму крови в отсутствие и в присутствии гидразида 4-аминобензойной кислоты, спектрофотометрически определяют скорость окисления субстрата после добавления пероксида водорода (100-200 мкМ), пероксидазную активность МПО в плазме крови определяют по разности скоростей окисления о-дианизидина в отсутствие и в присутствии гидразида 4-аминобензойной кислоты в фосфатно-цитратном буфере с pH 4,5, дополнительно определяют концентрацию миелопероксидазы в плазме крови путем внесения в лунки планшета аффинных антител против МПО, полученных от крыс, последующего добавления образцов плазмы и стандарта МПО, количество МПО в образцах плазмы определяют, сравнивая величину изменения оптической плотности в лунках со стандартом, после последовательного добавления антител против МПО, полученных от кроликов, конъюгата пероксидазы хрена с антителами против антител кролика и хромогенного субстрата, далее вычисляют коэффициент удельной активности МПО Куа, равный отношению активности фермента к его концентрации, и при значениях коэффициента удельной активности МПО выше 1,65 ед.опт.пл./пг/мин констатируют нарушение функционального состояния МПО.
Сущность изобретения поясняется фиг.1, 2 и 3, где:
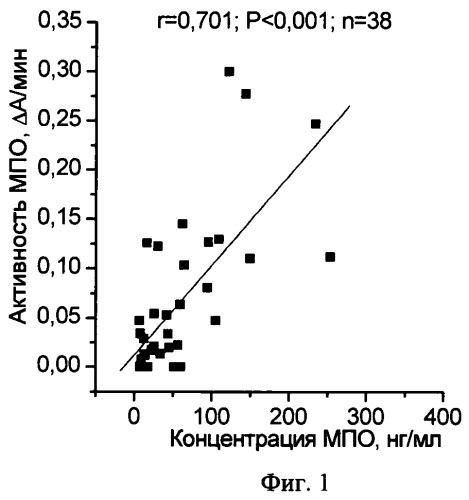
на фиг.1 проиллюстрирована взаимосвязь между концентрацией и пероксидазной активностью МПО в плазме крови здоровых людей;
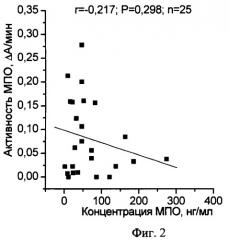
на фиг.2 показана взаимосвязь между концентрацией и пероксидазной активностью МПО в плазме крови больных сахарным диабетом 2 типа;
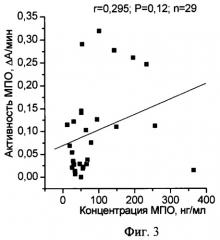
на фиг.3 показана взаимосвязь между концентрацией и пероксидазной активностью МПО в плазме крови больных ишемической болезнью сердца.
Способ осуществляют следующим образом.
Отделенную от клеточного осадка путем центрифугирования плазму крови в количестве 60-70 мкл вносят в спектрофотометрическую кювету объемом 0,8 мл, содержащую смесь лимонной кислоты и Na2HPO4 (pH 4,5) в отсутствие и в присутствии ингибитора МПО-гидразида 4-аминобензойной кислоты (50 мкМ), и субстрат о-дианизидин (380 мкМ). Пробу тщательно перемешивают непосредственно в кювете и начинают регистрацию увеличения ее оптической плотности на спектрофотометре при длине волны 450-460 нм в течение 8-10 мин после добавления пероксида водорода (100-200 мкМ). Оптическим контролем служит проба, содержащая такой же, как и в опытной пробе, объем буферного раствора и субстрата.
Расчет активности фермента проводят по формуле
где ΔD и ΔDинг - прирост оптической плотности за t минут в отсутствие и в присутствии гидразида 4-аминобензойной кислоты соответственно;
V - общий объем реакционной смеси;
t - время измерения активности;
ν - объем образца плазмы.
Измерения концентрации фермента проводят с помощью ИФА с использованием антител против МПО человека, полученных иммунизацией кроликов и крыс. В лунки полистирольного планшета на 12 часов при +4°C помещали 0,1 мл аффинных антител крыс против МПО человека (5 мг/л) в 0,1 М натрий-карбонатном буфере, pH 9,4, после промывки планшета 0,05% Tween 20 (v/v) в PBS (PBS-T) проводили блокировку BLOTTO-T (3%-ное обезжиренное молоко (w/v) в PBS-T) в течение 1 часа (0,2 мл), затем в лунках инкубировали в течение 1 часа стандартные растворы МПО (3-250 нг/мл) или пробы плазмы, разведенные BLOTTO-T (в 4-256 раз), после промывки планшета PBS-T в лунки помещали 0,1 мл антител кроликов против МПО (10 мг/л) в BLOTTO-T, после промывки планшета PBS-T в лунки помещали 0,1 мл антител коз против IgG кролика, конъюгированных с пероксидазой хрена (1:5000, «BioRad») в BLOTTO-T. После отмывки планшета PBS-T оценку активности проводили, выявляя пероксидазу с помощью хромогенной смеси: к раствору 10 мг о-фенилендиамина в 1 мл этанола добавляли 11 мл 0,1 М натрий-цитратного буфера, pH 4,0 и 5 мМ H2O2, спустя 4-5 мин к 0,1 мл смеси в лунках добавляли 0,05 мл 6 М H2SO4 и измеряли А492 на планшетном фотометре. Концентрацию МПО во фракциях рассчитывали по калибровочному графику с известными концентрациями МПО в диапазоне 3-250 нг/мл.
Далее вычисляют коэффициент удельной активности Куа, равный отношению активности фермента к его концентрации (С), который выражается в единицах, количественно равных изменению оптической плотности в минуту на пг фермента.
Расчет коэффициента удельной активации фермента проводят по формуле
Куа=АМПО/С
Коэффициент удельной активности МПО выше 1,65 ед.опт.пл./пг/мин позволяет говорить о нарушении функционального состояния фермента.
Сущность и практическая применимость заявляемого способа иллюстрируются следующими примерами.
Пример 1. Проведено клиническое обследование 47 добровольцев без выраженных признаков острых, инфекционных или аллергических заболеваний, без нарушений сердечного ритма и проводимости, без признаков воспаления и ишемической болезни сердца. Плазма крови была исследована описанным выше способом. Коэффициент удельной активности МПО был равен 1,35±0,30 ед.опт.пл./пг/мин, что соответствует нормальному функциональному состоянию МПО. Действительно, было показано, что в группе этих людей существует достоверная положительная корреляционная зависимость между активностью и содержанием МПО в плазме крови, что иллюстрирует фиг.1. Эти данные подтверждают нормальное функциональное состояние МПО.
Пример 2. В НИИ кардиологии (г.Минск) было проведено обследование группы больных с установленным диагнозом сахарный диабет (СД) 2 типа и ишемическая болезнь сердца (ИБС). Плазма крови была исследована описанным выше способом. Коэффициент удельной активности МПО в плазме крови больных СД 2 типа был равен 3,54±1,15 ед.опт.пл./пг/мин, а в группе больных ИБС - 1,71±0,37 ед.опт.пл./пг/мин, что соответствует нарушению функционального состояния МПО. Действительно, при исследовании показателей, характеризующих окислительно-восстановительные процессы в плазме крови как больных СД 2 типа, так и больных ИБС было достоверно увеличено количество окисленного глутатиона и продуктов, реагирующих с 2-тиобарбитуровой кислотой, что свидетельствует о развитии окислительного стресса. Подтверждением нарушения функционального состояния МПО явилось также отсутствие достоверной корреляционной зависимости между активностью и содержанием МПО в плазме крови как больных СД 2 типа, так и ИБС, что иллюстрируют фиг.2 и 3.
Таким образом, предлагаемый способ позволяет повысить информативность, точность и расширить диагностические возможности по сравнению с существующим способом, благодаря одновременной регистрации и количества, и активности МПО.
Источники информации
1. Sokolov A.V., Ageeva K.V., Pulina M.O. et al. Free Rad. Res. 2008. V.42. P.989-998.
2. Панасенко О.М., Чеканов А.В., Власова И.И. и др. Влияние церулоплазмина и лактоферрина на хлорирующую активность лейкоцитарной миелопероксидазы. Изучение методом хемилюминесценции. // Биофизика. 2008. Т.53. №5. С.573-581.
3. Власова И.И., Арнхольд Ю., Осипов А.Н., Панасенко О.М. рН-Зависимая регуляция активности миелопероксидазы. // Биохимия. 2006. Т.71. С.825-837.
4. Zhang R., Brennan M.-L., Fu X. et al. JAMA. 2001. V.286. P.2136-2142.
5. Baskol G., Demir H., Baskol M. et al. 2006. V.24. P.307-311.
6. Патент BY №13675, G01N 33/48, 30.10.2010.
Способ определения функционального состояния миелопероксидазы в плазме крови, включающий внесение субстрата о-дианизидина в разбавленную буферным раствором плазму крови, спектрофотометрическое определение скорости его окисления после добавления пероксида водорода в концентрации 100-200 мкМ, определение пероксидазной активности миелопероксидазы в плазме крови по разности скоростей окисления о-дианизидина в отсутствие и в присутствии гидразида 4-аминобензойной кислоты в фосфатно-цитратном буфере с pH 4,5, отличающийся тем, что дополнительно определяют концентрацию миелопероксидазы в плазме крови путем внесения в лунки планшета аффинных антител крыс против миелопероксидазы, последующего добавления образцов плазмы и стандарта миелопероксидазы, затем добавляют антитела кроликов против миелопероксидазы и конъюгированные с пероксидазой хрена антитела коз против IgG кролика, количество миелопероксидазы в образцах плазмы определяют, сравнивая интенсивность развития хромогенной реакции в лунках со стандартом, далее вычисляют коэффициент удельной активации миелопероксидазы Куа, равный отношению активности фермента к его концентрации, и при значениях коэффициента удельной активности миелопероксидазы выше 1,65 ед.опт.пл./пг/мин констатируют нарушение функционального состояния миелопероксидазы.