Оптоакустический мониторинг в реальном времени с помощью электрофизиологических катетеров
Иллюстрации
Показать всеИзобретение относится к оптоакустическим способам и средствам для мониторинга и оценки ткани. Катетер для оптоакустической оценки ткани содержит корпус, концевую секцию с концевым электродом, выполненным с возможностью абляции, оптический волновод для создания акустической волны и акустический детектор. При оценке ткани с использованием лазерного оптоакустического формирования изображения ткань подвергают абляции с использованием концевого электрода, подают энергию облучения, которая нагревает ткань для создания акустической волны, детектируют акустическую волну с помощью акустического преобразователя, регистрируют характеристики акустической волны и анализируют ее для оценки характеристики ткани. Система для оптоакустической оценки ткани, помимо катетера, включает электронный измеритель, выполненный с возможностью приема сигнала и регистрации темпорального профиля акустической волны и процессор, выполненный с возможностью реконструкции изображения или профиля ткани на основе темпорального профиля. Для оптоакустической оценки сердечной ткани используется система, включающая катетер. Использование изобретения позволяет улучшить чувствительность и пространственное разрешение оптоакустического исследования. 4 н. и 27 з.п. ф-лы, 9 ил.
Реферат
Область изобретения
Настоящее изобретения относится к электрофизиологическим катетерам и, в частности, к лазерным оптоакустическим электрофизиологическим катетерам для мониторинга ткани и оценки поражений.
Предпосылки создания изобретения
Для некоторых типов минимально инвазивных медицинских процедур невозможно в реальном масштабе времени получить информацию о состоянии области, находящейся в теле и подвергающейся лечению. Такое отсутствие информации не позволяет врачу использовать катетер для проведения процедуры. Примером таких процедур является лечение новообразований и заболеваний в печени и простате. Еще одним примером такой процедуры является абляция тканей сердца, применяемая для лечения мерцательной аритмии. Это состояние сердца приводит к генерированию анормальных электрических сигналов в эндокардиальной ткани, что вызывает нерегулярность сокращений сердца.
Наиболее часто встречающимся случаем сердечной аритмии является анормальная трассировка электрических сигналов через сердечную ткань. По существу большую часть случаев аритмии лечат путем абляции заподозренных центров таких электрических пропусков, тем самым заставляя эти центры становиться активными. Затем успех лечения зависит от локализации абляции в сердце и от самого поражения. Например, при лечении мерцательной аритмии абляционный катетер вводят в левое или правое предсердие, где его используют для нанесения абляционных поражений в сердце. Эти поражения предназначены для остановки неравномерности сердцебиения путем создания непроводящих барьеров между участками предсердий, которые препятствуют прохождению через сердце анормальной электрической активности.
Поражение должно быть создано так, чтобы прервать электропроводность в локализованном регионе (трансмуральность), но следует принять меры предосторожности, чтобы не допустить абляции прилегающих тканей. Кроме того, процесс абляции может вызвать нежелательное обугливание ткани и локализованную коагуляцию и привести к испарению воды из крови и ткани, создающему хлопки пара.
В настоящее время поражение оценивается после процедуры абляции путем позиционирования измерительного катетера в сердце, где он используется для измерения электрической активности в предсердиях. Это позволяет врачу оценить вновь сформированные поражения и определить, смогут ли они прекратить проводимость. Очевидно, что постабляционная оценка нежелательна, поскольку коррекция требует дополнительных медицинских процедур. Поэтому было бы желательно оценивать поражения по мере их формирования в ткани.
Известным из уровня техники способом оценки поражений по мере их формирования является измерение электрического импеданса. Биохимическое различие между подвергшейся абляции и нормальной тканью может привести к изменению электрического импеданса между этими типами ткани. Хотя при электрофизиологической терапии обычно осуществляют мониторинг импеданса, этот мониторинг напрямую не связан с формированием поражения. Измерение импеданса просто дает данные о локализации поражения ткани, но не дает данных о качестве, позволяющих оценить эффективность поражения.
Другим подходом является измерение электропроводности между двумя точками ткани. Этот процесс, известный как стимуляция поражения, также может определить эффективность лечения поражением. Этот способ, однако, измеряет успех или отсутствие такового каждого поражения и не дает информации в реальном времени о формировании поражения.
В более широком смысле, известно применение ультразвуковой акустоскопии для определения патологии в органах, состоящих из мягкой ткани и имеющих акустические границы. Однако ткани могут быть акустически гомогенны и, следовательно, неопределимы методом ультразвуковой акустоскопии. Подобные ограничения распространяются и на способы оптического формирования изображений, основанных на детектировании с разрешением по времени или по фазе диффузно отраженных световых импульсов или волн плотности фотонов.
Лазерная оптоакустическая технология может дать преимущества перед вышеупомянутыми технологиями. Повышение чувствительности, пространственное разрешение и интерпретация изображений могут быть получены путем соответствующего использования (1) лазерного облучения импульсами малой длительности для генерирования волн переходного напряжения в условиях темпорального ограничения напряжения, когда такое облучение дает большую амплитуду сгенерированного напряжения с профилями, напоминающими профили распространения света в тканях, для получения резких изображений с точной локализацией; (2) определения с разрешением по времени профиля напряжения для получения диагностической информации из темпорального профиля сгенерированной волны напряжения; и (3) широкополосных пьезоэлектрических детекторов для правильного воспроизведения профилей напряжения, для получения пространственного разрешения томографии. Однако применение такой технологии in vivo и, в частности, in vivo в внутрисердечных задачах и задачах, связанных с эпикардом, было ограничено разными факторами, включая пространственные ограничения и интеграцию оборудования для создания облучения и обнаружения оптоакустических данных.
Таким образом, существует потребность в интегрированном электрофизиологическом катетере, способном осуществлять мониторинг ткани и выполнять оценку поражения, особенно для внутрисердечной ткани и ткани эпикарда, в реальном масштабе времени с использованием оптоакустической технологии для улучшения чувствительности и пространственного разрешения.
Сущность изобретения
Настоящее изобретение исходит из того, что свет, направляемый в форме достаточно короткого импульса, селективно поглощается элементами ткани и окружающей средой (кровью) и преобразуется в теплоту. Эта теплота создает акустическую волну, которую можно обнаружить акустическим датчиком. Задержка во времени приема акустической волны пропорциональна расстоянию между элементами, генерирующими акустическую волну, и оптической системой, направляющей свет, и может использоваться для измерения толщины ткани. Для этого оптоакустический способ формирования изображения использует нерезонансные акустические частоты, которые возникают в результате свойств оптического поглощения материала в поле зрения оптического устройства, направляющего свет. Как таковые, выводимые сигналы имеют большую чувствительность к материалам с разными свойствами оптического поглощения, такими, как между тканью и кровью или воздухом. Таким образом, имеется возможность получить через кровь изображения биологической ткани с высоким разрешением с оперативным полем до нескольких сантиметров (которое определяется длиной волны, оптическим поглощением и размером акустического датчика). Такой способ формирования изображения может иметь особые преимущества во время и одновременно с абляцией и позволяет осуществлять визуализацию во время формирования поражения.
Настоящее изображение направлено на систему и способ оптоакустической оценки ткани и поражения в реальном масштабе времени по одной или более из следующих характеристик ткани: толщина ткани, прогрессия поражения, ширина поражения, хлопок пара и формирование обугливания. Система содержит элемент для абляции, средство подачи лазерного излучения и акустический датчик. Эти элементы работают, облучая ткань, подвергающуюся абляции, для создания акустических волн, которые имеют темпоральный профиль, который можно зарегистрировать и проанализировать аппаратурой для отбора акустических проб для реконструкции поперечного аспекта облученной ткани. Согласно настоящему изобретению элемент для абляции (например, высокочастотной абляции), средство подвода лазерного излучения, и акустический датчик сконфигурированы для взаимодействия с поверхностью ткани в общей ориентации, т.е. эти компоненты по существу обращены к поверхности ткани так, что направление облучения и направление акустического детектирования по существу противоположны друг другу, где волны напряжения, наведенные лазерным нагреванием ткани под поверхностью, отражаются обратно к поверхности ткани.
В более детальном варианте осуществления изобретения система содержит катетер, имеющий интегральную дистальную концевую секцию, сконфигурированную для облучения и акустического детектирования, электронный измеритель и процессор. Преимущественно, ткань, нагреваемая облучением, исходящим из концевой секции катетера, производит акустическую волну, которая принимается электронным измерителем для регистрации темпорального профиля акустической волны. Процессор использует темпоральный профиль для реконструкции поперечного аспекта ткани.
Настоящее изобретение также направлено на катетер для оптоакустической оценки ткани в реальном масштабе времени. В одном варианте катетер имеет корпус катетера и концевую секцию, сконфигурированную для облучения и акустического детектирования, в котором ткань нагревается облучением для создания акустической волны, которая детектируется акустическим детектором, установленным в концевой секции, и акустический детектор генерирует сигнал, представляющий характеристику ткани. В более детальном варианте катетер сконфигурирован для использования с сердечной тканью, а концевая секция сконфигурирована для высокочастотной абляции. Более того, излучение, излучаемое катетером, может быть лазерным импульсом, а исследуемой тканью может быть поражение, возникающее в результате высокочастотной абляции.
Настоящее изобретение также направлено на способ оценки ткани с помощью лазерной оптоакустической визуализации, при котором облучают ткань с дистального конца катетера для нагревания ткани и создания акустической волны, детектируют акустическую волну акустическим преобразователем, установленным на катетере, регистрируют характеристики акустической волны и анализируют акустическую волну для оценки характеристики ткани. Проводимый анализ может включать анализ на темпоральной основе, например, для определения расстояния между тканью генерирующей акустическую волну и дистальным концом катетера.
Настоящее изобретение предназначено для применения оптоакустической технологии в сочетании с высокочастотной абляцией. Для этой цели свет, используемый для нагревания ткани по существу не затрагивается тем участком [спектра] электромагнитного излучения, который используется для абляции. Спектральное окно для использования в настоящем изобретении составляет от 400 до 2000 нм, предпочтительно от 700 до 1100 нм, и определяется полосой (полосами) поглощения исследуемых контрастных образцов.
Краткое описание чертежей
Эти и другие признаки и преимущества настоящего изобретения будут более понятны из нижеследующего подробного описания со ссылками на приложенные чертежи где:
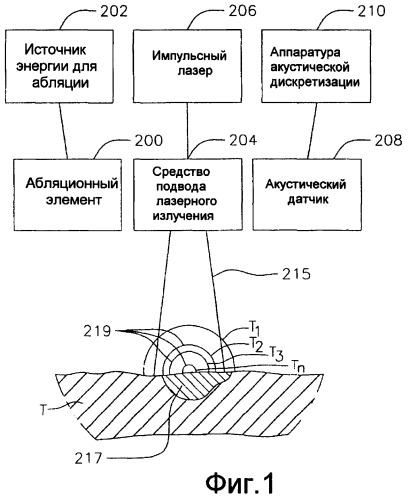
Фиг. 1 - вариант осуществления оптоакустической системы для абляции по настоящему изобретению.
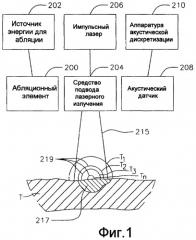
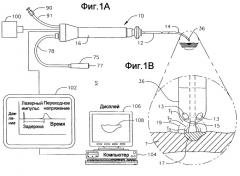
Фиг. 1А - другой вариант осуществления оптоакустической системы для абляции по настоящему изобретению.
Фиг. 1B - вид концевой секции катетера для использования в оптоакустической системе для абляции согласно настоящему изобретению.
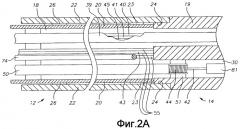
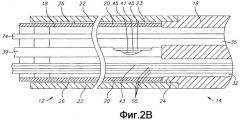
Фиг. 2А - вид сбоку в сечении по первому диаметру варианта осуществления катетера по настоящему изобретению, включая сочленение между корпусом катетера и промежуточной секцией.
Фиг. 2В - вид сбоку в сечении по второму диаметру, по существу перпендикулярному первому диаметру по фиг. 2A, варианта осуществления катетера по настоящему изобретению, включая сочленение между корпусом катетера и промежуточной секцией.
Фиг. 3А - вид сбоку в сечении по первому диаметру варианта осуществления катетера по настоящему изобретению, включая сочленение между пластиковым корпусом и концевым электродом.
Фиг. 3В - вид сбоку в сечении рядом со вторым диаметром, по существу перпендикулярным первому диаметру, показанному на фиг. 3, варианта осуществления катетера по настоящему изобретению, включая сочленение между пластиковым корпусом и концевым электродом.
Фиг. 3С - продольное сечение варианта промежуточной секции по фиг. 2А и 2В.
Фиг. 3D - вид сбоку в сечении по линии 3D-3D на фиг. 4 варианта осуществления катетера по настоящему изобретению, включая сочленение между пластиковым корпусом и концевым электродом.
Фиг. 4 - продольное сечение варианта осуществления концевого электрода по фиг. 3А и 3В.
Фиг. 5 - вид дистального конца варианта осуществления концевого электрода.
Фиг 5А - вид дистального конца другого варианта осуществления концевого электрода.
Фиг. 6А - вид сбоку в сечении по первому диаметру орошаемого катетера по настоящему изобретению, включая сочленение между корпусом катетера и промежуточной секцией.
Фиг. 6В - вид сбоку в сечении по второму диаметру, по существу перпендикулярному первому диаметру на фиг. 6А, варианта осуществления орошаемого катетера включая сочленение между корпусом катетера и промежуточной секцией.
Фиг. 7 - вид сбоку в сечении варианта осуществления катетера по настоящему изобретению, включая сочленение между пластиковым корпусом и промежуточной секцией.
Фиг. 8 - продольное сечение варианта осуществления промежуточной секции по фиг. 6А и 6В.
Фиг. 9 - продольное сечение варианта осуществления концевого электрода по фиг. 6А и 6В.
Подробное описание изобретения
На фиг. 1 показан вариант системы S для лазерного оптоакустического мониторинга для оценки в реальном масштабе времени формирования поражения, состояния ткани и морфологии ткани. Ткань Т подвергается высокочастотной абляции абляционным элементом 200, на который подается питание от источника 202 энергии для формирования поражения 217. Средство 204 подвода лазерного луча облучает поражение 217 и окружающую ткань в пределах его поля зрения 215 для стимуляции волн 219 давления (с разным временем Т1, Т2 … Тn задержки), которые обнаруживаются акустическими преобразователями 208 для формирования изображения поражения относительно окружающей ткани. Средство подвода лазерного луча может содержать оптоволоконный кабель, заключенный в катетер и предназначенный исключительно или в первую очередь для облучения, или интегрированный катетер, как будет описано ниже. Специалистам понятно, что формирование изображения согласно настоящему изобретению основано на контрасте, создаваемом разницей в поглощении. Для этого импульсный источник 206 лазерного излучения приводит в действие средство 204 для подвода лазерного луча для небольшого, но быстрого нагревания ткани и участка поражения в облучаемом поле зрения средства подвода лазерного луча. Такое нагревание вызывает микроскопическое расширение в поражении и в окружающей ткани, которые имеют разные показатели оптического поглощения, и такое расширение генерирует волны 219 давления с различимыми профилями напряжения, которые распространяются наружу. Акустический датчик 208 обнаруживает испускаемые волны давления, включая задержки Т1-Тn во времени, и преобразует профиль напряжения в электрические сигналы, которые принимаются аппаратурой 210 акустической дискретизации для реконструкции представления поражения в сечении. И когда задержка во времени приема акустических волн пропорциональна расстоянию источников, генерирующих акустические волны, от средства 204 подвода лазерного излучения, обнаруженные сигналы используются для определения толщины ткани, прогрессии поражения, ширины поражения и других оценочных параметров в реальном масштабе времени. Кроме того, применяя нерезонансные акустические частоты, которые возникают в результате свойств оптического поглощения различных материалов в облучаемом поле зрения средства подвода лазерного луча, полученный сигнал имеет тенденцию к значительно более высокой чувствительности к материалам с разными свойствами оптического поглощения, например между тканями с разной степенью абляции, тканью и кровью.
В более детальном варианте осуществления по фиг. 1А показана система S на основе катетера для лазерного оптоакустического мониторинга в реальном времени. Внутрисердечная ткань Т или ткань Т эпикарда подвергается высокочастотной абляции катетером 10, имеющим концевую секцию 36, выполненную с возможностью высокочастотной абляции для создания поражения 17. Для этого концевая секция 36 катетера имеет интегрированную структуру (фиг. 1В), из которой испускается излучение 15 для нагревания поражения 17 и окружающей ткани и стимуляции волн 19 давления (с разным временем Т1, Т2, … Тn задержки), которые обнаруживаются акустическими преобразователями 13 для формирования изображения поражения на фоне окружающей ткани. Источник 100 света создает импульсное облучение, которое направляется к концевой секции 36 катетера для небольшого, но быстрого нагревания ткани и поражения в пределах облучаемого поля зрения концевой секции 36. Аналогично, такое нагревание приводит к созданию микроскопического расширения в поражении и окружающей ткани, которые имеют разные свойства оптического поглощения, для генерирования волн давления с различимыми профилями напряжения, которые распространяются наружу. Преобразователи 13, которые могут включать пьезоэлектрические преобразователи, механические преобразователи или интерферометрические оптические датчики определяют время, величину и форму приходящих волн давления и преобразуют профиль напряжения в электрические сигналы, которые подаются на электронное следящее устройство или индикатор 102, например цифровой осциллограф, который работает как аналого-цифровой преобразователь, и регистрирует амплитуду и темпоральный профиль созданных лазером волн напряжения. Сигналы от электронного устройства 102, например оцифрованные сигналы от цифрового осциллографа, затем анализируются компьютером 104 для реконструкции изображения или представления 108 поражения на графическом устройстве 106 отображения. И вновь, когда задержка времени приема акустических волн пропорциональна расстоянию от источника, генерирующего акустические волны до источника облучения, обнаруженные сигналы могут использоваться для определения толщины ткани, прогрессии поражения, ширины поражения и других оценочных характеристик в реальном масштабе времени.
Согласно настоящему изобретению определение напряжения в вариантах, показанных на фиг. 1 и 1А, осуществляется в отраженном режиме. И, в частности, в системе катетера по фиг.1А, путем интегрирования излучения и оптического обнаружения в концевой секции 36 катетера обнаруженные волны напряжения были отражены к поверхности ткани, которая подверглась облучению, где акцент делается на высокое пространственное разрешение.
Как показано на фиг. 2А и 2В, вариант осуществления катетера 10 для использования в системе S согласно настоящему изобретению содержит удлиненный корпус 12 катетера, имеющий проксимальный и дистальный концы, отклоняющуюся промежуточную секцию 14 (однонаправленную или двунаправленную) на дистальном конце корпуса 12 катетера, и концевую секцию 36 на дистальном конце промежуточной секции, а также управляющую рукоятку 16 на проксимальном конце корпуса 12 катетера. Согласно настоящему изобретению концевая секция 36 имеет интегрированную конструкцию, которая осуществляет как облучение нужной ткани, так и обнаружение исходящих от нее волн напряжения.
Корпус 12 катетера содержит удлиненную трубчатую конструкцию, имеющую единственную осевую или центральную полость 18. Корпус 12 катетера выполнен гибким, т.е. изгибаемым, но по существу несжимаемым в направлении его длины. Корпус 12 катетера может иметь любую подходящую конструкцию и может быть выполнен из любого подходящего материала. Конструкция содержит внешнюю стенку 22, выполненную из экструдированного пластика. Внешняя стенка 22 может содержать внедренную плетеную сетку из нержавеющей стали или подобного материала для увеличения торсионной жесткости корпуса 12 катетера так, чтобы при повороте управляющей рукоятки 16 корпус 12 катетера, промежуточная секция 14 и концевая секция (концевой электрод) 36 катетера 10 вращались соответствующим образом.
Сквозь единственную полость 18 корпуса 12 катетера проходят компоненты, например провод 40 электрода и провода 41 и 45 термопары, защищенные оболочкой 39, оптоволоконный кабель 43, провода 55 преобразователя, сжимающая катушка 44, сквозь которую проходит натяжной провод 42, и кабель 74 электромагнитного датчика. Корпус катетера с единственной полостью может быть предпочтителен по сравнению с корпусом с множеством полостей, поскольку было обнаружено, что корпус с единственной полостью обеспечивает лучшее управление концом при вращении катетера. Единственная полость позволяет различным перечисленным компонентам свободно плавать в корпусе катетера. Если такие компоненты были бы заключены во множество полостей, они стремились бы накопить энергию при повороте рукоятки, что приводило бы к пружинящему действию, например, при отпускании рукоятки или при изгибании по кривой, что является нежелательной рабочей характеристикой.
Внешний диаметр корпуса 12 катетера не критичен, но предпочтительно не превышает прибл. калибр 8F, более предпочтительно, не превышает калибр 7F. Аналогично, толщина внешней стенки 22 не критична, но достаточно мала, чтобы в центральной полости 18 можно было разместить вышеперечисленные компоненты. Внутренняя поверхность внешней стенки 22 может быть выложена трубкой 20 жесткости, которая может быть изготовлена из любого подходящего материала, например, полиимида или нейлона. Трубка 20 жесткости и армированная сеткой внешняя стенка 22 обеспечивают улучшенную торсионную стабильность, одновременно минимизируя толщину стенки катетера, что позволяет довести до максимума диаметр центральной полости 18. Внешний диаметр трубки 20 жесткости приблизительно равен внутреннему диаметру внешней стенки 22 или немного меньше его. Для трубки 20 жесткости могут быть предпочтительны трубки из полиимида, поскольку они могут быть очень тонкостенными, одновременно обладая хорошей жесткостью. Это позволяет увеличить до максимума диаметр центральной полости 18, не жертвуя прочностью и жесткостью.
Как также показано на фиг. 3А, 3В и 3С, промежуточная секция 14 содержит более короткую секцию трубки 19, имеющую множество полостей. Трубка 19 выполнена из подходящего нетоксичного материала, предпочтительно более гибкого, чем корпус 12 катетера. Подходящим материалом для трубки 19 является неармированный полиуретан. Внешний диаметр промежуточной секции 14, как и внешний диаметр корпуса 12 катетера, предпочтительно не превышает калибр 8F, более предпочтительно, калибр 7F. Размер и количество полостей не критичны. В одном варианте осуществления изобретения промежуточная секция 14 имеет внешний диаметр прибл. калибра 7F (0,092 дюйма, 2,3368 мм). Трубка имеет первую смещенную от оси полость 30, вторую смещенную от оси полость 32, третью смещенную от оси полость 34 и четвертую смещенную от оси полость 35, которые по существу имеют одинаковый размер, каждая из которых имеет диаметр от прибл. 0,032 дюйма до прибл. 0,038 дюйма (0,8128-0,9652 мм), предпочтительно, 0,036 дюйма (0,0134 мм). В показанном варианте осуществления изобретения натяжной провод 42 проходит в первой полости 30, а оптический волновод, т.е. оптоволоконный кабель 43 и провода 55 преобразователя проходят через вторую полость 32. Провод 40 электрода проходит в третьей полости 34. Провода 41 и 43 термопары также проходят в третьей полости, а кабель 74 электромагнитного датчика проходит в четвертой полости 35.
Как лучше всего показано на фиг. 2А и 2В, корпус 12 катетера в одном варианте осуществления изобретения прикреплен к промежуточной секции 14 посредством наружной периферийной канавки 24, выполненной на проксимальном конце трубки 19, и которая принимает внутреннюю поверхность внешней стенки 22 корпуса 12 катетера. Промежуточная секция 14 и корпус 12 катетера прикреплены друг к другу клеем или подобным способом. Прежде чем промежуточная секция 14 и корпус 12 катетера будут прикреплены друг к другу, в корпус 12 катетера вставляют трубку 20 жесткости. Дистальный конец трубки 20 жесткости закреплен рядом с дистальным концом корпуса 12 катетера клеевым соединением 23, выполненным полиуретановым клеем или подобным средством. Предпочтительно, между дистальным концом корпуса 12 катетера и дистальным концом трубки 20 жесткости оставлено небольшое расстояние, например, прибл. 3 мм, чтобы оставить место в корпусе катетера для приема канавки 24 промежуточной секции 14. Если сжимающая катушка не используется, к проксимальному концу трубки 20 жесткости прилагают усилие и, когда трубка 20 жесткости находится под действием этого сжимающего усилия, выполняют первое клеевое соединение (не показано) между трубкой 20 жесткости и внешней стенкой 22 с помощью быстросохнущего клея, например, цианакрилового клея. После этого между проксимальным концом трубки 20 жесткости и внешней стенкой 22 формируют второе клеевое соединение 26, используя медленнее сохнущий, но более прочный клей, например полиуретан.
При необходимости, между дистальным концом трубки жесткости и проксимальным концом концевого электрода внутри корпуса катетера может быть расположен разделитель. Указанный разделитель обеспечивает переход на гибкость в зоне соединения между корпусом катетера и промежуточной секцией, что позволяет этому соединению изгибаться мягко без перегибов или складываний. Катетер, имеющий такой разделитель, описан в патентной заявке США № 08/924 616 «Steerable Direct Miocardial Revascularization Catheter», включенной в описание в качестве ссылки.
Как показано на фиг. 3А и 3В, концевая секция 36 отходит от дистального конца промежуточной секции 14. В показанном варианте осуществления концевой электрод имеет диаметр, приблизительно равный внешнему диаметру трубки 19 промежуточной секции 14. Промежуточная секция 14 и концевой электрод скреплены клеем 27 или подобным способом, нанесенным по окружности вокруг соединения трубки 19 и концевого электрода 36 (концевая секция). Более того, компоненты, проходящие между промежуточной секцией 14 и концевым электродом, например провод 40, провода 55 преобразователя, провода 41 и 45 термопары и натяжной провод 42, способствуют удержанию концевого электрода на промежуточной секции.
В показанном варианте концевая секция 36 имеет по существу пустотелый дистальный участок. Концевой электрод (концевая секция) содержит кожух 38 по существу равномерной толщины и запрессованный соединительный элемент или пробку 59, установленный на проксимальном конце кожуха, или рядом с ним, для уплотнения пустотелого дистального участка. Кожух и пробка выполнены из любого подходящего материала, который одновременно является и теплопроводным, и электропроводным, что позволяет проводить высокочастотную абляцию с использованием генератора высокой частоты. К таким подходящим материалам относятся, помимо прочих, платина, сплав на основе золота или сплав на основе палладия. Концевой электрод (концевая секция) и способ его изготовления раскрыты в заявке № 11/058,434, поданной 14 февраля 2005 года и в заявке № 11/453,188, поданной 13 января 2006 года, содержание которых включено в настоящее описание путем отсылки.
На концевую секцию 36 для проведения высокочастотной абляции энергия подается по проводу 40, который проходит через третью полость 34 промежуточной секции 14, центральную полость 18 корпуса 12 катетера и управляющую рукоятку 16, и его проксимальный конец заканчивается штекером 75, который может вставляться в соответствующий монитор (не показан). Часть провода 40, проходящая через центральную полость 18 корпуса 12 катетера, управляющую рукоятку 6 и дистальный конец промежуточной секции 14 заключена в защитную оболочку 39, которая может быть выполнена из любого подходящего материала, предпочтительно из Teflon RTM. Защитная оболочка 39 на дистальном конце закреплена в дистальном конце промежуточной секции 14 путем приклеивания ее в полости 34 полиуретановым или подобным клеем. Провод 40 прикреплен к концевому электроду 36 (концевой секции) любым известным способом. В показанном варианте соединение провода 40 с концевой секцией 36 выполнено, например, завариванием дистального конца провода 40 в первом глухом отверстии 31 (фиг. 3 D) в выравнивающем элементе 59 концевого электрода 36 (концевой секции).
В раскрытом варианте концевой электрод 36 снабжен средством температурного датчика. Можно использовать любое известное средство температурного датчика, например термопару или термистор. Как показано на фиг. 3А и 3В, подходящее средство температурного датчика для концевой секции 36 содержит термопару, сформированную парой проводов. Один провод из пары является медным проводом 41, например медным проводом номер "40". Другой провод пары является константановым проводом, который обеспечивает прочность и поддержку этой пары проводов. Провода 41 и 45 этой пары электрически изолированы друг от друга, за исключением их дистальных концов, где они контактируют и скручены друг с другом, и покрыты короткой пластиковой трубкой 63, например, из полиимида, и сверху покрыты эпоксидной смолой. Пластиковая трубка 63 затем крепится во второе глухое отверстие 33 концевого электрода 36 (фиг. 3В) с помощью эпоксидной смолы или подобного средства. Провода 41 и 45 проходят по третьей полости 34 в промежуточной секции 14. В корпусе 12 катетера провода 41 и 45 проходят по центральной полости 18 внутри защитной оболочки 39, вместе с проводом 40. Провода 41 и 45 затем проходят через управляющую рукоятку 16 и входят в соединитель, выполненный с возможностью соединения с температурным монитором (не показан). Альтернативно, средством датчика температуры может быть термистор. Подходящим термистором для использования в настоящем изобретении является модель № AB6N2-GC14KA143T/37C, выпускаемая компанией Thermometrics (штат Нью-Джерси).
Как показано на фиг. 2А, 3А и 3D, натяжной провод 42, являющийся частью средства для отклонения катетера и проходящий сквозь корпус 12 катетера, закреплен своим проксимальным концом к управляющей рукоятке 16, а дистальным концом закреплен на концевом электроде 36. Натяжной провод выполнен из любого подходящего металла, например из нержавеющей стали или из сплава Nitinol и, предпочтительно, покрыт Teflon RTM или подобным материалом. Покрытие обеспечивает скольжение натяжного провода. Натяжной провод предпочтительно имеет диаметр от прибл. 0,006 до 0,010 дюйма (0,1524-0,254 мм).
Катушка 44 сжатия расположена внутри корпуса 12 катетера и окружает натяжной провод. Катушка 44 сжатия проходит от проксимального конца корпуса 12 катетера до проксимального конца промежуточной секции 14 (фиг. 2А). Катушка сжатия выполнена из любого подходящего металла, предпочтительно из нержавеющей стали, и плотно намотана на самое себя для обеспечения гибкости, т.е. изгиба, но для сопротивления сжатию. Внутренний диаметр катушки сжатия предпочтительно немного превышает диаметр натяжного провода 42. Тефлоновое покрытие на натяжном проводе позволяет ему свободно скользить внутри катушки сжатия. При желании, в частности если провод 40 не заключен в защитную оболочку, внешняя поверхность катушек сжатия может быть покрыта гибкой, неэлектропроводной оболочкой, например, выполненной из трубки из полиимида, для предотвращения контакта межу катушками сжатия и любыми другими проводами внутри корпуса 12 катетера.
Как показано на фиг. 12А, катушка 44 сжатия закреплена своим проксимальным концом в проксимальном конце трубки 20 жесткости в корпусе 12 катетера клеевым соединением 50, а дистальным концом прикреплена к промежуточной секции 14 клеевым соединением 51. Оба клеевых соединения 50 и 51 предпочтительно содержат полиуретановый клей или подобный материал. Клей можно наносить шприцем или подобным средством через отверстие, выполненное между внешней поверхностью корпуса 12 катетера и центральной полостью 18. Такое отверстие можно формировать, например, иглой или подобным инструментом, который достаточно нагрет для формирования постоянного отверстия, и который прокалывает внешнюю стенку 22 корпуса 12 катетера и трубку 20 жесткости. Затем сквозь отверстия вводят клей на внешнюю поверхность катушки 44 сжатия, который растекается вокруг этой внешней поверхности для формирования клеевого соединения вокруг всей окружности катушки сжатия.
Как показано на фиг. 2А, 3А и 3С, натяжной провод 42 проходит в первую полость 30 промежуточной секции 14. Натяжной провод 42 дистальным концом прикреплен к концевому электроду 36 в третьем глухом отверстии 73, выполненном в выравнивающем элементе 59, как показано на фиг. 3D. Способ крепления натяжного провода 42 в концевом электроде 36 заключается в обжатии металлической трубки 46 на дистальном конце натяжного провода 42 и запаивании металлической трубки 46 внутри глухого отверстия 73. Крепление натяжного провода 42 в выравнивающем элементе 59 обеспечивает дополнительную поддержку, снижая вероятность того, что концевой электрод 36 (концевая секция) отвалится. Альтернативно, как понятно специалистам, натяжной провод 42 можно крепить к стороне трубки 19 промежуточной секции 14. Внутри первой полости 30 промежуточной секции 14 натяжной провод 42 проходит сквозь пластиковую, предпочтительно тефлоновую (Teflon, RTM), оболочку 81, которая предотвращает врезание натяжного провода в стенку промежуточной секции 14 во время изгиба промежуточной секции.
Продольное движение натяжного провода 42 относительно корпуса 12 катетера, возникающее в результате отклонения концевого электрода 36, достигается подходящими манипуляциями управляющей рукоятки 16. Подходящая управляющая рукоятка 16 описана в патенте США № 6602264, содержание которого полностью включено в настоящее описание путем отсылки.
В показанном варианте осуществления изобретения по фиг. 3А, 3В и 3D концевой электрод 36 несет электромагнитный датчик 72. Электромагнитный датчик 72 соединен с кабелем 74 электромагнитного датчика, который проходит по каналу 75 (фиг. 4) в выравнивающем элементе 59, в третьей полости 35 секции 36 концевого электрода, в центральной полости 18 корпуса 12 катетера в управляющую рукоятку 16. Как показано на фиг. 1, кабель 74 электромагнитного датчика затем выходит из проксимального конца управляющей рукоятки 16 внутри шнура 78 с электроразрывным соединением и подходит к модулю 75 управления датчиком, в котором размещена печатная плата (не показана). Альтернативно, печатная плата может располагаться в управляющей рукоятке 16, например, как описано в заявке на патент США № 08/924,616, озаглавленной "Управляемый катетер для прямой реваскуляризации миокарда", все содержание которой включено в настоящее описание путем отсылки. Кабель 74 электромагнитного датчика содержит множество проводов, заключенных в пластиковую оболочку. В модуле 75 управления датчиком провода из кабеля 74 электромагнитного датчика соединены с печатной платой. Печатная плата усиливает сигнал, полученный от электромагнитного датчика 72, и передает его на компьютер в машиночитаемой форме через соединитель 77 датчика на проксимальном конце модуля 75 управления датчиком, как показано на фиг. 1. Поскольку катетер может быть спроектирован для одноразового использования, печатная плата может содержать микросхему СППЗУ (EPROM), который отключает печатную плату прибл. через 24 часа после использования катетера. Это предотвращает возможность повторного использования катетера или, по меньшей мере, электромагнитного датчика. Подходящие электромагнитные датчики для использования в настоящем изобретении описаны, например, в патентах США №№ 5558091; 5443489; 5480422; 5546951; 5568809 и 5391199, и в международной публикации WO 95/02995, содержание которых включены в настоящее описание путем отсылки. Электромагнитный датчик 72 картирования может иметь длину прибл. 6-7 мм и диаметр прибл. 1,3 мм.
Согласно одному из признаков настоящего изобретения катетер 10 выполнен с возможностью облегчения оптоакустической оценки в реальном масштабе времени характеристик подвергшейся абляции ткани, включая, помимо прочего, толщину ткани, прогрессию поражения, ширину поражения и другие оценочные характеристики. Такие оценки проводятся путем использования нерезонансных акустических частот, которые являютс