Способ герметизации межкишечного анастомоза
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к хирургии, и может быть использовано для герметизации межкишечного анастомоза. Для этого перед погружением в брюшную полость и зашиванием срединной раны на серозный покров тонкой кишки по всей окружности межкишечного анастомоза проводят аппликацию 30-40 г сухого лиофилизированного криопреципитата. После этого в этот криопреципитат по каплям добавляют или 2-3 мл 5% раствора хлористого кальция или 4-5 мл стерильного тромбина 15 ед. NIH/мл, растворенного в 5% растворе аминокапроновой кислоты. Через 60 секунд после образования гелеобразной фибриновой пленки производят повторную аппликацию того или иного двухкомпонентного состава. Способ обеспечивает повышение прочности и биологической герметичности кишечных швов на фоне распространенного перитонита за счет эффективной фиксации фибрина, который при этом не оказывает повреждающего действия на ткани, способен к быстрому образованию фибриновой пленки, гомологичен и безопасен, проникает в зону шва, заполняя отверстия от вколов иглы, позволяя равномерно закрыть анастомоз по окружности. 4 ил., 4 пр.
Реферат
Изобретение относится к медицине, а именно к хирургии, и может быть использовано для укрепления и дополнительной герметичности межкишечных анастомозов, применяемых у больных с распространенным перитонитом.
Одной из наиболее важных проблем клинической медицины является проблема несостоятельности межкишечных анастомозов у больных с распространенным перитонитом. Известно, что в течение первых 4-7 суток после операции кишечный шов герметичен лишь за счет механического сшивания тканей и независимо от рядности проницаем для микрофлоры, находящейся в просвете кишки (Василевич А.П., Шотт А.В., Запорожец А.А. Использование биологических клеевых композиций при наложении кишечного шва. Здравоохранение Белоруссии. - 1989. - №5. - Стр. 4-8). Однако биологическая надежность кишечного анастомоза достигается лишь за счет выпавшего в зону швов белка и фибрина. В условиях перитонита и программированных санаций брюшной полости происходит уменьшение количества фибрина в зоне кишечного шва с последующим ослаблением процессов регенерации и биологической герметичности (Шуркалин Б.К., Горский В.А, Леоненко И.В. Проблема надежности кишечного шва. Consilium medicum. - 2004. - Т.6. - №6. - С.17-25). Этим обуславливается высокая частота несостоятельности швов межкишечных анастомозов. Наличие гнойного воспаления в брюшной полости и тяжелое состояние больного заставляют часто идти на формирование различных кишечных стом, применять отсроченное анастомозирование в процессе плановых санаций брюшной полости, экстраперитонизацию межкишечного соустья, окутывать зону кишечного анастомоза сальником, лоскутом брыжейки кишки, использовать твердую мозговую оболочку, консервированные аллотрансплантаты.
Известен способ герметизации кишечных швов путем нанесения на них медицинского клея «Сульфакрилат», регистрационное удостоверение №ФС 01031444/2587-06 от 07 февраля 2006 года (Марченко В.Т. Клинические и морфологические аспекты применения нового клея «Сульфакрилат» в хирургии органов грудной и брюшной полости. Дис. док. мед. наук. - Новосибирск. - 2004. - 212 с.).
Однако известный способ имеет ряд недостатков, а именно: 1) в состав клея «Сульфакрилат» входят не биологические вещества, стимулирующие регенерацию тканей, а химические: этил - альфа цианокрилат (связующий компонент), бутилакрилат (пластификатор), сульфоланметакрилат (противовоспалительный и антибактериальный компонент); 2) плохое впитывание клея в живые ткани; 3) ненадежность фиксации и быстрое отслаивание; 4) после нанесения «Сульфакрилата» в процессе его полимеризации в области кишечных швов формируется зона асептического коагуляционного некроза, которая обусловлена местным токсическим действием клея, и этот фактор в условиях перитонита может препятствовать герметичности кишечного шва и увеличивать риск его несостоятельности.
Наиболее близким по достигаемому техническому результату (прототипом) является способ герметизации операционных швов с применением фибринового клея «Тиссукол Кит», Бакстер А.Г., Австрия (Абжуева О.В., Русанов В.М., Жидков И.Л. Экспериментальное и клиническое изучение эффективности нового лечебного средства - фибринового клея. Гематология и трансфузиология. - 2000. - Т.45. - №1. - С.35-37; Ахаладзе Г.Г. Применение препаратов фибринового клея в гепатопанкреатобиллиарной хирургии. Consilium medicum. T.4. - №6. - 2002; Перельман М.И., Кононенко С.Н., Зыков А.С., Лимончиков С. В., Павленко И.А. Современные клеевые композиции в торокальной хирургии. Хирургия. - 2002. - №2. - C.47-49).
Известное биологическое гемостатическое средство местного применения имеет следующее действие: «Тиссукол Кит» (Регистрационный номер П N 014732/01) состоит из флакона с лиофилизированным порошком Тиссуколом (компонент 1), флакона с лиофилизированным Тромбином разной концентрации (компонент 2) и 2 флаконов с растворителями (апротинин и хлорид кальция). В комплект входят шприцы/система «Дупложект». Для растворения компонента Тиссукол используется специальное устройство для нагрева до 37°С и перемешивания - «Фибринотерм», которое ускоряет растворение Тиссукола (полное растворение занимает 10-15 мин). Компоненты клея могут наноситься следующими способами: 1. Последовательное нанесение каждого из компонентов; 2. Одновременное нанесение с использованием системы «Дупложект» (кассета для 2-х шприцев с общим плунжером) и аппликационной иглы (короткая тупая игла, в основании которой происходит перемешивание). Для распыления раствора Тиссукола с применением системы «Дупложект» и распылительной головки используется «Тиссомат»: блок контроля подачи сжатого газа, включающий ножной переключатель, манометр, кран-редуктор и специальный шланг. Применяемая доза раствора Тиссукола зависит от размеров поверхности, которую нужно зафиксировать или покрыть, а также от применяемого метода нанесения. Обычно одного набора достаточно для заклеивания поверхности площадью не менее 10 кв. см. При нанесении клея путем распыления того же количества хватит для закрытия поверхности площадью от 25 до 100 кв. см.
Известный способ имеет следующие недостатки (Северцев А.Н., Брехов Е.И., Миронов Н.П., Репин И.Г., Иванова Е.Н., Башилов В.П. Использование в клинической практике некоторых фармакологических препаратов для достижения окончательного гемостаза при резекция печени. - Клинический вестник "Кремлевская медицина». - №2. - 2000. - С.22-26): 1) невысокая адгезивная способность клея, что диктует в ряде случаев необходимость повторного нанесения; 2) ненадежная фиксация фибриновой пленки; 3) сложность применения во время операции и необходимость соблюдения определенного времени для подготовки клея и для достаточного фибринообразования в зависимости от активности используемого тромбина; 4) наличие дополнительного специального оборудования (нагреватель и распылитель); 5) возможность спонтанного образования фибрина в емкости, содержащей фибриноген; 6) высокая стоимость клея «Тиссукол Кит», ограничивающая его применение в клинической практике.
Техническим результатом заявляемого способа является повышение прочности и биологической герметичности кишечных швов, применяемых на фоне распространенного перитонита.
Технический результат достигается тем, что перед погружением в брюшную полость и зашиванием срединной раны на серозный покров тонкой кишки по всей окружности межкишечного анастомоза делают аппликацию 30-40 г сухого лиофилизированного криопреципитата, причем для получения стабильного фибрина и фиксации его в месте анастомоза в сухой лиофилизированный криопреципитат по каплям добавляют или 2-3 мл 5% хлористого кальция или 4-5 мл стерильного тромбина 15 ед. NIH/мл, растворенного в 5% растворе аминокапроновой кислоты и через 60 секунд после образования гелеобразной фибриновой пленки производят повторную аппликацию двухкомпонентного состава.
Авторы предлагают эффективный способ укрепления межкишечных анастомозов за счет образования в зоне кишечных швов фибриновой пленки путем смешивания на биологических тканях двухкомпонентного состава.
Способ проиллюстрирован фигурами 1-4.
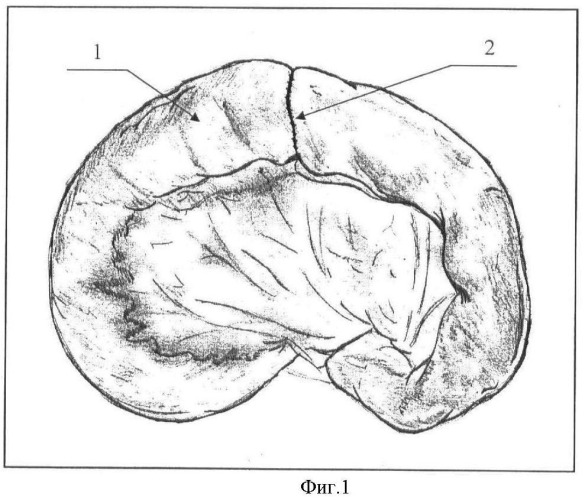
На фигуре 1 после резекции тонкой кишки представлено формирование однорядного межкишечного энтероэнтероанастомоза «конец в конец» с использованием атравматического шовного материала.
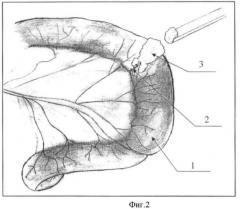
На фигуре 2 представлена аппликация на серозный покров тонкой кишки по окружности межкишечного энтероэнтероанастомоза 30-40 г сухого лиофилизированного криопреципитата (например, производства Рубцовской станции переливания крови), содержащего фибриноген и другие адгезивные белки плазмы крови.
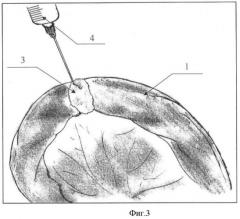
На фигуре 3 представлено добавление в сухой криопреципитат по каплям из шприца или 2-3 мл 5% хлористого кальция или 4-5 мл стерильного тромбина 15 ед. NIH/мл, растворенного в 5% растворе аминокапроновой кислоты.
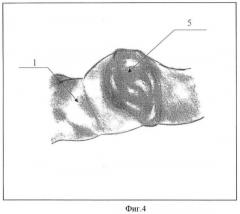
На фигуре 4 представлено формирование в зоне межкишечного энтероэнтероанастомоза гелеобразной фибриновой пленки, полностью закрывающей все кишечные швы.
Позиции, отмеченные на фигурах 1, 2, 3, 4, обозначают: 1 - тонкая кишка; 2 - межкишечный энтероэнтероанастомоз «конец в конец»; 3 - сухой лиофилизированный криопреципитат в зоне кишечных швов; 4-5% раствор хлористого кальция или раствор тромбина, добавляемый в сухой лиофилизированный криопреципитат; 5 - формирование фибриновой гелеобразной пленки, герметизирующей кишечные швы.
Способ осуществляют следующим образом.
Под интубационным наркозом выполняют лапаротомию, резекцию тонкой кишки и накладывают межкишечный энтероэнтероанастомоз по типу «конец в конец» или «бок в бок»» однорядным швом с использованием атравматического шовного материала. Диаметр анастомоза 3 см. Операцию заканчивают трансназальной интубацией тонкой кишки, санацией и дренированием брюшной полости. Перед погружением в брюшную полость и зашиванием срединной раны на серозный покров тонкой кишки по всей окружности межкишечного анастомоза делается аппликация 30-40 г сухого лиофилизированного криопреципитата (например, производства Рубцовской станции переливания крови), содержащего фибриноген и другие адгезивные белки плазмы крови. Во избежание гемотрансмиссивных инфекций при заготовке криопреципитата используется карантинизированная плазма доноров. Для получения стабильного фибрина и фиксации его по всей окружности анастомоза в сухой криопреципитат по каплям из шприца добавляется или 2-3 мл 5% хлористого кальция или 4-5 мл стерильного тромбина 15 ед. NIH/мл, растворенного в 5% растворе аминокапроновой кислоты. Тромбин является белковым препаратом, полученным из карантинизированной плазмы крови человека, выпускаемым ООО фирма «Технология - Стандарт», г. Барнаул. Через 20-30 сек после добавления второго раствора в области межкишечного анастомоза начинают активизироваться процессы образования гелеобразной фибриновой пленки, адгезивные свойства которой постепенно увеличиваются и достигают максимума к 5 мин. Через 60 сек в зоне анастомоза осуществляется повторная аппликация двухкомпонентного состава (манипуляции с последовательным нанесением сухого криопреципитата, или 5% хлористого кальция, или раствора тромбина). После образования плотного фибринового сгустка в виде герметизирующей швы гелеобразной пленки тонкая кишка погружается в брюшную полость. Срединная рана зашивается наглухо.
Клинические примеры
1. Больной Ж., 58 лет, поступил в отделение гнойной хирургии краевой клинической больницы 04.04.2010 г.с жалобами на умеренные боли в животе, слабость, недомогание, выделение кишечного содержимого из дренажных ран на передней брюшной стенке. Из анамнеза: считает себя больным с 23.03.2010 г., когда с клиникой ущемленной паховой грыжи слева поступил в х/о ЦРБ по месту жительства. В экстренном порядке оперирован - грыжесечение по Постемскому. В грыжевом мешке находилась петля тонкой кишки, признана жизнеспособной, на сомнительные участки тонкой кишки наложены погружные серо-серозные швы. На 7 сутки явления кишечной непроходимости. 30.03.2010 г. - лапаротомия, назоинтестинальная интубация, санация, дренирование брюшной полости. На 5 сутки появилось кишечное отделяемое из дренажной раны в правой подвздошной области. Консультирован хирургом краевого центра медицины катастроф. Доставлен санитарным транспортом в отделение гнойной хирургии Краевой клинической больницы. Диагноз при поступлении: Ущемленная паховая грыжа слева. Оперативное лечение в ЦРБ: 23.03.2010 г. - грыжесечение, 30.03.10 - лапаротомия, интубация кишечника. Острая перфорация и несостоятельность швов на тонкой кишке. Послеоперационный распространенный фибринозно-гнойный перитонит. Абдоминальный сепсис. После предоперационной подготовки оперирован. 05.04.2010 г. - релапаротомия, обструктивная резекция тонкой кишки с формированием приводящей и отводящей культи тонкой кишки и оставлением их в брюшной полости без наложения межкишечного анастомоза, трансназальная интубация приводящей части тонкой кишки, санация и дренирование брюшной полости. Проводилось интенсивное лечение в условиях отделения реанимации с постоянной аспирацией из зонда. 07.04.2010 г. выполнена санационная релапаротомия. Во время ревизии на петлях тонкой кишки сохраняются фибринозные наложения с инфильтрацией стенки кишки и брюшины. Культи тонкой кишки состоятельны. От наложения межкишечного анастомоза решено воздержаться. Произведена санация и дренирование брюшной полости. 09.04.2010 г. выполнена санационная релапаротомия. При ревизии: фибринозные наложения незначительные, блестящая париетальная брюшина, скудный серозный выпот, петли тонкой кишки не расширены, культи состоятельны. Наложен отсроченный двухрядный энтероэнтероанастомоз «бок в бок». Перед зашиванием передней брюшной стенки с целью герметизации кишечных швов на зону межкишечного анастомоза произведена аппликация двухкомпонентного состава в последовательности: криопреципитат - 2 мл 5% хлористого кальция - криопреципитат - 2 мл 5% хлористого кальция. Через 5 минут в зоне анастомоза образовался плотный фибриновый сгусток. Кишка погружена в брюшную полость. Послойно швы на рану. Дальнейший послеоперационный период протекал без осложнений. Признаков несостоятельности анастомоза не отмечено. Постепенно восстановился пассаж по кишечнику, нормализовалась температура. Больной выписан в удовлетворительном состоянии.
2. Больной Б., 52 лет, поступил в отделение гнойной хирургии краевой клинической больницы 10.10.2010 г. в тяжелом состоянии. Из анамнеза: 07.10.2010 г. был оперирован в х/о ЦРБ по поводу мезентериального тромбоза с некрозом тонкой кишки. Выполнена резекция тонкой кишки с наложением энтероэнтероанастомоза «бок в бок», санация и дренирование брюшной полости. При поступлении: состояние тяжелое, стабильное. Находится на ИВЛ. Без сознания (медикаментозный сон). В носу назогастральный зонд с застойным отделяемым. АД 120/70 мм рт.ст. Пульс - 100 в мин. При пальпации живот мягкий, инфильтратов не пальпируется. Срединный шов размером 16×2 см без признаков воспаления. В подвздошных областях силиконовые дренажи с серозно-геморрагическим отделяемым. С-м Щеткина-Блюмберга отрицателен. Проведены дополнительные методы обследования: КТ брюшной полости и забрюшинного пространства: Двусторонняя полисегментарная пневмония. Пневмоперитонеум. Дилатация петель кишечника. Атеросклероз аорты и ее ветвей. АПАЧИ II - 15 баллов. Анализы: Нв - 120 г/л, тромбоциты - 144×109, лейкоцитоз - 22×109, палочкоядерный сдвиг влево - 17, мочевина -11,4 ммоль/л, креатинин - 148 ммоль/л, белок - 40 г/л. Клинический диагноз при поступлении: Мезентериальный тромбоз в бассейне ВБА с некрозом тонкой кишки. Состояние после резекции тонкой кишки и наложения межкишечного анастомоза в НРБ от 08.10.10. Послеоперационный вялотекущий перитонит. Сепсис. ПОН. Операция 11.10.2010 г. - программированная релапаротомия. Выделена верхняя брыжеечная артерия от устья на протяжении 5 см. При ее ревизии до границы резекции брыжейки тонкой кишки пульсация ее сохранена, имеется несостоятельность по задней губе межкишечного анастомоза с подтеканием кишечного содержимого при надавливании. Ниже анастомоза и до слепой кишки остается участок подвздошной кишки длиной 40-50 см. Эта часть кишки с ишемическими крупноочаговыми пятнами багрово-синюшного цвета, стенка ее инфильтрирована, утолщена. Пульсации брыжейки в этом месте не определяется. При ревизии слепая кишка с крупными очагами некроза зеленого цвета /до 4-5 см в диаметре/ с истончением стенки по типу «пергаментной бумаги»). Произведена обструктивная резекция межкишечного анастомоза, оставшейся части подвздошной кишки и правой половины ободочной кишки с формированием культей тонкой и ободочной кишки, трансназальная интубация приводящего отдела кишечника, санация и дренирование брюшной полости. 13.10.2010 г. - санационная релапаротомия. Культи поперечно-ободочной кишки и тощей кишки состоятельны, розового цвета, дополнительных очагов некроза нет. Тощая кишка не растянута. Наложен отсроченный еюнотрансверзоанастомоз «бок в бок» двухрядным швом /атравматическая нить «Моносин» 3,0/. Выполнена санация и дренирование брюшной полости. Перед зашиванием передней брюшной стенки на зону еюнотрансверзоанастомоза произведена последовательная аппликация 40 г сухого криопреципитата и раствора 5% хлористого кальция (2-3 мл) с последующим формированием фибриновой пленки. В послеоперационном периоде проводилась инфузионная, антибактериальная терапия, физиолечение. Осложнений не было. Шов зажил первичным натяжением. Больной выписан в удовлетворительном состоянии.
Таким образом, эффективность предложенного способа заключается в том, что двухкомпонентный состав, применяемый для повышения биологической герметичности межкишечных анастомозов в условиях распространенного перитонита: 1) не оказывает повреждающего действия на ткани; 2) обладает способностью к быстрому образованию фибриновой пленки (в течение 20-30 сек); 3) обладает гомологичностью и безопасностью по отношению к тканям человека; 4) имеет сродство к тканям, вследствие чего проникает в зону шва и заполняет отверстия от вколов иглы; 5) позволяет равномерно закрыть анастомоз по окружности; 6) имеет стоимость в 5-7 раз ниже в сравнении с прототипом, что обуславливает его большую доступность для лечебной сети.
3. Больной Ч., 43 года, поступил в отделение гнойной хирургии КГБУЗ «Краевая клиническая больница» 11.11.2011 г. в крайне тяжелом состоянии с жалобами на боли в животе, тошноту, рвоту. Из анамнеза заболевания установлено, что 05.08.11 г. была тупая травма живота. За медицинской помощью в х/о ЦРБ обратился только 08.11.2011 г. В экстренном порядке был оперирован. На операции обнаружены множественные разрывы тощей кишки, распространенный фибринозно-гнойный перитонит. Была выполнена лапаротомия, ушивание разрывов тощей кишки, санация и дренирование брюшной полости. В послеоперационном периоде явления продолжающегося перитонита, сепсиса. Консультирован в центре медицины катастроф, транспортом санитарной авиации вывезен в краевую больницу. Анализ крови при поступлении: Нв - 80 г/л, лейкоциты 9,5×109, п/я нейтрофилы - 32, Калий - 3,9 ммоль/л, Натрий - 149 ммоль/л, креатинин - 112 ммоль/л, общий белок - 43 г/л. После предоперационной подготовки 12.11.2011 г. был повторно оперирован. Выполнена релапаротомия. На операции обнаружен гемоперитонеум и несостоятельность швов на тонкой кишке, продолжающийся распространенный фибринозно-гнойный перитонит. Произведена обструктивная резекция тощей кишки с формированием и оставлением культей тонкой кишки в брюшной полости без наложения анастомоза. Приводящие отделы были дренированы путем кишечной интубации. Учитывая тяжелое течение перитонита, 14.11.2011 г. выполнена 2 санационная релапаротомия, во время которой была ушита острая перфорация тонкой кишки и сформирована управляемая лапаростома. 15.11.2011 г. проведена дополнительная санационная релапаротомия. 17.11.2011 г. выполнена 4 программированная санация брюшной полости. При ревизии отмечено, что явления перитонита стали уменьшаться. Учитывая положительную динамику, больному наложен отсроченный дуоденоэнтероанастомоз «бок в бок». После установки дренажей и перед зашиванием передней брюшной стенки с целью герметизации кишечных швов на зону дуоденоэнтероанастомоза произведена аппликация двухкомпонентного состава в последовательности: криопреципитат - 4-5 мл стерильного тромбина 15 ед. NIH/мл - криопреципитат - 4-5 мл стерильного тромбина 15 ед. NIH/мл. Через 7 минут в зоне анастомоза образовался плотный фибриновый сгусток. Кишка погружена в брюшную полость. Наложены редкие швы на рану, преимущественно на кожу. Последующий период протекал тяжело. В течение 10 суток находился в отделении реанимации. Постепенно восстановился пассаж по кишечнику, стабилизировалось состояние больного. Несостоятельности отсроченного дуоденоэнтероанастомоза не отмечено. В удовлетворительном состоянии пациент был выписан 13.12.2011 г. на долечивание в ЦРБ.
4. Больной В., 58 лет, поступил в отделение гнойной хирургии КГБУЗ «Краевая клиническая больница» 8.12.2012 г. с жалобами на умеренные боли в животе, наличие колостомы на передней брюшной стенке и плохое ее функционирование, выделение кишечного содержимого из дренажной раны в левом подреберье, повышение температуры до 38°С. Из анамнеза заболевания установлено, что 02.11.2011 г. в экстренном порядке был оперирован в х/о ЦРБ по поводу ущемленной диафрагмальной грыжи слева. Выполнены ликвидация ущемления, ушивание левого купола диафрагмы, спленэктомия, наложение петлевой колостомы. На фоне дальнейшего почти месячного лечения в ЦРБ у больного в дренажную рану левого подреберья открылся кишечный свищ, стала повышаться температура до 38°С. Консультирован в краевом центре медицины катастроф, вывезен в краевую больницу. При поступлении состояние тяжелое, обусловленное вялотекущим перитонитом и абдоминальным сепсисом. Анализ крови при поступлении: Нв - 78 г/л, лейкоциты 21,7×109, п/я нейтрофилы - 25, Калий - 4,5 ммоль/л, Натрий - 134 ммоль/л, креатинин - 95 ммоль/л, общий белок - 50 г/л. После предоперационной подготовки 09.12.2011 г. выполнена релапаротомия. На операции обнаружено множество межпетельных абсцессов, явления распространенного гнойного перитонита, несостоятельность колостомы, деструкция тонкой кишки с образованием несформированного тонкокишечного свища. Произведена кишечная интубация, дренирование межпетельных абсцессов, левосторонняя гемиколэктомия с колостомой, обструктивная резекция тонкой кишки (зона несформированного тонкокишечного свища), санация и дренирование. Были сформированы культи тонкой кишки, культя ободочной кишки с оставлением их в брюшной полости. Колостома не выводилась, межкишечный анастомоз не накладывался. Учитывая явления распространенного перитонита, тяжелого абдоминального сепсиса, 12.12.2011 г. произведена санационная релапаротомия. 14.12.2011 г. при выполнении 3 санационной релапаротомии была отмечена положительная динамика в течении послеоперационного перитонита. Больному была сформирована концевая трансверзостома и наложен отсроченный энтероэнтероанастомоз "бок в бок". Перед окончанием операции и формировании лапаростомы с целью герметизации кишечных швов на зону энтероэнтероанастомоза произведена аппликация двухкомпонентного состава в последовательности: криопреципитат - 4-5 мл стерильного тромбина 15 ед. NIH/мл - криопреципитат - 4-5 мл стерильного тромбина 15 ед. NIH/мл. Через 6 минут в зоне анастомоза образовался плотный фибриновый сгусток. Кишка погружена в брюшную полость. Сформирована лапаростома путем редких швов на кожу. Однако последующий послеоперационный период осложнился образованием несформированного свища желудка. Больной оперирован повторно. 21.12.2011 г. произведена 4 релапаротомия с ушиванием несформированного свища желудка, санацией и дренированием брюшной полости. При проведении этой операции появилась возможность ревизии укрепленного межкишечного анастомоза. Было отмечено, что в зоне межкшечного анастомоза имеется плотная несмещаемая фибриновая пленка, полностью закрывающая швы и герметизирующая соустье. В последующем больному 23.12.2011 г. выполнена заключительная 5 программированная санация брюшной полости. Послеоперационный период протекал тяжело. На фоне интенсивной терапии состояние пациента стабилизировалось, восстановился пассаж по кишечнику, начала функционировать колостома. Лапаростомная рана зажила вторичным натяжением. Несостоятельности наложенного энтероэнтероанастомоза не отмечено. Больной 01.02.2012 г. в удовлетворительном состоянии выписан на долечивание в ЦРБ.
Способ герметизации межкишечного анастомоза путем добавления в зону кишечных швов местных биологических гемостатических препаратов, отличающийся тем, что перед погружением в брюшную полость и зашиванием срединной раны на серозный покров тонкой кишки по всей окружности межкишечного анастомоза делают аппликацию 30-40 г сухого лиофилизированного криопреципитата, причем для получения стабильного фибрина и фиксации его в месте анастомоза в сухой лиофилизированный криопреципитат по каплям добавляют или 2-3 мл 5% раствора хлористого кальция или 4-5 мл стерильного тромбина 15 ед. NIH/мл, растворенного в 5% растворе аминокапроновой кислоты и через 60 с после образования гелеобразной фибриновой пленки производят повторную аппликацию двухкомпонентного состава.