Способ получения резорбируемой полилактидной матрицы для культивирования и имплантации клеток, предназначенных для заживления ран
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и медицины и представляет собой способ получения резорбируемой полилактидной матрицы для культивирования и имплантации клеток, предназначенных для заживления ран, включающий получение резорбируемой гидрофильной пористой полилактидной матрицы, равномерно покрытой микрофибриллярным коллагеном 1-го типа, для чего предварительно получают гидрофильную пористую полилактидную матрицу толщиной от 13 мкм до 15 мкм и диаметром пор от 2 мкм до 3 мкм, затем проводят нанесение на гидрофильную пористую полилактидную матрицу 0,01%-ного раствора коллагена 1-го типа в 0,1%-ной уксусной кислоте, инкубируют в течение 30 минут при комнатной температуре, далее поверхность матрицы промывают фосфатно-солевым буфером рН 7,4 для удаления несвязавшегося с субстратом белка, процедуру нанесения раствора коллагена 1-го типа проводят еще 2 раза, гидрофильную поверхность пористой полилактидной матрицы, равномерно покрытую микрофибриллярными структурами коллагена диаметром от 10 нм до 20 нм, используют для культивирования кератиноцитов человека. Изобретение обеспечивает повышение эффективности структуры белкового слоя матрицы, упрощение и удешевление способа и сокращение сроков резорбции полилактидной матрицы. 3 з.п. ф-лы, 3 пр., 6 ил.
Реферат
Изобретение относится к области медицины, в частности к регенеративной медицине, которая включает принципы и методы клеточной биологии и клеточной инженерии, то есть культивирование и имплантацию клеток кожи человека, предназначенных для заживления ран, на полимерных матрицах.
Восстановление структурной и функциональной целостности кожных покровов методами клеточной терапии в настоящее время находит широкое применение (Ruszczak, 2000; Boyce, Warden, 2002). Культивируемые клетки кожи - базальные кератиноциты и дермальные фибробласты - являются основой для создания клеточных продуктов, используемых в клинике (Nishiyama et al., 1998). Для отделения от подложки и переноса на рану сформированного многослойного пласта кератиноцитов его предварительно обрабатывают протеолитическими ферментами. В процессе такой обработки частично повреждаются поверхностные рецепторы клеток, и только часть клеток после имплантации на рану остается жизнеспособной и выполняет свою функцию.
В настоящее время эта проблема может быть решена путем культивирования кератиноцитов на матрице, приготовленной из биодеградируемого полимера. Клеточный пласт, сформированный на такой полимерной матрице, переносят вместе с ней на пораженный участок кожи без какой-либо предварительной обработки. Под влиянием раневого микроокружения полимер начинает постепенно деградировать, а клетки сохраняют способность выполнять свои функции по восстановлению поврежденных тканей.
Помимо таких свойств, как биодеградируемость и биосовместимость, которыми должен обладать полимер, предназначенный для формирования полимерной матрицы, к нему предъявляются и специфические требования. Матрица на основе этого полимера должна быть достаточно механически прочной для переноса на рану и подвергаться резорбции в организме после имплантации на рану в течение 1-2 недель.
В настоящее время широкое применение при формировании матриц, предназначенных для культивирования клеток кожи, находят полимеры, относящиеся к группе гидроксиалканоатов, а именно полилактид, поликапролактон, полигликолид, а также сополимеры на их основе.
Один из наиболее широко используемых полимеров этого класса для культивирования клеток кожи является поли (D,L-лактид), приготовленный на основе молочной кислоты, которая является продуктом метаболизма млекопитающих. Несмотря на все достоинства полилактида, его недостатком является гидрофобность поверхности приготовленной на его основе матрицы, что затрудняет взаимодействие и рост на ней культивируемых клеток. Поэтому для улучшения свойств поверхности такой матрицы, к которым особенно чувствительны культивируемые кератиноциты, необходима предварительная модификация полимера. Один из возможных вариантов увеличения гидрофильности - синтез сополимера с введением дополнительного гидрофильного вещества.
Известен способ формирования полимерной матрицы на основе полилактида и его сополимеров (Garric et al., 2007). На основе полилактида и полиэтиленгликоля получают триблоксополимеры, которые обладают большей гидрофильностью по сравнению с полилактидом. На основе данного блоксополимера получают матрицы толщиной около 150 мкм. Для оценки степени гидрофобности поверхности измеряют значения контактного угла смачивания при нанесении воды, величина которого ниже по сравнению с поверхностью необработанной полилактидной матрицы, что обусловлено присутствием фрагментов полиэтиленгликоля в макромолекулярной цепи. На полученные матрицы высевают кератиноциты и после 2 дней культивирования клетки фиксируют, и морфологию сформированного пласта кератиноцитов оценивают с помощью сканирующей электронной микроскопии. Недостатком такого способа приготовления матрицы является ее непрозрачность и, следовательно, отсутствие возможности прижизненного наблюдения за поведением на ней культивируемых клеток. Также было показано, что присутствие только полиэтиленгликоля в сополимере увеличивает адгезию и пролиферацию фибробластов, но не оказывает никакого влияния на адгезию и пролиферацию кератиноцитов.
Одним из других способов модификации поверхности полимера может быть нанесение на нее белков внеклеточного матрикса, которые кроме повышения гидрофильности поверхности имеют сайты для специфического взаимодействия с поверхностными рецепторами клеток. Наиболее часто используемым для этой цели покрытием является коллаген - основной структурный элемент дермы кожи, на которой in vivo располагаются базальные кератиноциты.
Известен способ формирования полимерной матрицы, где в качестве полимера используют поликапролактон (Dai et al., 2004). Растворы поликапролактона в хлористом метилене с концентрацией от 0.5% до 2.5% смешивают с раствором коллагена с концентрацией 0.25% в 1.0%-ном растворе уксусной кислоты наносят на подложку с последующей промывкой поверхности фосфатно-солевым буфером рН 7.4. На полученные полимерные матрицы высевают суспензию кератиноцитов. Морфологию кератиноцитов на данных матрицах после 1 и 3 дней культивирования оценивают с помощью метода сканирующей электронной микроскопии.
Одним из недостатков таких полимерных матриц является их непрозрачность, что не позволяет оценить морфологические особенности сформированного пласта кератиноцитов прижизненно, а требует предварительной фиксации клеток. Кроме того, скорость резорбции поликапролактона очень низкая, и он остается в организме в течение длительного времени после регенерации ткани (Pitt, 1990). Вместе с тем известно, что скорость формирования пласта кератиноцитов зависит от возраста донора и состояния его здоровья, поэтому отсутствие возможности прижизненного наблюдения за размножением клеток и соответственно установления точных сроков формирования пласта на матрице в каждом конкретном случае ограничивает применение непрозрачных матриц.
В известном способе для получения матриц используют поли (D,L-лактид) (Garric et al., 2005). Полилактидные матрицы толщиной 50 мкм покрывают коллагеном I-го типа. На модифицированные молекулярным коллагеном полилактидные матрицы высевают суспензию кератиноцитов и после 5 сут культивирования клетки фиксируют и окрашивают с помощью раствора йодистого пропидия. Полученные препараты анализируют с помощью флуоресцентной микроскопии.
К недостаткам данного способа получения полилактидной матрицы толщиной 50 мкм относятся ее непрозрачность и, следовательно, отсутствие возможности прижизненного наблюдения за состоянием клеток в процессе их роста при культивировании и формировании многослойного пласта кератиноцитов.
Известен способ получения полилактидных матриц, который является наиболее близким по технической сущности к предлагаемому изобретению и поэтому выбран в качестве прототипа и заключается в следующем (Швед и др., 2007). Полилактид с молекулярной массой 57 кДа растворяют в хлористом метилене до конечной концентрации раствора 50 мг/мл. На покровное стекло размером 18×18 мм2 наносят 85 мкл раствора полимера. Затем покровные стекла, покрытые полилактидом, высушивают на воздухе при комнатной температуре в течение 1 сут. Получают гидрофобную полилактидную матрицу, которая представляет собой сплошной слой полилактида на поверхности покровного стекла.
Затем гидрофобную поверхность полилактидной матрицы, представляющей сплошной слой полилактида, модифицируют нанесением на нее раствора коллагена I-го типа в 0.1%-ной уксусной кислоте до конечной концентрации 0.2% (2 мг/мл). В раствор коллагена добавляют NaH2PO4 (1 M) до конечной концентрации 20 мМ, рН 7.4. Сразу после растворения коллаген наносят на поверхность гидрофобной полилактидной матрицы и помещают в атмосферу аммиака на 15 мин для его структурирования. После инкубации поверхность матрицы дважды промывают фосфатно-солевым буфером рН 7.4 для удаления несвязавшегося с поверхностью белка и стерилизуют УФ-облучением в течение 2 ч. При таком способе нанесения коллагена, за счет повышения рН раствора, отдельные трехспиральные молекулы белка структурируются в коллагеновые фибриллы. При этом модификация такой матрицы коллагеном увеличивает ее гидрофильность.
Гидрофильную полилактидную матрицу, представляющую сплошной слой полилактида, помещают в культуральный сосуд и на нее наносят суспензию кератиноцитов кожи человека из расчета 360-370 тыс. кл на 1 см2 поверхности. Кератиноциты кожи человека культивируют на модифицированной фибриллярным коллагеном полилактидной матрице в смеси сред DMEM и F12(3:1) с добавлением 10% эмбриональной сыворотки коров в течение 9 сут. Прижизненную оценку прикрепления, распластывания и роста кератиноцитов на разных сроках культивирования клеток проводят с помощью инвертированного микроскопа.
Недостатком известного способа являются неэффективность резорбируемой гидрофильной полилактидной матрицы, представляющей сплошной слой полилактида и неравномерность покрытия поверхности матрицы коллагеном, что не позволяет использовать такую матрицу для культивирования и имплантации кератиноцитов человека, предназначенных для заживления ран.
Указанные недостатки обусловлены тем, что использование полилактидной матрицы, представляющей сплошной слой полилактида, не обеспечивает необходимого и достаточного поступления питательных веществ к имплантированным на рану кератиноцитам кожи человека. Наряду с этим, модификация такой матрицы фибриллярными структурами коллагена 1-го типа для повышения ее гидрофильности не обеспечивает равномерного покрытия белком ее поверхности, что обусловлено образованием крупных, связанных между собой белковых структур, состоящих из сети взаимодействующих коллагеновых фибрилл.
Предлагаемое изобретение лишено указанных недостатков благодаря осуществлению получения гидрофильных пористых полилактидных матриц и модификации таких матриц микрофибриллярными структурами коллагена 1-го типа диаметром от 10 нм до 20 нм, что обеспечивает равномерное покрытие белком поверхности матрицы и повышает ее гидрофильность.
Техническим результатом предлагаемого изобретения является повышение эффективности и надежности структуры пористой гидрофильной полилактидной матрицы, равномерности покрытия коллагеном ее поверхности и упрощение способа модификации поверхности такой матрицы для использования ее в дальнейшем в качестве основы для культивирования и имплантации кератиноцитов, предназначенных для заживления ран, за счет получения матрицы с высокой плотностью пор и модификации такой матрицы микрофибриллярными структурами коллагена 1-го типа и имеет ряд преимуществ, которые обусловлены в основном тем, что:
- пористая структура матрицы обеспечивает доступ питательных веществ к клеткам, имплантированным на рану;
- эффективное прикрепление, распластывание и рост клеток, а также сокращение сроков образования многослойного пласта кератиноцитов на гидрофильной поверхности пористой полилактидной матрицы, равномерно покрытой микрофибриллярными структурами коллагена диаметром от 10 нм до 20 нм, по сравнению с гидрофильной поверхностью полилактидной матрицы, представляющей сплошной слой полилактида, покрытой фибриллярными структурами коллагена, может иметь промышленный масштаб за счет упрощения способа нанесения коллагена I-го типа;
- сокращение сроков резорбции полилактидной матрицы после имплантации на рану за счет ее пористости.
Технический результат достигается тем, что в известном способе получения резорбируемой гидрофильной полилактидной матрицы для культивирования и имплантации клеток, предназначенных для заживления ран, который включает известные и общие с заявленным новым способом признаки, используют растворение полилактида в органическом растворителе, нанесение раствора полилактида на покровное стекло, высушивание на воздухе, покрытие гидрофобной поверхности полилактидной матрицы коллагеном I-го типа, структурирование коллагена, прижизненную оценку прикрепления, распластывания и роста клеток при культивировании на прозрачной гидрофильной полилактидной поверхности матрицы, представляющей сплошной слой полилактида, в предлагаемом способе получают гидрофильную пористую полилактидную матрицу, покрытую микрофибриллярным коллагеном I-го типа, причем предварительно получают гидрофобную пористую полилактидную матрицу нанесением на поверхность покровного стекла раствора, содержащего 3.5% полилактида и 1.5% полиэтиленгликоля в хлористом метилене в количестве от 85 мкл до 100 мкл, причем равномерное распределение раствора на поверхности осуществляют вращением стекла, после испарения растворителя образовавшуюся двухфазную матрицу высушивают при комнатной температуре в течение 2 сут, затем прикрепленную к стеклу прозрачную гидрофобную матрицу толщиной от 13 мкм до 15 мкм помещают в дистиллированную воду объемом не более 50 мл и выдерживают при комнатной температуре в течение 1 сут, после растворения в воде полиэтиленгликоля в составе матрицы на его месте образуются поры диаметром от 2 мкм до 3 мкм, затем на гидрофобную поверхность пористой полилактидной матрицы наносят 0.01%-ный раствор коллагена I-го типа в 0.1%-ной уксусной кислоте в количестве от 90 мкл до 100 мкл и инкубируют в течение 30 мин при комнатной температуре, затем поверхность матрицы дважды промывают фосфатно-солевым буфером рН 7.4 для удаления несвязавшегося белка, процедуру нанесения раствора коллагена проводят еще 2 раза, после чего на гидрофильную поверхность пористой полилактидной матрицы, равномерно покрытой микрофибриллярными структурами коллагена диаметром от 10 нм до 20 нм, наносят кератиноциты кожи человека и после образования многослойного пласта клеток в результате культивирования в течение 9 сут матрицу открепляют от стекла для последующей имплантации на кожные раны разной этиологии для их заживления. При этом в процессе создания матрицы диаметр пор на гидрофобной поверхности полилактидной матрицы оценивают с помощью сканирующей электронной микроскопии, а диаметр микрофибрилл коллагена на гидрофильной поверхности пористой полилактидной матрицы оценивают с помощью атомно-силовой микроскопии. Кроме того, оценивают скорость резорбции гидрофильных пористых полилактидных матриц, модифицированных микрофибриллярным коллагеном I-го типа после их имплантации на раны экспериментальных животных.
Заявленный способ был апробирован в лабораторных условиях на базе Учреждения Российской академии наук Института цитологии РАН Санкт-Петербурга. Результаты проведенных исследований поясняются следующими примерами.
Наиболее предпочтительный вариант осуществления предлагаемого изобретения описан в примере 1. В пределах сущности и объема изобретения возможны другие варианты способа приготовления матрицы, охватываемые приводимой формулой изобретения.
Пример 1.
В частном конкретном случае осуществления предлагаемого изобретения получают резорбируемую гидрофильную пористую полилактидную матрицу для культивирования и имплантации кератиноцитов кожи человека, предназначенных для заживления ран. Предварительно получают гидрофобную полилактидную матрицу. Для этого на поверхность покровного стекла размером 18×18 мм2 наносят раствор, содержащий 3.5% полилактида и 1.5% полиэтиленгликоля в хлористом метилене в количестве 100 мкл, причем равномерное распределение раствора полимеров на поверхности осуществляют вращением стекла. В работе используют полиэтиленгликоль с молекулярной массой 6 кДа (Sigma, США). Получение полилактида с молекулярной массой 57 кДа осуществляют известным способом (Schwach et al., 1999).
После испарения растворителя образовавшуюся на стекле двухфазную матрицу высушивают при комнатной температуре в течение 2 сут. Затем рассчитывают количество полимерного материала на 1.0 мм2 поверхности покровного стекла. При нанесении 100 мкл раствора полимеров с концентрацией 50 мг/мл на поверхность покровного стекла площадью 324 мм2 количество нанесенного полимерного материала на 1.0 мм2 составляет 15 мкг. Толщину такой полимерной матрицы рассчитывают на основании данных по определению количества полимерного материала на 1.0 мм2 поверхности подложки для полимерных матриц, толщину которых можно измерить с помощью микрометра (МК-50-1, Китай). Для этого используют полимерные матрицы толщиной от 50 мкм до 150 мкм. Например, получают полилактидную матрицу нанесением раствора, содержащего 450 мг полилактида и 50 мг полиэтиленгликоля, на фторопластовую подложку площадью 10000 мм2. При этом количество полимерного материала на 1.0 мм2 поверхности составляет 50 мкг, эта величина соответствует толщине матрицы 50 мкм. Следовательно, при нанесении полимерного материала на поверхность стекла в количестве 15 мкг на 1.0 мм2 толщина матрицы будет составлять 15 мкм.
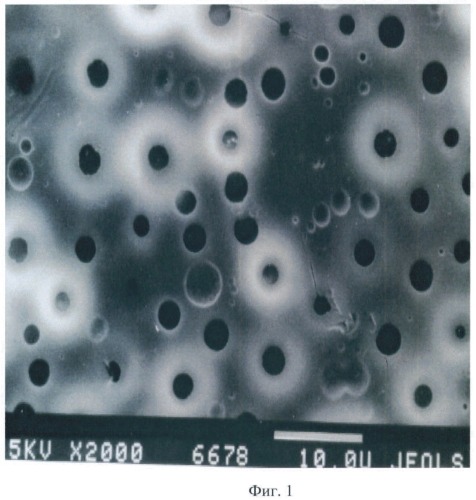
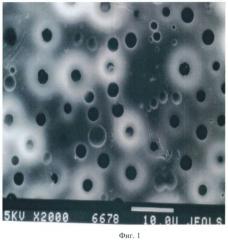
Затем прикрепленную к стеклу полилактидную матрицу помещают в дистиллированную воду объемом не более 50 мл и выдерживают при комнатной температуре в течение 1 сут. После растворения полиэтиленгликоля и удаления из матрицы на его месте образуются поры. Диаметр пор оценивают с помощью сканирующего электронного микроскопа (Jeol JSM-35C, Япония). Результаты сканирующей электронной микроскопии гидрофобной поверхности пористой полилактидной матрицы представлены на фиг.1 (увел. 2000х). На фиг.1 поры выявляются в виде темных зон, диаметром от 2 мкм до 3 мкм.
Поверхность пористой матрицы, которую получают на основе полилактида, гидрофобная, что затрудняет адгезию и рост на ней культивируемых кератиноцитов кожи человека. Поэтому для улучшения свойств поверхности такой матрицы проводят модификацию полилактидной матрицы. Для этого на гидрофобную поверхность пористой полилактидной матрицы наносят коллаген I-го типа, который повышает гидрофильность поверхности матрицы, а также имеет сайты для специфического взаимодействия с поверхностными рецепторами клеток. Коллаген I-го типа получают известным способом (Chandrakasan et al., 1967). Процедуру нанесения белка осуществляют следующим образом. Коллаген I-го типа растворяют в 0.1%-ной уксусной кислоте до конечной концентрации раствора 0.01%. Затем 100 мкл раствора белка наносят на гидрофобную поверхность пористой полилактидной матрицы и инкубируют при комнатной температуре в течение 30 мин. После чего поверхность матрицы дважды промывают фосфатно-солевым буфером рН 7.4 для удаления несвязавшегося белка. Процедуру нанесения раствора коллагена I-го типа проводят еще 2 раза. Коллаген I-го типа прочно связывается с гидрофобной поверхностью пористой полилактидной матрицы. Взаимодействие белка с такой поверхностью носит гидрофобный характер за счет высокого содержания в молекуле коллагена неполярных или гидрофобных аминокислотных остатков.
Структуру коллагенового покрытия на поверхности пористой полилактидной матрицы оценивают с помощью атомно-силового микроскопа (Dimension 3100, VEECO, Япония). Структурные формы и размер фибриллярных структур коллагена I-го типа, определенные с помощью атомно-силовой микроскопии, представлены на фиг.2. На фиг.2 видно равномерное покрытие поверхности такой матрицы связанными между собой микрофибриллами коллагена I-го типа диаметром от 10 нм до 20 нм. Таким образом, при трехкратном, последовательном нанесении коллагена I-го типа, растворенного в 0.1%-ной уксусной кислоте, отдельные трехспиральные молекулы коллагена образуют коллагеновые микрофибриллы за счет гидрофобного взаимодействия между молекулами белка при инкубировании на поверхности гидрофобной пористой полилактидной матрицы. Такие микрофибриллы равномерно покрывают поверхность пористой полилактидной матрицы и повышают ее гидрофильность.
Для сравнения проводят выяснение влияния способа нанесения коллагена на его структурирование и размер фибриллярных структур на поверхности полилактидной матрицы. Для этого на гидрофобную поверхность полилактидной матрицы, представляющей сплошной слой полилактида, наносят коллаген I-го типа способом, который описан в прототипе. В основе этого способа модификации гидрофобной поверхности полилактидной матрицы коллагеном лежит способность коллагена, предварительно растворенного в 0.1%-ной уксусной кислоте, изменять структурное состояние при смещении рН раствора белка в щелочную область до его изоэлектрической точки. При щелочном значении рН раствора молекулы коллагена диаметром 1.5 нм и длиной около 300 нм формируют коллагеновые фибриллы. Структурные формы и размер фибриллярных структур коллагена I-го типа, определенные с помощью атомно-силовой микроскопии, представлены на фиг.3. На фиг.3 видны крупные, связанные между собой белковые структуры, состоящие из сети взаимодействующих между собой коллагеновых фибрилл диаметром от 100 нм до 150 нм. Однако формирование таких белковых структур не обеспечивает равномерного покрытия гидрофобной поверхности полилактидной матрицы, представляющей сплошной слой полилактида, коллагеном I-го типа.
Поэтому с целью получения гидрофильной и равномерно покрытой коллагеном I-го типа поверхности пористой полилактидной матрицы используют способ нанесения белка на гидрофобную поверхность пористой полилактидной матрицы, при котором на такой матрице формируются микрофибриллярные структуры коллагена I-го типа диаметром от 10 нм до 20 нм, и этот способ описан в предлагаемом изобретении.
Гидрофильную пористую полилактидную матрицу, покрытую микрофибриллярным коллагеном I-го типа, прикрепленную к стеклу, используют для культивирования и имплантации кератиноцитов, предназначенных для заживления ран. Предварительно такую матрицу стерилизуют в течение 2 ч, облучая УФ-светом, и переносят в культуральный сосуд для культивирования на ней кератиноцитов. Кератиноциты получают из кожи здоровых доноров известным способом (Rheinwald, 1980). Культивирование кератиноцитов кожи человека на такой матрице осуществляют следующим образом. Суспензию полученных кератиноцитов в количестве 370 тыс. на 1 см2 наносят на гидрофильную поверхность пористой полилактидной матрицы и культивируют в течение 9 сут в смеси сред DMEM и F12 (3:1) с добавлением 10% FBS, 5 мкг/мл инсулина, 5 мкг/мл гидрокортизона, 10 нг/мл эпидермального фактора роста, холерного токсина 10-10 М (Sigma, США), 5 мг/мл трансферрина, 1.8×10-4 М аденина (ISN-Flow, США), 2×10-11 М лиотиронина (Koch-Light, США). Питательную среду меняют через каждые 2-3 сут.
Затем проводят оценку прикрепления, распластывания и роста кератиноцитов на гидрофильной поверхности прозрачной пористой полилактидной матрицы, покрытой микрофибриллярным коллагеном I-го типа. Прозрачность такой матрицы сохраняется в течение всего времени культивирования клеток, что позволяет проводить прижизненное наблюдение за клеточными культурами и постоянно оценивать их состояние с помощью инвертированного микроскопа (Nikon esclipse TS 100, Япония). Прижизненные наблюдения за созреванием многослойного пласта кератиноцитов кожи человека проводят на 2 сут, 4 сут и 9 сут культивирования клеток.
Эксперименты показывают, что через 2 сут после посева кератиноциты полностью прикрепляются и распластываются на гидрофильной поверхности пористой полилактидной матрицы.
Через 4 сут после посева клеток на гидрофильной поверхности пористой полилактидной матрицы образуются колонии кератиноцитов с большой площадью связанных между собой филлоподиальными структурами.
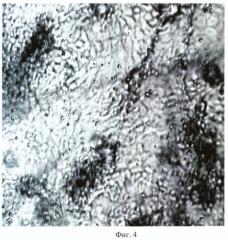
Распределение кератиноцитов на гидрофильной поверхности пористой полилактидной матрицы через 9 сут культивирования представлено на фиг.4 (увел. 60х). На фиг.4 видно, что после 9 сут культивирования кератиноциты равномерно распределяются на гидрофильной поверхности пористой полилактидной матрицы и образуют многослойный пласт клеток, который покрывает всю поверхность такой матрицы.
Полученный многослойный пласт кератиноцитов на гидрофильной поверхности пористой полилактидной матрицы после ее открепления от поверхности покровного стекла пригоден для последующей имплантации на кожные раны разной этиологии для их заживления.
Ниже приводятся подписи к фиг.1-4, которые представлены в примере 1.
Фиг.1. Сканирующая электронная микроскопия гидрофобной поверхности пористой полилактидной матрицы с диаметром пор от 2 мкм до 3 мкм (увел. 2000х).
Фиг.2. Атомно-силовая микроскопия гидрофильной поверхности пористой полилактидной матрицы, покрытой микрофибриллярными структурами коллагена I-го типа.
Фиг.3. Атомно-силовая микроскопия гидрофильной поверхности полилактидной матрицы, представляющей сплошной слой полилактида, покрытой фибриллярными структурами коллагена I-го типа.
Фиг.4. Распределение кератиноцитов на гидрофильной поверхности пористой полилактидной матрицы, покрытой микрофибриллярными структурами коллагена I-го типа, через 9 сут культивирования (увел. 60х).
Пример 2.
В этом варианте осуществления предлагаемого изобретения предварительно получают гидрофобную пористую полилактидную матрицу с диаметром пор не более 2 мкм. Известно, что размер пор зависит как от молекулярной массы полиэтиленгликоля, так и от его процентного содержания в растворе полилактида. Для получения такой гидрофобной пористой полилактидной матрицы с диаметром пор не более 2 мкм процентное содержание полиэтиленгликоля в растворе полилактида снижают в 3 раза. Получение такой матрицы осуществляют следующим образом. На поверхность покровного стекла размером 18×18 мм2 наносят раствор, содержащий 4.5% полилактида и 0.5% полиэтиленгликоля в хлористом метилене в количестве 100 мкл, причем равномерное распределение раствора полимеров на поверхности осуществляют вращением стекла.
После испарения растворителя образовавшуюся на стекле двухфазную матрицу высушивают при комнатной температуре в течение 2 сут.
Прикрепленную к стеклу полилактидную матрицу помещают в дистиллированную воду объемом не более 50 мл и выдерживают при комнатной температуре в течение 1 сут. После растворения полиэтиленгликоля в составе матрицы на его месте образуются поры. Диаметр пор оценивают с помощью сканирующей электронной микроскопии. Результаты сканирующей электронной микроскопии гидрофобной поверхности пористой полилактидной матрицы представлены на фиг.5 (увел. 2000х). На фиг.5 поры выявляются в виде темных зон, диаметром не более 2 мкм.
Модификацию гидрофобной поверхности такой пористой полилактидной матрицы, прикрепленной к поверхности покровного стекла, проводят коллагеном I-го типа, как описано в примере 1.
Культивирование кератиноцитов кожи человека на гидрофильной поверхности такой пористой полилактидной матрицы с диаметром пор не более 2 мкм проводят, как описано в примере 1.
Прижизненную оценку прикрепления, распластывания и роста кератиноцитов на гидрофильной поверхности пористой полилактидной матрицы, покрытой микрофибриллярным коллагеном I-го типа, проводят в процессе всего срока культивирования с помощью инвертированного микроскопа.
Эксперименты показывают, что через 2 сут после посева кератиноциты полностью прикрепляются и распластываются на гидрофильной поверхности пористой полилактидной матрицы.
Через 4 сут после посева клеток на гидрофильной поверхности пористой полилактидной матрицы образуются колонии кератиноцитов с большой площадью связанных между собой филлоподиальными структурами.
Распределение кератиноцитов на гидрофильной поверхности пористой полилактидной матрицы через 9 сут культивирования представлено на фиг.6 (увел. 60 х). На фиг.6 видно, что после 9 сут культивирования кератиноциты равномерно распределены на гидрофильной поверхности полилактидной матрицы, причем образовавшийся многослойный пласт клеток покрывает всю поверхность полилактидной матрицы и, кроме того, наблюдаются немногочисленные колонии кератиноцитов.
Полученный многослойный пласт кератиноцитов на гидрофильной поверхности пористой полилактидной матрицы после ее открепления от поверхности покровного стекла пригоден для последующей имплантации на кожные раны разной этиологии для их заживления.
Ниже приводятся подписи к фиг.5-6, которые представлены в примере 2.
Фиг.5. Сканирующая электронная микроскопия гидрофобной поверхности пористой полилактидной матрицы с диаметром пор не более 2 мкм (увел. 2000х).
Фиг.6. Распределение кератиноцитов на гидрофильной поверхности пористой полилактидной матрицы, покрытой микрофибриллярными структурами коллагена I-го типа, через 9 сут культивирования (увел. 60х).
Пример 3.
В этом проводят оценку резорбции гидрофильных пористых полилактидных матриц, модифицировнных микрофибриллярными структурами коллагена, после имплантации их на раны экспериментальных животных. Приготовление и модификацию микрофибриллярными структурами коллагена I-го типа гидрофобной пористой полилактидной матрицы проводят, как описано в примере 1. Гидрофильную пористую полилактидную матрицу открепляют от поверхности покровного стекла и имплантируют на рану экспериментальных животных. Для оценки резорбции гидрофильных пористых полилактидных матриц проводят гистологический анализ биоптатов ткани. Гистологический анализ биоптатов ткани показывает, что через 1 неделю после имплантации гидрофильная пористая полилактидная матрица, модифицированная микрофибриллярным коллагеном, полностью резорбирует.
Данное изобретение может быть использовано для получения резорбируемой гидрофильной пористой полилактидной матрицы для культивирования и имплантации клеток, предназначенных для заживления ран, а также в качестве модели in vitro для тестирования лекарственных препаратов и биологически активных веществ.
Источники информации
Швед Ю.А., Кухарева Л.В., Зорин И.М., Блинова М.И., Билибин А.Ю., Пинаев Г.П. 2007. Взаимодействие культивируемых клеток кожи с разными структурными формами коллагена, нанесенного на полилактидную матрицу. Цитология. 49 (1): 32-38.
Boyce S.T., Warden G.D. 2002. Principles and practices for treatment of cutaneous wounds with cultured skin substitutes. Amer. J. Surgery. 183: 445-456.
Chandrakasan G., Torchia D.A., Piez K.A. 1967. Preparation of intact monomeric collagen from rat tail tendon and skin and the structure of the nonhelical ends in solution. J. Biol. Chem. 251: 6062-6067.
Dai N.-T., Williamson M.R., Khammo N., Adams E.F., Coombes A.G.A. 2004. Composite cell support membranes based on collagen and polycaprolactone for tissue engineering of skin. Biomaterials. 25: 4263-4271.
Garric X., Mole's J.P., Garreau H., Guilhou J-J., Vert M. 2005. Human skin cell cultures onto PLA50 (PDLLA) bioresorbable polymers: Influence of chemical and morphological surface modifications. J. Biomed. Mat. Res., Part A. 72A: 180-189.
Garric X., Garreau H., Vert M. 2007. Behaviors of keratinocytes and fibroblasts on films of PLA50-PEO-PLA50 triblock copolymers with various PLA segment. J. Mater Science: Mater, in Medicine. 19: 1645-1651.
Nishiyama Т., Tsunenaga M., Akutsu N., Amano S., Nakayama Y. 1998. Role of dermal - epidermal communication on regulation of skin structure and function. In: Skin: interface of a living system. London: Excerpta Medica. 55-72.
Pitt C.G. 1990. Poly(o-caprolactone) and its copolymers. In: Biodegradable Polymers as Drug Delivery Systems. New York: Marcel Dekker. 71-120.
Rheinwald J.G. 1980. Serial cultivation of normal epidermal keratinocytes. Meth.CellBiol.21A:229-254.
Ruszczak Z.B. 2000. Modern aspects of wound healing: an update. Dermatol. Surg. 26: 219-229.
1. Способ получения резорбируемой полилактидной матрицы для культивирования и имплантации клеток, предназначенных для заживления ран, включающий растворение полилактида в органическом растворителе, нанесение раствора полилактида на покровное стекло, высушивание на воздухе, покрытие гидрофобной поверхности полилактидной матрицы коллагеном 1-го типа, структурирование коллагена, прижизненную оценку прикрепления, распластывания и роста клеток при культивировании на прозрачной гидрофильной поверхности полилактидной матрицы, представляющей сплошной слой полилактида, отличающийся тем, что получают гидрофильную пористую полилактидную матрицу, покрытую микрофибриллярным коллагеном 1-го типа, причем предварительно получают гидрофобную пористую полилактидную матрицу, нанесением на поверхность покровного стекла, содержащего 3,5% полилактида и 1,5% полиэтиленгликоля в хлористом метилене в количестве от 85 мкл до 100 мкл, причем равномерное распределение раствора на поверхности осуществляют вращением стекла, после испарения растворителя, образовавшуюся двухфазную матрицу высушивают при комнатной температуре в течение 2 суток, затем прикрепленную к стеклу прозрачную гидрофобную матрицу толщиной от 13 мкм до 15 мкм помещают в дистиллированную воду объемом не более 50 мл и выдерживают при комнатной температуре в течение 1 суток, после растворения в воде полиэтиленгликоля в составе матрицы на его месте образуются поры диаметром от 2 мкм до 3 мкм, затем на гидрофобную поверхность пористой полилактидной матрицы наносят 0,01%-ный раствор коллагена 1-го типа в 0,1%-ной уксусной кислоте в количестве от 90 мкл до 100 мкл и инкубируют в течение 30 мин при комнатной температуре, затем поверхность матрицы дважды промывают фосфатно-солевым буфером рН 7,4 для удаления несвязавшегося белка, процедуру нанесения раствора коллагена проводят еще 2 раза, после чего на гидрофильную поверхность пористой полилактидной матрицы, равномерно покрытой микрофибриллярными структурами коллагена диаметром от 10 нм до 20 нм, наносят кератиноциты кожи человека и после образования многослойного пласта клеток в результате культивирования в течение 9 суток матрицу открепляют от стекла для последующей имплантации на кожные раны разной этиологии для их заживления.
2. Способ по п.1, отличающийся тем, что диаметр пор на гидрофобной поверхности полилактидной матрицы оценивают с помощью сканирующей электронной микроскопии.
3. Способ по п.1, отличающийся тем, что диаметр микрофибрилл коллагена на гидрофильной поверхности пористой полилактидной матрицы оценивают с помощью атомно-силовой микроскопии.
4. Способ по п.1, отличающийся тем, что оценивают скорость резорбции гидрофильных пористых полилактидных матриц, модифицированных микрофибриллярным коллагеном 1-го типа, после их имплантации на раны экспериментальных животных.