Фармацевтическая композиция, обладающая противовоспалительным, иммунотропным, противоаллергическим и ранозаживляющим действием
Иллюстрации
Показать всеИзобретение относится к области химико-фармацевтической промышленности, медицины и ветеринарии, а именно к новым лекарственным средствам для лечения воспалительных заболеваний различного генеза. Предложена фармацевтическая композиция, обладающая противовоспалительным, иммунотропным, противоаллергическим и ранозаживляющим действием, которая представляет собой раствор для парентерального применения и содержит пептиды, ассоциированные с фосфолипидами, полученные из печени тресковых, солюбилизатор, натрия хлорид, консервант и воду для инъекций. Композиция может дополнительно содержать спирт этиловый в количестве 1,0-15,0 мас.%, антиоксидант в количестве 0,01-0,5 мас.% и буфер в количестве 0,1-5,0 мас.%. Фармацевтическая композиция не обладает побочными эффектами, присущими ранее известным лекарственным средствам, которые были использованы по тому же назначению. Использование позволяет исключить применение стероидных и нестероидных противовоспалительных средств или значительно снизить их дозы. 7 з.п. ф-лы, 15 пр., 7 табл., 1 ил.
Реферат
Изобретение относится к области химико-фармацевтической промышленности, медицины и ветеринарии, а именно: к созданию новых лекарственных средств для лечения воспалительных заболеваний различного генеза.
Известны средства для лечения кожи, слизистых оболочек, полости рта, респираторного тракта и пр., в состав которых входят противовоспалительные вещества. В частности, известны противовоспалительные композиции для наружного применения, в состав которых входят глюкокортикоиды и другие активные компоненты, действие которых направлено на подавление различных стадий реакции воспаления.
Противовоспалительное действие стероидных препаратов основано на том, что они способны ингибировать ядерный фактор kB, необходимый для запуска транскрипции генов, кодирующих многие противовоспалительные белки и ферменты. Однако помимо положительного действия данные препараты имеют длинный список побочных эффектов, среди которых: нервные и психические нарушения, эпилептиформные судороги, эйфория, задержка натрия и воды в организме, дисфункция коры надпочечников (Машковский М.Д., 2000).
Побочные действия противовоспалительных препаратов нестероидной природы (НПВП) не столь серьезны, как при применении глюкокортикоидов, но противовоспалительное действие, оказываемое ими, слабее. Действие НПВП связано с ингибированием циклооксигеназ и, соответственно, снижением продукции простагландинов и тромбоксанов.
Развивающиеся патологические процессы характеризуются снижением локального и общего иммунного статуса организма, активацией свободнорадикальных механизмов и перекисного окисления липидов; развитием интоксикационных процессов и диктуют необходимость комплексного терапевтического подхода.
Поэтому разработка безопасных, обладающих высокой терапевтической эффективностью средств, продолжает оставаться актуальной задачей.
Известны циклические пептиды, получаемые синтетическим путем, обладающие антиаллергическим, противовоспалительным действием (Pat. US 2010/0144607 А1, опубл. 10.06.2010).
Недостатком данного патента является многостадийность и дороговизна синтеза, характерная для получения синтетических пептидов.
Для лечения воспалительных заболеваний различной этиологии находят широкое применение композиции на основе природного сырья. Так, известна мазь с фитокомплексом, обладающая противовоспалительным и ранозаживляющим действием (Pat. RU 2317098 (С1), опубл. 20.02.2008), композиция, обладающая ранозаживляющим и противовоспалительным действием на основе гиалуроновой кислоты и фактора некроза опухоли-альфа (Pat. RU 2153352 (С1), опубл. 27.07.2000).
Для повышения стабильности и биодоступности действующего биологически активного вещества в состав средств дополнительно вводят различные вспомогательные вещества, в том числе фосфолипиды. Функциональное значение фосфолипидов основано на их бифильности, что позволяет регулировать проницаемость клеточных мембран и способствовать лучшему проникновению действующих веществ в клетку. Для этого получают, например, липосомы, наполненные различными биологически активными веществами, или иные комплексы. Введение биологически активных субстанций в состав подобных комплексов позволяет повысить не только биодоступность лекарственных субстанций, но сделать их более стабильными.
Известен способ получения пептид/липидного комплекса методом солиофилизации раствора пептидов и раствора липидов (Pat. US 6287590 B1, опубл. 11.09.2001). Однако недостатком данного способа является предварительное раздельное растворение минимум двух субстанций для получения комплекса, который может быть использован для создания лекарственных средств.
Известна композиция для лечения псориаза и хронического простатита, содержащая фосфолипиды, а также ряд биологически активных веществ - жирные кислоты, стерины, пептиды, аминокислоты, витамины, микроэлементы, извлеченные из текстикул крупного рогатого скота последовательным фракционированием диоксидом углерода и этиловым спиртом (Pat. RU 2275205 С2, опубл. 27.04.2006, заявка от 18.08.2003). Присутствие фосфолипидов в данной композиции определяет основную направленность действия лекарственного средства, как регулятора внутриклеточных процессов на мембранном уровне.
Задачей данного изобретения является расширение арсенала лекарственных средств в форме раствора для парентерального применения, обладающего противовоспалительным, иммунотропным, противоаллергическим и ранозаживляющим действием.
Технический результат изобретения заключается в выраженном терапевтическом эффекте при лечении воспалительных и других заболеваний различной этиологии без проявления побочных эффектов.
Поставленная задача решается путем создания фармацевтической композиции, обладающей противовоспалительным, иммунотропным, противоаллергическим и ранозаживляющим действием, которая представляет собой раствор для парентерального применения и содержит пептиды, ассоциированные с фосфолипидами, полученные из печени тресковых, солюбилизатор, изотонирующий агент натрия хлорид, консервант и воду для инъекций при следующем содержании компонентов (мас.%):
| Пептиды, ассоциированные с фосфолипидами, | |
| полученные из печени тресковых | 0,01-10,0 |
| Солюбилизатор | 1,0-15,0 |
| Натрия хлорид | 0,1-0,9 |
| Консервант | 0,01-0,5 |
| Вода для инъекций | до 100 |
Принципиально новым в предлагаемом изобретении является применение пептидов, ассоциированных с фосфолипидами, полученных из печени тресковых, которые являются селективными ингибиторами циклооксигеназы-2 (ЦОГ-2) и 5-липооксигеназы (5-ЛОГ).
В качестве противовоспалительного средства пептиды, ассоциированные с фосфолипидами, полученные из печени тресковых, используют для профилактики и лечения различных заболеваний, включая воспалительные и аллергические острые и хронические процессы на коже и слизистой: дерматиты различной этиологии, экземы, маститы, эндометриты; кожные проявления заболеваний внутренних органов (панкреатиты, гепатиты, нефриты, циститы и др.), острые и хронические заболевания суставов (артриты, артрозы, спондилиты и др.). Средство снимает зуд, отеки, гиперемию в местах расчесов в результате укусов эктопаразитов.
Пептиды, ассоциированные с фосфолипидами, полученные из печени тресковых, характеризуются следующей совокупностью существенных признаков: продукт содержит пептиды и фосфолипиды при следующем их количественном соотношении, мас.%: пептиды 40-99 и фосфолипиды 1-60. Фосфолипиды представлены преимущественно фосфатидилхолином. Пептидная фракция представлена комплексом полипептидов различной молекулярной массы (до 25 кДа). Состав пептидов может изменяться в зависимости от конкретного вида рыб, состояния используемого сырья, не оказывая при этом значимого влияния на целевую фармакологическую активность. Заявленные свойства продукт проявляет при указанном соотношении пептидной и фосфолипидной фракций. Выделение из продукта отдельных пептидных фракций или отдельных полипептидов с последующим определением их фармакологической активности свидетельствовало об уменьшении выраженности эффектов и недостижении заявленного в настоящем изобретении суммарного противовоспалительного, иммунотропного, противоаллергического и ранозаживляющего действия.
Солюбилизатор выбран из группы, состоящей из полиэтиленгликоля, поливинилпирролидона, поливинилового спирта, полиэтиленгликоля гидроксистеарата, полиэтиленгликоля глицерилгидроксистеарата, полисорбата, глицерина или их смеси.
Консервант выбран из группы, состоящей из нипагина, нипазола, бензилового спирта, бензалкония хлорида, натрия бензоата или их смеси.
Композиция может дополнительно содержать спирт этиловый в количестве 1,0-15,0 мас.% для улучшения растворимости основного действующего вещества и повышения микробиологической стабильности.
Композиция может дополнительно содержать антиоксидант в количестве 0,01-0,5 мас.%, выбранный из группы, состоящей из натрия метабисульфита, натрия сульфита натрия тиосульфата или трилона Б.
Композиция может дополнительно содержать буфер в количестве 0,1-5,0 мас.% для создания и поддержания необходимого значения рН раствора, выбранный из группы фосфатного, цитратного, ацетатного буфера.
Пример 1. Композиция для парентерального применения (в г на 100 г).
Пептиды, ассоциированные с фосфолипидами - 0,1
Полиэтиленгликоль 660 гидроксистеарат (Solutol) - 5,0
Натрия хлорид - 0,76
Спирт этиловый - 10,0
Нипагин - 0,1
Нипазол - 0,02
Вода для инъекций - до 100
Комплекс пептидов, ассоциированных с фосфолипидами, используемый в данном Примере выполнения, получен из печени трески и содержит 15,3% фосфолипидов в пересчете на фосфатидилхолин и 84,7% полипептидов, содержащих преимущественно основные пептидные фракции приблизительной массой 6,5 кДа и 17 кДа в приблизительно равных количествах.
Пример 2. Композицию для парентерального применения получают аналогично примеру 1, добавляя комплекс пептидов, ассоциированных с фосфолипидами, в количестве 0,25 г/100 г. Комплекс пептидов, ассоциированных с фосфолипидами, используемый в данном Примере выполнения, получен из печени путассу и содержит 9,5% фосфолипидов в пересчете на фосфатидилхолин и 90,5% полипептидов, содержащих преимущественно основную пептидную фракцию приблизительной массой 6,5 кДа и пептидные фракции приблизительной массой 6,5 кДа и 15 кДа в меньшем количестве.
Пример 3. Композицию для парентерального применения получают аналогично примеру 1, добавляя комплекс пептидов, ассоциированных с фосфолипидами, в количестве 0,20 г/100 г. Комплекс пептидов, ассоциированных с фосфолипидами, используемый в данном Примере выполнения, получен из печени минтая и содержит 23,4% фосфолипидов в пересчете на фосфатидилхолин и 76,6% полипептидов, содержащих преимущественно основную пептидную фракцию приблизительной массой 17 кДа и пептидные фракции приблизительной массой 6,5 кДа и 15 кДа в меньшем количестве.
Были проведены экспериментальные исследования.
Пример 4. Оценка противовоспалительного действия на модели экспериментального острого риносинусита у крыс, индуцированного интраназальным введением формалина.
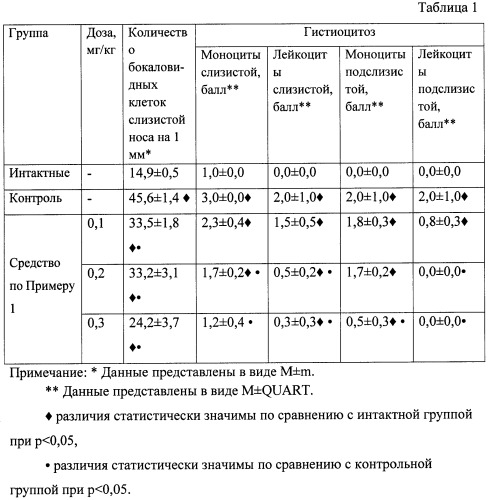
Средство, приготовленное по Примеру 1, вводили интраназально в дозах 0,1; 0,2; 0,3 мг/кг массы крысы в течение 7 дней. Данные по оценке противовоспалительного действия приведены в таблице 1.
В Таблице 1 приведена сравнительная характеристика изменений слизистой носовых ходов у крыс при экспериментальном остром риносинусите (N=6).
Установлено, что средство, приготовленное по Примеру 1 оказало выраженный дозозависимый противовоспалительный эффект. Количество бокаловидных клеток значимо отличалось от показателей в интактной и контрольной группах животных. В максимальной дозе средство статистически значимо снижало выраженность инфильтрации мононуклеарами и лейкоцитами в собственной пластинке слизистой оболочки и инфильтрацию лейкоцитами в подслизистом слое.
Такой эффект связан с более ранним, по завершении воспалительного процесса, исчезновением клеток крови, которые появились в очаге раньше (нейтрофильные гранулоциты), и более поздней элиминацией мононуклеаров, обладающих меньшей хемотаксической чувствительностью. Данные факты указывают на выздоровление и отражают выраженный противовоспалительный эффект композиции на основе пептидов, ассоциированных с фосфолипидами.
Пример 5. Оценка иммуностимулирующего действия.
Для оценки влияния композиции на клеточный иммунный ответ в соответствии с руководством по экспериментальному (доклиническому) изучению новых фармакологических веществ использовали реакцию гиперчувствительности замедленного типа (ГЗТ).
С целью выявления фармакологической активности средства в отношении Т-клеточного иммунного ответа мышам вводили средство, приготовленное по Примеру 1, в дозе 100 мкл/мышь в течение 6 суток (период развития реакции гиперчувствительности замедленного типа). Результаты проведенного исследования представлены в таблице 2.
В таблице 2 представлена реакция гиперчувствительности замедленного типа (индекс реакции) у инбредных мышей при внутримышечном введении препарата (M±SD).
| Таблица 2 | ||
| Группа | Количество животных в группе | Индекс реакции |
| Интактная | 10 | 0,4±0,1 |
| Контроль | 10 | 6,9±2,8* |
| Средство по Примеру 1 | 10 | 12,9±4,7* |
| * - различия статистически значимы по сравнению с интактной группой при p<0,05, ** - различия статистически значимы по сравнению с контролем при p<0,05. |
Установлено, что средство, приготовленное по Примеру 1, оказывает влияние на развитие реакции замедленного типа, в частности увеличивает ее практически в 2 раза. Полученные данные свидетельствуют о том, что шестидневное введение средства оказывает иммуностимулирующее действие.
Пример 6. Влияние на энзиматическую активность 5-ЛОГ.
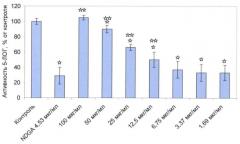
Исследование влияния средства, приготовленного по Примеру 1, на энзиматическую активность 5-ЛОГ проводили с использованием набора Lipoxygenase Inhibitor Screening Assay Kit (Cayman Chemical, USA) и очищенной 5-ЛОГ картофеля (Cayman Chemical, USA), в качестве препарата сравнения использовали селективный ингибитор 5-ЛОГ - NDGA (нордигидрогвайяретовую кислоту).
На чертеже показано влияние на активность фермента 5-ЛОГ.
☆ Различия достоверны при p<0.05 при сравнении с контрольной группой.
☆☆ Различия достоверны при p<0.05 при сравнении с группой NDGA.
Из данных, представленных на чертеже, видно, что композиция, содержащая пептиды, ассоциированные с фосфолипидами, обладает значительной ингибирующей активностью по отношению к ферменту 5-ЛОГ. При использовании композиции в концентрации 3,37 мкг/мл его ингибирующая активность сопоставима с ингибирующей активностью препарата сравнения селективного ингибитора 5-ЛОГ NDGA в концентрации 4,53 мкг/мл.
Пример 7. Антиоксидантная активность в отношении радикала DPPH.
Антиоксидантную активность композиции исследовали в отношении радикала DPPH спектрофотометрическим методом. В качестве препарата сравнения использовали раствор для инъекций Алфлутоп, применяемый для лечения артрозов различной локализации.
Установили, что IC50 для композиции, содержащей пептиды, ассоциированные с фосфолипидами, составляет около 4,5 мг/мл, что сопоставимо с препаратом сравнения Алфлутоп (4,6 мг/мл).
Пример 8. Противовоспалительная активность на модели адъювантного артрита, вызванного введением полного адъюванта Фрейнда. Данная модель позволяет оценить противовоспалительную активность лекарственных препаратов разных групп в отношении таких патологий как ревматоидный артрит, артроз и других хронических воспалительных патологий опорно-двигательной системы. В качестве препарата сравнения использовали раствор для инъекций Алфлутоп.
Было установлено наличие выраженных фармакологических эффектов для исследуемого средства, приготовленного по Примеру 1, который проявил себя как противовоспалительный, хондро- и остеопротекторный препарат.
Пример 9. Оценка местного противовоспалительного действия на модели острого тонзиллита на крысах-самцах линии Wistar, индуцированного введением раствора каррагенина непосредственно в ткань одного из парных лимфатических узлов крысы. Действие средства оценивали по концентрации C-реактивного белка (СРБ, белок острой фазы, появляющийся в крови при воспалительных процессах), определяли гематологические показатели и исследовали ткани лимфатических узлов. В качестве препаратов сравнения использовали НПВС диклофенак и глюкокортикоид дексаметазон.
В таблице 3 приведены данные по противовоспалительной активности на модели острого тонзиллита.
Было установлено, что препарат сравнения Диклофенак в дозе 11 мг/кг не оказал противовоспалительного эффекта, т.к. по всем исследуемым показателям данная группа практически не отличалась от контрольной, но при этом смертность в данной группе составила 30%. Дексаметазон в дозе 5 мг/кг оказал преимущественно токсическое (высокая смертность в группе и выраженное катаболическое влияние на белковый обмен) и иммуносупрессивное действие в виде отсутствия местной реакции в лимфатическом узле на введение патогена.
Применение исследуемого средства по Примеру 1 в дозах 0,3 и 0,4 мг/кг сопровождалось менее выраженным отеком ткани пораженных лимфатических узлов. Кроме того, в этих группах наблюдалось статистически значимое, по отношению к контрольной группе, уменьшение площади герминативных центров фолликулов, а в группе с дозой 0,3 мг/кг показатель достиг уровня интактной группы.
Биохимические показатели крови выявили статистически достоверное снижение уровня C-реактивного белка во всех группах с явным эффектом дозозависимости. Несмотря на некоторое снижение уровня альбумина крови, что могло быть связано с оперативным вмешательством, общий белок в группе средства по Примеру 1 с дозой 0,3 мг/кг приближался к уровню интактной группы. При этом гематологические показатели в группах 0,3 и 0,4 практически не отличались от таковых в интактной группе.
В ходе данного эксперимента было показано, что выраженным противовоспалительным действием обладает средство по Примеру 1 в дозах 0,3 и 0,4 мг/кг.
Пример 10. Влияние на энзиматическую активность ЦОГ-1 и ЦОГ-2.
Влияние средства на основе пептидов по Примеру 1, ассоциированных с фосфолипидами, на энзиматическую активность ЦОГ-1 и ЦОГ-2 проводилось с использованием коммерческого набора СОХ inhibitor screening assay kit (Cayman Chemical, USA). В качестве препарата сравнения использовали селективный ингибитор ЦОГ-1 - SC-560 в концентрации 100 нМ. Средство на основе пептидов, ассоциированных с фосфолипидами, вводили в дозе 20 мкг/мл.
Тест-система напрямую оценивает количество простагландина F2α (PGF2α), сформированного в ходе редукции индуцированной хлоридом олова (SnCl2) PGH2 - продукта взаимодействия циклооксигеназы (фермента) и арахидоновой кислоты (субстрата). Тест-система включает телячью ЦОГ-1 и человеческую рекомбинантную ЦОГ-2, позволяя тем самым определять активность фармакологических субстанций в отношении обоих ферментов. Результаты эксперимента приведены в таблице 4.
В Таблице 4 приведены сравнительные данные по активности при взаимодействии средства на основе пептидов, ассоциированных с фосфолипидами, с ЦОГ-1 и ЦОГ-2 (M±SD).
| Таблица 4 | ||||
| Группа | Взаимодействие с ЦОГ-1 | Взаимодействие с ЦОГ-2 | ||
| Концентрация PGF2α, нг/мл | Активность, % от контроля | Концентрация PGF2α, нг/мл | Активность, % от контроля | |
| Контрольная | 6368±272 | 100 | 548±74 | 100 |
| Средство по Пр.1, 20 мкг/мл | 8653±569 | 136 | 345±85 | 63 |
| Sc - 560,100 нМ | 2798±272 | 44 | - | - |
Из данных, представленных в таблице 4, видно, что селективный ингибитор SC-560 подавляет активность ЦОГ-1 на 56%. При этом в образце, содержащем средство на основе пептидов, ассоциированных с фосфолипидами, концентрация образовавшегося PGF2α выше таковой в контроле на 36%, т.е. можно говорить об активирующем влиянии препарата на активность фермента ЦОГ-1. Препарат также оказал ингибирующее действие на энзиматическую активность фермента ЦОГ-2.
Таким образом, двойное ингибирование 5-ЛОГ и ЦОГ-2 приводит к усилению и расширению противовоспалительных эффектов, связанных с выработкой основных форм лейкотриенов и простагландинов, а также снижению побочных эффектов. Известно, что двойные ингибиторы при этом не блокируют важнейшие медиаторы липоксины, проявляющие противовоспалительное действие.
Пример 11. Противоаллергическое действие.
Противоаллергическое действие оценивали на модели экспериментального контактного аллергического дерматита на беспородных мышах-самцах.
В качестве аллергена использовали 1-хлор-2,4-динитробензол (ДНХБ, Sigma, США) в смеси ацетона с оливковым маслом (4:1). На 1-е сутки эксперимента мышей сенсибилизировали путем однократного нанесения 100 мкл 0,5%-ДНХБ на выбритые участки кожи живота. На 5-е сутки эксперимента животным наносили разрешающую дозу аллергена 20 мкл 0,25% ДНХБ на наружную и внутреннюю поверхности «опытного» уха. Результаты реакции регистрировали на 8-е сутки эксперимента путем измерения массы «опытного» и «контрольного» уха и расчета индекса реакции (ИР).
Лечебный эффект препарата оценивали после развития аллергической реакции, т.е. после стадии разрешения. С этой целью лечение препаратами проводили с 5-х по 7-е сутки эксперимента.
Средство по Примеру 1 вводили внутримышечно в дозе 2,5 мг/кг (0,075 мл) и 5,0 (0,15 мл) мг/кг.
В качестве препаратов сравнения использовали Супрастин, раствор для инъекций, и Алезан, крем-гель. Супрастин вводили внутримышечно в терапевтической дозе в объеме 0,025 мл и в дозе, в 2 раза превышающей терапевтическую, в объеме 0,05 мл. Алезан наносили на ухо в терапевтической дозе 10 мг/кг и в дозе, в 2 раза превышающей терапевтическую, 20 мг/кг.
В Таблице 5 показаны противоаллергические свойств (индекс реакции) на модели контактного дерматита (М±m, n=10).
| Таблица 5. | ||||
| № группы | Группа | Форма, путь введения | Доза, мг/кг | Индекс реакции |
| 1 | Интактная | - | - | 26,4±2,5 |
| 2 | Контроль | - | - | 69,8±8,3* |
| 3 | Негативный контроль | - | - | 25,8±5,4** |
| 4 | Плацебо | Гель местно | - | 36,5±9,0** |
| 5 | Плацебо | Раствор в/м | - | 39,9±8,3** |
| 6 | Алезан | Гель местно | 10 | 42,9±5,4* ** |
| 7 | 20 | 46,1±6,1* ** | ||
| 8 | Средство по Пр.1 | Раствор в/м | 2,5 | 26,7±5,9** |
| 9 | 5,0 | 36,2±7,8** | ||
| 10 | Супрастин | Раствор в/м | 0,5 | 20,7±6,5** |
| 11 | 10,0 | 29,8±6,6** | ||
| * - различия статистически значимы по сравнению с интактными животными по критерию Стьюдента, при p<0,05; | ||||
| ** - различия статистически значимы по сравнению с контрольными животными по критерию Стьюдента, при p<0,05 |
Препарат сравнения Алезан не проявил выраженного противоаллергического действия, снижение ИР наблюдали в 1,5 ниже по сравнению с контрольными животными.
При исследовании средства, приготовленного по Примеру 1, установили статистически значимое снижение ИР по сравнению с контрольной группой в 2,6 раза и также был достигнут уровень интактных животных.
Пример 12. Исследование токсичности.
При исследовании острой токсичности средства, приготовленного по Примеру 1, на мышах и крысах при внутримышечном, внутривенном и местном путях введения, установить значения ЛД50 оказалось невозможным, ввиду отсутствия гибели животных. По степени воздействия на организм композиция пептидов, ассоциированных с фосфолипидами, относится к 4 классу опасности по ГОСТ 12.1.007 (вещества малоопасные). В рекомендуемых дозах не оказывают местно-раздражающего, эмбриотоксического и канцерогенного действия.
Пример 13. Применение препаратов пептидов, ассоциированных с фосфолипидами, для лечения воспалительных дерматологических заболеваний различной этиологии у животных.
Клиническую апробацию нового средства на основе пептидов, ассоциированных с фосфолипидами, провели в ветеринарном поликлиническом центре «Элвет». Группа состояла из 16-ти кошек и 14-ти собак в возрасте от 3 до 8 лет. У всех животных наблюдали многочисленные расчесы, зуд, перхоть, сухие и мокнущие экземы. Средство назначали по 2 мл × 2 раза в день в течение 3-5 дней.
Осмотр после назначенного лечения выявил следующее: все животные хорошо переносили применение препарата, побочных явлений не наблюдалось. В месте введения инъекций не наблюдали никаких нежелательных реакций, инъекции были безболезненны. Уже через 1-3 дня наблюдали исчезновение зуда, снижение гиперемии тела, ранки постепенно заживали, корочки при этом мягко отходили. Использование препарата позволило без дополнительного введения кортикоидов добиться ремиссии (Фиг.).
Пример 14. Применение препаратов пептидов, ассоциированных с фосфолипидами, для лечения маститов крупного рогатого скота.
Клиническую апробацию нового средства провели на базе хозяйства ЗАО «Предпортовый» у коров с воспалением молочной железы различной этиологии. В результате клинического осмотра и мастидиновых тестов были выбраны животные с диагнозами: острый и хронический катаральный маститы. В результате были сформированы 4 группы, которым была подобрана различная вариация базисной лечебной терапии в соответствии с инструкцией к препаратам и учетом патологического процесса и его выраженности.
Оценка терапевтической эффективности препарата проводилась при помощи балльной системы, в зависимости от числа пораженных долей вымени и количества молока.
Балльная шкала оценки пораженных молочных долей: 1 - одна доля, 2 - две доли, 3 - три доли, 4 - четыре доли.
Балльная оценка удоев молока в сутки с 1 головы: 0 - 8-16 л, 1 - 4-8 л, 2 - 1-4 л, 3 - отсутствие молока.
Суммарная оценка терапевтической эффективности применения различных схем лечения мастита (M±QUART) представлена в виде таблице 6.
| Таблица 6. | ||||
| Группы, схема лечения | Поражение вымени в динамике | Удои молока в динамике | ||
| До лечения | После лечения | До лечения | После лечения | |
| Группа №1 | 1,7±0,3 | 0,9±0,3 | 1,4±0,2 | 1,2±0,4 |
| Средство по пр. 1 п/к + Мастиет Форте | ||||
| Группа №2 | 2,6±0,5 | 1,2±0,5 | 2,4±0,2 | 1,4±0,4 |
| 4% раствор Гентамицина в/м + Стрептомицин в 0,5% растворе Новокаина интрацистернально | ||||
| Группа №3 | 2,3±0,5 | 1,3±0,4 | 1,8±0,4 | 1,4±0,3 |
| 4% раствор Гентамицина в/м | ||||
| Группа №4 | 1,9±0,3 | 0,7±0,2* | 1,7±0,3 | 0,7±0,2* |
| Средство по примеру 1 п/к + 4% раствор Гентамицина в/м | ||||
| * различия статистически значимы по сравнению с данными до лечения, при p<0,05 |
Было показано, что применение средств на основе пептидов, ассоциированных с фосфолипидами в базисной терапии, позволяет сократить сроки использования антибиотиков в лечебной терапии маститов и в кратчайшие сроки восстановить нормальный объем удоев и в дальнейшем использовать молоко без ограничения, оказывают положительное действие в период реконвалесценции, а также являются безопасными и характеризуются хорошей переносимостью.
Пример 15. Применение средств на основе пептидов, ассоциированных с фосфолипидами, для лечения эндометритов различной этиологии у крупного рогатого скота.
Клиническую апробацию проводили на базе хозяйства ЗАО «Гатчинское». Исследование проводилось на крупном рогатом скоте черно-пестрой породы молочного направления, возрастная группа от 3 до 5 лет, женского пола с воспалительными процессами эндометрия матки различной этиологии. Среднесуточный удой в стаде (количеством 34 головы) составляет 12-16 литров молока в сутки на голову. В результате клинического осмотра были выбраны животные с диагнозами: катаральный, серозный и гнойный эндометриты. В результате были сформированы 4 группы, которым была подобрана различная вариация базисной лечебной терапии в соответствии с инструкцией к препаратам и учетом патологического процесса и его выраженности.
Оценку терапевтической эффективности средств проводили при помощи балльной системы, в зависимости от степени выраженности патологического процесса и количества молока.
Балльная шкала оценки тяжести эндометрита: 0 - без патологии, 1 - катаральный, 2 - серозный, 3 - гнойный.
Балльная оценка удоев молока в сутки с 1 головы: 0 - 8-16 л, 1 - 4-8 л, 2 - 1-4 л, 3 - отсутствие молока.
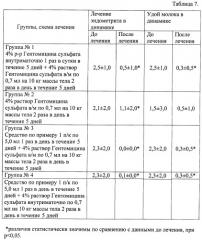
Суммарная оценка терапевтической эффективности применения различных схем лечения эндометрита (M±QUART) представлена в виде таблице 7.
При анализе терапевтической эффективности различных схем лечения эндометритов крупного рогатого скота с использованием средства по Примеру 1.
Наиболее выраженный терапевтический результат лечения наблюдался при сочетании раствора пептидов, ассоциированных с фосфолипидами и 4% раствора гентамицина. На фоне проведенного лечения во всех группах в конце терапии отмечалось повышение содержания белка в сыворотке крови подопытных коров, что может быть отражением наработки антител (увеличение произошло за счет глобулиновых фракций) и характеризовать процессы реконвалесценции после перенесенной бактериальной инфекции.
Внедрение новых схем лечения эндометритов позволить сократить сроки использования антибиотиков в лечении эндометритов, ускорить выздоровление с нормализацией количества удоев и отсутствия в дальнейшем ограничений по использованию молока.
Таким образом, экспериментальные данные свидетельствуют, что композиция на основе пептидов, ассоциированных с фосфолипидами, полученных из печени тресковых, обладает противовоспалительным, противоаллергическим, антиоксидантным и иммуностимулирующим действием и не оказывают токсического воздействия при различных путях введения.
В результате проведенных испытаний композиций на основе пептидов, ассоциированных с фосфолипидами, установлено, что средства являются перспективными в терапии воспалительных заболеваний человека и животных различного генеза и наряду с высокой эффективностью обладают хорошей переносимостью и безопасностью.
1. Фармацевтическая композиция, обладающая противовоспалительным, иммунотропным, противоаллергическим и ранозаживляющим действием, характеризующаяся тем, что она представляет собой раствор для парентерального применения и содержит пептиды, ассоциированные с фосфолипидами, полученные из печени тресковых, солюбилизатор, натрия хлорид, консервант и воду для инъекций при следующем содержании компонентов, мас.%:
| пептиды, ассоциированные с фосфолипидами, | |
| полученные из печени тресковых | 0,01-10,0 |
| солюбилизатор | 1,0-15,0 |
| натрия хлорид | 0,1-0,9 |
| консервант | 0,01-0,5 |
| вода для инъекций | до 100 |
2. Композиция по п.1, где солюбилизатор выбран из группы, состоящей из полиэтиленгликоля, поливинилпирролидона, поливинилового спирта, полиэтиленгликоля гидроксистеарата, полиэтиленгликоля глицерилгидроксистеарата, полисорбата, глицерина или их смеси.
3. Композиция по п.1, где консервант выбран из группы, состоящей из нипагина, нипазола, бензилового спирта, бензалкония хлорида, натрия бензоата или их смеси.
4. Композиция по п.1, дополнительно содержит спирт этиловый в количестве 1,0-15,0 мас.%.
5. Композиция по п.1, дополнительно содержит антиоксидант в количестве 0,01-0,5 мас.%.
6. Композиция по п.5, где антиоксидант выбран из группы, состоящей из натрия метабисульфита, натрия сульфита, натрия тиосульфата или трилона Б.
7. Композиция по п.1 дополнительно содержит буфер в количестве 0,1-5,0 мас.%.
8. Композиция по п.7, где буфер выбран из группы, состоящей из фосфатного, цитратного или ацетатного буфера.