Комплекс нуклеиновой кислоты и композиция для доставки нуклеиновой кислоты
Иллюстрации
Показать всеГруппа изобретений относится к медицине и предоставляет комплекс нуклеиновой кислоты и сильно разветвленного циклического декстрина, представляющий собой глюкан со степенью полимеризации 50-5000, включающий внутренний разветвленный циклический структурный фрагмент, образованный альфа-1,4-глюкозидными связями и как минимум одной альфа-1,6-глюкозидной связью, и внешний разветвленный структурный фрагмент, связанный с внутренним разветвленным циклическим структурным фрагментом. Группа изобретений включает также композицию, состоящую из комплекса, диацилфосфатидилхолина, как минимум одного соединения, выбранного из холестерина, и первичный алифатический амин, а также применение и способ доставки к клетке. Группа изобретений обеспечивает низкую токсичность и высокую степень безопасности, способность устойчиво поддерживать содержание нуклеиновой кислоты в клетке. 5 н. и 9 з.п. ф-лы, 1 табл., 3 ил., 6 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к комплексу нуклеиновой кислоты, который способен устойчиво находиться в клетке, обладая при этом низкой токсичностью и высокой степенью безопасности, а также к композиции для доставки нуклеиновой кислоты.
УРОВЕНЬ ТЕХНИКИ
С развитием биотехнологии в последние годы был обнаружен целый ряд нуклеиновых кислот, проявляющих физиологическую активность в клетках. Например, известно, что siRNA (малая интерферирующая РНК) вызывает разрушение mRNA целевого гена в клетке и подавляет экспрессию целевого гена (РНК-интерференция). Ингибирующее действие на экспрессию целевых генов вследствие РНК-интерференции применимо для облегчения или лечения симптомов заболеваний, вызванных аномальной экспрессией определенных генов или кластеров генов, и ожидается разработка терапевтических агентов, в которых применяется siRNA. Однако, поскольку нуклеиновые кислоты являются растворимыми в воде макромолекулами, несущими отрицательный заряд, эффективность их доставки к внутриклеточным генам является чрезвычайно низкой, что приводит к неэффективности генной терапии с применением siRNA.
Было известно, что эффективной доставке генов в клетки способствует применение носителя (вектора). Векторы включают вирусные векторы и невирусные векторы. Вирусные векторы проявляют высокую эффективность при введении нуклеиновых кислот в клетку; однако имеются различные неизвестные аспекты безопасности, включающие патогенность, иммуногенность и цитотоксичность. Следовательно, для клинических приложений желательно применение невирусных векторов.
Примеры невирусных векторов включают Lipofectamin™2000, который в настоящее время является коммерчески доступным. Далее, сообщалось о катионных липидах с особой структурой (см. патентный документ 1) и композиции (см. патентный документ 2), содержащей амфифильное соединение и поликатион. Внутриклеточную доставку нуклеиновых кислот с применением невирусного вектора проводят, смешивая на первой стадии нуклеиновую кислоту, доставку которой предполагается осуществить, с этим невирусным вектором для образования комплекса, и затем приводя этот комплекс в контакт с целевой клеткой. Если невирусный вектор может образовать липосому, этот вектор вводят в клетку с нуклеиновой кислотой, заключенной в липосому, тем самым осуществляя внутриклеточную доставку нуклеиновой кислоты.
Однако такие нуклеиновые кислоты, как siRNA, обладают специфической особенностью, которая заключается в низкой стабильности и значительном электрическом заряде. Поэтому при смешивании с невирусным вектором уменьшение стабильности нуклеиновой кислоты становится проблемой, которая препятствует непрерывному поступлению нуклеиновой кислоты в клетку. Хотя был известен пример, в котором нуклеиновая кислоты была захвачена липосомой за счет формирования комплекса siRNA и катионного полимера (см. непатентный документ 1), это неприменимо на практике из-за цитотоксичности катионного полимера. Далее, даже если может образоваться стабильный комплекс известного невирусного вектора и нуклеиновой кислоты, этот комплекс может обладать невысокой способностью проникать в клетку или же может быстро доставляться в клетку. Следовательно, такие известные невирусные векторы не могут обеспечить устойчивое наличие нуклеиновой кислоты в клетке, что не позволяет сохранять желаемые результаты, получаемые от действия нуклеиновой кислоты.
С точки зрения известного уровня техники желательна разработка методик для эффективной доставки нуклеиновых кислот (например, siRNA) в клетку и для устойчивого поддержания наличия в клетке этих нуклеиновых кислот, имеющих низкую токсичность и высокую безопасность.
Патентный документ 1: Japanese Unexamined Patent Publication No. 2002-529439
Патентный документ 2: Japanese Unexamined Patent Publication No. 2005-508394
Непатентный документ 1: Kentaro Kogure et al., Development of a non-viral-multifunctional-envelope-type nano device by a novel lipid film hydration method, J. Control. Release, 98 (2004) 317-323
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Проблемы, решаемые настоящим изобретением
Задача настоящего изобретения заключается в решении проблем известного уровня техники. Конкретно, задача настоящего изобретения заключается в предоставлении комплекса нуклеиновой кислоты, обладающего низкой токсичностью и высокой степенью безопасности, который способен устойчиво обеспечивать наличие нуклеиновой кислоты, например, siRNA или аналогичной, в клетке; а также композиции для доставки нуклеиновой кислоты, которая способна эффективно доставлять комплекс нуклеиновой кислоты в клетку. Другой задачей настоящего изобретения является предоставление фармацевтической композиции, включающей композицию для доставки нуклеиновой кислоты, а также способа доставки нуклеиновой кислоты в клетку, путем приведения в контакт композиции для доставки нуклеиновой кислоты с клеткой.
Средства решения указанных проблем
Авторы настоящего изобретения провели обширные исследования для решения указанных выше проблем и обнаружили, что комплекс нуклеиновой кислоты, обладающий низкой токсичностью и высокой степенью безопасности, который способен устойчиво обеспечивать наличие нуклеиновой кислоты в клетке, может быть получен путем образования комплекса нуклеиновой кислоты, которую предполагается ввести в клетку, и сильно разветвленного циклического декстрина. Авторы настоящего изобретения обнаружили далее, что безопасность и эффективность внутриклеточной доставки, а также внутриклеточная устойчивость нуклеиновой кислоты могут быть дополнительно улучшены применением, в качестве носителя для доставки комплекса нуклеиновой кислоты в клетку, носителя, включающего (A) диацилфосфатидилхолин, (B) холестерин и/или его производное и (C) первичный алифатический амин. Работа над изобретением была завершена проведением дополнительных исследований на основе этих данных.
Сущность настоящего изобретения может быть изложена в следующих абзацах.
Абзац 1. Комплекс нуклеиновой кислоты, включающий нуклеиновую кислоту и сильно разветвленный циклический декстрин.
Абзац 2. Комплекс нуклеиновой кислоты согласно абзацу, где количество сильно разветвленного циклического декстрина составляет от 1 до 4000 массовых частей на одну массовую часть нуклеиновой кислоты.
Абзац 3. Комплекс нуклеиновой кислоты согласно абзацу 1 или 2, где нуклеиновая кислота представляет собой siRNA.
Абзац 4. Комплекс нуклеиновой кислоты согласно любому из абзацев 1-3, где сильно разветвленный циклический декстрин представляет собой глюкан со степенью полимеризации 50-5000, включающий внутренний разветвленный циклический структурный фрагмент, образованный α-1,4-глюкозидными связями и как минимум одной α-1,6-глюкозидной связью, и внешний разветвленный структурный фрагмент, связанный с внутренним разветвленным циклическим структурным фрагментом.
Абзац 5. Комплекс нуклеиновой кислоты согласно любому из абзацев 1-4, который представляет собой агрегат, полученный смешиванием нуклеиновой кислоты с сильно разветвленным циклическим декстрином в водном растворе.
Абзац 6. Композиция для доставки нуклеиновой кислоты, включающая комплекс нуклеиновой кислоты согласно любому из абзацев 1-5 и носитель для доставки нуклеиновой кислоты.
Абзац 7. Композиция для доставки нуклеиновой кислоты согласно абзацу 6, где носитель для доставки нуклеиновой кислоты представляет собой композицию, включающую (A) диацилфосфатидилхолин, (B) как минимум одно соединение, выбранное из холестерина и его производных и (C) первичный алифатический амин.
Абзац 8. Композиция для доставки нуклеиновой кислоты согласно абзацу 7, где компонент (A) носителя для доставки нуклеиновой кислоты представляет собой диацилфосфатидилхолин, в котором ацильный фрагмент включает от 4 до 23 атомов углерода.
Абзац 9. Композиция для доставки нуклеиновой кислоты согласно абзацу 7, где компонент (B) носителя для доставки нуклеиновой кислоты представляет собой холестерин.
Абзац 10. Композиция для доставки нуклеиновой кислоты согласно абзацу 7, где компонент (C) носителя для доставки нуклеиновой кислоты представляет собой алкиламин, включающий от 10 до 20 атомов углерода.
Абзац 11. Композиция для доставки нуклеиновой кислоты согласно абзацу 7, где мольное соотношение компонентов (A):(B):(C) составляет 5-9:1-5:1.
Абзац 12. Композиция для доставки нуклеиновой кислоты согласно абзацу 7, где носитель для доставки нуклеиновой кислоты представляет собой липосомальный препарат, в котором оболочка липосом образована компонентами (A)-(C).
Абзац 13. Фармацевтическая композиция, включающая композицию для доставки нуклеиновой кислоты согласно любому из абзацев 6-12.
Абзац 14. Фармацевтическая композиция согласно абзацу 13, где нуклеиновая кислота представляет собой siRNA.
Абзац 15. Применение композиции для доставки нуклеиновой кислоты согласно любому из абзацев 6-12 для получения фармацевтического средства для доставки нуклеиновой кислоты в клетку.
Абзац 16. Применение согласно абзацу 15, где нуклеиновая кислота представляет собой siRNA.
Абзац 17. Способ доставки нуклеиновой кислоты в клетку, где указанный способ включает стадию приведения композиции для доставки нуклеиновой кислоты согласно любому из абзацев 6-12 в контакт с клеткой.
Абзац 18. Способ согласно абзацу 17, где нуклеиновая кислота представляет собой siRNA.
Эффекты изобретения
Комплекс нуклеиновой кислоты по настоящему изобретению получают из нуклеиновой кислоты и сильно разветвленного циклического декстрина, что дает возможность получить комплекс нуклеиновой кислоты с высокой степенью безопасности и постоянно поддерживать присутствие нуклеиновой кислоты в клетке в течение длительного периода времени так, чтобы мог устойчиво проявляться полезный эффект от действия нуклеиновой кислоты. Далее, комплекс нуклеиновой кислоты по настоящему изобретению может быть легко превращен в комплекс с носителем для доставки нуклеиновой кислоты и может быть даже легко инкапсулирован в носитель для доставки нуклеиновой кислоты в липосомальной форме. Следовательно, комплекс по настоящему изобретению обладает отличными характеристиками с точки зрения легкости включения в состав композиции для доставки нуклеиновых кислот. Кроме того, композиция для доставки нуклеиновых кислот по настоящему изобретению обладает способностью вводить комплекс нуклеиновой кислоты в клетку.
Для доставки комплекса нуклеиновой кислоты по настоящему изобретению в клетку применение носителя, включающего (A) диацилфосфатидилхолин, (B) холестерин и/или его производное и (C) первичный алифатический амин, в качестве носителя для внутриклеточной доставки, может увеличить эффективность внутриклеточной доставки комплекса нуклеиновой кислоты, а также способно дополнительно улучшить стабильность и безопасность такой внутриклеточной доставки.
Как указано выше, комплекс нуклеиновой кислоты и композиция для доставки нуклеиновой кислоты по настоящему изобретению могут демонстрировать полезные результаты благодаря эффективности, устойчивости и высокой степени безопасности; следовательно, указанные комплекс и композиция особенно применимы в качестве лекарственных средств для генной терапии. Таким образом, фармацевтическая композиция или способ доставки нуклеиновой кислоты в клетку по настоящему изобретению способны обеспечить более эффективную доставку нуклеиновой кислоты в клетку.
Лучшие варианты осуществления настоящего изобретения
Далее по тексту настоящее изобретение описано более подробно.
(1) Комплекс нуклеиновой кислоты
Комплекс нуклеиновой кислоты по настоящему изобретению включает нуклеиновую кислоту и сильно разветвленный циклический декстрин.
Нуклеиновая кислота, входящая в комплекс по настоящему изобретению, не ограничена по типу или структуре, если только существует необходимость доставить ее в клетку. Конкретные примеры таких нуклеиновых кислот включают siRNA, mRNA, tRNA, rRNA, cDNA, miRNA (микроРНК), рибозимы, антисмысловые олигонуклеотиды, олигонуклеотидные ловушки, плазмидные ДНК, пептид-нуклеиновые кислоты, триплекс-образующие олигонуклеотиды (TFOs), аптамеры, гены и т.д., причем среди перечисленных примеров предпочтительными являются siRNA. Недостаток siRNA заключается в низкой стабильности в присутствии известных ранее невирусных векторов, но если превратить siRNA в комплекс нуклеиновой кислоты по настоящему изобретению, она приобретает способность непрерывно доставляться в клетку, как если бы она имела прекрасную стабильность. Нуклеиновая кислота, применяемая в комплексе нуклеиновой кислоты по настоящему изобретению, может быть получена из организмов людей, животных, растений, бактерий, вирусов и т.п., или может быть синтезирована химическим путем. Эти нуклеиновые кислоты могут быть однонитевыми, двухнитевыми или трехнитевыми и не ограничены по молекулярной массе. Кроме того, в настоящем изобретении могут применяться нуклеиновые кислоты, модифицированные химическими реагентами, ферментами или пептидами. Помимо этого в настоящем изобретении нуклеиновые кислоты могут применяться по отдельности или в виде комбинации двух или большего числа кислот.
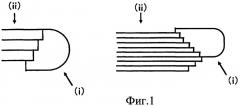
Сильно разветвленный циклический декстрин, применяемый в комплексе нуклеиновой кислоты по настоящему изобретению, получают действием ветвящего фермента на сахарид, включающий α-1,4-гликозидные связи и как минимум одну α-1,6-гликозидную связь, например амилопектин, и он представляет собой глюкан со степенью полимеризации от 50 до 5000, содержащий внутренний разветвленный циклический структурный фрагмент и внешний разветвленный структурный фрагмент. Внутренний разветвленный циклический структурный фрагмент представляет собой циклический структурный фрагмент, образованный α-1,4-гликозидными связями и как минимум одной α-1,6-гликозидной связью; и внешний разветвленный структурный фрагмент представляет собой нециклический структурный фрагмент, связанный с внутренним разветвленным циклическим структурным фрагментом. Внешний разветвленный структурный фрагмент связан со внутренним разветвленным циклическим структурным фрагментом как минимум одной α-1,6-гликозидной связью. Предпочтительные формы сильно разветвленного циклического декстрина включают упомянутый выше глюкан, в котором внутренний разветвленный циклический структурный фрагмент имеет степень полимеризации от 10 до 100, упомянутый выше глюкан, в котором внешний разветвленный структурный фрагмент имеет степень полимеризации 40 или выше, и упомянутый выше глюкан, в котором отдельные цепи внешнего разветвленного структурного фрагмента имеют среднюю степень полимеризации от 10 до 20. Сильно разветвленный циклический декстрин может, например, представлять собой молекулу, показанную на фиг.1, в которой внутренний разветвленный циклический структурный фрагмент помечен символом (i) и внешний разветвленный структурный фрагмент помечен символом (ii).
Степень полимеризации можно определить способом гель-фильтрации с использованием дифференциального рефрактометра исходя из положения вещества с известной степенью полимеризации. При этих измерениях, показания дифференциального рефрактометра пропорциональны концентрации глюкана, и показания фотометра рассеяния лазерного излучения под малыми углами пропорциональны степени полимеризации продукта и концентрации глюкана. Следовательно, степень полимеризации глюкана можно определить измерением соотношения показаний двух указанных приборов, т.е. дифференциального рефракторметра и фотометра рассеяния лазерного излучения под малыми углами. Конкретные условия описаны в US 6248566 B1 (патент Японии №3107358).
Сильно разветвленный циклический декстрин и способ его получения описаны в US 6248566 B1 (патент Японии №3107358), причем сильно разветвленный циклический декстрин продается под зарегистрированной товарной маркой “Cluster Dextrin” компанией Ezaki Glico Co., Ltd.
В комплексе нуклеиновой кислоты по настоящему изобретению соотношение сильно разветвленного циклического декстрина и нуклеиновой кислоты не ограничено, но, как правило, оно составляет от 1 до 4000 массовых частей, предпочтительно от 10 до 1000 массовых частей и более предпочтительно от 100 до 400 массовых частей сильно разветвленного циклического декстрина на одну часть нуклеиновой кислоты. В величинах мольных соотношений, приведенные выше соотношения составляют, например, от 0,1 до 1000 молей, предпочтительно от 1 до 100 молей и более предпочтительно от 10 до 20 молей сильно разветвленного циклического декстрина на моль нуклеиновой кислоты. Соответствие приведенным выше соотношениям дает возможность добиться еще более выдающейся непрерывности внутриклеточной доставки нуклеиновой кислоты с помощью носителя для доставки нуклеиновой кислоты и ее безопасности.
Средний диаметр частиц комплекса нуклеиновой кислоты по настоящему изобретению, как правило, составляет от 6 до 60 нм, предпочтительно от 8 до 30 нм и более предпочтительно от 10 до 20 нм. Средний диаметр частиц комплекса нуклеиновой кислоты измеряют как среднеобъемный диаметр частиц с применением способа динамического рассеяния лазерного излучения.
Комплекс нуклеиновой кислоты по настоящему изобретению представляет собой комплекс, образованный путем агрегации нуклеиновой кислоты и сильно разветвленного циклического декстрина. Комплекс нуклеиновой кислоты по настоящему изобретению получают смешиванием нуклеиновой кислоты и сильно разветвленного циклического декстрина в растворе, в котором можно устойчиво диспергировать два этих вещества. Конкретные примеры растворов, в которых можно устойчиво диспергировать нуклеиновую кислоту и сильно разветвленный циклический декстрин, включают буферные растворы, такие как Tris и т.п. Эти буферные растворы могут содержать хелатирующие средства, например этилендиаминтетрауксусную кислоту (ЭДТУ) и т.п. Условия смешивания нуклеиновой кислоты и сильно разветвленного циклического декстрина, как в случае упомянутого выше раствора, могут быть, например, следующими: примерно 0,1 мкМ - 100 мкМ, предпочтительно примерно 1 мкМ - 10 мкМ нуклеиновой кислоты смешивают с примерно 1 мкМ - 1000 мкМ и предпочтительно примерно 10 мкМ - 100 мкМ сильно разветвленного циклического декстрина, при комнатной температуре в течение примерно 1-100 минут и предпочтительно от примерно 5 до примерно 10 минут. Полученный таким образом комплекс нуклеиновой кислоты по настоящему изобретению образуется в виде дисперсии в растворе. Эта дисперсия может быть непосредственно или, при необходимости, после разбавления или концентрирования, смешана с носителем для доставки нуклеиновой кислоты.
(2) Композиция для доставки нуклеиновой кислоты
Комплекс нуклеиновой кислоты вводят в носитель для доставки нуклеиновой кислоты путем смешивания с этим носителем, и за счет этого появляется возможность доставки нуклеиновой кислоты в клетку. Т.е. в настоящем изобретении разработана также композиция для доставки нуклеиновой кислоты, включающая комплекс нуклеиновой кислоты и носитель для доставки нуклеиновой кислоты.
Носитель для доставки нуклеиновой кислоты представляет собой невирусный вектор, применяемый в качестве носителя нуклеиновой кислоты для доставки (введения) нуклеиновой кислоты в клетку. Композиция для доставки нуклеиновой кислоты представляет собой композицию, применяемую для приведения нуклеиновой кислоты в контакт с клеткой, в которую предполагается доставить нуклеиновую кислоту, с целью введения содержащейся в композиции нуклеиновой кислоты в клетку.
Состав носителя для доставки нуклеиновой кислоты
Состав носителя для доставки нуклеиновой кислоты, применяемого в композиции для доставки нуклеиновой кислоты по настоящему изобретению, не имеет ограничений, при условии, что он способен вводить нуклеиновую кислоту в клетку. Примеры применимых носителей для доставки нуклеиновых кислот включают известные носители, например Lipofectamine™ 2000 и т.п.
С точки зрения дальнейшего улучшения внутриклеточной устойчивости нуклеиновой кислоты, содержащейся в комплексе нуклеиновой кислоты, и дополнительного улучшения эффективности и безопасности внутриклеточной доставки предпочтительно применять, например, носитель, включающий (A) диацилфосфатидилхолин, (B) холестерин и/или его производное и (C) первичный алифатический амин (далее по тексту именуемый «носитель 1»).
На диацилфосфатидилхолин (далее по тексту иногда именуемый «Компонент (A)»), применяемый в носителе 1, не накладывается никаких ограничений, если он является фармакологически приемлемым, и он может представлять собой, например, диацилфосфатидилхолин, в котором ацильный фрагмент содержит от 4 до 23 атомов углерода. Число атомов углерода в двух ацильных группах, входящих в диацилфосфатидилхолин, может быть одинаковым или различным.
Конкретные примеры диацилфосфатидилхолинов включают дилауроилфосфатидилхолин, димиристоилфосфатидилхолин, дипальмитоилфосфатидилхолин, дистеароилфосфатидилхолин, диолеоилфосфатидилхолин, дилинолеоилфосфатидилхолин, миристоилпальмитоилфосфатидилхолин, миристоилстеароилфосфатидилхолин, пальмитоилстеароилфосфатидилхолин, дибутилоилфосфатидилхолин, дигексаноилфосфатидилхолин, дигептаноилфосфатидилхолин, дидеканоилфосфатидилхолин, дифтаноилфосфатидилхолин, дидодецилфосфатидилхолин, диэйкозаноилфосфатидилхолин, дигенэйкозаноилфосфатидилхолин, диэрукоилфосфатидилхолин, диарахидоноилфосфатидилхолин, бис(трикозадиноил)фосфатидилхолин и т.д. Предпочтительные примеры из числа перечисленных соединений включают диацилфосфатидилхолины, в которых ацильный фрагмент включает от 12 до 18 атомов углерода; более предпочтительные примеры включают димиристоилфосфатидилхолин, дипальмитоилфосфатидилхолин, дистеароилфосфатидилхолин, миристоилпальмитоилфосфатидилхолин, миристоилстеароилфосфатидилхолин, пальмитоилстеароилфосфатидилхолин и подобные диацилфосфатидилхолины, в которых ацильный фрагмент включает от 13 до 17 атомов углерода; особенно предпочтительные примеры включают димиристоилфосфатидилхолин, дипальмитоилфосфатидилхолин и дистеароилфосфатидилхолин; и наиболее предпочтительным примером является дистеароилфосфатидилхолин. Перечисленные диацилфосфатидилхолины могут применяться по отдельности или в комбинации из двух или нескольких соединений.
Выбор холестерина и/или его производного (далее по тексту иногда именуемому «компонентом B»), применяемого в носителе 1, не ограничен, в случае если они являются фармакологически приемлемыми. Производными холестерина являются катионные липиды со скелетом холестерина, и их конкретные примеры включают 3β-[N-(N',N'-диметиламиноэтан)-карбамоил]холестерин (DC-Chol), 3β-[N',N',N'-триметиламиноэтан]холестерина йодид (TC-Chol), бис(гуанидиний)-трен-холестерин (BGTC), N-холестерилоксикарбонил-3,7-диазанонан-1,9-диамин, β-аланин-диэтаноламин-холестерин, N4-спермин холестерил карбамат (GL-67), N[N4-3-аминопропилспермидин]холестерил карбамат (GL-78), N4-спермин холестерил карбоксамид (GL-90), N1,N8-бис(аргинин карбоксамид)-N4-спермидин холестерил карбамат (GL-95) и N-[N1,N4,N8-трис(3-аминопропил)спермидин]холестерил карбамат (GL-96). Предпочтительные примеры компонента (B) включают холестерин. В носителе 1 холестерин и его производные могут применяться в качестве компонента (B) по отдельности или в виде комбинации из двух или более соединений.
Выбор первичного алифатического амина (далее по тексту иногда называемого «компонентом (C)»), применяемого в носителе 1, не ограничен, в случае если он является фармакологически приемлемым, и этот амин может представлять собой, например, алкиламин, в котором алкильный фрагмент включает от 10 до 20 атомов углерода.
Конкретные примеры первичных алифатических аминов включают лауриламин, миристиламин, пальмитиламин, стеариламин, олеиламин, деканоиламин, фтаноиламин и т.д. Среди перечисленных предпочтительными являются алкиламины, в которых алкильный фрагмент включает от 12 до 18 атомов углерода; более предпочтительными являются стеариламин, олеиламин и пальмитоиламин; и особенно предпочтительным является стеариламин. Эти первичные алифатические амины могут применяться по отдельности или в комбинации из двух или более соединений.
Носитель 1 включает комбинацию компонентов (A)-(C), описанных выше. Для дальнейшего улучшения эффективности внутриклеточной доставки нуклеиновой кислоты и дальнейшего снижения токсичности предпочтительными являются следующие комбинации:
(A) диацилфосфатидилхолин, в котором ацильный фрагмент содержит от 4 до 23 атомов углерода, (B) холестерин и/или его производное и (C) C10-20 алкиламин; и более предпочтительно (A) димиристоилфосфатидилхолин, дипальмитоилфосфатидилхолин и/или дистеароилфосфатидилхолин, (B) холестерин и (C) стеариламин.
В носителе 1 соотношение компонентов (A)-(C) не ограничивается, и, например, мольное соотношение компонентов (A):(B):(C) может составлять 5-9:1-5:1, предпочтительно 6-9:1-4:1 и более предпочтительно 7-8:2-3:1. Соответствие этим соотношениям делает возможным добиться внутриклеточной доставки нуклеиновой кислоты с наиболее высокой эффективностью и меньшей токсичностью.
Общее количество компонентов (A)-(C) по отношению к общей массе носителя 1 составляет, например, от 1 до 100 мас.%, предпочтительно от 20 до 90 мас.% и более предпочтительно от 30 до 70 мас.%.
Помимо компонентов (A)-(C), носитель 1 может содержать другие катионные липиды. Конкретные примеры применимых катионных липидов включают скваламин, 3a,7a,12a-трис(3-аминопропокси)-5β-холан-24-(N,N-бис(3-аминопропил)амин), 3a,7a,12a-трис(3-аминопропокси)-5β-холан-24-(N-(N-(3-аминопропил))-3-аминопропил)амин, 3a,7a,12a-трис(3-азидопропокси)-5β-холан-24-(N,N-бис(2-цианоэтил)амин), 3a,7a,12a-трис(3-азидопропокси)-5β-холан-24-(N-(бензилоксикарбонил)-N-(3-гидроксипропил)амин) и подобные катионные липиды, с которыми связаны стероиды; «молекулярные зонтики», являющиеся конъюгатами спермина, и подобные катионные липиды, с которыми связана холевая кислота; катионные липиды, с которыми связан гликозид стерина; катионные липиды, с которыми связан стероид сапонин; диметилдиоктадециламмония бромид (DDAB), 1,2-димиристоил-3-триметиламмоний пропан, 1,2-диолеоил-3-триметиламмоний пропан (DOTAP), 1,2-диолеоил-3-триметиламмоний пропан метилсульфат, 1,2-дипальмитоил-3-триметиламмоний пропан, 1,2-дистеароил-3-триметиламмоний пропан, N-(1-(2,3-бис(олеоилокси)пропил)-N,N,N-триметиламмония гидрохлорид (DOTMA), соль димиристоилоксипропил диметилгидроксиэтиламмония бромид (DMRIE), диолеоилоксипропил диметилгидроксиэтиламмония бромид (DORIE), диметилдидодециламмония бромид, N-(a-триметиламмонийацетил)додецил-D-глутамина гидрохлорид, N-(a-триметиламмонийацетил)-O,O'-бис-(1H,1H,2H,2H-перфтордецил)-L-глутамина гидрохлорид, O,O'-дидодеканоил-N-(a-триметиламмонийацетил)диэтаноламина гидрохлорид, метилаллил дидодецил аммония бромид, N-{p-(w-триметиламмонийбутилокси)бензоил}дидодецил-L-глутамина гидрохлорид, 9-(w-триметиламмонийбутил)-3,6-бис(додеканоил)карбазола бромид, диметилдиоктадецил аммония гидрохлорид, N-w-триметиламмонийдеканоил-дигексадецил-D-глутамина бромид, N-{p-(w-триметиламмонийгексилокси)бензоил}дитетрадецил-L-глутамина бромид, p-(w-триметиламмонийдецилокси)-p'-октилоксиазобензола бромид (MC-1-0810), p-{w-(b-гидроксиэтил)диметиламмонийдецилокси}-p'-октилоксиазобензола бромид (MC-3-0810), O,O',O''-тридодеканоил-N-(w-триметиламмонийдодеканоил)-трис(гидроксиметил)аминометана бромид (TC-1-12), 1,2-дилаурил-глицеро-3-этилфосфохолин, 1,2-димиристоил-глицеро-3-этилфосфохолин, 1,2-дипальмитоил-глицеро-3-этилфосфохолин, 1,2-дистеароил-глицеро-3-этилфосфохолин, 1,2-диолеоил-глицеро-3-этилфосфохолин, 1-пальмитоил-2-олеоил-глицеро-3-этилфосфохолин и подобные катионные липиды, включающие четвертичные аммониевые соли.
Если носитель 1 содержит катионный липид, отличающийся от компонентов (A)-(C), доля этого катионного липида не ограничена, до тех пор пока не нарушается эффект от настоящего изобретения, и эта доля может составлять, например, от 1 до 10 частей по массе, предпочтительно от 2 до 8 частей по массе и более предпочтительно от 4 до 6 частей по массе, на 100 частей по массе компонентов (A)-(C) в совокупности.
Далее, носитель 1 может при необходимости включать масляную основу. Добавление масляной основы позволяет использовать ее способность регулировать эффективность введения нуклеиновой кислоты при участии носителя 1. Например, если масляную основу добавляют для того, чтобы отрегулировать удельный вес носителя 1, можно управлять контактом клетки с носителем 1, тем самым улучшая эффективность введения in vitro. Далее, например, если добавляют масляный носитель с функцией температурной чувствительности, ядро носителя, содержащее нуклеиновую кислоту, может разрушиться в заранее определенных температурных условиях, вызвав неоднородности на клеточной поверхности и улучшив, тем самым эффективность введения нуклеиновой кислоты. Кроме того, например, если добавлена масляная основа, которая обладает способностью разрушаться при внешних воздействиях, ядро носителя 1 может быть разрушено этими внешними воздействиями, вызвав появление неоднородностей на клеточной поверхности, что улучшает эффективность введения нуклеиновой кислоты.
Примеры масляных основ, которые могут быть добавлены к носителю 1, включают перфторуглерод, перфторпентан, перфтороктил бромид, перфторгексан, перфтортрибутиламин, соевое масло, рафинированное соевое масло, гидрированное соевое масло, неомыленное соевое масло, сквален, касторовое масло, гвоздичное масло, сорбитана триолеат, терпентиновое масло, сафлоровое масло, жирные кислоты сафлорового масла, олеиновую кислоту, пальмовое масло, рапсовое масло, сивушное масло, оливковое масло, льняное масло, кунжутное масло, хлорофилльное масло, кротоновое масло, масло бергамота, кедровое масло, апельсиновое масло, фенхелевое масло, эвкалиптовое масло, кукурузное масло, лавандовое масло, майорановое масло, лимонное масло, хлопковое масло, кокосовое масло, масло яичных желтков, розовое масло, хвойное масло, миндальное масло, арахисовое масло, масло камелии, очищенное камфорное масло, масло ромашки обыкновенной, коричное масло, масло мяты перечной, этерифицированное кукурузное масло, имбирное масло, масло римской ромашки, масло горца змеиного, масло мяты кудрявой, подсолнечное масло, какао-масло, масло проростков пшеницы, масло с оксидом цинка, гидрированные масла, гидрированные растительные масла, легкий жидкий парафин, жидкий парафин, триглицериды жирных кислот со средней длиной цепи, молочный жир, горькое апельсиновое масло, полиоксиэтилен касторовое масло, полиоксиэтилен гидрированное касторовое масло 10, полиоксиэтилен гидрированное касторовое масло 100, полиоксиэтилен гидрированное касторовое масло 20, полиоксиэтилен гидрированное касторовое масло 40, полиоксиэтилен гидрированное касторовое масло 5, полиоксиэтилен гидрированное касторовое масло 50, полиоксиэтилен гидрированное кастровое масло 60, полиоксил 35 касторовое масло, технологические масла и т.д. Среди перечисленных масляных основ перфторпентан является чувствительным к температуре и имеет свойство закипать при температуре 29,5°C, превращаясь в газ. Кроме того, перфторгексан, перфтороктилбромид и перфтортрибутиламин обладают способностью разрушаться при внешних воздействиях и имеют свойство вызывать образование пор в ядре носителя 1 и разрушать его при получении внешнего сигнала, а именно ультразвукового воздействия.
Если масляная основа включена в состав носителя, ее доля не ограничена до тех пор пока это не препятствует получению эффекта настоящего изобретения, и эта доля может составлять, например, от 0,1 до 50 частей по массе, предпочтительно от 1 до 30 частей по массе и более предпочтительно от 5 до 20 частей по массе на 100 частей совокупной массы компонентов (A)-(C).
Далее, носитель 1 при необходимости может включать мембранно-фузогенный липид (вспомогательный липид). При наличии мембранно-фузогенного липида эффективность внутриклеточной доставки с участием носителя 1 дополнительно улучшается. Примеры таких мембранно-фузогенных липидов включают диолеоилфосфатидилэтаноламин, диолеоилфосфатидилхолин, трансфосфатидилфосфатидилэтаноламин, 1,2-бис-(10,12-трикозадиноил)фосфоэтаноламин, 1,2-диэлаидоилфосфоэтаноламин, 1,2-дигексадецилфосфоэтаноламин, 1,2-дигексаноилфосфоэтаноламин, 1,2-дилауроилфосфоэтаноламин, 1,2-дилинолеоилфосфоэтаноламин, 1,2-димиристоилфосфоэтаноламин, 1,2-диолеоилфосфоэтаноламин, 1,2-дипальмитолеоилфосфоэтаноламин, 1,2-дипальмитоилфосфоэтаноламин, 1,2-дифитаноилфосфоэтаноламин, 1,2-дистеароилфосфоэтаноламин, 1-пальмитоил-2-олеоилфосфоэтаноламин, 1-пальмитоил-2-(10,12-трикозадиноил)фосфоэтаноламин, 1,2-диолеоилфосфоэтаноламин-N-капроиламин, 1,2-дипальмитоилфосфоэтаноламин-N-капроиламин, 1,2-диолеоилфосфоэтаноламин-N,N-диметил, 1,2-дипальмитоилфосфоэтаноламин-N,N-диметил, 1,2-дипальмитоилфосфоэтаноламин-N-додеканоил, 1,2-диолеоилфосфоэтаноламин-N-додеканоил, 1,2-диолеоилфосфоэтаноламин-N-додеканиламин, 1,2-дипальмитоилфосфоэтаноламин-N-додеканиламин, 1,2-диолеоилфосфоэтаноламин-N-глутарил, 1,2-дипальмитоилфосфоэтаноламин-N-глутарил, 1,2-диолеоилфосфоэтаноламин-N-лактозу, 1,2-диолеоилфосфоэтаноламин-N-[4-(p-малеимидметил)циклогексанкарбоксилат], дипальмитоилфосфоэтаноламин-N-[4-(p-малеимидметил)циклогексанкарбоксилат], 1,2-дипальмитоилфосфоэтаноламин-N-[4-(p-малеимидфенил)бутиламид], 1,2-диолеоилфосфоэтаноламин-N-[4-(p-малеимидфенил)бутират], 1,2-диолеоилфосфоэтаноламин-N-метил, дипальмитоилфосфоэтаноламин-N-метил, 1,2-диолеоилфосфоэтаноламин-N-[3-(2-пиридилдитио)пропионат], 1,2-дипальмитоилфосфоэтаноламин-N-[3-(2-пиридилдитио)пропионат], 1,2-диолеоилфосфоэтаноламин-N-(сукцинил), 1,2-дипальмитоилфосфоэтаноламин-N-(сукцинил) и т.д. Среди перечисленных липидов в носителе 1 может преимущественно применяться диолеоилфосфатидилэтаноламин.
Если указанный мембранно-фузогенный липид включен в состав носителя 1, его доля не ограничена до тех пор, пока это не препятствует получению эффекта настоящего изобретения, и эта доля может составлять, например, от 1 до 500 частей по массе, предпочтительно от 10 до 250 частей по массе и более предпочтительно от 25 до 100 частей по массе на 100 частей совокупной массы компонентов (A)-(C).
Носитель 1 может содержать различные добавки, например средства для придания изотоничности, наполнители, разбавители, загустители, стабилизаторы, буферы, консерванты и т.д.; и/или водные носители, например очищенную воду, растворы сахара в воде, буферные растворы, физиологический солевой раствор, водные растворы полимеров, воду, не содержащую РНКазу, и т.д.; в соответствии с формой применения. Количества таких добавок и водных носителей могут быть выбраны надлежащим образом в зависимости от формы применения носителя для доставки нуклеиновых кислот.
Форма носителя для доставки нуклеиновой кислоты
Форма носителя для доставки нуклеиновой кислоты не ограничена, если только в этот носитель может быть инкапсулирована нуклеиновая кислота, которую предполагается доставить в клетку, но предпочтительно носитель имеет форму липосомы. Например, если носитель 1 имеет форму липосомы, компоненты (A)-(C) и другие необязательно применяемые липиды образуют оболочку липосомы.
Если носитель для доставки нуклеиновой кислоты имеет форму липосомы, он может представлять собой малую однослойную везикулу (SUV), большую однослойную везикулу (LUV) или многослойную везикулу (MLV). Диаметр частицы носителя для доставки нуклеиновой кислоты может быть выбран в соответствии с типом клетки, в которую доставляют нуклеиновую кислоту, и может составлять, например, от примерно 20 нм до примерно 100 нм для SUV, от примерно 200 нм до примерно 1000 нм для LUV и от примерно 400 нм до примерно 3500 нм для MLV. Диаметр липосом измеряют с применением методики динамического рассеяния лазерного излучения.
Для получения липосом и регулирования их диаметра можно применять способы, известные в технике. Например, в случае носителя 1, липосомы могут быть получены способом тонкой пленки, способом выпаривания в обращенной фазе, способом впрыскивания раствора в эфире, способом удаления ПАВ и нагреванием или подобными способами, с применением масляной фазы, содержащей компоненты (A)-(C) и водной фазы (водного носителя). Диаметр част