Композиция штаммов рода lactobacillus для производства лекарственного средства
Иллюстрации
Показать всеИзобретение относится к биотехнологии и может быть использовано при производстве препарата для эффективного восстановления биологического равновесия вагинальной микрофлоры. Композиция содержит штаммы Lactobacillus fermentum 57A, депонированный под номером В/00007, Lactobacillus plantarum 57B, депонированный под номером В/00008, и Lactobacillus gasseri 57C, депонированный под номером В/00007, в соотношении 0,5:0,5:1. Применение данной композиции обеспечивает восстановление нарушенного равновесия вагинальной микрофлоры женщины, приводит к снижению риска бактериального вагиноза, оказывает иммуномодулирующий эффект. 3 з.п. ф-лы, 8 табл., 4 ил.
Реферат
Предметом изобретения является композиция штаммов рода Lactobacillus и применение композиции штаммов рода Lactobacillus с целью создания фармацевтического препарата.
Состав микрофлоры влагалища дифференцируется по отдельным периодам жизни женщины и впрямую зависит от гормональной активности. Основную информацию об экосистеме влагалища принесли исследования Cruickshank и Sherman, которые описали микрофлору влагалища у плода в полости матки, новорожденных, девочек перед половым созреванием, женщин в генеративный период и после менопаузы. В полости матки влагалище плода бесплодно, но в первые 2-3 недели после рождения количественный состав микрофлоры приближен к количественному составу микрофлоры влагалища взрослой женщины: это результат эстрогенной стимуляции матери. Перед появлением первой менструации в среде влагалища доминируют такие бактерии, как S. epidermidis, Bacteroides spp., Peptococcus spp., Porphyromonas spp., G. vaginalis. В репродуктивный период среда влагалища в главной степени населена бактериями рода Lactobacillus. Раньше считали, что род этот представлен одним лишь видом, т.е. Lactobacillus acidophilus. В последние десятилетия развитие современных молекулярных методов дало возможность классифицировать большинство бактерий, благодаря чему оказалось, что род Lactobacillus acidophilus неоднороден и составляет комплекс нескольких видов, таких как: L. crispatus, L. amylovorus, L. gallinarum, L. acidophilus sensu stricto, L. gasseri, L. johnsoni. Применяя современные молекулярные методы, в том числе методы секвенирования ДНК, а также улучшенные процедуры разведения, доказали, что виды, которые встречаются чаще остальных в правильной среде влагалища у здоровых женщин, это виды из комплекса acidophilus, такие как L. johnsoni, L. gasseri, L. acidophilus, L. crispatus, и, кроме того, L. plantarum и L fermentum.
Механизмы действия бактерий рода Lactobacillus в среде влагалища еще не до конца изучены. Но повсеместно считается, что они:
- синтезируют противомикробные вещества, такие как молочную, уксусную и пироглутаминовую кислоты, снижая, таким образом, рН среду влагалища до уровня 3,7-4,6;
- синтезируют короткие пептиды и/или белки с более сложным строением, похожие на бактерицин, которые адгезируют к рецепторам на поверхности чувствительных бактерий, приводя их к лизису, а впоследствии - к смерти бактерии,
- обладают способностью соперничать с другими микроорганизмами, главным образом болезнетворными, за доступ к питательным компонентам и рецепторам на эпителии влагалища,
- модифицируют токсины и рецепторы для них,
- производят перекись водорода - некоторые виды Lactobacillus, производящее Н2О2,
доминируют в культурах микробов здоровых влагалищ,
- оказывают разнородное влияние, иммуномодулируя иммунитет носителя.
Благодаря этим разнообразным особенностям, бактерии рода Lactobacillus удерживают некое состояние биологического равновесия влагалища, благодаря этому не допускают к размножению болезнетворных культур микроорганизмов, обитающих в женских родовых путях, что способствует снижению риска появления бактериального вагиноза.
Поскольку заражения мочеполовых путей у женщин в большой мере являются последствием нарушения равновесия микрофлоры влагалища, способы, как предупреждения, так и лечения, направлены на восстановление расстроенного равновесия.
В 1992 году в США было проведено исследование (Hilton Е. Isenberg HD., Alperstein P., France K., Borenstein MT. Ingestion of yogurt containing Lactobacillus acidophilus as prophylaxis for candidal vaginitis. Ann Intern. Med. 1992; 116; 353-357), заключающееся в том, что 35 пациенток с рецидивом кандидоза вульвы и влагалища ежедневно в течение 6-ти месяцев принимали йогурт с Lactobacillus acidophilus с целью предупреждения рецидива болезни. Конечным пунктом исследования была колонизация влагалища и анального отверстия Candida и Lactobacillus, а также кандидоз. Исследование окончило 13 больных, но анализ был сделан для 33. Было констатировано существенное снижение числа заражений Candida в течение 6 месяцев у пациенток, зараженных Candida (в анальном отверстии и влагалище). Исследование проводили с применением обыкновенного йогурта, который содержал L. acidophilus, синтезирующий средние количества Н2О2. Не были идентифицированы штаммы L. acidophilus, изолируемые от женщин. Группа женщин также была минимальной. Зато была определена точная зависимость между присутствием L. acidophilus в анальном отверстии и во влагалище: если в анальном отверстии не было L. acidophilus, вероятность его присутствия во влагалище равнялась 15,5%, если же L. acidophilus был в анальном отверстии, вероятность, что будет во влагалище, составляла 54,8% (P<0,001). Авторы констатировали, что кишечный штамм L. acidophilus колонизировал влагалище, но при недостатке молекулярных доказательств это невозможно доказать.
Похожее исследование было проведено в 1996 году в Израиле (Shaley Е., Battino S., Weiner Е., Colodner R., Keness Y. Ingestion of yogurt containing Lactobacillus acidophilus compared with pasteurized. Yogurt as prophylaxis for recurrent candidal vaginitis and bacterial vaginosis. Arch. Fam. Med. 1996; 5: 593-596) на основании того же протокола и с применением йогурта, содержащего L. Acidophilus, производящий Н2O2. В этих исследованиях не было отмечено профилактическое действие в отношении рецидивов кандидамикоза влагалища (такой же эффект показал йогурт с мертвыми бактериями), только в отношении бактериального вагиноза, одновременно с увеличением числа женщин, колонизированных L. acidophilus. Зато определено сосуществование колонизации Candida анального отверстия и влагалища.
В 2001 году в Финляндии было проведено (Kontiokari Т., Sundqvist К., Nuutinen М., Pokka Т., Koskela М., Uhari М. Randomised trial of cranberry-lingonberry juice and Lactobacillus GG drink for the prevention of urinary tract infections in women. Brit. Med. J. 2001; 322: 1571-1573) открытое рандомизированное исследование возможности предупреждения рецидива воспаления мочевых путей у женщин с применением сока из клюквы и брусники или напитка с Lactobacillus GG. Исследование длилось 12 месяцев и заключалось в наблюдении рецидива воспаления у 150 женщин, разделенных на 3 группы, у которых раньше врачи констатировали факт заражения мочевых путей (>105 бактерий/мл мочи). Конечным параметром было появление рецидива воспаления. Не определено эффекта действия Lactobacillus GG по сравнению с соком из клюквы/брусники. Возможно, что Lactobacillus GG, как типичный кишечный штамм, не колонизировал устья уретры/влагалища.
В 2003 году (Reid О., Charbonneau D., Erb J., Kochanowski В., Beuerman D., Poehner R., Bruce AW. Oral use of Lactobacillus rhamnosus GR-1 and L. fermentum RC-14 signficantly alters vaginal flora: randomized, placebo-controlled trial in 64 healthy women. FEMS Immunol Med. Microbiol. 2003; 35: 131-134) были проведены - с применением плацебо-рандомизированные клинические исследования влияния Lactobacillus rhamnosus GR-1 и L. fermentum RC-14, принимаемых перорально в течение 60 дней, на влагалищную флору у 64 здоровых женщин. Микроскопный анализ показал возвращение к нормальной флоре у 37% женщин из исследуемой группы по сравнению с 13% женщин из контрольной группы. Выращивание дало четкую картину существенного увеличения числа Lactobacillus и снижения числа дрожжей и кишечных палочек. Пробиотик был безопасен при ежедневном употреблении.
В 2004 году эти же авторы провели следующее исследование с применением этих же штаммов (Reid G., Burton J., Hammond JA., Bruce AW. Nucleic acid-based diagnosis of bacterial vaginosis and improved management using probiotic lactobacilli. J. Med. Food 2004; 7: 223-228) у 59 женщин с бессимптомным бактериальным вагинозом, который был диагнозирован при помощи DGGE. Отмечено возвращение микрофлоры влагалища, подавленной присутствием Lactobacillus, по истечении 2 месяцев от применения пробиотика.
Переход (cross-colonisation) бактерий из анального отверстия во влагалище касается также таких патогенов, как Streptococcus agalactiae, уропатогенные штаммы Escherichia coli или Staphylococcus aureus. В недавно опубликованной статье (Warner JE., Onderdonk АВ. Diversity of toxic shock syndrome toxin l-positive Staphylococcus aureus isolates. Apel. Environ Microbiol. 2004; 70: 6931-6935) показано при помощи метода PFGE идентичные штаммы S. aureus, присутствующие в обоих местах у 59% исследуемых женщин.
Необходимо обратить внимание на то, что в научной литературе нет доказательств на переход или перекрестную колонизацию анального отверстия и влагалища штаммами Lactobacillus. Возможно, препятствовал этому недостаток соответствующих молекулярных методов. Кроме того, применение Lactobacillus в виде молочных продуктов невозможно у всех пациентов по диетическим причинам. Описываемые штаммы Lactobacillus, применяемые перорально, проявляли недостаточную жизнеспособность в пищеводе и требовали защиты в виде специальных капсул.
По польскому патентному номеру 189577 известно применение соединения бактерий молочной кислоты вида Lactobacillus brevis и Lactobacillus salivarius, подвид salicinius, для создания фармацевтической композиции, применяемой при внутривлагалищном лечении вагиноза и воспаления влагалища. Данный патент описывает также фармацевтическую композицию соединения бактерий молочной кислоты вида Lactobacillus brevis и Lactobacillus salivarius, подвид salicinius. Исследования (Strus М., Podstawy stosowania probiotyków dopochwowych w zakażeniach narządu moczowo-płciowego, Zakażenia, 2005, 4, 40-43 Струс М. Основания применения влагалищных пробиотиков в заражениях мочеполовых органов/ Заражения, 2005, 4, 40-43) показывают, что в микрофлоре влагалища у здоровых женщин часто Lactobacillus присутствует в нескольких видах. Чаще всего можно выделить штаммы, принадлежащие к комплексу L. acidophilus, и, кроме того, виды: L. fermentum и L. plantarum. Примененные по патентному номеру 189577 штаммы, однако, не типичны для польских женщин. Также способ применения (внутривлагалищный) неудобный в ежедневном применении.
По польскому патенту Р-373518 известны новые штаммы: Lactobacillus fermentum 57А, депонированный под номером В/00007, Lactobacillus plantarum 57В, депонированный под номером В/00008, Lactobacillus gasseri 57С, депонированный под номером В/00009, Lactobacillus plantarum 78В, депонированный под номером В/00010.
Предметом изобретения является также композиция новых штаммов рода Lactobacillus, в том числе штаммы Lactobacillus fermentum 57А, Lactobacillus plantarum 57B, Lactobacillus gasseri SIC, относительные количества которых определяет пропорция 0,5:0,5:1.
Вышеуказанные штаммы были получены из заднего свода влагалища здоровой женщины, с нормальной флорой влагалища. Исследования доказывают, что штаммы Lactobacillus plantarum 57B, Lactobacillus fermentum 57А и Lactobacillus gasseri 57С исполняют все требования для пробиотических продуктов. На основании проведенных тестов можно констатировать, что новые штаммы более полезны по сравнению с другими исследованными штаммами. Дополнительно, каждый из отобранных и депонированных штаммов имеет сильную ведущую черту. Штамм Lactobacillus plantarum 57B характеризуется сильными антагонистическими свойствами, особенно к патогенам, таким как Gardnerella vaginalis и Escherichia coli, Lactobacillus fermentum 57A очень хорошо прилегает к клеткам организма носителя, a Lactobacillus gasseri 57С синтезирует большое количество перекиси водорода.
Целью изобретения была разработка композиций штаммов рода Lactobacillus, находящих применение в эффективном восстановлении соответствующей бактериальной флоры влагалища в удобной для приема форме.
Изобретение состоит в композиции штаммов рода Lactobacillus и ее применении. Композиция, в состав которой входят штаммы Lactobacillus fermentum 57A, Lactobacillus plantarum 57B и Lactobacillus gasseri 57С, обладает особенными свойствами, такими как сильное дифференцирование в сфере сродства к эпителию пищевода и к эпителию влагалища, дающее возможность колонизации влагалища и анального отверстия впоследствии перехода через кишечник, и коагрегация, дающая возможность синергического содействия компонентов. Композиция соединяется с произвольным, фармацевтически допускаемым носителем и/или вспомогательными веществами. Композиция применяется перорально. Композиция имеет вид капсулы.
Применение композиции новых штаммов рода Lactobacillus, содержащей Lactobacillus fermentum 57A, Lactobacillus plantarum 57B и Lactobacillus gasseri 57С, отличающихся различными свойствами, такими как: сильное сродство с эпителием пищевода и эпителием влагалища, дающее возможность колонизации влагалища и анального отверстия впоследствии перехода через кишечник, и коагрегация, дающая возможность синергического содействия компонентов, для изготовления фармацевтического препарата для перорального применения с целью восстановления соответствующей бактериальной флоры влагалища и анального отверстия.
Применение композиции заключается в приготовлении порции фармацевтического препарата в виде капсулы, состоящего из лиофилизата штаммов бактерий Lactobacillus fermentum 57А, Lactobacillus plantarum 57B и Lactobacillus gasseri 57C и фармацевтически допустимого носителя и/или дополнительных веществ.
Неожиданно было констатировано, что композиция штаммов рода Lactobacillus обладает уникальной способностью одновременной колонизации влагалища и анального отверстия. Примененные в композиции штаммы рода Lactobacillus не подвергаются внешнему влиянию при переходе через пищевод; в этом случае композицию можно принимать перорально.
Неожиданно было констатировано, что штаммы рода Lactobacillus, входящие в состав композиции, обладают уникальным свойством взаимной коагрегации.
Штамм Lactobacillus fermentum 57А проявляет очень хорошее сродство с кишечным эпителием и обладает способностью прилегания к этому эпителию, создавая условия для его колонизации. Так как штамм Lactobacillus gasseri 57С проявляет очень хорошее сродство с эпителием влагалища и не обладает сильной чертой сродства с кишечным эпителием, он не сумел бы самостоятельно колонизировать кишечник. Явление коагрегации с остальными штаммами дает ему возможность косвенно участвовать в колонизации кишечного эпителия, и, следовательно, анального отверстия. Таким образом, в пищеводе возникают многочисленные популяции Lactobacillus gasseri, которые могут перейти на эпителий влагалища, который является натуральной средой для этого вида и к которому он проявляет большую степень сродства. Следовательно, благодаря коагрегации, облегченный переход Lactobacillus gasseri 57С и остальных двух штаммов в экосистему влагалища провоцирует быструю колонизацию эпителия влагалища.
I. Исследования стойкости композиции, содержащей штаммы Lactobacillus на условия в пищеводе.
1. Живучесть штаммов Lactobacillus при низком рН, соответствующим pH желудочного сока.
Живучесть штаммов Lactobacillus при низком pH определили путем применения модифицированной методики Lankaputra и Shah (1995). Исследуемые штаммы Lactobacillus fermentum 57А, Lactobacillus plantarum 57B, Lactobacillus gasseri 57C размножали в жидкой питательной среде MRS. Выращивание культуры проводили в бескислородных условиях при температуре 37°С в течение 24 часов. По истечении этого времени, методом серийных разбавок определили полученную концентрацию отдельных штаммов бактерий. Затем, с помощью 1N HCL, уровень pH рабочей среды снижали до величины 1,2, равной уровню pH желудочного сока. В дальнейшем, культуру инкубировали в течение 20 минут в бескислородных условиях при температуре 37°С, а затем посеяли с целью определения степени уменьшения исследуемых популяций бактерий, подверженных влиянию низкого pH.
Результаты указаны в таблице № 1.
| Таблица 1 | ||
| Стойкость штаммов Lactobacillus при низком pH. | ||
| Концентрация бактерий в КОЕ/1 мл | ||
| Исследуемый штамм | Исходная концентрация | Концентрация по истечении 20 мин при pH 1,2 |
| L fermentum 57А | 2×108 | 1×108 |
| Lactobacillus plantarum 57В | 1×109 | 2,2×107 |
| Lactobacillus gasseri 57С | 2,5×108 | 3×1088 |
| Контрольная культура L. rhamnosus GG | 1×108 | 1×107 |
2. Живучесть штаммов Lactobacillus в искусственном желудочном соке.
Живучесть штаммов Lactobacillus в искусственном желудочном соке определили путем применения модифицированной методики Pedersen & со. (2004). Исследуемые штаммы Lactobacillus fermentum 57A, Lactobacillus plantarum 57B, Lactobacillus gasseri 57C размножали в жидкой питательной среде MRS. Выращивание культуры проводили в бескислородных условиях, при температуре 37°С в течение 24 часов. Затем переносили по 100 мкл каждого штамма с концентрацией порядка 108-109 КОЕ /1 мл в 10 мл искусственного желудочного сока (7 мл 36% HCL, 3,6 г пепсина [Difco], 2 г NaCL на 1 л дистиллированной воды) с pH 2,5, полученным при помощи 1N HCL. Определили исходную концентрацию разведения отдельных штаммов бактерий при помощи метода серийных разбавок. В дальнейшем, культуру инкубировали в течение 20 минут в бескислородных условиях при температуре 37°С, а затем посеяли с целью определения степени уменьшения исследуемых популяций бактерий, подверженных влиянию искусственного желудочного сока.
Результаты указаны в таблице №2.
| Таблица 2 | ||
| Живучесть штаммов Lactobacillus в искусственном желудочном соке с пепсином. | ||
| Концентрация бактерий в КОЕ/1 мл | ||
| Исследуемый штамм | Исходное время [примечание переводчика - вероятно должно быть: Исходная концентрация] | Концентрация по истечении 20 мин. при pH 1,2 |
| L. fermentum 57А | 1,3×107 | 8×106 |
| Lactobacillus plantarum 57В | 1,4×107 | 9,1×108 |
| Lactobacillus gasseri 57С | 2×106 | 9×105 |
| Контрольная культура L. rhamnosus GG | 6,9×107 | 2,5×107 |
3. Определение стойкости штаммов Lactobacillus к солям желчных кислот.
Для определения стойкости исследуемых штаммов Lactobacillus к солям желчных кислот использовали методику Dashkevicz & Feighner (1989). Эта методика заключалась в том, что в агар MRS [Oxoid] добавляли индикатор, изменяющий цвет - бромкрезоловый пурпур [РОСН] в количестве 0,17 г/л и соли желчных кислот [OXGAL фирмы Difco], в пяти разных концентрациях: 1 г/л, 2 г/л, 5 г/л, 1.0 г/л, 20 г/л. На приготовленные таким образом среды MRS засеяли методом редукции 10 мкл жидких, ранее приготовленных культур исследуемых штаммов Lactobacillus, которые инкубировали в стандартных бескислородных условиях в течение 48 часов. После окончания инкубации культуры штаммов, неподатливых на данную концентрацию солей желчных кислот, приобретали светло-желтый цвет; также питательная среда изменяла свой цвет с фиолетового на желтый. Интенсивность роста исследуемых штаммов и смены цвета питательной среды на желтый определили по полуколичественной шкале от - до +++.
Результаты указаны в таблице № 3.
| Таблица 3 | ||||
| Стойкость штаммов Lactobacillus к солям желчных кислот в концентрациях: 1, 2, 5, 10, 20 г/л. | ||||
| Концентрация солей желчных кислот | Lactobacillus fermentum 57А | Lactobacillus plantarum 57В | Lactobacillus gasseh 57C | Контрольная культура L. rhamnosus GG |
| 1 г/л | +++ | +++ | +++ | +++ |
| 2 г/л | +++ | +++ | + | +++ |
| 5 г/л | +++ | +++ | - | +++ |
| 10 г/л | +++ | +++ | - | +++ |
| 20 г/л | +++ | +++ | - | +++ |
4. Исследование адгерентных свойств штаммов 57А, 57B, 57С, а также смеси этих штаммов с линиями человеческих клеток кишечника СаСо2.
Тканевую культуру на линии CаСо2 проводили методом многократных пассажей в течение 20 дней до получения монолитного слоя (monolayer). Применяли среду DMEM (Dulbecco Minimal Essential Medium) (Gibco), обогащенную путем добавления 10% инактивированной, эмбриональной телячьей сыворотки. Кроме того, среда содержала 3 мМ/мл L-глютамина и антибиотики: 100 мкг/мл стрептомицина и 100 U/мл-1 пенициллина. Выращивание культуры проводили при температуре 37°С в атмосфере повышенной влажности, содержащей 10% СО2, дважды в неделю изменяя питательную среду.
Исследуемые штаммы Lactobacillus (каждый в отдельности, а затем в виде смеси) выращивали в течение 48 часов в 5 мл бульона MRS в инкубаторе, при температуре 37°С, в бескислородных условиях, а затем все вместе вращали на центрифуге (скорость 2 тыс. оборотов в течение 10 минут). Супернатант слили, а оставшиеся на дне пробирки бактерии заливали свежим MRS в количестве 1 мл и проверяли их концентрацию при помощи десятичных разбавлений, записывая результат при помощи КОЕ/мл. Исходная концентрация для клеток штамма 57А составляла 8×107, для штамма 57B - 2,5×108, для штамма 57С - 8×107, а для смеси - 2×109. Затем взяли 100 мкл исследуемых суспензий бактерий и добавили к 900 мкл питательной среды DMEM. Приготовленную таким образом смесь добавляли в ямки, содержащие клетки линии СаСo2. Клетки тканевой линии, вместе с исследуемыми штаммами, инкубировали при температуре 37°C, в атмосфере, обогащенной 10% СO2, в течение 30 минут. После инкубации клетки дважды промывали при помощи PBS для устранения не прицепленных бактерий, а затем фиксировали 3,7% формальдегидом при комнатной температуре в течение 1 часа. После фиксирования клетки вновь промывали при помощи PBS и красили кристаллическим фиолетовым ЧДА в течение 3 минут. Препарат оценивали под микроскопом при 1000-кратном увеличении. Посчитали клетки Lactobacillus и Bifidobacterium в 20 полях препарата, определяя среднее арифметическое значение из 20 полей. Интерпретацию полученных результатов провели по следующему шаблону:
Описание степени адгеренции тестируемых бактерий рода Lactobacillus в ткань кишечника СаСо2.
| Степень адгеренции | Число бактериальных клеток |
| +++ | Свыше 80 |
| II | Предел 60-80 |
| + | Предел 40-60 |
| - | Менее 40 |
| Таблица 4 | |
| Результаты адгеренции в ткань CaCo2 бактерий рода Lactobacillus 57A, 57B, 57C и смеси этих штаммов в присутствии контрольной культуры GG. | |
| Штамм | Ткань СаСo2** |
| Lactobacillus fermentum 57А | ++ |
| Lactobacillus plantarum 57B | - |
| Lactobacillus gasseh 57C | + |
| Смесь штаммов Lactobacillus 57А, 57B, 57С | ++ |
| Контрольная культура L rhamnosus GG | +++ |
Исследуемые штаммы L. fermentum 57А, L. plantarum 57B, L gasseri 57C проявили большую стойкость, как при низком pH (уровень pH схож с уровнем в желудочном соке), как и к искусственному желудочному соку, содержащему пепсин - энзим, присутствующий в желудочном соке.
В случае стойкости к солям желчных кислот штаммы L. fermentum 57A, L. plantarum 57B проявляют похожую, высокую стойкость к солям желчных кислот, в отличие от штамма L. gasseri 57С, который, уже при концентрации солей желчных кислот, равной 2 г/л, теряет свою жизнеспособность. Анализируя вышеуказанные результаты, можно предполагать, что штаммы L. fermentum 57A, L. plantarum 57B, L. gasseri 57С, без заметного уменьшения их числа, переживают неблагоприятные условия, господствующие в человеческом желудке. В случае действия солей желчных кислот штаммы L. fermentum 57А, L. plantarum 57B не должны в существенный способ изменить численность, только штамм L. gasseri 57С, проявляющий большую чувствительность к солям желчных кислот, может уменьшить свою численность в несколько логарифмов. Вышеуказанный анализ свидетельствует о возможности применения штаммов L. fermentum 57A, L. plantarum 57B, L. gasseri 57С, принимаемых перорально, для колонизации влагалища и анального отверстия. Исследуемые штаммы L. fermentum 57А, L. plantarum 57В. L. gasseri 57С проявили очень дифференцированную адгеренцию к линии кишечного СаСo2. Кажется, что только штамм L. fermentum 57А в состоянии адгериривать в эпителий человеческого кишечника, у остальных штаммов нет такой способности. Опираясь на эти результаты, можно предполагать, что концентрация Lactobacillus в конечном отрезке толстой кишки, по отношению к концентрации препарата, вводимого перорально, может снизиться в небольшой степени, не только по поводу действия желудочного сока, но также благодаря хорошим адгеренционным свойствам штамма L. fermentum 57А.
II. Показание свойств коагрегации штаммов Lactobacillus, входящих в состав композиции.
Выделенные штаммы Lactobacillus обладают уникальным свойством взаимной коагрегации, благодаря которому могут выступать в естественном комплексе (коагрегате), который является смесью 2 или 3 штаммов, объединенных вместе благодаря поверхностному воздействию. Такое сродство между натурально отобранными штаммами, заселяющими ту же экологическую нишу, ведет к взаимодействию в сфере захвата рецепторов на поверхности эпителия, антагонизму перед другими, часто патологическими компонентами микрофлоры, и лучшему использованию доступных источников энергии. Явление коагрегации указано на примере исполнения:
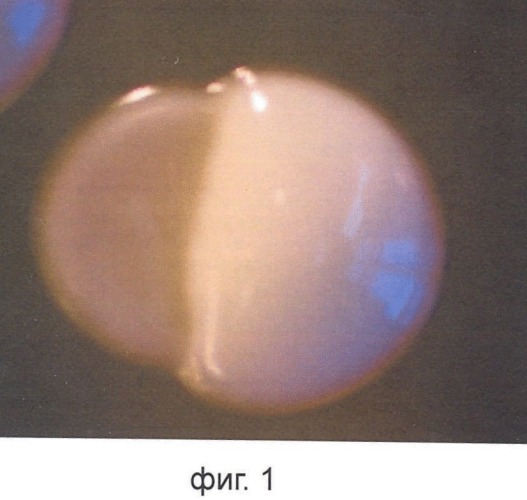
Фиг.1 представляет коагрегацию штаммов, входящих в состав композиции. Макроскопическая фотография колонии показывает присутствие двух морфологически разных составных одной колонии (слева - L. fermentum, справа - L. plantarum);
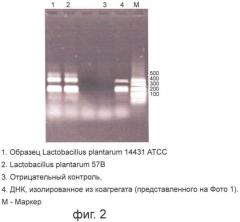
Фиг.2 представляет изображение полосок в электрофорезом геле после реакции PCR (ДНК, изолированное из коагрегата) со стартером для вида L. plantarum, подтверждающее присутствие штамма L. plantarum 57B в коагрегате, представленном на Фиг.1;
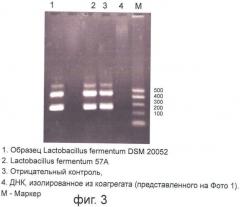
Фиг.3 представляет изображение полосок в электрофорезом геле после реакции PCR (ДНК, изолированное из коагрегата) со стартером для вида L. plantarum, подтверждающее присутствие штамма L. fermentum 57А в коагрегате, представленном на Фиг.1.
III. Способность к колонизации анального отверстия и влагалища.
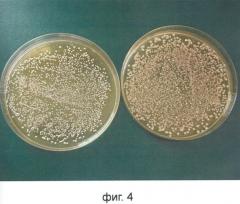
Композиция штаммов Lactobacillus обладает уникальной способностью колонизации пищевода и влагалища, являющуюся результатом неоднородности и содействия его отдельных компонентов. Это было ярко выражено в исследовании колонизации эпителия анального отверстия и влагалища методом in vivo во время клинических исследований - одни компоненты комплекса (Lactobacillus fermentum 57А и Lactobacillus plantarum 57B) при пероральном введении появляются в большом количестве на поверхности эпителия анального отверстия, другие (Lactobacillus gasseri 57С) - в большом количестве появляются на эпителии влагалища.
Фиг.4. Макроскопическая фотография иллюстрирует морфологически дифференцированные колонии, представляющие популяции Lactobacillus, заселяющие эпителий анального отверстия (левая фотография - доминирование L. plantarum 57В) и влагалища (правая фотография - доминирование L. gasseri 57С). Образец был получен от женщины, которая принимала композицию штаммов Lactobacillus в течение 21 дня.
Здесь мы видим дифференцированное сродство видов Lactobacillus к обоим местам в виде разницы в количествах отдельных колоний.
| Таблица 5 | ||
| Количество штаммов Lactobacillus в мазках из влагалища и анального отверстия пациентки, применяющей композицию по настоящему изобретению. | ||
| Количество колоний - влагалище | Количество колоний - анальное отверстие | |
| Lactobacillus gasseri 57С | 1×108 | 1×103 |
| Lactobacillus plantarum 57B | 3×104 | 1×105 |
Пример исполнения I.
Клиническое исследование пациентов.
Клинические исследования были проведены на группе 18 здоровых женщин, без клинических признаков воспаления половых путей, но с историей рецидивирующих воспалительных состояний влагалища. Исследования показали, что после перорального введения композиции штаммов Lactobacillus по настоящему изобретению:
1) снижается pH влагалища до 0,4,
2) снижается показатель по шкале Нугента на 2 единицы,
3) возрастает количество штаммов Lactobacillus на эпителии влагалища на два логарифма (log КОЕ/мл).
| Таблица 6 | ||||||||
| Влияние применения композиции штаммов Lactobacillus на pH влагалища | ||||||||
| № пациентки | Визит I | Визит III-10 | Визит IV-20 | Визит V-31 | Визит VI-50 | Визит VII-62 | Визит VIII-70 | |
| 1. | 7 | 5,5 | 5,2 | 5,5 | 5,5 | 5,2 | 5,2 | - |
| 2. | 9 | 4,9 | 4,9 | 4,9 | 5,5 | 4,9 | 4,9 | 4,6 |
| 3. | 27 | 4,9 | 4,6 | 4,4 | 4,2 | 4,4 | 4,6 | 4,6 |
| 4. | 29 | 5,5 | 4,6 | 4,6 | 4,2 | 4,2 | - | - |
| 5. | 5 | 4,6 | 4,6 | 4,9 | 4,9 | 4,6 | 4,6 | 4,2 |
| 6. | 6 | 4,6 | 4,6 | 5,2 | 5,5 | 5,2 | 4,6 | 4,4 |
| 7. | 1 | 5,5 | 5,2 | 5,5 | 4,9 | 4,9 | 4,6 | 5,5 |
| 8. | 25 | 4,0 | 4,2 | 4,4 | 4,0 | 4,2 | 4,0 | 5,2 |
| 9. | 10 | 4,9 | 5,2 | 4,6 | 4,6 | 4,6 | 4,9 | 4,4 |
| 10. | 8 | 5,2 | 5,5 | 4,9 | 4,9 | 4,6 | 4,4 | 4,4 |
| 11. | 11 | 4,4 | 4,9 | 4,0 | 4,2 | 4,2 | 4,2 | 4,4 |
| 12. | 16 | 4,4 | 4,9 | 4,6 | 4,6 | 4,4 | 4,2 | 4,6 |
| 13. | 13 | 4,9 | 5,5 | 4,9 | 4,9 | 4,9 | 4,2 | 4,4 |
| 14. | 12 | 4,6 | 4,6 | 4,9 | 4,9 | 4,6 | 4,6 | 4,6 |
| 15. | 19 | 5,5 | 5,5 | 5,2 | 5,5 | 4,9 | 4,9 | 4,9 |
| 16. | 14 | 5,5 | 4,9 | 4,9 | 4,9 | 4,9 | 4,6 | 4,4 |
| 17. | 21 | 4,9 | 4,6 | 4,6 | 4,9 | 4,9 | 4,4 | - |
| 18. | 23 | 5,5 | 5,5 | 4,4 | 4,9 | 4,4 | 4,6 | 4,6 |
| Среднее значение pН | 5,0 | 4,9 | 4,8 | 4,8 | 4,6 | 4,6 | 4,6 |
Описание:
- без визита
| Таблица 7 | ||||||||
| Влияние применения композиции штаммов Lactobacillus на показатель по шкале Нугента (0-3 нормальная флора, 4-6 сомнительный результат, 7-10 бактериальный вагиноз | ||||||||
| № пациентки | Визит I | Визит III-10 | Визит IV-20 | Визит V-31 | Визит VI-50 | Визит VII-62 | Визит VIII-70 | |
| 1. | 7 | 5 | 3 | 1 | 0 | 0 | 2 | - |
| 2. | 9 | 6 | 6 | 6 | 3 | 0 | 1 | 1 |
| 3. | 27 | 1 | 0 | 1 | 0 | 0 | 1 | 1 |
| 4. | 29 | 6 | 5 | 4 | 1 | 1 | - | - |
| 5. | 5 | 1 | 1 | 3 | 3 | 1 | 0 | 1 |
| 6. | 6 | 1 | 11 | 2 | 33 | 1 | 0 | 0 |
| 7. | 1 | 4 | 3 | 3 | 4 | 4 | 2 | 1 |
| 8. | 25 | 0 | 0 | 1 | 0 | 0 | 0 | 1 |
| 9. | 10 | 2 | 3 | 0 | 0 | 0 | 0 | 1 |
| 10. | 8 | 4 | 6 | 3 | 3 | 1 | 1 | 1 |
| 11. | 11 | 1 | 1 | 0 | 1 | 1 | 1 | 1 |
| 12. | 16 | 0 | 1 | 1 | 1 | 0 | 1 | 1 |
| 13. | 13 | 3 | 4 | 3 | 1 | 1 | 1 | 1 |
| 14. | 12 | 2 | 3 | 2 | 2 | 2 | 0 | 2 |
| 15. | 19 | 2 | 2 | 2 | 3 | 1 | 1 | 1 |
| 16. | 14 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| 17. | 21 | 1 | 0 | 1 | 0 | 1 | 0 | - |
| 18. | 23 | 5 | 3 | 0 | 0 | 0 | 1 | 1 |
| Среднее значение | 2,50 | 2,39 | 1,8 | 1,28 | 0,76 | 0,69 | 1,1 | |
| по шкале Нугента | (3) | (2) | (2) | (1) | (1) | (1) | (1) |
Описание:
- без визита
| Таблица 8 | ||||||||
| Влияние применения композиции штаммов Lactobacillus на общее количество штаммов Lactobacillus (КОЕ/мл), колонизирующих эпителий влагалища | ||||||||
| № пациентки | Bизит I log КОЕ/мл | Визит III-10log КОЕ/мл | Визит IV-20 log КОЕ/мл | Визит V-31log КОЕ/мл | Визит VI-50 log КОЕ/мл | Визит VII-62 log КОЕ/мл | Визит VIII-70 log КОЕ/мл | |
| 1. | 7 | 1×101 | 1×105 | 1×104 | 1×105 | 1×104 | 1×106 | - |
| 2. | 9 | 1×104 | 1×104 | 1×100 | 1×103 | 1×103 | 1×107 | 1×103 |
| 3. | 27 | 1×103 | 1×105 | 1×108 | 1×105 | 1×105 | 1×105 | 1×105 |
| 4. | 29 | 1×103 | 1×104 | 1×106 | 1×105 | 1×1044 | 1×105 | 1×103 |
| 5. | 5 | 1×100 | 1×100 | 1×100 | 1×105 | 1×105 | 1×100 | 1×103 |
| 6. | 6 | 1×102 | 1×105 | 1×105 | 1×105 | 1×105 | 1×107 | 1×103 |
| 7. | 1 | 1×103 | 1×100 | 1×100 | 1×100 | 1×100 | 1×104 | 1×104 |
| 8. | 25 | 1×107 | 1×107 | 1×107 | 1×107 | 1×107 | 1×107 | 1×106 |
| 9. | 10 | 1×105 | 1×104 | 1×107 | 1×107 | 1×106 | 1×105 | 1×105 |
| 10. | 8 | 1×101 | 1×100 | 1×104 | 1×106 | 1×103 | 1×103 | 1×103 |
| 11. | 11 | 1×104 | 1×105 | 1×106 | 1×106 | 1×1066 | 1×105 | 1×104 |
| 12. | 16 | 1×104 | 1×105 | 1×104 | 1×103 | 1×103 | 1×104 | 1×105 |
| 13. | 13 | 1×104 | 1×104 | 1×106 | 1×105 | 1×1077 | 1×106 | 1×107 |
| 14. | 12 | 1×105 | 1×104 | 1×105 | 1×105 | 1×106 | 1×106 | 1×103 |
| 15. | 19 | 1×103 | 1×100 | 1×1066 | 1×105 | 1×104 | 1×104 | 1×104 |
| 16. | 14 | 1×100 | 1×100 | 1×107 | 1×100 | 1×100 | 1×105 | 1×103 |
| 17. | 21 | 1×105 | 1×108 | 1×106 | 1×107 | 1×103 | 1×107 | - |
| 18. | 23 | 1×100 | 1×106 | 1×105 | 1×106 | 1×107 | 1×105 | 1×106 |
| Среднее значение общего количества Lactobacillus | 1×103 | 1×104 | 1×105 | 1×105 | 1×104 | 1×105 | 1×104 |
Описание:
- без визита
Пример исполнения II (фармацевтический препарат).
Одна капсула фармацевтического препарата содержит:
- активное вещество - 109 лиофилизированных штаммов Lactobacillus в следующих пропорциях: 50% Lactobacillus gasseri 57С, 25% Lactobacillus fermentum 57A, 25% Lactobacillus plantarum 57B,
- дополнительные вещества: лактоз, манитол, глютаминат натрия, стеарат магния.
Препарат применяют перорально в виде 1-2 капсул 1 раз в день, запивая водой.
Препарат применяют в качестве вспомогательного средства с целью восстановления и/или пополнения правильной бактериальной флоры мочеполовых органов и установления правильного уровня pH влагалища.
1. Применение композиции, включающей три штамма рода Lactobacillus: Lactobacillus fermentum 57A, депонированный под номером В/00007, Lactobacillus plantarum 57В, депонированный под номером В/00008, Lactobacillus gasseri 57C, депонированный под номером В/00009, относительные количества которых определяет пропорция 0,5:0,5:1 для производства перорально вводимого лекарственного средства, обладающего сильным сродством с эпителием пищевода и эпителием влагалища, обеспечивающими колонизацию влагалища и анального отверстия после прохода через кишечник, и коагрегацию, обеспечивающую синергическое содействие компонентов.
2. Применение композиции по п.1, которая дополнительно содержит фармацевтически пригодный носитель.
3. Применение композиции по п.1, которая изготовляется в виде капсулы.
4. Применение композиции по п.1, которая содержит лактозу, маннитол, глютаминат натрия и стеарат магния.