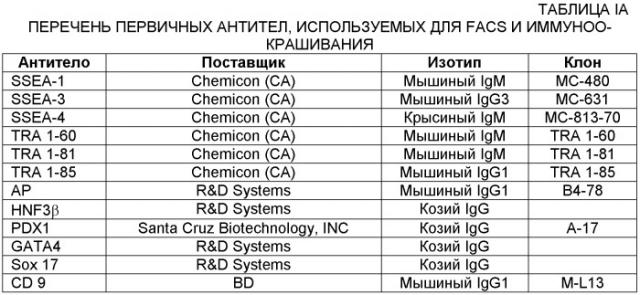
Дифференцировка эмбриональных стволовых клеток человека
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описаны способы дифференцировки плюрипотентных стволовых клеток путем культивирования плюрипотентных стволовых клеток в среде определенного химического состава, дополненной В27 и обработанной активином А. Изобретение позволяет улучшить эффективность дифференцировки стволовых клеток в эндокринные клетки поджелудочной железы. 3 н. и 29 з.п. ф-лы, 53 ил., 7 табл., 37 пр.
Реферат
ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящая заявка является частичным продолжением заявки США №11/736908, поданной 18 апреля 2007, по которой испрашивается приоритет временной заявки США №60/745899, поданной 28 апреля 2006, временной заявки США №60/827695, поданной 30 сентября 2006 и временной заявки США №60/882670, поданной 29 декабря 2006, полные содержания которых включены в настоящее описание в качестве ссылки.
Настоящее изобретение относится к способам стимуляции дифференцировки плюрипотентных стволовых клеток. В частности, настоящее изобретение относится к усовершенствованному способу формирования эндодермы поджелудочной железы, клеток, экспрессирующих гормоны поджелудочной железы, и клеток, секретирующих гормоны поджелудочной железы. Настоящее изобретение также относится к способам стимуляции дифференцировки плюрипотентных стволовых клеток без применения слоя клеток-кормилиц.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
Достижения в области клеточной заместительной терапии сахарного диабета I типа и недостаточность трансплантируемых островков Лангерганса сфокусировали интерес на развитии источников инсулин-продуцирующих клеток, или β-клеток, подходящих для трансплантации. Одним подходом является воспроизведение функциональных β-клеток из плюрипотентных стволовых клеток, например, таких как эмбриональные стволовые клетки.
В эмбриональном развитии позвоночных плюрипотентная клетка дает начало группе клеток, включающей три зародышевых листка (эктодерму, мезодерму и эндодерму), в процессе, известном как гаструляция. Ткани, такие как, например, щитовидной железы, тимуса, поджелудочной железы, кишечной трубки и печени, будут развиваться из эндодермы через промежуточную стадию. Промежуточной стадией в этом процессе является образование дефинитивной эндодермы. Клетки дефинитивной эндодермы экспрессируют целый ряд маркеров, таких как HNF-3бета, GATA4, Mixl1, CXCR4 и Sox-17.
Формирование поджелудочной железы происходит в результате дифференцировки дефинитивной эндодермы в панкреатическую эндодерму. Клетки панкреатической эндодермы экспрессируют панкреатический дуоденальный гомеобокс-ген, Pdx1. В отсутствие Pdx1 поджелудочная железа не в состоянии развиваться больше вентральных и дорсальных зачатков. Таким образом, экспрессия Pdx1 отмечает критический этап в органогенезе поджелудочной железы. Зрелая поджелудочная железа содержит, наряду с другими клеточными типами, экзокринную ткань и эндокринную ткань. Экзокринная и эндокринная ткани возникают в результате дифференцировки панкреатической эндодермы.
Клетки, обладающие признаками островковых клеток, по имеющимся сведениям, были получены из эмбриональных клеток мыши. Например, Lumelsky et al. (Science 292:1389, 2001) сообщают о дифференцировке мышиных эмбриональных стволовых клеток в инсулин-секретирующие структуры, аналогичные панкреатическим островкам. Soria et al. (Diabetes 49:157, 2000) сообщают, что инсулин-секретирующие клетки, полученные из мышиных эмбриональных стволовых клеток, нормализуют гликемию у мышей с диабетом, индуцированным стрептозотоцином.
В одном примере Hori et al. (PNAS 99: 16105, 2002) описывают, что обработка мышиных эмбриональных стволовых клеток ингибиторами фосфоинозитид 3-киназы (LY294002) продуцировала клетки, которые были похожи на β-клетки.
В другом примере Blyszczuk et al. (PNAS 100:998, 2003) сообщает о воспроизведении инсулин-продуцирующих клеток из мышиных эмбриональных стволовых клеток, конститутивно экспрессирующих Pax4.
Micallef et al. сообщает, что ретиноевая кислота может регулировать детерминацию эмбриональных стволовых клеток в форму Pdx1-позитивной панкреатической эндодермы. Ретиноевая кислота является наиболее эффективной в индукции экспрессии Pdx1 при добавлении в культуры на 4 день дифференцировки эмбриональных стволовых клеток на протяжении периода, соответствующего концу гаструляции у эмбриона (Diabetes 54:301, 2005).
Miyazaki et al. сообщает о линии мышиных эмбриональных стволовых клеток, гиперэкспрессирующих Pdx1. Их результаты показывают, что экзогенная экспрессия Pdx1 явно усиливала экспрессию генов инсулина, соматостатина, глюкокиназы, нейрогенина 3, P48, Pax6, и HNF6 в полученных в результате дифференцированных клетках (Diabetes 53: 1030, 2004).
Skoudy et al. сообщает, что активин A (представитель суперсемейства TGFβ) положительно регулирует экспрессию экзокринных панкреатических генов (p48 и амилазы) и эндокринных генов (Pdx1, инсулина и глюкагона) в мышиных эмбриональных стволовых клетках. Максимальный эффект наблюдался с использованием 1 нМ активина А. Они также наблюдали, что на уровень экспрессии инсулина и мРНК Pdx1 не влияла ретиноевая кислота; однако обработка 3 нМ FGF7 приводила к повышенному уровню транскрипта Pdx1 (Biochem. J. 379: 749, 2004).
Shiraki et al. изучали эффекты факторов роста, которые специфически усиливали дифференцировку эмбриональных стволовых клеток в Pdx1-позитивные клетки. Они наблюдали, что TGFβ2 воспроизводимо давал более высокую долю Pdx1-позитивных клеток (Genes Cells. 2005 Jun; 10(6): 503-16).
Gordon et al. демонстрировали индукцию brachyury+/HNF-3beta+клеток эндодермы из мышиных эмбриональных стволовых клеток в отсутствие сыворотки и в присутствии активина наряду с ингибитором сигнального пути Wnt (US 2006/0003446A1).
Gordon et al. (PNAS, Vol 103, p.16806, 2006) утверждает, что «пути передачи сигнала Wnt и TGF-бета/nodal/активин одновременно требовались для образования передней первичной полоски».
Однако мышиная модель развития эмбриональной стволовой клетки не может точно имитировать программу развития у высших млекопитающих, например у людей.
Thomson et al. выделяли эмбриональные стволовые клетки из бластоцист человека (Science 282:114, 1998). Параллельно Gearhart с соавторами получал линии эмбриональных зародышевых клеток человека (hEG) из зародышевой ткани гонад (Shamblott et al., Proc. Natl. Acad. Sci. USA 95:13726, 1998). В отличие от мышиных эмбриональных стволовых клеток, дифференцировке которых можно препятствовать просто культивированием с лейкоз-ингибирующим фактором (LIF), эмбриональные стволовые клетки человека должны поддерживаться в самых особых условиях (патент США №6200806; WO 99/20741; WO 01/51616).
D'Amour et al. описывает получение обогащенных культур дефинитивной эндодермы, полученных из эмбриональных стволовых клеток человека в присутствии высокой концентрации активина и низкой концентрации сыворотки (D'Amour KA et al. 2005). Трансплантация этих клеток под почечную капсулу мышей приводила к дифференцировке в более зрелые клетки с характеристиками некоторых органов эндодермы. Клетки дефинитивной эндодермы, полученные из эмбриональных стволовых клеток человека, далее могут быть дифференцированы в Pdx1-позитивные клетки после добавления FGF-10 (US 2005/0266554A1).
D'Amour et al. (Nature Biotechnology - 24, 1392-1401 (2006)) утверждает «Мы разработали процесс, который превращает эмбриональные стволовые клетки человека (hES) в эндокринные клетки, способные синтезировать гормоны поджелудочной железы инсулин, глюкагон, соматостатин, панкреатический полипептид и грелин. Этот процесс имитирует органогенез поджелудочной железы in vivo, направляя клетки через стадии, напоминающие дефинитивную эндодерму, эндодерму кишечной трубки, панкреатическую эндодерму и эндокринного предшественника на пути к клеткам, которые экспрессируют эндокринные гормоны».
В другом примере Fisk et al. сообщает о системе получения клеток панкреатических островков из эмбриональных стволовых клеток человека (US2006/0040387A1). В этом случае путь дифференцировки был разделен на три стадии. Эмбриональные стволовые клетки человека сначала дифференцировали в эндодерму, используя сочетание н-бутирата и активина А. Затем клетки культивировали с антагонистами TGFβ, такими как Noggin в сочетании с EGF или бетацеллюлином для получения Pdx1-позитивных клеток. Конечная дифференцировка индуцировалась под действием никотинамида.
В одном примере Benvenistry et al. утверждает: «Мы сделали вывод о том, что гиперэкспрессия Pdx1 усиливала экспрессию панкреатических обогащенных генов, для индукции экспрессии инсулина могут потребоваться дополнительные сигналы, которые присутствуют только in vivo» (Benvenistry et al, Stem Cells 2006; 24:1923-1930).
Таким образом, все еще остается существенная потребность в разработке условий для создания линий плюрипотентных стволовых клеток, которые могут быть размножены для направления на текущие клинические нужды, сохраняющих потенциал к дифференцировке в панкреатические эндокринные клетки, в клетки, экспрессирующие гормоны поджелудочной железы, или клетки, секретирующие гормоны поджелудочной железы. Авторы изобретения предприняли альтернативный подход к улучшению эффективности дифференцировки эмбриональных стволовых клеток человека в эндокринные клетки поджелудочной железы.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В одном варианте осуществления настоящее изобретение относится к способу дифференцировки плюрипотентных стволовых клеток, включающему стадии:
а) культивирования плюрипотентных стволовых клеток и
b) дифференцировки плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы,
c) дифференцировки клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы в клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы и
d) дифференцировки клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы в клетки, экспрессирующие маркеры, характерные для панкреатической эндокринной линии дифференцировки.
В одном варианте осуществления клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, дифференцируются из плюрипотентных стволовых клеток путем обработки плюрипотентных стволовых клеток одним из следующих способов:
а) культивирования плюрипотентных стволовых клеток в среде, содержащей активин А в отсутствие сыворотки, затем культивирования клеток с активином А и сывороткой, а затем культивирования клеток с активином А и сывороткой другой концентрации, или
b) культивирования плюрипотентных стволовых клеток в среде, содержащей активин А в отсутствие сыворотки, затем культивирования клеток с активином А с сывороткой другой концентрации, или
c) культивирования плюрипотентных клеток в среде, содержащей активин A и лиганд Wnt в отсутствие сыворотки, затем удаления лиганда Wnt и культивирования клеток с активином A с сывороткой, или
d) культивирования плюрипотентных стволовых клеток на субстрате тканевой культуры, покрытом внеклеточным матриксом, и культивирования плюрипотентных стволовых клеток с активином A и лигандом Wnt, или
e) культивирования плюрипотентных стволовых клеток на субстрате тканевой культуры, покрытом внеклеточным матриксом, затем культивирования плюрипотентных стволовых клеток с активином A и лигандом Wnt в первой культуральной среде, содержащей сыворотку, затем культивирования плюрипотентных стволовых клеток с активином A во второй культуральной среде, содержащей сыворотку, или
f) культивирования плюрипотентных стволовых клеток на субстрате тканевой культуры, покрытом внеклеточным матриксом, затем культивирования плюрипотентных стволовых клеток с активином A и лигандом Wnt в первой культуральной среде, содержащей сыворотку, затем культивирования плюрипотентных стволовых клеток с активином A и лигандом Wnt во второй культуральной среде, содержащей сыворотку в другой концентрации, или
g) культивирования плюрипотентных стволовых клеток в среде, дополненной B27, и содержащей лиганд Wnt и активин A, или
h) культивирования плюрипотентных стволовых клеток на субстрате тканевой культуры, покрытом внеклеточным матриксом, в среде, дополненной B27 и содержащей активин A.
В одном варианте осуществления клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы, дифференцируются из клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы, путем обработки клеток, эксперессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы, одним из следующих способов:
а) обработки клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы фактором роста фибробластов и ингибитора сигнального пути хэджхог (hedgehog), затем удаления среды, содержащей фактор роста фибробластов и ингибитор сигнального пути хэджхог, и последующего культивирования клеток в среде, содержащей ретиноевую кислоту, фактор роста фибробластов и ингибитор сигнального пути хэджхог, или
b) обработки клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы, ретиноевой кислотой и по меньшей мере одним фактором роста фибробластов, или
c) обработки клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы, ретиноевой кислотой, затем удаления ретиноевой кислоты и последующей обработки клеток по меньшей мере одним фактором роста фибробластов.
В одном варианте осуществления клетки, экспрессирующие маркеры, характерные для панкреатической эндокринной линии дифференцировки, дифференцируются из клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы, путем обработки клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы, одним из следующих способов:
a) культивирования клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы, в среде, содержащей DAPT и экзендин 4, затем удаления среды, содержащей DAPT и экзендин 4, и последующего культивирования клеток в среде, содержащей экзендин 1, IGF-1 и HGF, или
b) культивирования клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы, в среде, содержащей экзендин 4, затем удаления среды, содержащей экзендин 4 и в дальнейшем культивирования клеток в среде, содержащей экзендин 1, IGF-1 и HGF, или
c) культивирования клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы, в среде, содержащей DAPT и экзендин 4, или
d) культивирования клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы в среде, содержащей экзендин 4, или
e) оОбработки клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы фактором, который ингибирует сигнальный путь Notch.
В одном варианте осуществления настоящее изобретение относится к способу лечения пациента, страдающего диабетом, включающему стадии:
a) культивирования плюрипотентных стволовых клеток,
b) дифференцировки плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы,
c) дифференцировки клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы в клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы,
d) дифференцировки клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы, в клетки β-клеточной линии дифференцировки и
e) имплантации пациенту клеток β-клеточной линии дифференцировки.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 панели a) показана экспрессия маркеров дефинитивной эндодермы CXCR4, GATA4, HNF-3бета, Mixl1, Sox-17 в линии эмбриональных стволовых клеток человека H9 после обработки 100 нг/мл активина A в течение двух, пяти и восьми дней. Экспрессию маркеров дефинитивной эндодермы исследовали на уровне мРНК и нормировали к уровням экспрессии в необработанных эмбриональных стволовых клетках человека. На панели b) показана экспрессия маркеров передней эндодермы Cerberus, Otx-1 и Hex генов в линии эмбриональных стволовых клеток человека H9 после обработки 100 нг/мл активина A в течение трех и пяти дней.
На фиг.2 показана экспрессия маркеров дефинитивной эндодермы в линии эмбриональных стволовых клеток человека H9 после обработки 100 нг/мл активина A в течение пяти дней. Экспрессию маркеров дефинитивной эндодермы определяли с помощью иммуногистохимии. На панели (a) показана экспрессия Sox-17. На панели (b) показана экспрессия HNF-3бета. На панели (c) показана экспрессия Oct3/4.
На фиг.3 показана экспрессия маркеров дефинитивной эндодермы в линии эмбриональных стволовых клеток человека H9, следуя пошаговому протоколу дифференцировки. Экспрессию маркеров дефинитивной эндодермы исследовали на уровне мРНК и нормировали к уровням экспрессии в необработанных эмбриональных стволовых клетках человека. На панели (a) показана экспрессия GATA4. На панели (b) показана экспрессия Sox-17. На панели (c) показана экспрессия HNF-3бета. На панели (d) показана экспрессия Mixl1. Точки на графике, отмеченные 'AA', означают обработку активином A в течение одного (1 д), трех (3 д), пяти (5 д) или семи дней (7 д). Точки на графике, отмеченные 'UT', означают необработанные контроли, культивированные в течение одного (1 д), трех (3 д), пяти (5 д) или семи дней (7 д).
На фиг.4 показана экспрессия маркеров экстра-эмбриональной эндодермы в линии эмбриональных стволовых клеток человека H9, следуя пошаговому протоколу дифференцировки. Экспрессию маркеров экстраэмбриональной эндодермы исследовали на уровне мРНК и нормировали к уровням экспрессии в необработанных эмбриональных стволовых клетках человека. На панели (a) показано действие 100 нг/мл активина A на экспрессию AFP. На панели (b) показано действие 100 нг/мл активина A на экспрессию Sox7. Точки на графике, отмеченные 'AA', означают обработку активином A в течение одного (1 д), трех (3 д), пяти (5 д) или семи дней (7 д). Точки на графике, отмеченные 'UT' означают необработанные контроли, культивированные в течение одного (1 д), трех (3 д), пяти (5 д) или семи дней (7 д).
На фиг.5 показана экспрессия маркеров мезодермы и эктодермы в линии эмбриональных стволовых клеток человека H9, следуя пошаговому протоколу дифференцировки. Экспрессию маркеров мезодермы и эктодермы исследовали на уровне мРНК и нормировали к уровням экспрессии в необработанных эмбриональных стволовых клеток человека. На панели (a) показано действие 100 нг/мл активина A на экспрессию Brachyury. На панели (b) показано действие 100 нг/мл активина A на экспрессию Zic1. Точки на графике, отмеченные 'AA', означают обработку активином А в течение одного (1 д), трех (3 д), пяти (5 д) или семи дней (7 д). Точки на графике, отмеченные 'UT', означают необработанные контроли, культивированные в течение одного (1d), трех (3д), пяти (5д) или семи дней (7д).
На фиг.6 показана экспрессия маркеров дефинитивной эндодермы Brachyury (панель a) CXCR4 (панель b), Mixl1 (панель c), Sox17 (панель d), HNF-3бета (панель e), Oct4 (панель F) в линии эмбриональных стволовых клеток человека H7 после обработки 100 нг/мл активином A в течение одного, трех, пяти и семи дней. Экспрессию маркеров дефинитивной эндодермы исследовали на уровне мРНК и нормировали к уровням экспрессии в необработанных эмбриональных стволовых клетках человека.
На фиг.7 показана экспрессия маркеров дефинитивной эндодермы в линии эмбриональных стволовых клеток человека H9 после применения протокола дифференцировки. Экспрессию маркеров дефинитивной эндодермы определяли с помощью иммуногистохимии. На панелях (a) и (b) показана экспрессия Sox-17. На панелях (c) и (d) показана экспрессия HNF-3бета. На панелях (e) и (f) показана экспрессия GATA4. На панелях (b), (d) и (f) показано контрастное окрашивание ядер с использованием DAPI. Колонки, отмеченные как «обработанные», означают обработку активином А (100 нг/мл) в течение пяти дней. Колонки, отмеченные как «необработанные», означают необработанные контроли.
На фиг.8 показана экспрессия маркеров панкреатической эндодермы в линии эмбриональных стволовых клеток человека H9 после применения второго протокола дифференцировки. Экспрессию маркеров панкреатической эндодермы исследовали с помощью ПЦР и нормировали к уровням экспрессии в эмбриональных стволовых клетках человека, обработанных активином А. На панели (a) показана экспрессия Pdx1. На панели (b) показана экспрессия GLUT-2. На панели (c) показана экспрессия PTF1a.
На фиг.9 показана экспрессия маркеров панкреатической эндодермы в линии эмбриональных стволовых клеток человека H9 после применения второго протокола дифференцировки. Экспрессию маркеров панкреатической эндодермы определяли с помощью иммуногистохимии. На панели (a) показана экспрессия Pdx1 в необработанном контроле, а на панели (b) показана экспрессия Pdx1 в культуре, обработанной в соответствии с пошаговым протоколом дифференцировки.
На фиг.10 показана экспрессия маркеров панкреатической эндодермы в линии эмбриональных стволовых клеток человека H9 после применения третьего протокола дифференцировки. Экспрессию панкреатических эндокринных маркеров исследовали с помощью ПЦР и нормировали к уровням экспрессии в эмбриональных стволовых клетках человека, обработанных активином А. На панели (а) показана экспрессия NeuroD1. На панели (b) показана экспрессия Ngn3. На панели (с) показана экспрессия инсулина. На панели (d) показана экспрессия Hes-1, уровень экспрессии нормирован к клеткам панкреатической эндодермы.
На фиг.11 показана экспрессия маркеров панкреатической эндодермы в линии эмбриональных стволовых клеток человека H9 после применения протокола дифференцировки. Экспрессию маркеров панкреатической эндодермы исследовали с помощью ПЦР и нормировали к уровням экспрессии в эмбриональных стволовых клетках человека, обработанных активином А. На панели (а) показана экспрессия Nkx2.2. На панели (b) показана экспрессия Pdx1.
На фиг.12 показана экспрессия PDX-1 в клетках каждого пассажа (P0, P1 и P2) в культуре. Экспрессию PDX-1 исследовали с помощью ПЦР и нормировали к уровням экспрессии в эмбриональных стволовых клетках человека H9, обработанных активином А.
На фиг.13 показана экспрессия маркеров гепатоцитов в линии эмбриональных стволовых клеток человека H9 после применения третьего протокола дифференцировки. Экспрессию маркеров гепатоцитов исследовали с помощью ПЦР и нормировали к уровням экспрессии в эмбриональных стволовых клетках человека, обработанных активином А. На панели (а) показана экспрессия AFP. На панели (b) показана экспрессия альбумина.
На фиг.14 показана экспрессия маркеров плюрипотентности в линии эмбриональных стволовых клеток человека H9. Экспрессию маркеров плюрипотентности исследовали с помощью иммуногистохимии. На панели (а) показана экспрессия Oct-4. На панели (b) показана экспрессия щелочной фосфатазы.
На фиг.15 показан кариотип линии эмбриональных стволовых клеток человека H9. Кариотип определяли на клетках с числом пассажей P36, которые культивировали на клетках-кормилицах - мышиных эмбриональных фибробластах.
На фиг.16 изображена схема протокола дифференцировки по настоящему изобретению, где эмбриональные стволовые клетки человека дифференцированы в дефинитивную эндодерму в системе без питающего подслоя.
На фиг.17 изображен профиль FACS линии эмбриональных стволовых клеток человека H9 с количеством пассажей 44, культивированных на MATRIGEL различных концентраций и подвергаемых действию сыворотки низкой концентрации (0,5-2%) и высокой концентрации активина A (100 нг/мл) в течение 5 дней. Экспрессия маркера дефинитивной эндодермы CXCR4 (CD184) показана по оси Y, а экспрессия ES маркера CD9 показана по оси X.
На фиг.18 показаны результаты ПЦР в режиме реального времени в отношении маркеров дефинитивной эндодермы из культур линии эмбриональных стволовых клеток человека H9 пассажа 44, культивированных с разведением MATRIGEL 1:10 разведением MATRIGEL 1:20 или разведением MATRIGEL 1:30 и подвергнутых протоколу дифференцировки, описанному в примере 14. Кратность индукции относится к недифференцированным клеткам линии эмбриональных стволовых клеток человека H9, с количеством пассажей 44, культивированных в среде, кондиционированной с использованием эмбриональных фибробластов мыши.
На фиг.19 показаны графики рассеяния общей экспрессии генов в недифференцированных плюрипотентных стволовых клетках и клетках дефинитивной эндодермы, полученных в результате дифференцировки плюрипотентных стволовых клеток. Показанные данные представляют собой данные, полученные от культур линии эмбриональных стволовых клеток человека H9 пассажа 44, культивированных на эмбриональных фибробластах мыши (правая панель), и пассажа 83, культивированных на MATRIGEL (левая панель).
На фиг.20 изображена экспрессия CXCR4 по данным FACS на 5 день для линии эмбриональных стволовых клеток человека H1 (панель a), линии эмбриональных стволовых клеток человека H7 (панель b) и линии эмбриональных стволовых клеток человека H9 (панель c), культивированных на эмбриональных фибробластах мыши клетках-кормилицах, подвергнутых протоколу дифференцировки дефинитивной эндодермы, описанному в примере 4.
На фиг.21 показаны результаты ПЦР в режиме реального времени экспрессии указанных маркеров дефинитивной эндодермы в культурах линии эмбриональных стволовых клеток человека H7 (панель a) и линии эмбриональных стволовых клеток человека H9 (панель b), культивированных на эмбриональных фибробластах мыши клетках-кормилицах. Результаты выражены как кратность увеличения относительно недифференцированных клеток.
На фиг.22 изображена экспрессия CXCR4 по данным FACS на 5 день для линии эмбриональных стволовых клеток человека H1 (панель a), линии эмбриональных стволовых клеток человека H7 (панель b) и линии эмбриональных стволовых клеток человека H9 (панель c), культивированных на MATRIGEL (разведение 1:30) и подвергавшихся протоколу дифференцировки дефинитивной эндодермы, описанному в примере 4.
На фиг.23 показаны результаты ПЦР в режиме реального времени экспрессии указанных маркеров дефинитивной эндодермы в культурах линии эмбриональных стволовых клеток человека H7 (панель a), и линии эмбриональных стволовых клеток человека H9 (панель b), и линии эмбриональных стволовых клеток человека H1 (панель c). Результаты выражены как кратность увеличения относительно недифференцированных клеток. Клетки были обработаны в соответствии со способами, описанными в примере 4.
На фиг.24 представлены фазово-контрастные изображения культур эмбриональных стволовых клеток человека линии H9 пассажа 46 в присутствии 100 нг/мл активина A (панель a) или 100 нг/мл активина A+20 нг/мл Wnt-3a (панель b). Клетки обрабатывали в течение пяти дней.
На фиг.25 изображена экспрессия CXCR4 по данным FACS в культурах эмбриональных стволовых клеток человека линии H7 пассажа 44 (панели a и b) и H9 пассажа 46 (панели c и d) после обработки в соответствии со способами, описанными в примере 4. На панелях b и d показано действие 20 нг/мл Wnt-3a на экспрессию CXCR4. На панелях a и c показана экспрессия CXCR4 в отсутствие Wnt-3a. Результаты были получены через 5 дней после обработки.
На фиг.26 представлены данные ПЦР в режиме реального времени экспрессии генов, указанных в культурах эмбриональных стволовых клеток человека линии H7 (панель a) и H9 (панель b). Культуры обрабатывали по протоколу дифференцировки, описанному в примере 4. Также были протестированы действия агонистов Wnt - Wnt-3a (20 нг/мл), Wnt-5a (20 нг/мл) и Wnt-7a (20 нг/мл), как указано на этих панелях. Клетки обрабатывали в течение 5 дней. Результаты выражены как кратность увеличения относительно недифференцированных клеток.
На фиг.27 представлена экспрессия CXCR4 в культурах эмбриональных стволовых клеток человека линии H9 пассажа 46, по данным FACS через пять дней после обработки. На панели (a) представлена экспрессия CXCR4 в отсутствие Wnt-3a. На панели (b) представлена экспрессия CXCR4 после обработки 10 нг/мл Wnt-3a. На панели (c) представлена экспрессия CXCR4 после обработки 20 нг/мл Wnt-3a, и на панели (d) представлена экспрессия CXCR4 после обработки 50 нг/мл Wnt-3a.
На фиг.28 представлена экспрессия характерных маркеров, указанных в культурах эмбриональных стволовых клеток человека линии H9 через 5 дней после обработки. Результаты показаны как кратность увеличения экспрессии относительно необработанных клеток, как определено с помощью ПЦР в режиме реального времени. На панели (а) показано действие 10, 20 и 50 нг/мл Wnt-3a на экспрессию указанных маркерных генов дефинитивной эндодермы. На панели (b) показано действие 1, 5 или 10 нг/мл Wnt-3a (ось x метки: 10, 5, 1) на экспрессию goosecoid и экспрессию CXCR4 через 2 (2 д) и 5 (5 д) дней после обработки. На панели (с) показано действие 1, 5 или 10 нг/мл Wnt-3a на число клеток, на 2 день или 5 день
На фиг.29 представлена экспрессия CXCR4 в культурах эмбриональных стволовых клеток человека линии H9 по данным FACS, после 5 дневной обработки по протоколу дифференцировки, описанному в примере 4. Клетки культивировали в отсутствие Wnt-3a или GSK-3B ингибитора (панель a), 20 нг/мл Wnt-3a в течение всего 5 дневного периода (панель b), 1000 нМ GSK-3B ингибитора IX в течение всего 5 дневного периода (панель c), 500 нМ GSK-3B ингибитора IX в течение всего 5 дневного периода (панель d), 100 нМ GSK-3B ингибитора IX в течение всего 5 дневного периода (панель e), 10 нМ GSK-3B ингибитора IX в течение всего 5 дневного периода (панель f), 100 нМ GSK-3B ингибитора IX в течение 1-2 дней (панель g), 10 нМ GSK-3B ингибитора IX в течение 1-2 дней (панель h).
На фиг.30 представлена генная экспрессия маркеров дефинитивной эндодермы посредством ПЦР в режиме реального времени. Результаты выражены как кратность увеличения относительно необработанных клеток. На панели (а) показаны данные, полученные от эмбриональных стволовых клеток человека линии H9 с количеством пассажей 48, обработанных по протоколу для дефинитивной эндодермы, описанному в примере 4, содержащему Wnt-3a или GSK-3B ингибитор в указанных концентрациях и времени. На панели (b) показаны данные, полученные от эмбриональных стволовых клеток человека линии H9 с количеством пассажей 46, обработанных по протоколу для дефинитивной эндодермы, описанному в примере 4, содержащему Wnt-3a или GSK-3B ингибитор в указанных концентрациях и времени.
На фиг.31 представлена экспрессия CXCR4 по данным FACS для линий эмбриональных стволовых клеток, используемых в настоящем изобретении. На панелях (a-d) показаны данные, полученные от эмбриональных стволовых клеток человека линии H9 с количеством пассажей 49. На панелях (e-f) показаны данные, полученные от эмбриональных стволовых клеток человека линии H1 с количеством пассажей 46. Данные были получены через 5 дней после обработки. Клетки были обработаны в следующих условиях: панель (a): 10 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3a в течение первых двух дней; панель (b): 100 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3a в течение первых двух дней; панель (c): 100 нг/мл активина A в течение всех пяти дней плюс 100 нМ GSK-3B ингибитора IX в течение первых двух дней; панель (d): 10 нг/мл активина A в течение всех пяти дней плюс 100 нМ GSK-3B IX ингибитора в течение первых двух дней, панель (e): 100 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3a в течение первых двух дней, и панель (f):10 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3a в течение первых двух дней.
На фиг.32 представлена генная экспрессия маркеров дефинитивной эндодермы, как определено с помощью ПЦР в режиме реального времени для культур эмбриональных стволовых клеток человека линии H9 пассажа 49, обработанных 10, 50 или 100 нг/мл активина A плюс 20 нг/мл Wnt-3a: панель (a): экспрессия AFP, Bry, CXCR4, GSC, HNF-3B, и POU5F (Oct-4) и панель (b): SOX-17 и GATA4. Результаты выражены как кратность увеличения относительно необработанных клеток.
На фиг.33 представлена экспрессия CXCR4 по данным FACS для эмбриональных стволовых клеток линии H9 пассажа 53. Данные были получены через 5 дней после обработки. Клетки обрабатывали в следующих условиях: Панель (a): 100 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3a в течение первых двух дней и 25 нг/мл BMP-4 в течение 3-5 дней; панель (b): 100 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3a в течение первых двух дней; панель (c): 100 нг/мл активина A в течение всех пяти дней плюс 100 нМ GSK-3B ингибитора IX в течение первых двух дней; панель (d): 20 нг/мл Wnt-3a+25 нг/мл BMP-4 в течение всех пяти дней; панель (e): 100 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3a+100 нМ GSK-3B ингибитора IX в течение первых двух дней, и панель (f): 100 нг/мл активина A+25 нг/мл BMP-4 в течение всех пяти дней. Для всех панелей ось X представляет экспрессию CD9, а ось Y представляет экспрессию CXCR4 (CD184).
На фиг.34 представлена генная экспрессия маркеров дефинитивной эндодермы, как определено с помощью ПЦР в режиме реального времени, для культур эмбриональных стволовых клеток человека линии H1 пассажа 46, обработанных 10 или 100 нг/мл активина A плюс 20 нг/мл Wnt-3a или 100 нМ GSK-3B ингибитора: панель (a): экспрессия AFP, Bry, CXCR4, GSC, и POU5F (Oct-4) и панель (b): SOX-17, HNF-3B, и GATA4. Результаты выражены как кратность увеличения относительно необработанных клеток.
На фиг.35 представлена генная экспрессия маркеров дефинитивной эндодермы, как определено с помощью ПЦР в режиме реального времени для культур эмбриональных стволовых клеток человека линии H9 пассажа 49, обработанных 50 или 100 нг/мл активина A плюс 10 или 100 нМ GSK-3B ингибитора: панель (a): экспрессия AFP, Bry, CXCR4, GSC, HNF-3B, и POU5F (Oct-4) и панель (b): SOX-17 и GATA4. Результаты выражены как кратность увеличения относительно необработанных клеток.
На фиг.36 представлена генная экспрессия маркеров дефинитивной эндодермы, как определено с помощью ПЦР в режиме реального времени для культур эмбриональных стволовых клеток человека линии H9 пассажа 53, обработанных сочетаниями активина A, Wnt-3a, GSK-3 ингибитора, и BMP-4, в течение пяти дней: панель (a): экспрессия AFP, Bry, CXCR4, GSC, HNF-3B, и SOX7 и панель (b): SOX-17, HNF-3B и GATA4.
На фиг.37 представлено процентное значение экспрессии CXCR4, определенной с помощью FACS, в культурах эмбриональных стволовых клеток человека линии H9, обработанных в условиях, перечисленных в примере 22.
На фиг.38 представлена экспрессия маркеров дефинитивной эндодермы, как определено с помощью FACS, в культурах эмбриональных стволовых клеток человека линии H9, культивированных на фибронектине (панель a) или MATRIGEL™ (панель b).
На фиг.39 представлена экспрессия маркеров дефинитивной эндодермы, как определено с помощью ПЦР в режиме реального времени, в культурах эмбриональных стволовых клеток человека линии H9, культивированных на фибронектине или 1:10 разведении MATRIGEL с пониженным содержанием фактора роста
На фиг.40 представлено действие различных концентраций MATRIGEL в присутствии сыворотки низкой концентрации, 100 нг/мл активина A и 20 нг/мл Wnt-3a на дифференцировку эмбриональных стволовых клеток человека в дефинитивную эндодерму. Клетки были обработаны в соответствии со способами, описанными в примере 4. Результаты показаны как уровни экспрессии указанных генов, как определено с помощью ПЦР в режиме реального времени.
На фиг.41 изображена роль Wnt-3a в образовании дефинитивной эндодермы эмбриональными стволовыми клетками человека, подращиваемыми на MATRIGEL, но дифференцированных на эмбриональных фибробластах мыши. На панелях (a-d) показаны данные ПЦР в режиме реального времени для указанных генов. На панелях (e-g) показаны данные FACS для указанных условий.
На фиг.42 показана дифференцировка эмбриональных стволовых клеток человека, культивируемых на субстрате для тканевых культур, покрытом MATRIGEL™ для дефинитивной эндодермы с последующей обработкой Wnt ингибитором DKK-1. Показанные результаты представляют собой экспрессию указанных генов, как определено с помощью ПЦР в режиме реального времени в клетках H9, обработанных в соответствии со способами, описанными в примере 4 в присутствии 20 нг/мл Wnt-3A плюс 100 нг/мл DKK1 (DE+DKK1) или в отсутствие DKK1 (DE).
На фиг.43 показано иммунофлуоресцентное окрашивание маркеров дефинитивной эндодермы в культурах эмбриональных стволовых клеток человека линии H9, культивированных на субстрате для тканевых культур, покрытом MATRIGEL, и дифференцированных в сыворотке низкой концентрации плюс 100 нг/мл активина-A без (панель a) или с (панель b) 20 нг/мл Wnt-3a. Ecad=E-кадгерин, NCAM=N-кадгерин.
На фиг.44 показана дифференцировка эмбриональных стволовых клет