Рекомбинантные флавивирусные вакцины
Иллюстрации
Показать всеГруппа изобретений относится к области биотехнологии, в частности к химерным флавивирусам и их применению при лечении и профилактике заболеваний, вызванных флавивирусной инфекцией. Химерный флавивирус содержит по меньшей мере одну мутацию в оболочечном белке химерного флавивируса и одну или более мутаций в (i) 3'-нетранслируемой области (3'-UTR) генома химерного флавивируса и/или (ii) в капсидном белке химерного флавивируса. При этом химерный флавивирус проявляет снижение висцеротропизма в сравнении с химерным флавивирусом с отсутствием мутаций, причем вирус является полностью аттенуированным. 4 н. и 28 з.п. ф-лы, 5 ил., 7 табл.
Реферат
Предпосылки изобретения
Изобретение относится к вакцинам, которые включают в себя рекомбинантные флавивирусы.
Флавивирусы представляют собой маленькие оболочечные вирусы с положительной цепью РНК, которые, главным образом, передаются с помощью инфицированных москитов и клещей. Некоторые флавивирусы, такие как вирусы желтой лихорадки, денге, японского энцефалита, клещевого энцефалита и лихорадки западного Нила, представляют собой существующую или потенциальную угрозу здоровью населения всего мира. Вирус желтой лихорадки, например, был причиной эпидемий в определенных регионах Африки, расположенных к югу от Сахары, а также в некоторых областях Южной Америки. Несмотря на то, что многие инфекции вирусом желтой лихорадки являются мягкими, это заболевание также может вызывать тяжелое опасное для жизни состояние. Начальная или острая фаза болезненного состояния обычно характеризуется высокой лихорадкой, ознобом, головной болью, болью в спине, болью в мышцах, потерей аппетита, тошнотой и рвотой. Через трое или четверо суток эти симптомы исчезают. У некоторых пациентов симптомы затем снова возникают, поскольку заболевание входит в так называемую токсическую фазу. В ходе этой фазы высокая лихорадка появляется снова и может приводить к шоку, кровотечению (например, кровотечению из ротовой полости, носа, глаз и/или желудка), почечной недостаточности и печеночной недостаточности. Кроме того, печеночная недостаточность приводит к желтухе, при которой происходит окрашивание кожи и белков глаз в желтый цвет, и таким образом дает название "желтая лихорадка". Приблизительно половина пациентов, у которых возникает токсическая фаза, погибают в течение от 10 до 14 суток. Однако индивиды, которые выздоравливают от желтой лихорадки, приобретают пожизненный иммунитет против повторного заражения. Количество человек, инфицированных вирусом желтой лихорадки, возросло на протяжении последних двух десятилетий и в настоящее время составляет приблизительно 200000 случаев и приблизительно 30000 обусловленных им смертей каждый год. Повторное увеличение случаев заражения вирусом желтой лихорадки, таким образом, представляет собой серьезную проблему для здоровья населения.
Вирус лихорадки западного Нила (WN) широко распространен в Африке, Индийском субконтиненте, Европе, Украине, России, Центральной Азии и Среднем Западе (Monath and Heinz, in Virology 3rd ed., Fields et al., eds., Lippincott-Raven, pp.961-1034, 1995). В 1999 году в США произошла беспрецедентная эпидемия энцефалита у человека и лошадей, вызванная вирусом WN (Enserik, Science 286:1450-1451, 1999). С того времени вирус постоянно существует в Америке, охватывая приблизительно всю территорию США. До настоящего времени рекордным годом с точки зрения заболеваемости/смертности в США был 2003 год с 9862 зарегистрированными случаями, среди которых приблизительно одна треть сопровождалась неврологическими симптомами и 264 смертями. Заболевание у человека варьирует от мягкого подобного денге состояния до смертельного менингоэнцефалита и наиболее тяжелое состояние возникает у пожилых людей. В настоящее время не существует эффективного медикаментозного лечения против вируса лихорадки западного Нила и способы контроля и профилактики не оказывают значительного влияния на количество случаев инфекции. Риск миграции вируса в Южную Америку, а также эпидемий в развивающихся странах является чрезвычайно высоким. Разработка безопасной и эффективной вакцины обеспечит борьбу с эпидемиями в будущем.
Флавивирусы, включая вирус желтой лихорадки и вирус лихорадки западного Нила, обладают двумя основными биологическими свойствами, ответственными за индукцию ими болезненного состояния у человека и животных. Первым из этих двух свойств является нейротропизм, который представляет собой склонность вируса к проникновению и инфицированию нервной ткани организма-хозяина. Нейротропная флавивирусная инфекция может приводить к воспалению и повреждению головного и спинного мозга (т.е. к энцефалиту), нарушению сознания, параличу и судорогам. Вторым из этих биологических свойств флавивирусов является висцеротропизм, который представляет собой склонность вируса к проникновению и инфицированию жизненно важных висцеральных органов, включая печень, почки и сердце. Висцеротропная флавивирусная инфекция может приводить к воспалению и повреждению печени (гепатит), почки (нефрит) и сердечной мышцы (миокардит), вызывая недостаточность или дисфункцию этих органов.
Нейротропизм и висцеротропизм, по-видимому, являются отдельными и обособленными свойствами флавивирусов. Некоторые флавивирусы являются, главным образом, нейротропными (такие как вирус лихорадки западного Нила), другие являются, главным образом, висцеротропными (например, вирус желтой лихорадки и вирус денге), однако другие обладают обоими свойствами (такие как вирус киасанурской лесной болезни). Однако как нейротропизм, так и висцеротропизм в определенной степени представлены во всех флавивирусах. В организме-хозяине, вероятно, происходит взаимодействие висцеротропизма и нейротропизма, поскольку инфицирование внутренних органов происходит до проникновения в центральную нервную систему. Таким образом, нейротропизм зависит от способности вируса к репликации в экстраневральных органах (внутренних органах). Эта экстраневральная репликация вызывает виремию, которая, в свою очередь, отвечает за проникновение в головной и спинной мозг. Полностью процессированные зрелые вирионы флавивирусов содержат три структурных белка: капсид (C), мембрану (M) и оболочку (E). Семь неструктурных белков (NS1, NS2A, NS2B, NS3, NS4A, NS4B и NS5) продуцируются в инфицированных клетках. Как домен связывания с рецептором, так и домен слияния вируса расположены в белке E. Кроме того, белок E также является желательным компонентом флавивирусных вакцин, поскольку антитела против этого белка могут нейтрализовать инфекционность вируса и обеспечить защиту организма-хозяина против заболевания. Зрелые вирионы флавивирусов, находящиеся в инфицированных клетках, содержат премембранный (prM) белок, который является предшественником белка M. Продукция белков флавивируса происходит посредством трансляции одной длинной открытой рамки считывания с образованием полибелка с последующей комплексной серией посттрансляционных протеолитических расщеплений полибелка с образованием зрелых вирусных белков (Amberg et al., J. Virol. 73:8083-8094, 1999; Rice, "Flaviviridae," In Virology, Fields et al., ed., Raven-Lippincott, New York, Vol.I, p.937, 1995). Структурные белки располагаются в N-концевой области полибелка в порядке C-prM-E, а неструктурные белки расположены в C-концевой области в порядке, указанном выше.
Живые вакцины обеспечивают наиболее эффективные и продолжительные защитные иммунные ответы против заболевания, вызываемого вирусными инфекциями. В случае флавивирусов, разработка успешной вакцины требует модификации вирулентных свойств, чтобы вакцинный вирус обладал сниженным нейротропизмом и висцеротропизмом у человека или животных. Для разработки вакцин против флавивирусов использовали несколько различных подходов. В случае вируса желтой лихорадки было разработано две вакцины (вакцина против желтой лихорадки 17D и французская нейротропная вакцина) посредством серийного пассирования (Monath, "Yellow Fever", In Plotkin and Orenstein, Vaccines, 3rd ed., Saunders, Philadelphia, pp.815-879, 1999). Вакцина против желтой лихорадки 17D была разработана посредством серийного пассирования в ткани куриного эмбриона, и его результатом был вирус со значительно сниженным нейротропизмом и висцеротропизмом. Французская нейротропная вакцина была разработана посредством серийных пассирований вируса в ткани головного мозга мыши, и их результатом была потеря висцеротропизма, но сохранение нейротропизма. Действительно, с применением французской вакцины была связана высокая встречаемость неврологических повреждений (поствакцинальный энцефалит).
Другой подход к аттенуации включает в себя конструирование химерных флавивирусов, которые включают в себя компоненты двух (или более) различных флавивирусов. Были получены химерные флавивирусы, которые включают в себя структурные и неструктурные белки из различных флавивирусов. Например, в так называемой технологии ChimeriVax™ используют капсид вируса желтой лихорадки 17D и неструктурные белки для доставки оболочечных белков (prM и E) других флавивирусов (см., например, Chambers et al., J. Virol. 73:3095-3101, 1999). Действительно, эту технологию использовали для разработки вакцин-кандидатов против вирусов денге, вируса японского энцефалита (JE), вируса лихорадки западного Нила и вируса энцефалита Сент-Луис (SLE) (см., например, Pugachev et al., в New Generation Vaccines, 3rd ed., Levine et al., eds., Marcel Dekker, New York, Basel, pp.559-571, 2004; Chambers et al., J. Virol. 73:3095-3101, 1999; Guirakhoo et al., Virology 257:363-372, 1999; Monath et al., Vaccine 17:1869-1882, 1999; Guirakhoo et al., J. Virol. 74:5477-5485, 2000; Arroyo et al., Trends Mol. Med. 7:350-354, 2001; Guirakhoo et al., J. Virol. 78:4761-4775, 2004; Guirakhoo et al., J. Virol. 78:9998-10008, 2004; Monath et al., J. Infect. Dis. 188:1213-1230, 2003; Arroyo et al., J. Virol. 78:12497-12507, 2004; и Pugachev et al., Am. J. Trop. Med. Hyg. 71:639-645, 2004). Они представляют собой живые вирусные вакцины, которые, аналогично вакцине YF17D, вызывают сильные гуморальные и клеточные иммунные ответы, направленные против требуемого гетерологичного вируса. Исходя из подробной охарактеризации вакцин ChimeriVax™ против JE и денге, было выявлено, что основные признаки вакцин ChimeriVax™ включают в себя способность к репликации до высоких титров в субстратных клетках (7 log10 БОЕ/мл или выше), низкую нейровирулентность у мышей-отъемышей и новорожденных мышей (значительно ниже, чем в случае YF17D), высокую аттенуацию в официальных испытаниях на обезьянах в отношении нейровирулентности и висцеротропизма, высокую генетическую и фенотипическую стабильность in vitro и in vivo, слабую репликацию в москитах, которая является важной для предотвращения неконтролируемого распространения в природе, и индукцию сильного защитного иммунитета у мышей, обезьян и человека после введения однократной дозы без тяжелых побочных эффектов после иммунизации.
В других подходах к аттенуации проводили мутагенез флавивирусов, включая химерные флавивирусы. Описано несколько экспериментальных подходов к аттенуации флавивирусных патогенов дикого типа (см., например, обзор Pugachev et al., Int. J. Parasitol. 33:567-582, 2003). Например, было выявлено, что мутации в определенных аминокислотах оболочечных белков химерных флавивирусов, включающих в себя капсидные и неструктурные белки вируса желтой лихорадки и мембранные и оболочечные белки вируса японского энцефалита, вируса денге или вируса лихорадки западного Нила, снижают висцеротропизм (см., например, WO 03/103571 и WO 2004/045529). Другой подход, исходно примененный в отношении вируса денге-4 дикого типа, включает в себя крупные делеции из 30 нуклеотидов или более в 3'-нетранслируемой области (3'UTR; Men et al., J. Virol. 70:3930-3937, 1996; патент США №6184024 B1). Одну из этих делеций, названную делецией дельта 30 или Δ30, впоследствии исследовали для вирусов денге-4 и денге-1 дикого типа и химерного вируса денге-4/WN (Durbin et al., AJTMH 65:405-413, 2001; Whitehead et al., J. Virol. 77:1653-1657, 2003; Pletnev et al., Virology 314:190-195, 2003; WO 03/059384; WO 03/092592; WO 02/095075). Кроме того, было выявлено, что некоторые из крупных делеций 3'UTR (длиной 417-616 нуклеотидов), внесенные в вирусы клещевого энцефалита (TBE) и Лангат дикого типа, являются высокоаттенуирующими в модели на мышах (Mandl et al., J. Virol. 72:2132-2140, 1998; Pletnev, Virology 282:288-300, 2001). Для вакцинного вируса YF17D было опубликовано ограниченное количество данных, полученных in vitro. В частности, Bredenbeek и соавторы показали, что крупная делеция всех трех элементов повторяющихся последовательностей (RS) в 3'UTR (длиной 188 нуклеотидов; расположение элементов RS представлено на фиг.1A) или делеция 25 нуклеотидов в элементе консервативной последовательности 2 (CS2) не препятствует репликации в клетках BHK, в то время как три другие делеции (длиной 25-68 нуклеотидов), которые нарушают CS1 или последнюю с 3'-конца структуру стебель-и-петля, являются летальными (Bredenbeek et al., J. Gen. Virol. 84:1261-1268, 2003). Другие авторы показали, что мутации, внесенные в крупную 3'-концевую структуру стебель-петля 3'UTR флавивируса (денге), приводят к аттенуации, но с сохранением способности вируса иммунизировать организм-хозяин (Markoff et al., J. Virol. 76:3318-3328, 2002).
Во втором подходе, который был описан для аттенуации высокопатогенного вируса TBE дикого типа, использовали относительно крупные делеции в капсидном белке C, как описано Kofler и коллегами, которые внесли ряд делеций в белок C вируса TBE и выделили несколько жизнеспособных мутантных форм (Kofler et al., J. Virol. 76:3534-3543, 2002). В частности, делеция из 16 аминокислот в центральном гидрофобном домене белка (предсказанная спираль I; см. на фиг.2A) существенно снижала репликацию вируса в клетках BHK и значительно снижала нейроинвазивность у мышей. Иммунизация этим мутантным TBE защищала мышей от заражения высокопатогенным штаммом TBE Hypr (>100 LD50) (Kofler et al., J. Virol. 76:3534-3543, 2002).
Для многих значимых с медицинской точки зрения флавивирусов, обладающих висцеротропными свойствами, таких как, помимо прочих, вирусы лихорадки западного Нила, денге и омской геморрагической лихорадки, в настоящее время не существует одобренных вакцин.
Сущность изобретения
Это изобретение относится к рекомбинантным флавивирусам (например, вирусам желтой лихорадки или химерным флавивирусам), которые включают в себя одну или несколько мутаций, которые обеспечивают небольшое снижение висцеротропизма уже аттенуированного флавивируса, как описано в настоящем описании. Пример химерного флавивируса, относящегося к этому изобретению, представляет собой флавивирус, который включает в себя капсидный и неструктурные белки первого флавивируса (например, вируса желтой лихорадки, такого как штамм вируса желтой лихорадки 17D) и мембранный и оболочечный белки второго флавивируса (например, вируса, выбранного из группы, состоящей из вируса японского энцефалита, денге-1, денге-2, денге-3, денге-4, энцефалита долины Муррей, энцефалита Сент-Луис, западного Нила, Кунжин, энцефалита Росио, Ильеус, центрально-европейского энцефалита, сибирского энцефалита, русского весенне-летнего клещевого энцефалита, киасанурской лесной болезни, Алхурма, омской геморрагической лихорадки, шотландского энцефалита овец, Повассан, Негиши, Абсеттаров, Гансалова, Апои и Hypr). В случае химерного флавивируса, включающего в себя мембранный и оболочечный белки вируса лихорадки западного Нила, оболочечный белок необязательно может включать в себя замены аминокислот оболочечного белка 107, 316 и 440. Мутации рекомбинантных флавивирусов по этому изобретению могут представлять собой, например, одну или несколько делеций или замен.
Мутации по этому изобретению могут быть расположены в участках рекомбинантных флавивирусов, включающих в себя, например, 3'-нетранслируемую область рекомбинантных флавивирусов, и, главным образом, включают в себя менее 30 нуклеотидов. В качестве примера мутации этого типа, мутация может представлять собой мутацию, которая дестабилизирует структуру стебля в 3'-нетранслируемой области вируса (например, структуру стебля в неконсервативном участке 3'-нетранслируемой области вируса) или возможных альтернативных элементов предсказанной вторичной структуры или общей структуры. В качестве конкретных примеров, мутация может представлять собой любую одну или несколько из d7, dA, dB, dC и dD, как описано в настоящем описании. В других примерах, мутация может охватывать один или несколько нуклеотидов консервативной последовательности 2 (CS2) и, таким образом, может представлять собой, например, CS2 d5 или CS2 d16. В других примерах мутантный флавивирус адаптирован к субстрату клеточной культуры, вызывающему спонтанную модификацию мутации, которую он включает в себя (например, модификацию делеции, такую как, например, модификация, которая увеличивает исходную 5-нуклеотидную делецию в мутанте dC до 24 нуклеотидов; см. ниже), или мутацию во втором участке, которая не нарушает аттенуацию in vivo.
Мутации по этому изобретению также можно вносить в последовательности капсида. Такие мутации могут включать в себя, например, делецию 1-3 аминокислот капсидного белка. В качестве конкретного примера таких мутаций, мутации могут представлять собой одну или несколько делеций в спирали I капсидного белка (например, мутацию C2, как описано в настоящем описании).
В других примерах, мутации по этому изобретению могут включать в себя одну или несколько замен аминокислот оболочки. В одном примере такие мутации оболочки представляют собой замены одной или нескольких из аминокислот оболочечного белка 138, 176, 177, 244, 264 и 280 или их сочетания. Конкретные примеры таких сочетаний включают в себя следующие сочетания: 176, 177 и 280; 176, 177, 244, 264 и 280 и 138, 176, 177 и 280.
Рекомбинантные флавивирусы по этому изобретению могут включать в себя мутации только в одном из участков, указанных выше, или в двух или трех из этих участков. Кроме того, рекомбинантные флавивирусы могут включать в себя одну или несколько мутаций в шарнирной области оболочечного белка флавивируса и/или мутацию в мембранном белке флавивируса. В качестве конкретных примеров рекомбинантных флавивирусов по этому изобретению следует отметить флавивирусы, включающие в себя мутацию C2 в сочетании с мутациями d7, dB, dD и/или Е#5 (т.е. Е176, Е177 и Е280) (см. ниже), необязательно применительно к ChimeriVax™-WN02 (также см. ниже). Дополнительные примеры рекомбинантных флавивирусов, включающих в себя множественные мутации, представлены в других частях настоящего описания.
Это изобретение также относится к способам профилактики или лечения флавивирусной инфекции у субъектов (например, у человека или у ветеринарных субъектов), включающим в себя введение субъекту вакцины, включающей в себя один или несколько из описанных в настоящем описании рекомбинантных флавивирусов, а также к фармацевтическим композициям, которые включают в себя такие рекомбинантные флавивирусы. Кроме того, это изобретение относится к молекулам нуклеиновых кислот (например, молекулам РНК или ДНК), которые содержат геномы (или комплементарные им последовательности) таких рекомбинантных флавивирусов. Кроме того, это изобретение относится к применению рекомбинантных флавивирусов, описанных в настоящем описании, для получения инактивированных вакцин. Также это изобретение относится к способам аттенуации флавивирусных вакцин-кандидатов, включающим в себя внесение в флавивирусные вакцины-кандидаты одной или нескольких мутаций, которые снижают висцеротропизм флавивирусных вакцин-кандидатов, как описано в настоящем описании.
Это изобретение обладает несколькими преимуществами. Вирусы, подвергаемые мутациям по этому изобретению, представляют собой живые аттенуированные флавивирусы, которые сохраняют способность инфицировать клетки млекопитающих. Вследствие того, что вирусы являются инфекционными, важно убедиться в том, что они являются достаточно аттенуированными, чтобы не приводить к заболеванию вакцинированных субъектов. Настоящее изобретение относится к подходам к регуляции флавивирусных вакцин-кандидатов, обеспечивающей, таким образом, возможность продукции безопасных вакцин. Рекомбинантные флавивирусы по этому изобретению также обладают преимуществами, поскольку они являются относительно безопасными по сравнению с исходными штаммами и штаммами дикого типа. Этот признак является преимущественным с точки зрения их применения и введения в качестве живых аттенуированных вакцин, а также с точки зрения их получения и применения в качестве инактивированных вакцин.
Другие признаки и преимущества этого изобретения станут очевидными из следующего подробного описания, рисунков и формулы изобретения.
Краткое описание чертежей
Фиг.1A представляет собой схематическое изображение 3'-нетранслируемой области вируса желтой лихорадки, на котором показаны домены этого участка (повторяющиеся последовательности (RS), CS2, CS1 и последняя с 3'-конца структура стебель-петля), а также примеры мутаций по этому изобретению (например, dA, dB, dC, dD, d7, d14, CS2 d5 и CS2 d16).
Фиг.1B представляет собой схематическое изображение последовательности и вторичной структуры 3'-нетранслируемой области вируса желтой лихорадки с середины 3 элемента RS и до конца UTR (Proutski et al., J. Gen. Virol. 78:1543-1549, 1999).
Фиг.1C представляет собой схематическое изображение предсказания оптимальной вторичной структуры 3'UTR YF17D, проведенного с использованием алгоритма укладки РНК Zuker.
Фиг.1D представляет собой схематическое изображение эффектов делеций в 3'UTR (показанных для делеции dC; способ Zuker) на оптимальную структуру YF17D (сравнить с фиг.1C).
Фиг.1Е представляет собой схематическое изображение эффекта спонтанного увеличения размера делеции в вирусе dC от 5 нуклеотидов (на уровне Р2) до 24 нуклеотидов (на уровне Р5) на предсказанную вторичную структуру (сравнить с фиг.1D и фиг.1C). Увеличенный размер делеции приводит к структуре, сходной с исходной оптимальной структурой YF17D.
Фиг.2А представляет собой схематическое изображение последовательности капсидного белка вируса клещевого энцефалита, а также делеций в этом белке, описанных Kofler et al., J. Virol. 76:3534-3543, 2002.
Фиг.2В представляет собой схематическое изображение последовательности капсидного белка YF17D. Участки, предсказанные с помощью компьютерного анализа, как обладающие α-спиральной вторичной структурой (α-спирали I-IV), а также гидрофобными участками, указаны (SCQ ID №6=Фиг.2B).
Фиг.3 представляет собой схематическое изображение модели гомологии гомодимера белка Е YF, показывающей расположение остатков, которые отличаются между YF дикого типа (Asibi) и штаммом вакцины YF17D.
Фиг.4 представляет собой схематическое изображение мембранного белка (M) и оболочечного белка (E) вируса лихорадки западного Нила, показывающее различные сочетания мутаций, внесенных в эти участки с использованием двухплазмидного подхода.
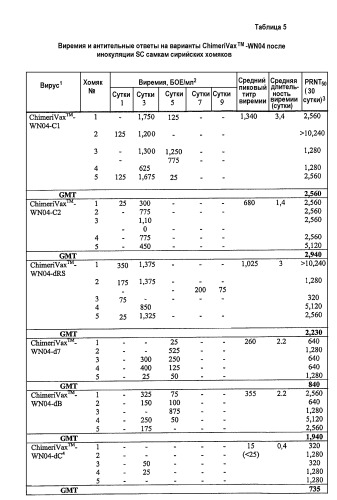
Фиг.5 представляет собой график, на котором представлена кинетика роста выбранных вариантов ChimeriVax™-WN04 и контролей в WN02 с крупными бляшками (вакцина со сниженной аттенуацией) и мелкими бляшками.
Подробное описание
Настоящее изобретение относится к рекомбинантным флавивирусам, которые можно использовать в терапевтических способах, таких как способы вакцинации. Основной чертой флавивирусов по этому изобретению является наличие аттенуирующих мутаций в геномах вирусов. Эти мутации могут аттенуировать вирус, например, посредством уменьшения висцеротропизма и/или нейротропизма вирусов. Мутации могут находиться в участках генома флавивируса, включающих в себя 3'-нетранслируемую область (3'UTR), последовательности капсида и/или последовательности оболочки. Как описано ниже, мутации по этому изобретению можно использовать для регуляции аттенуации вакцинных штаммов, которые уже включают в себя одну или несколько других аттенуирующих мутаций. Таким образом, например, мутации по этому изобретению можно идентифицировать по результату в виде снижения размера бляшек в анализах бляшкообразования и/или снижения виремии в моделях на животных (см. ниже). Мутации по этому изобретению, таким образом, обеспечивают дополнительный уровень безопасности в отношении аттенуации таких вирусов. Подробное описание вирусов и способов по этому изобретению представлено ниже.
Одним примером флавивируса, который можно подвергать мутациям по этому изобретению, является вирус желтой лихорадки, например, вакцинный штамм YF17D (Smithburn et al., "Yellow Fever Vaccination", World Health Org., p.238, 1956; Freestone, in Plotkin et al. (eds.), Vaccines, 2nd edition, W.B.Saunders, Philadelphia, 1995). Также по этому изобретению можно использовать другие штаммы вируса желтой лихорадки, например YF17DD (регистрационный номер GenBank №U 17066) и YF17D-213 (регистрационный номер GenBank №U17067) (dos Santos et al., Virus Res. 35:35-41, 1995), YF17D-204 France (X15067, X15062), YF17D-204, 234 US (Rice et al., Science 229:726-733, 1985; Rice et al., New Biologist 1:285-296, 1989; C 03700, K 02749), и штаммы вируса желтой лихорадки, описанные Galler et al., Vaccine 16 (9/10):1024-1028, 1998.
Дополнительные флавивирусы, которые можно подвергать мутациям по этому изобретению, включают в себя другие переносимые москитами флавивирусы, такие как вирусы японского энцефалита (например, SA14-14-2), денге (серотипы 1-4), энцефалита долины Муррей, энцефалита Сент-Луис, лихорадки западного Нила, Кунжун, энцефалита Росио и Ильеус; клещевые флавивирусы, такие как вирусы центрально-европейского энцефалита, сибирского энцефалита, русского весенне-летнего клещевого энцефалита, киасанурской лесной болезни, Алхурма, омской геморрагической лихорадки, шотландского энцефалита овец, Повассан, Негиши, Абсеттаров, Гансалова, Апои и Hypr; а также вирусы из вирусов рода Hepaci (например, вирус гепатита C). Все эти вирусы обладают некоторой способностью к инфицированию внутренних органов. Висцеротропизм этих вирусов может приводить к дисфункции жизненно важных внутренних органов, однако репликация вируса в этих органах может вызывать виремию и, таким образом, приводить к проникновению в центральную нервную систему. Таким образом, в дополнение к снижению риска повреждения внутренних органов, снижение висцеротропизма этих вирусов посредством мутагенеза может уменьшить их способность проникать в головной мозг и вызывать энцефалит.
В дополнение к перечисленным выше вирусам, а также к другим флавивирусам, также к этому изобретению относятся химерные флавивирусы, которые включают в себя один или несколько типов мутаций, указанных выше. Эти химеры могут состоять из флавивируса (т.е. основного флавивируса), в котором структурный белок (или белки) заменен соответствующим структурным белком (или белками) второго вируса (т.е. тестируемого или предопределенного вируса, такого как флавивирус; см., например, патент США №6696281; патент США №6184024; патент США №6676936 и патент США №6497884). Например, химеры могут состоять из основного флавивируса (например, вируса желтой лихорадки), в котором мембранный и оболочечный белки заменены мембранным и оболочечным белками второго тестируемого вируса (например, вируса лихорадки западного Нила, вируса денге (серотип 1, 2, 3 или 4), вируса японского энцефалита или другого вируса, такого как любой из упомянутых в настоящем описании вирусов). Химерные вирусы можно получать из любого сочетания вирусов, однако, как правило, источником встраиваемого структурного белка(ов) является вирус, против которого хотят достичь иммунитета.
Конкретным примером типа химерного вируса, который можно подвергать мутациям по настоящему изобретению, является вакцинный штамм вируса желтой лихорадки человека, YF17D, в котором мембранный и оболочечный белки заменены мембранным и оболочечным белками другого флавивируса, такого как вирус лихорадки западного Нила, вирус денге (серотип 1, 2, 3 или 4), вирус японского энцефалита, вирус энцефалита Сент-Луис, вирус энцефалита долины Муррей или любой другой флавивирус, такой как один из перечисленных выше вирусов. Химерные флавивирусы, полученные с использованием этого подхода, обозначают как так называемые вирусы "ChimeriVax". Для получения вирусов по этому изобретению можно использовать следующие химерные флавивирусы, которые были получены с использованием технологии ChimeriVax™ и депонированы в Американской коллекции типовых культур (ATCC) в Manassas, Virginia, U.S.A. по условиям Будапештского договора и которым присвоена дата депонирования 6 января 1998 года: химерный вирус желтой лихорадки 17D/Денге типа 2 (YF/DEN-2; ATCC регистрационный номер ATCC VR-2593) и химерный вирус желтой лихорадки 17D/японского энцефалита SA14-14-2 (YF/JE A1.3; ATCC регистрационный номер ATCC VR-2594). Подробные описания получения химерных вирусов, которые можно использовать по этому изобретению, представлены, например, в следующих публикациях: WO 98/37911; WO 01/39802; Chambers et al., J. Virol. 73:3095-3101, 1999; WO 03/103571; WO 2004/045529; патент США №6696281; патент США №6184024; патент США №6676936 и патент США №6497884.
Как указано выше, новые мутации по этому изобретению находятся в последовательностях 3'UTR, капсида и/или оболочки флавивирусов, включая химерные флавивирусы. Каждый из этих типов мутаций, которые можно объединять друг с другом и/или с другими аттенуирующими мутациями, описан ниже.
Мутации 3'-нетранслируемой области
Организация 3'UTR вакцинного штамма вируса желтой лихорадки, YF17D, которая является общей для всех вирусов ChimeriVax™, представлена на фиг.1A. Она включает в себя в порядке от 3'-конца: (i) последнюю с 3'-конца структуру стебель-и-петля, которая, предположительно, выполняет функцию промотора для синтеза минус-цепи РНК и является консервативной у всех флавивирусов, (ii) два элемента консервативной последовательности, CS1 и CS2, которые обладают высокой степенью гомологии нуклеотидной последовательности с другими переносимыми москитами флавивирусами, и (iii) уникальные для штаммов вируса желтой лихорадки Восточной Африки, включая вакцинный вирус YF17D, три копии элемента повторяющихся последовательностей (RS), расположенные на 5'-конце 3'UTR (Chambers et al., Annu. Rev. Microbiol. 44:649-688, 1990). 3'UTR также включает в себя ряд предсказанных структур стебель-петля, таких как структуры в неконсервативном участке ниже элементов RS, как представлено на фиг.1B.
Мутации 3'UTR по настоящему изобретению, как правило, представляют собой короткие аттенуирующие делеции, например менее чем 30 нуклеотидов (например, 1, 2, 3 и т.д.) и вплоть до 29 (например, длиной 2-25, 3-20, 4-15, 5-10 или 6-8 нуклеотидов). При внесении в вакцины-кандидаты по отдельности или совместно с другими аттенуирующими мутациями новые мутации по этому изобретению могут обеспечивать дополнительный уровень аттенуации, таким образом, обеспечивая подход для регуляции уровня аттенуации вакцины-кандидата. В некоторых примерах короткие делеции 3'UTR по этому изобретению разрабатывают для дестабилизации вторичной структуры одной или нескольких из предсказанных структур стебля в 3'UTR и/или общей структуры 3'UTR. В дополнение к делециям, мутации в таких структурах также могут включать в себя замены, которые аналогично приводят к дестабилизации структуры стебля. В определенных примерах, структуры стебель-петля, которые подвергают мутациям по этому изобретению, находятся в неконсервативных участках 3'UTR или в консервативных участках, которые допускают такие мутации (например, в CS2). Например, для 3'UTR вируса желтой лихорадки (например, YF17D), как в случае неизмененного вируса желтой лихорадки, так и в случае химеры на основе вируса желтой лихорадки, дестабилизирующие структуру стебля мутации могут находиться в любой одной или нескольких структурах стебля, представленных на фиг.1B, на которой показаны четыре примера таких делеций (dA, dB, dC и dD), которые описаны далее. Таким образом, в дополнение к этим конкретным примерам, другие примеры мутаций 3'UTR в вирусе желтой лихорадки включают в себя мутации, которые содержат, например, 1-2, 3-8, 4-7 или 5-6 нуклеотидов в следующих последовательностях структур стеблей, которые представлены на фиг.1B, от 5'-конца к 3'-концу: TGGAG, CTCCA, GACAG, TTGTC, AGTTT, GGCTG, CAGCC, AACCTGG, TTCTGGG, CTACCACC, GGTGGTAG, GGGGTCT, AGACCCT, AGTGG и TTGACG.
В дополнение к мутациям, дестабилизирующим структуру стебля, мутации по этому изобретению также включают в себя другие короткие делеции в 3'UTR. Например, это изобретение относится к определенным мутациям, которые находятся в пределах мутации Δ30, описанной выше. Таким образом, например, это изобретение относится к любым приемлемым мутациям, которые представляют собой 1, 2, 3 и т.д. и вплоть до 29 (например, 1-25, 2-20, 3-15, 4-14, 5-13, 6-12, 7-11, 8-10 или 9) нуклеотидов в длину в пределах этого участка. В качестве конкретного примера, это изобретение относится к делеции d7, в которой удалены следующие нуклеотиды из этого участка в YF17D: нуклеотиды 345-351 (AAGACGG; нумерация от 1 нуклеотида 3'UTR после кодона терминации UGA вирусной ORF; фиг.1A). Мутации, которые включают в себя делецию, например, 1, 2, 3, 4 или 5 дополнительных нуклеотидов с 3'-конца или 5'-конца этой последовательности, также относятся к этому изобретению. В других примерах, к этому изобретению относятся короткие делеции в консервативных последовательностях CS1 и CS2. Эти мутации могут включать в себя делецию, например, 1-29, 2-25, 3-20, 4-15, 5-10 или 6-8 нуклеотидов этих последовательностей. В качестве двух конкретных примеров, которые описаны ниже, из YF17D-специфичной CS2 3'UTR удалены нуклеотиды 360-364 (GGTTA; CS2d5; фиг.1A) и/или нуклеотиды 360-375 (GGTTAGAGGAGACCCT; CS2d16; фиг.1A). Мутации, которые включают в себя делецию, например, 1, 2, 3, 4 или 5 дополнительных нуклеотидов с 3'-конца или 5'-конца этой последовательности, также относятся к этому изобретению. Для других флавивирусных 3'UTR можно проводить сходные мутации, исходя из вторичных структур 3'UTR. Предсказание вторичных структур 3'UTR других флавивирусов опубликовано, например, для денге, Кунжун и TBE (см., например, Proutski et al., Virus Res. 64:107-123, 1999) и HCV (см., например, Kolykhalov et al., J. Virol. 70:3363-3371, 1996). Кроме того, множество нуклеотидных последовательностей 3'UTR многих штаммов флавивирусов, соответствующих всем четырем основным серокомплексам (YF, JE, денге и TBE), являются доступными в GenBank. Последовательности дополнительных штаммов можно определить посредством секвенирования вируса. Вторичные структуры этих последовательностей можно легко предсказать с использованием стандартного программного обеспечения (например, программы mfold или RNAfold) для выявления потенциальных структур стебель-петля, которые можно подвергать мутагенезу.
Как описано ниже, мутации 3'UTR по этому изобретению можно использовать для обеспечения дальнейшей аттенуации уже аттенуированных вакцин-кандидатов. Таким образом, одну или несколько из мутаций 3'UTR, описанных в настоящем описании (например, d7, dB, dC и/или dD), можно вносить для обеспечения дополнительного уровня безопасности вакцинного штамма вируса желтой лихорадки YF17D. Необязательно, мутацию(ии) 3'UTR можно вносить в этот штамм с одной или несколькими дополнительными аттенуирующими мутациями, такими как аттенуирующая мутация в шарнирной области оболочечного белка вируса (например, замена любой одной или нескольких из аминокислот оболочечного белка 48-61, 127-131 и 196-283, например аминокислоты 279, или одной или нескольких аминокислот оболочечного белка в вирусе желтой лихорадки, соответствующих аминокислотам 204, 252, 253, 257, 258 и 261 вируса денге 1 (см., например, WO 03/103571); шарнирная область оболочечных белков флавивируса расположена между доменами I и II; см., например, Rey et al., Nature 375:291-298, 1995), мутация аминокислот мембранного белка вируса желтой лихорадки (например, мембранной части в виде спирали мембранного белка, например, аминокислоты, соответствующей положению 66 в мембранном белке вируса лихорадки западного Нила) или любые мутации капсида или оболочечного белка, описанные в настоящем описании (например, аминокислотные замены в положениях, соответствующих аминокислотам вируса лихорадки западного Нила 138, 176, 177, 244, 264, 280, 313, 316, 380 и 440, отдельно или в сочетании).
Действительно, можно объединять указанные мутации или делеции в 3'UTR с одной или несколькими мутациями или делециями в гене капсида (как описано ниже), в гене prM (например, в положениях M5 или M60 химер YF-японский энцефалит или в M66 в химерах YF-WN или в расположенных рядом аминокислотах (см. PCT/US2005/037369 и ниже)) или в гене E в участках, о которых известно, что они аттенуируют флавивирусы. Ген E содержит функциональные домены, аминокислотные замены в которых могут нарушать функцию и, таким образом, снижать вирулентность, как описано Hurrelbrink and McMinn (Adv. Virus Dis. 60:1-42, 2003). Функциональные участки белка E, в которые можно вносить мутации, которые совместно с делециями/мутациями 3'UTR, описанными в настоящей заявке, могут приводить к должным образом аттенуированной вакцине, включают в себя: a) предполагаемый связывающий рецептор участок на наружной поверхности домена III, b) молекулярную шарнирную область между доменами I и II, которая определяет зависимые от кислот конформационные изменения белка E в эндосоме и снижает эффективность интернализации вируса; c) область контакта белков prM/M и E, участок белка E, который контактирует с prM/M после перестройки из димера в тример после воздействия низких значений pH в эндосоме; d) конец домена слияния домена II, который вовлечен в слияние с мембраной эндосомы в ходе процесса интернализации; и e) якорный участок в виде стебля, который также функционально вовлечен в конформационные изменения белка E в ходе индуцируемых кислотой процессов слияния.
Мутации 3'UTR также можно вносить в химерные флавивирусные вакцины-кандидаты. В одном примере, который описан ниже, одну или несколько мутаций 3'UTR, описанных в настоящем описании, вносят в вакцину-кандидат (обозначаемую в настоящем описании как ChimeriVax™-WN02), которая включает в себя