Фармацевтическая композиция на основе наномицелл, содержащих эпигаллокатехингаллат, и ее применение для лечения атопического дерматита, болезни крона, аденомиоза и гиперпластических заболеваний предстательной железы
Иллюстрации
Показать всеИзобретение относится к области фармацевтической промышленности, в частности к композиции, содержащей эпигаллокатехин-3-галлат в качестве активного компонента и целевую добавку. Фармацевтическая композиция для перорального введения, содержащая эпигаллокатехин-3-галлат и блок-сополимер оксиэтилена и оксипропилена, в котором содержание гидрофобного блока составляет менее 50 мас.%, а молекулярная масса гидрофильного блока составляет 2250 Да и более при определенном массовом соотношении эпигаллокатехин-3-галлата и блок-сополимера 1.1-10:1. Применение вышеописанной фармацевтической композиции для лечения атонического дерматита, болезни Крона, аденомиоза и гиперпластических заболеваний предстательной железы. Композиция обладает повышенной биодоступностью при пероральном применении, улучшает абсорбцию активного соединения - эпигаллокатехин-3-галлата в кровоток. 2 н. и 4 з.п. ф-лы, 2 ил., 4 табл., 10 пр.
Реферат
Изобретение относится к области фармации и касается новых фармацевтических композиций для пероральной доставки эпигаллокатехин-3-галлата (EGCG) и способов лечения заболеваний с их помощью.
Роль соединений растительного происхождения в создании новых лекарственных препаратов в последние годы вызывает небывалый интерес. Этому вопросу посвящены многочисленные исследования, в результате которых выявлен ряд соединений, обладающих широким спектром биологических активностей, таких как флавоноиды, флавины, катехины и др.
Наибольший интерес в последнее время вызывают полифенолы зеленого чая, в основном катехины, обладающие целым спектром защитных эффектов. Водный экстракт зеленого чая содержит эпигаллокатехин-3-галлат (epigallocatechin-3-gallate, EGCG), эпигаллокатехин (epigallocatechin, EGC), эпикатехин-3-галлат (epicatechin-gallate, ECG) и эпикатехин (epicatechin, EC).
Известно, что как антиоксидант EGCG в 100 раз более эффективен, чем витамин С и в 25 раз более эффективен, чем витамин Е (α-токоферол). Антиоксидантная природа катехинов обусловлена самой их химической природой, а именно обилием в их составе гидроксильных групп, превращающих данные соединения в молекулярные "ловушки" свободных радикалов, которые повреждают структуру ДНК клетки и клеточные мембраны. По сути, это самое первое свойство, благодаря которому EGCG стал рассматриваться как заслуживающее пристального внимания биологически активное вещество. И до сих пор способность EGCG и других чайных катехинов защищать здоровые клетки от оксидативного стресса является одним из наиболее изучаемых вопросов.
Важнейшим дополнительным свойством EGCG является мощный антипролиферативный потенциал: клетками-мишенями являются все клетки, где наблюдается стимуляция экспрессии сигнальных каскадов, от которых зависит рост и количество данного типа клеток. Модуляция вышеуказанных процессов катехинами характеризует их с позиций мощных противовоспалительных, антипролиферативных, антиангиогенных природных компонентов (By Hirofumi Tachibana (2011) Green tea polyphenol sensing, Proc. Jpn. Acad., 87, 66-80; Nurulain Т. Zaveri (2006) Green tea and its polyphenolic catechins: Medicinal uses in cancer and noncancer applications. Life Sciences, 78, 2073-2080).
Максимально возможное потребление чая в течение дня приводит к увеличению концентрации EGCG до 326 нг/мл в плазме человека. Время полувыведения EGCG составляет 5-5,5 часов, что намного выше, чем у других катехинов. Побочные эффекты при приеме эпигаллокатехинов начинают проявляться только при очень высоких дозировках, превышающих граммы.
В настоящее время проводятся многочисленные исследования свойств и эффектов катехинов зеленого чая. Так, недавно, были получены данные по противовирусной активности катехинов зеленого чая в отношении различных вирусов. Активность катехинов была исследована в отношении вирусов простого герпеса, аденовирусов, вирусов гриппа и иммунодефицита человека (Li S, Hattori Т, Kodama EN. (2011) Epigallocatechin gallate inhibits the HIV reverse transcription step, Antivir Chem Chemother, 21(6), 239-243).
Было показано, что в системах in vitro катехины значительно подавляют инфекционную активность вируса простого герпеса, воздействуя, главным образом, на стадии прикрепления вируса и проникновения его в клетку хозяина, а также на более поздние стадии вирусной инфекции (Cheng HY, Lin CC, Lin TC (2002) Antiviral properties of prodelphinidin B-23, -O-gallate from green tea leaf, Antivir Chem Chemother, 13 (4), 223-229).
Что касается гриппозной инфекции, то недавно учеными из Кореи были опубликованы данные по противогриппозной активности катехинов зеленого чая в отношении вирусов гриппа типа A (H1N1 и H3N2) и типа В. Исследования показали гемагглютинингибирующую активность ряда катехинов, причем действие эпигаллокатехина было более выраженным. В клетках МДСК эпигаллокатехин изменял физические свойства вирусной мембраны, тем самым нарушая жизнедеятельность вируса, подавлял синтез вирусной РНК и ингибировал нейраминидазную активность. То есть, по существу, действовал практически на все стадии вирусной инфекции (Song JM, Lee KH, Seong BL (2005) Antiviral effect of catechins in green tea on influenza virus, Antiviral Res., 68 (2), 66-74). Сходные результаты по противовирусной активности эпигаллокатехина были получены в НИИ гриппа РАМН в системах in vitro. В настоящее время ведутся работы по изучению механизмов антивирусной активности эпигаллокатехина и исследования на животных моделях.
Кроме того, были получены данные по антитромботической активности катехинов. Эпигаллокатехин в этом аспекте наиболее эффективен (Kang WS, Lim IH, Yuk DY, Chung RY, Park JB, Yoo HS, Yun YP. (1999) Antithrombotic activities of green tea catechins and epigallocatechins gallate, Thromb Res, 96 (3), 229-237), что чрезвычайно важно при лечении гриппа, так как известно, что патогенетические механизмы развития гриппозной инфекции включают в себя и воздействие на сосудистую систему, приводящее к агрегации тромбоцитов, что, в свою очередь, приводит к таким частым осложнениям гриппа, как инфаркты и инсульты.
В настоящее время считается доказанным, что противовоспалительная активность EGCG основана на его способности блокировать цитокинзависимые пути стимуляции патологической клеточной пролиферации.
Необходимо упомянуть и о способности EGCG повышать общую иммунную реактивность организма.
Понятно, что общий иммунный статус чрезвычайно важен для реализации полноценной противовоспалительной реакции в том или ином органе или ткани и нарушение иммунного ответа является важнейшим звеном в патогенезе многих гиперпластических и инфекционных заболеваний.
Иммуномодулирующие свойства EGCG заключаются, во-первых, в нормализации патологического иммунного ответа организма, имеющего место, в частности, при аллергических реакциях. Кроме того, EGCG восстанавливает баланс Th1- и Th2-подтипов Т-хелперных лимфоцитов - важных участников иммунного ответа (В.И.Киселев, А.А.Ляшенко (2005). Молекулярные механизмы регуляции гиперпластических процессов. М., изд. "Димитрейд График Групп").
Однако противовоспалительная активность EGCG является только одной из многочисленных биологических активностей данного соединения.
Другим важнейшим свойством EGCG является его способность, с одной стороны, подавлять патологический клеточный рост, опосредованный полипептидными ростовыми факторами (в частности, эпидермальным фактором роста), а с другой стороны, вызывать избирательный апоптоз клеток с аномально высокой пролиферативной активностью. Таким образом, EGCG является мощным блокатором гиперпластических процессов в эпителиальных тканях различного происхождения (Sah JF, Balasubramanian S, Eckert RL, Rorke EA. (2004) Epigallocatechin-3-gallate Inhibits Epidermal Growth Factor Receptor Signaling Pathway, J. Biol. Chem., 279, 12755-12762; Masuda M, Suzuki M, Lim J.T.E., Weinstein I.B (2003) Epigallocatechin-3-gallate Inhibits Activation of HER-2/neu and Downstream Signaling Pathways in Human Head and Neck and Breast Carcinoma Cells, din. Cancer Res., 9, 3486-3491).
Помимо этого EGCG выраженно тормозит патологический рост кровеносных сосудов (патологический неоангиогенез) - процесс, часто сопровождающий гиперпластические процессы (Sylvie Lamy, Denis Gingras, Richard Beliveau (2002) Green tea catechins inhibit vascular endothelial growth factor receptor phosphorylation, Cancer Res, 62, 381-385).
На сегодняшний день онкопротекторные свойства EGCG можно считать полностью доказанными и хорошо документированными. Достоверно установлена способность EGCG блокировать молекулярные механизмы, приводящие к патологическому увеличению числа клеток (патологической пролиферации), патологическому неоангиогенезу (росту сосудов) и повышению инвазивной активности трансформированных клеток. К настоящему моменту идентифицировано большое число молекулярных мишеней, ингибируемых EGCG и опосредующих все звенья патогенеза гиперпластических процессов и злокачественного роста. В экспериментальных, клинических и широкомасштабных эпидемиологических исследованиях биологическая активность EGCG и других чайных катехинов показана в отношении огромного числа предопухолевых и опухолевых заболеваний молочной железы, яичников, шейки матки, эндометрия, простаты, кожи, желудочно-кишечного тракта (ротовой полости, пищевода, желудка, тонкого и толстого кишечника, печени, поджелудочной железы), легких (Yang CS, Landau JM, Huang MT, Newmark HL (2001) Inhibition of carcinogenesis by dietary polyphenolic compounds, Annu. Rev. Nutr., 21, 381-406; Fujiki H, Suganuma M, Okabe S et al. (1996) Japanese green tea as a cancer preventive in humans).
Большая часть наблюдений, подтверждающих широкий спектр биологических свойств эпигаллокатехинов, получена в экспериментах in vitro. Максимальная активность EGCG в работе с клеточными линиями наблюдалась в концентрации 10-50 мкм (Naghma Khan, Farrukh Afaq, Mohammad Saleem, Nihal Ahmad, and Hasan Mukhtar (2006) Targeting Multiple Signaling Pathways by Green Tea Polyphenol Epigallocatechin-3-Gallate, Cancer Res, 66 (5)).
Тогда как при приеме препаратов, содержащих катехины зеленого чая, максимальная концентрация EGCG в плазме испытуемых не превышала 1 мкм, повышение дозировок приводило к появлению побочных эффектов, но не отражалось существенно на содержании EGCG в крови (Н-Н. Sherry Chow, Yan Cai, David S. Alberts, et al. (2001) Polyphenon E Single-dose Administration of Epigallocatechin Gallate and Phase I Pharmacokinetic Study of Tea Polyphenols following, Cancer Epidemiol Biomarkers Prev, 10, 53-58).
Авторы, исследующие фармакокинетику EGCG, приходят к заключению, что это обусловлено низкой биодоступностью катехинов. По разным данным биодоступность катехинов не превышает 1%. При таких параметрах биодоступности пероральный прием катехинов не позволит достичь необходимого терапевтического уровня катехинов в органах мишенях, а, следовательно, добиться устойчивого лечебного эффекта. В связи с этим предпринимаются различные попытки улучшения этого параметра путем создания различных формуляций на основе катехинов (Imtiaz A. Siddiqui, Vaqar M. Adhami, Dhruba J. Bharali, Bilal B. Hafeez, Mohammad, Asim, Sabih I. Khwaja, Nihal Ahmad, Huadong Cui, Shaker A. Mousa, and Hasan, Mukhtar (2009) Introducing Nanochemoprevention as a Novel Approach for Cancer Control: Proof of Principle with Green Tea Polyphenol Epigallocatechin-3-Gallate, Cancer Res., 69(5), 1712-1716; Kristin R. Landis-Piwowar, Congde Huo, Di Chen, Vesna Milacic, Guoqing Shi, Tak Hang Chan and Q. Ping Dou (2007) A Novel Prodrug of the Green Tea Polyphenol Epigallocatechin-3-Gallate as a Potential Anticancer Agent, Cancer Res, 67, 4303-4310).
Авторами показано, что EGCG в составе наночастиц, полученных на основе полимеров молочной кислоты и полиэтиленгликоля, обладает такой же фармакологической активностью в дозах примерно в 10 раз ниже по сравнению с дозами свободного EGCG. превышающую таковую у препаратов без формуляции. Эти данные воспроизводились не только на клеточных линиях, но и на моделях in vivo при внутрибрюшинном введении препарата. Полученные результаты позволяют с большой уверенностью предположить, что увеличение биодоступности приводит к существенному увеличению биологических эффектов. Однако авторы не приводят данных о том, что повышение дозы нанонкапсулированного EGCG позволяет получить фармакологическую активность препарата по сравнению со свободным EGCG. Более того, такое решение имеет один существенный недостаток, признаваемый самими авторами. Дело в том, что используемые в данной работе полимеры крайне не устойчивы в кислой среде желудка и по этой причине могут быть использованы только в инъекционной форме. Известна попытка использовать липосомальную форму EGCG (Jia-You Fang, Woan-Ruoh Lee, Shing-Chuan Shen, Yen-Ling Huang (2006) Effect of liposome encapsulation of tea catechins on their accumulation in basal cell carcinomas, Journal of Dermatological Science, 42, 101-109). Однако положительный эффект этой композиции был получен только при наружном и подкожном использовании препарата.
Наиболее близкой к предложенной можно считать недавно описанную фармацевтическую композицию на основе нанолипидных частиц, позволяющих повысить оральную биодоступность EGCG примерно в два раза (Adam Smith, Brian Giuntac, Paula С.Bickfordb, Michael Fountaine, Jun Tana, and R. Douglas Shytle (2010) Nanolipidic particles improve the bioavailability and α-secretase inducing ability of epigallocatechin-3-gallate (EGCG) for the treatment of Alzheimer's disease, International Journal of Pharmaceutics, 389, 207-212). Однако двукратное увеличение биодоступности не позволяет в полной мере использовать фармацевтический потенциал EGCG. Поэтому создание формуляции EGCG, повышающих его биодоступность и пригодных для перорального использования, сохраняют свою актуальность.
Задачей настоящего изобретения явилось получение наномицеллярных структур, содержащих EGCG и обеспечивающих технический результат - повышение биодоступности при пероральном применении.
Задача решается новой фармацевтической композицией для перорального введения, содержащей эпигаллокатехин-3-галлат в качестве активного компонента и целевую добавку, которая содержит в качестве целевой добавки блок-сополимер оксиэтилена и оксипропилена, в котором содержание гидрофобного блока составляет менее 50 мас.%, а молекулярная масса гидрофильного блока составляет 2250 Да и более, при массовом соотношении активного компонента и блок-сополимера 1:1-10:1.
При этом в качестве блок-сополимера оксиэтилена и оксипропилена композиция может содержать Плюроник F127
Кроме того, фармацевтическая композиция может содержать дополнительно фармацевтически приемлемый носитель.
При этом фармацевтическая композиция может представлять собой таблетку, или лиофилизированный порошок, или суспензию, или капсулу.
Задача также решается применением вышеописанной фармацевтической композиции для лечения атопического дерматита, болезни Крона, аденомиоза и гиперпластических заболеваний предстательной железы.
Используемые в предложенной композиции блок-сополимеры оксиэтилена и оксипропилена также известны под названием «Плюроник» или «Полоксамер».
Гидрофобно-гидрофильные свойства плюроников и их способность солюбилизировать водонерастворимые соединения определяются размерами и соотношением полиоксиэтиленового (гидрофильного) и полиоксипропиленового (гидрофобного) блоков полимера. Несмотря на то, что указанные блок-сополимеры широко используются в фармацевтических и косметических композициях, в том числе и для увеличения растворимости гидрофобных водонерастворимых соединений (Foster В, Cosgrove Т, Hammouda В (2009) Pluronic triblock copolymer systems and their interactions with ibuprofen, Langmuir, 25(12), 6760-6766), требуется индивидуальное решение об их использовании для каждого конкретного лекарства.
Анализ растворимости EGCG в плюрониках с различным содержанием гидрофобных и гидрофильных блоков показал, что полимеры, содержащие 50 мас.% и более гидрофильного блока, обладают более высокой солюбилизирующей способностью, чем полимеры, содержащие менее 50 мас.% гидрофильного блока. При этом известно, что у ряда плюроников молекулярная масса гидрофобного блока постоянная, а весовое процентное содержание полиоксиэтиленового блока изменяется.
Неожиданно оказалось, что биодоступность EGCG зависит также и от молекулярной массы гидрофильного блока. Более высокую биодоступность обеспечивают блок-сополимеры оксиэтилена и оксипропилена, в которых содержание гидрофобного блока составляет менее 50 мас.%, а молекулярная масса гидрофильного блока составляет 2250 Да и более. Наиболее эффективным оказался плюроник F127, позволяющий получить стабильные водные дисперсии, содержащие более 50 мг/мл EGCG. Пероральное введение такой композиции EGCG крысам позволило значительно (более чем в 10 раз) повысить его биологическую доступность, выражаемую как системную экспозицию к препарату. Массовое соотношение активного компонента и выбранного блок-сополимера может варьировать в зависимости от желательной длительности высвобождения и составляет в среднем 10:1-2:1. Наиболее оптимальное соотношение плюроника EGCG и оказалось 1:1,5.
Композиции согласно изобретению могут быть получены, например, путем совместного или раздельного растворения компонентов в подходящих растворителях, таких как вода, спиртовые или водно-спиртовые растворы, последующего смешения полученных растворов в необходимых пропорциях.
Полученные растворы далее могут быть объединены и высушены для получения твердой лекарственной формы. Высушивание производят любым технологически подходящим методом или их комбинацией, включая, но не ограничиваясь, такие методы, как упаривание на роторном испарителе или спидваке, лиофильная сушка, сушка в потоке.
Готовые лекарственные формы могут быть получены путем таблетирования высушенных композиций с использованием необходимых эксципиентов, например стеарата натрия, лактозы, производных целлюлозы и др.
Готовые лекарственные формы могут быть получены путем упаковки высушенных композиций в капсулы, например желатиновые капсулы с твердой оболочкой.
Настоящее изобретение также относится к методам лечения заболеваний с помощью предложенных фармацевтических композиций, содержащих эффективное количество EGCG.
Учитывая вышеупомянутые молекулярные мишени действия EGCG, a именно восстановление процессов апоптоза, антипролиферативную, противоопухолевую и антиангиогенную активность, противовирусную активность, описанные составы предлагаются для лечения таких пролиферативных заболеваний как миома матки, аденомиоз, гиперпластические заболевания предстательной железы.
Эффективное количество эпигаллокатехин-3-галлата, необходимое для лечения и профилактики, может варьироваться в зависимости от вида и тяжести заболевания, возраста и состояния пациента и может быть определено в каждом конкретном случае лечащим врачом. При этом используемые дозы находятся в пределах от 2 до 2000 мг в сутки.
Изобретение иллюстрируется чертежами, где:
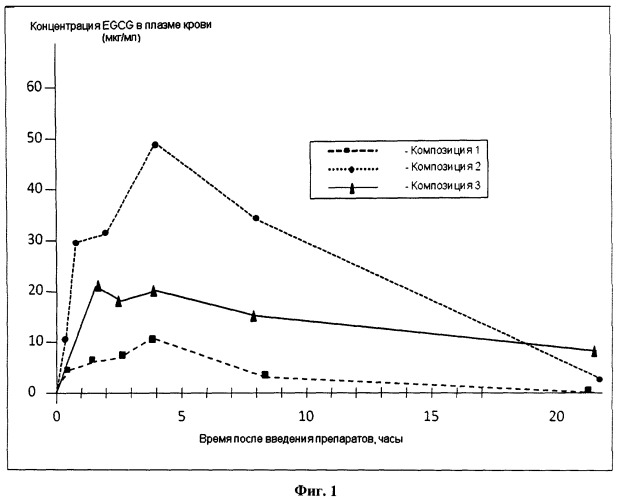
на фиг.1 показаны графики зависимости концентрации EGCG в плазме крыс от времени после введения препарата для трех композиций:
Композиция 1 - EGCG - 500 мг/кг
Композиция 2 - EGCG/F127 - 500 мг/кг
Композиция 3 - EGCG/F127 - 100 мг/кг,
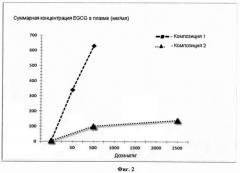
на фиг.2 показаны графики зависимости суммарной концентрации EGCG в плазме крыс от дозы EGCG для двух композиций:
Композиция 1 - EGCG/F127
Композиция 2 - Контроль EGCG.
Изобретение также иллюстрируется следующими примерами.
Пример 1
Изготовление композиции EGCG с плюроником F127 для исследования растворимости
EGCG в количестве 50 мг растворяется в 1 мл спиртово-водного раствора (97/3 по объему), содержащего различные концентрации плюроника F127. Полученную смесь инкубируют при 20-25°С в течение 30 мин при постоянном перемешивали. Этанол выпаривают, а полученную формуляцию высушивают при глубоком вакууме. Высушенный образец суспендируют в дистиллированной воде, инкубируют 30 мин при комнатной температуре, фильтруют и определяют EGCG методом HPLC в соответствии с описанием, приведенным в примере 5. Следует отметить, что образцы свободного EGCG (содержание катехина 90%), исследуемые в этих экспериментах, имеют водную растворимость 0, 48 мг/мл. Результаты экспериментов представлены в таблице 1.
| Таблица 1 | ||
| Растворимость EGCG в водно-спиртовых растворах с различным содержанием F127 | ||
| EGCG (мг/мл) | F127 (%), вес/объем | EGCG (мг/мл) |
| 50 | 2 | 0,87 |
| 50 | 4 | 7,24 |
| 50 | 6 | 16,37 |
| 50 | 8 | 43,88 |
Как следует из представленных результатов, растворимость EGCG в 8% плюронике F-127 возрастает в 105 раз по сравнению с растворимостью в воде.
Пример 2
Изготовление композиции EGCG с плюроником F127 для орального дозирования (доза 50 мг/кг).
25 мг EGCG растворяют в 1 мл этанола, и затем полученный раствор смешивают с 1 мл 5% (вес-объем) раствора плюроника F127 в спиртово-водном растворе (97/3 по объему). Раствор инкубируют при комнатной температуре в течение 30 мин при постоянном перемешивании. Этанол выпаривают, а полученную формуляцию высушивают при глубоком вакууме. Контрольный препарат EGCG готовят путем суспендирования в дистиллированной воде в концентрации 25 мг/мл.
Пример 3
Изготовление композиции EGCG с плюроником F127 для орального дозирования (доза 100 мг/кг)
37,5 мг EGCG растворяют в 1 мл этанола и затем полученный раствор смешивают с 1 мл 6% (вес-объем) раствора плюроника F127 в спиртово-водном растворе (97/3 по объему). Раствор инкубируют при комнатной температуре в течение 30 мин при постоянном перемешивании. Этанол выпаривают, а полученную формуляцию высушивают при глубоком вакууме. Контрольный препарат EGCG готовят путем суспендирования в дистиллированной воде в концентрации 25 мг/мл
Пример 4
Изготовление композиции EGCG с плюроником F127 для орального дозирования (доза 500 мг/кг)
50 мг EGCG растворяют в 1 мл этанола, и затем полученный раствор смешивают с 1 мл 8% (вес-объем) раствора плюроника F127 в спиртово-водном растворе (97/3 по объему). Раствор инкубируют при комнатной температуре в течение 30 мин при постоянном перемешивании. Этанол выпаривают, а полученную формуляцию высушивают при глубоком вакууме. Контрольный препарат EGCG готовят путем суспендирования в дистиллированной воде в концентрации 50 мг/мл. Для тестирования максимальной концентрации EGCG (2500 мг/кг) субстанцию суспендируют в воде в концентрации 200 мг/кг.
Пример 5
Фармакокинетические исследования образцов, изготовленных в примерах 3-4
В экспериментах использовали лабораторных крыс породы Sprague-Dawley весом 250-350 гр. Все исследования на животных проводили в соответствии "Guidelines for Care and Use of Experimental Animal".
Пероральное введение контрольных препаратов EGCG проводили в дозах 100, 500 и 2500 мг/кг. Образцы формуляций EGCG вводили животным в дозах 50, 100, 500 мг/кг. После фиксированных интервалов времени (10, 30 мин, 1, 1.5, 2, 3, 8 и 24 часа) у животных забирали образцы крови, из которых после центрифугирования отбирали плазму для анализа, замораживали и хранили при -80°С до проведения исследований.
Для проведения аналитических исследований образцы плазмы размораживали, центрифугировали и разделяли по аликвотам объмом 0,1 мл. Образцы экстрагировали 3 раза в 2 мл этилацетата в течение 5 мин при постоянном встряхивании. После экстракции образцы центрифугировали при 1000 об/мин 10 мин. Супернатант отделяли и помещали в стеклянную пробирку. Органическую фазу выпаривали и высушенные образцы хранили при -80°С до хроматографического анализа.
| Таблица 2. | |||||
| Фармакокинетический профиль EGCG в плазме крыс | |||||
| Группа | Формуляция | Cmax мкг/мл | Соотношение Cmax Формул./Контроль | AUC0-24ч мкг·ч/мл | Соотношение AUC0-24ч Формул./Контроль |
| Г-1* | Контроль 2,5 г/кг | 58,6±22,4 | --- | 179,2±54,33 | --- |
| Г-2 | Контроль 500 мг/кг | 10,65±1,14 | --- | 49,23±4,95 | --- |
| Г-3 | EGCG/F127 500 мг/кг | 49,34±2,86 | 4,63 | 632,8±57,7 | 12,9 |
| Г-4 | EGCG/F127 100 мг/кг | 21,73±2,50 | 341,4±19,1 | ||
| *В группе Г-1 введение препарата в указанной дозировке приводило к гибели животных |
Для группы Г-5 (контроль, 100 мг/кг) и Г-6 (EGCG/F127, 50 мг/кг) уровень EGCG концентрации в плазме были ниже, чем LOQ и не определялся.
Результаты, представленные в таблице 2, позволяют сделать следующие выводы.
1. Формуляции EGCG, вводимые животным в дозе 500 мг/кг, повышают системную экспозицию исследуемого, вещества более чем в 10 раз превышающую таковую при назначении EGCG без формуляции.
2. Максимальная доза EGCG, введенная животным без формуляции (2500 мг/кг), является токсичной для животных. Важно отметить, что ни одна из доз формулированного EGCG не вызывала токсических реакций.
Графическая презентация данных показана на следующем рисунке - фармакокинетический профиль EGCG в плазме крыс (см. Фиг.1).
Пример 6
Зависимость концентрации EGCG от назначения различных доз контрольных препаратов и препаратов с формуляцией.
Исследовалась зависимость концентрации EGCG в плазме крыс от назначения различных доз контрольных препаратов и препаратов с формуляцией. Представленные результаты показывают, что увеличение концентрация EGCG без формуляции при назначении животным имеет нелинейный характер и выходит на плато при дозировке 500 мг/кг. Тогда как введение формуляции EGCG приводит к пропорциональному увеличению концентрации в плазме животных. На рисунке представлены результаты экспериментов (Фиг.2).
Пример 7
Эффективность предлагаемого средства при лечении атопического дерматита
Под нашим наблюдением находилось 52 больных атопическим дерматитом (АД) в возрасте от 18 до 28 лет, из них 39 мужчин (75%) и 13 женщин (25%). Кожные проявления заболевания соответствовали клинике АД с типичной для данного дерматоза морфологией и локализацией высыпаний. У больных выявлены следующие клинические формы АД: эритематозно-сквамозная со слабой или умеренной лихенификацией - у 37 пациентов (71,2%), экзематозная - у 9 больных (17,3%), пруригоподобная - у 5 (9,6%), лихеноидная - у 1 (1,9%). Тяжесть заболевания оценивалась по индексу SCORAD и колебалась в пределах от 12,2 до 61,5. Из них с легкой степенью было 32 больных (61,5%), средней - 18 больных (34,6%), тяжелой - 2 больных (3,9%). Белый разлитой стойкий дермографизм определялся у 46%. Всех больных беспокоил зуд различной степени интенсивности: от незначительного до биопсирующего. Среди больных 42 человека (80,8%) характеризовали зуд как умеренный, терпимый, 10 больных - как нетерпимый. Большинство - 45 больных (86,5%) - отмечали раздражительность, плохое настроение, быструю утомляемость, нарушение сна. У большинства больных (91,9%) отмечались колебания в динамике заболевания. Наиболее часто обострение АД наблюдалось с наступлением осенне-зимнего периода. Среди факторов, провоцирующих очередное обострение, 33 (63,5%) пациента отмечают нарушение гипоаллергенной диеты, 10 (19,2%) - стрессовые ситуации, 6 (11,5%) - инфекционные заболевания, 5 больных АД (9,6%) - прием лекарственных средств.
Для лечения больных АД был применен новый препарат, активной субстанцией которого является EGCG, обладающий повышенной биодоступностью.
Препарат использовали в виде капсул, содержащих 100 мг активного вещества. Все пациенты получали препарат в дозировке по 1 капсуле 3 раза в сутки.
Оценку результатов терапии проводили на основании изменения клинической картины на 7 и 14 день лечения и через 1 месяц от начала лечения. Объективными критериями служили динамика кожной симптоматики заболевания, оцениваемая с помощью шкалы SCORAD.
Среди 52 пациентов, получавших препарат, клиническое выздоровление, характеризующееся исчезновением зуда и воспалительных изменений кожи, было достигнуто у 12 больных (23,1%) с легкой степенью и у 11 больных (21,1%) со средней степенью тяжести заболевания в среднем через 15 дней от момента начала терапии. Значительное улучшение отмечалось у 10 пациентов (19,2%) с легкой и у 6 (11,6%) со средней степенью тяжести заболевания. Положительная динамика на фоне проводимой терапии в виде улучшения была отмечена у 8 больных (15,3%) с легкой степенью, у 1 (1,9%) - с тяжелой степенью тяжести заболевания. Отсутствие эффекта от проводимой терапии наблюдали у 2 больных (3,8%) с легкой степенью и у 1 больного (1,9%) со среднетяжелой степенью тяжести заболевания. Клиническая эффективность препарата составила 75%.
Продукция цитокинов
Методом проточной цитометрии на бусах, покрытых антителами к цитокинам, определяли уровень продукции фактора некроза опухолей альфа (ФНО-α) и интерферона g (ИФН-g) у больных атопическим дерматитом до и после лечения.
После лечения наблюдали достоверное (t-test, p<0,05) снижение продукции ФНО-α. ИФН-g.
Продукция IgE
Лечение препаратом приводило к достоверному снижению уровня IgE, что наблюдается достаточно редко при этом заболевании. Повторный забор крови у больных после лечения осуществляли через 1,5-2 месяца. Время жизни иммуноглобулинов в сыворотке крови составляет около 1 месяца. Соответственно, снижение уровня IgE в сыворотке крови больных АД после лечения означает прямое действие препарата на продукцию IgE. Снижение IgE наблюдали в 100% случаев, даже если исходный уровень был низким.
Пример 8
Клиническая эффективность новой формуляции EGCG для профилактики рецидивов при болезни Крона
Цель
Определить эффективность новой формуляции EGCG для поддержания ремиссии при болезни Крона.
Структура исследования
Рандомизированное двойное слепое плацебо-контролируемое исследование; длительность - 1 год.
Больные
64 больных (от 18 до 68 лет, 52% мужчины) с болезнью Крона в стадии клинической ремиссии, но с высоким риском рецидивирования. Лабораторные показатели отражали наличие хронического воспалительного процесса. Критерии исключения: возраст <18 или >75 лет; прием мезаламина, сульфасалазина или кортикостероидов в течение предшествующих 3 месяцев, а иммуносупрессивных препаратов - в течение предшествующих 6 месяцев.
Лечение
Больные получали 2-3 раза в сутки EGCG новой формуляции в капсулах по 50-100 мг или плацебо.
Критерии оценки
Частота рецидивов и длительность ремиссии. Рецидив определялся по повышению индекса активности болезни Крона по сравнению с базисным уровнем на 100 пунктов и его удержанию на уровне >150 баллов в течение 2 недель.
Основные результаты
Лечение EGCG в капсулах по 50 мг снизило частоту рецидивов по сравнению с плацебо (28 и 69% соответственно; р<0,001).
Вывод
Лечение EGCG в капсулах по 50 мг снижает частоту рецидивов и поддерживает ремиссию при болезни Крона в тех случаях, когда клинические проявления заболевания отсутствуют, но содержание в крови маркеров воспаления повышено.
Пример 9
Применение EGCG у женщин с гиперпластическими процессами в эндометрии (Аденомиоз)
В исследовании принимали участие 32 пациентки, средний возраст которых 47,3±1,53 лет, отказавшиеся от гормональной терапии и у которых отсутствовали показания к хирургическому лечению.
Больные получали EGCG по 100 мг 2 раза в сутки в течение 6 месяцев. Оценка эффективности проводилась через 3 месяца и 6 месяцев по клиническим данным, определению уровня гормонов, УЗИ, РДВ и пайпель-биопсия эндометрия. Результаты представлены в Таблице 3.
| Таблица 3 | |||
| Динамика клинических симптомов заболевания при лечении препаратами EGCG | |||
| Показатели | До лечения, % | После 3 месяцев лечения, % | После 6 месяцев лечения, % |
| Менорраргия (обильные менструации) | 65,6 | 56,3 | 23,4 |
| Метроррагия | 46,9 | 28,1 | 15,6 |
| Боли внизу живота, связанные с менструальным циклом | 28,1 | 18,8 | 15,6 |
| Пред- и постменструальные кровяные выделения | 21,9 | 21,9 | 12,5 (скудные) |
Пример 10
Изучение уровня простатического специфического антигена в крови у пациентов с диагнозом рак предстательной железы на фоне приема EGCG в новой формуляции.
В исследовании принимали участие 12 пациентов с I-II стадией рака предстательной железы (РПЖ). Диагноз подтвержден гистологическими исследованиями. Содержание простатического специфического антигена (ПСА, PSA) в крови пациентов, отобранных для участия в исследовании, находился в диапазоне 12-20 нг/мл. Измерение ПСА проводили по методу, описанному в работе (Jerry McLarty, Rebecca L.H. Bigelow, Mylinh Smith, et al. (2009) Tea Polyphenols Decrease Serum Levels of Prostate-Specific Antigen, Hepatocyte Growth Factor, and Vascular Endothelial Growth Factor in Prostate Cancer Patients and Inhibit Production of Hepatocyte Growth Factor and Vascular Endothelial Growth Factor In vitro. Cancer Prev Res, 2 (7), 673-681).
Пациенты принимали препарат в течение 30 дней по 100 мг 3 раза в день. Результаты исследования суммированы в Таблице 4.
| Таблица 4 | |||
| Показатели PSA при лечении препаратами EGCG. | |||
| Пациенты | Концентрация PSA (нг/мл) до приема препарата | Концентрация PSA (нг/мл) после приема препарата | Процент снижения PSA |
| 1 | 12,3 | 3,7 | 30 |
| 2 | 18,5 | 6,3 | 34 |
| 3 | 16,4 | 5,2 | 32 |
| 4 | 12,3 | 5,0 | 40 |
| 5 | 16,8 | 5,5 | 33 |
| 6 | 12,5 | 4,3 | 34 |
| 7 | 13,8 | 5,4 | 39 |
| 8 | 14,6 | 4,4 | 30 |
| 9 | 12,7 | 4,0 | 31 |
| 10 | 19,5 | 7,8 | 40 |
| 11 | 12,6 | 4,5 | 36 |
| 12 | 17,9 | 7,0 | 39 |
1. Фармацевтическая композиция для перорального введения, содержащая эпигаллокатехин-3-галлат в качестве активного компонента и целевую добавку, отличающаяся тем, что содержит в качестве целевой добавки блок-сополимер оксиэтилена и оксипропилена, в котором содержание гидрофобного блока составляет менее 50 мас.%, а молекулярная масса гидрофильного блока составляет 2250 Дальтон и более, при массовом соотношении активного компонента и блок-сополимера 1:1-10:1.
2. Фармацевтическая композиция по п.1, отличающаяся тем, что содержит в качестве блок-сополимера оксиэтилена и оксипропилена Плюроник F127.
3. Фармацевтическая композиция по п.1, отличающаяся тем, что представляет собой лиофилизированный порошок.
4. Фармацевтическая композиция по п.1, отличающаяся тем, что содержит дополнительно фармацевтически приемлемый носитель.
5. Фармацевтическая композиция по п.4, отличающаяся тем, что представляет собой таблетку, или лиофилизированный порошок, или суспензию, или капсулу.
6. Применение фармацевтической композиции по любому из пп.1-5 для лечения атонического дерматита, болезни Крона, аденомиоза и гиперпластических заболеваний предстательной железы.