Фармацевтическая композиция, содержащая ghrp-6, для предотвращения и устранения фиброза и других патологических отложений в тканях
Иллюстрации
Показать всеГруппа изобретений относится к медицине, в частности к применению стимулирующего секрецию пептида GHRP-6, который многократно вводят в составе фармацевтической композиции, которая предотвращает и устраняет отложение патологического фиброзного материала в паренхиматозных тканях внутренних органов, таких как печень, легкие, пищевод, тонкий кишечник, почки, кровеносные сосуды, суставы, и другие системные формы кожного фиброза любого этиопатогенеза. Кроме того, этот пептид предотвращает и устраняет отложение амилоидного и гиалинового материала в любых своих соответствующих химических формах и типах тканей, среди прочего, в мозге, мозжечке, кровеносных сосудах, печени, кишечнике, почках, селезенке, поджелудочной железе, суставах и коже. Таким образом, корректирует клеточные, тканевые и органные дисфункции, вызванные этими отложениями. Пептид по настоящему изобретению наносят инфильтрацией или местно, внося вклад в предотвращение и устранение келоидов и гипертрофических рубцов в коже, возникающих как следствие ожогов и другой травмы кожи. Группа изобретений обеспечивает быстрое уменьшение избыточного количества коллагенового материала и внеклеточного матрикса, устранение патологических отложений фиброзного материала в паренхиматозных внутренних тканях. 5 н. и 21 з.п. ф-лы, 7 пр., 19 табл., 1 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области фармацевтической промышленности и медицины и более конкретно к применению пептидов, стимулирующих секрецию, которые многократно вводят в фармацевтической композиции для предотвращения и устранения патологических отложений фиброзного материала в паренхиматозных внутренних тканях, как например, в печени, легких, пищеводе, тонком кишечнике, почках, кровеносных сосудах, суставах, и при других системных формах кожного фиброза любого этиопатогенеза.
ОПИСАНИЕ ПРЕДШЕСТВУЮЩЕГО УРОВНЯ ТЕХНИКИ
Случаи фиброза включают группу моноорганных или системных патологических процессов, характеризуемых патологическим отложением внеклеточного матрикса в паренхиме практически любого внутреннего органа, кровеносных сосудах или коже. Их рассматривают как следствие сочетанных событий аутоиммунного характера или интерстициальных ответов на длительные имитирующие и воспалительные процессы. Как правило, избыток коллагенового материала откладывается в паренхиме интерстициальными эффекторными клетками или разрастающимся материалом стромы, который вызывает облитерацию функциональной ткани. Эффекторные клетки, опосредующие эти события, обладают мезенхимальным происхождением и, как предполагают, вполне специфичны по отношению к поражаемой ткани. Как правило, миофибробласты принимают участие в вызывании патологических фиброзов. Механизмы, опосредующие развитие фиброза, являются сложными и остаются неполностью выясненными. Независимо от причины, как предполагают, трансформирующий фактор роста β (TGF-β), фактор роста соединительной ткани (CTGF) и тромбоцитарный фактор роста (PDGF) принимают участие в этих процессах независимо от органа-мишени. Длительные фиброзы, как правило, летальны при отсутствии до настоящего времени доступного лечения. Далее авторы настоящего изобретения описывают некоторые технические аспекты фиброзных процессов в различных органах (Ding J, Yu J, Wang C, Hu W, Li D, Luo Y, Luo H, Yu H. Ginkgo biloba extract alleviates liver fibrosis induced by CCl4 in rats. Liver International 2005: 25: 1224-1232.) (Friedman SL. Reversal of hepatic fibrosis - Fact or fantasy? Hepatology. 2006 Jan 30;43(S1):S82-S88).
Фиброз печени
Если печень повреждена, то воспалительный ответ и реструктурирование внеклеточного матрикса (EM) восстанавливают нормальную функцию и архитектуру этого органа. Однако, если процесс повреждения продолжается, то дисбаланс факторов, принимающих участие в восстановлении и устранении проблемы, изменяет регуляцию EM и способствует избыточному синтезу его компонентов. Печень является основным органом, принимающим участие в регуляции метаболизма, фильтрации крови и регуляции гормонов. Звездчатые клетки печени (HSC) расположены в пространстве между эндотелиальными клетками и гепатоцитами, которое называется пространство Диссе или перисинусоидальное пространство, окружая эндотелиальные клетки длинными цитоплазматическими отростками. HSC способны синтезировать и секретировать компоненты EM, и они представляют собой важный источник фиброзного материала. В них накапливаются сложные эфиры ретинола, синтезируются факторы роста и другие цитокины, с дополнительной ролью в регуляции воротного кровообращения. HSC могут переходить из покоящегося состояния в активное состояние посредством индукции паракринной секреции провоспалительных цитокинов, продукции активных форм кислорода или посредством изменений структуры EM, нарушающей клеточный фенотип. В ходе активации HSC дифференцируются в вытянутые по форме миофибробласты, экспрессирующие гладкомышечный α-актин и утрачивающие весь запасаемый ретинол. В этом состоянии HSC приобретают новые свойства, которые помогают им поддерживать и усиливать воспалительный ответ: способность к пролиферации, сократимость, продукция цитокинов и, главным образом, синтез и секреция компонентов EM. Среди основных факторов, способствующих продукции белков EM в активированных HSC, представлен TGF-β, синтезируемый главным образом купферовскими клетками в активированной фазе; TGF-β главным образом продуцируется HSC в фазе поддержания, поддерживая непрерывную активацию. Как правило, все фиброзные уплотнения печени несовместимы с жизнью
Фиброз легких
Фиброз легких представляет собой сравнительно медленно прогрессирующее заболевание, также включающее несколько форм. Гистологически он характеризуется временной гетерогенностью повреждений, преобладанием фибробластов. Несмотря на то, что последовательность событий в патогенезе фиброза легких хорошо документирована, существует мало информации относительно точных механизмов, опосредующих основное поражение. Считается, что к этому имеют отношение иммунологические факторы, преимущественно аутоиммунные. Генетические факторы также принимают участие. Микроскопически, бессимптомное свойство включает гиперпластическое изменение в клетках альвеолярного эпителия (пневмоцитах II типа), сопровождающееся хорошо различимыми ядрышками и цитологическим атипизмом, как правило, имитируя вирусную инфекцию. Возможно обнаружение ультраструктурных внутриядерных тубулярных включений. Процесс отложения EM и, в частности, коллагена в паренхиме легкого бессимптомно нарушает архитектуру легкого, вызывая спадение бронхиол и альвеол, которые в конечном итоге становятся нефункциональными и нарушают легочную вентиляцию. TGF-α также принимает участие в качестве одного из основных цитокинов, которые регулируют этот процесс. Миофибробласты представляют собой EM-продуцирующие клетки (Medranda Gomez MA, Paricio Nunez P, Tovar Martinez A, Ferrer Marin F, Gonzalez Martinez P, Garcia Puche MJ. Pulmonary fibrosis. Rev Esp Enferm Dig. 2005 Nov;97(11):843-4).
Системный кожный фиброз или склеродермия
Системный склероз (SS) представляет собой в высшей степени многокомпонентное заболевание. До настоящего времени не существует приемлемой теории, объясняющей его патогенез. Однако документированы существенные патологические изменения в фибробластах, эндотелиальных клетках и клетках иммунной системы, в частности, В- и T-лимфоцитах. Функциональные изменения в этих клетках способствуют развитию типичной триады патологических изменений при SS: кожный и висцеральный прогрессирующий фиброз, облитерация просвета малых артерий и артериол, и иммунные нарушения. Изменения гуморального и клеточного иммунитета вызывают секрецию большого количества антител, некоторые из которых являются весьма специфичными для заболевания, инфильтрацию мононуклеарных клеток в пораженные ткани и нарушение регуляции продукции цитокинов и факторов роста. До сих пор отсутствует ясность в том, какие из этих изменений являются основным событием, инициирующим заболевание, или связаны ли все они между собой при вызывании прогрессирующего фиброзного процесса при SS. Однако ключевой компонент патогенеза включает нарушение регуляции и постоянную активацию генов, кодирующих несколько типов коллагена и другие белки EM в фибробластах пациентов с SS. Это представляет собой основное отличие между нормальными фибробластами, способными к нормальному заживлению ран, и SS-фибробластами с неконтролируемой продукцией и отложением коллагена, что приводит к патологическому фиброзу в пораженных органах. Стоит повторить еще раз, что TGF-β является одним из факторов роста, которые, как полагают, явным образом принимают участие в фиброзе тканей при SS. Один из наиболее важных эффектов включает синтез нескольких типов коллагена и других белков EM, таких как фибронектин (31). Фибробласты пациентов с SS экспрессируют на своих поверхностях значительные количества рецептора TCF-β, возможно отвечающего за усиление сигнала, индуцируемого посредством TGF-β, и усиление продукции коллагена (30). Это заболевание также необратимо приводит к летальному исходу (Steen V. Targeted therapy for systemic sclerosis. Autoimmun Rev. 2006 Feb;5(2): 122-4).
Диабетический нефросклероз или диабетическая нефропатия
Практически у каждого пациента с диабетом развивается утолщение базальной мембраны клубочков и канальцев спустя 2-3 года после диагностирования заболевания. У некоторых из них также развивается расширение гломерулярного мезангия и интерстициальный фиброз, патологические маркеры прогрессирующей диабетической нефропатии. Эта нефропатия клинически прогрессирует также с развитием протеинурии, гипертензии и почечной недостаточности. Существует хорошая корреляция между расширением области мезангия, тяжестью интерстициального фиброза и атеросклерозом, что также приводит к уменьшению скорости клубочковой фильтрации. В конечном итоге расширение мезангия снижает растяжение клубочка в результате окклюзии клубочковых капилляров и уменьшения области эффективной фильтрации. Аналогичным образом, тубулоинтерстициальный фиброз приводит к изменению архитектуры и функции канальцев, вызывая почечную недостаточность. При этом заболевании выявлена роль TGF-β в регуляции фиброзных процессов, происходящих в почках пациентов с диабетом. Это заболевание является прогрессирующим, бессимптомно развивающимся и приводит для пациента к летальному исходу вследствие почечной недостаточности
Фиброз полового члена или болезнь Пейрони
По существу, заболевание включает патологический рубец эластической оболочки (белочной оболочки) эректильной ткани полового члена, приводя к ретракции органа в спокойном состоянии и искривлению и ретракции в ходе эрекции. Хотя сложно зарегистрировать начало заболевания, большинство авторов согласно в том, что фиброзной дегенерации белочной оболочки предшествует воспалительный процесс, который вызывает васкулитный, иммунный или травматический процесс, или коллагенoпатию. Описывают первый период инвазии, когда фиброзная бляшка может бессимптомно прогрессировать, означая искривление или ретракцию полового члена с болью в ходе эрекции или проницаемостью. Преобладающие симптомы вызваны фиброзом. У некоторых пациентов может также наличествовать дополнительный ассоциированный фиброз в хряще мочки уха. Хотя и не приводящее к летальному исходу это заболевание серьезно осложняет качество жизни пациентов. Стоит отметить еще раз, что TGF-β принимает участие в качестве провоцирующего или усиливающего фактора молекулярной основы заболевания (Jakut M. New discoveries in the basic science understanding of Peyronie's disease. Curr Urol Rep. 2004 Dec;5(6):478-84).
Микрососудистое заболевание мозга
Васкулопатию выявляют в мозге пациентов, страдающих болезнью Альцгеймера, в качестве маркера патогенеза этой и других видов деменции. Послойное и региональное распределение сосудистых повреждений коррелирует с появлением нейрофибриллярных клубков и старческих бляшек. Более 100 лет назад ранее зарегистрировали физиологические аномалии в сосудах мозга пожилых людей, включая ригидность, искривление и извитость. Менее 20 назад эти данные были подтверждены с дополнительным описанием еще более деформированных сенильных капилляров в гиппокампе с возрастными изменениями основных сосудов. Ультраструктурно можно различить: (a) мембранозные включения в базальной мембране; и (b) микрососудистые коллагеновые отложения (фиброз) или утолщение компонентов базальной мембраны. Капиллярные перициты заметно дегенерируют с возрастом. Отложение коллагеновых волокон во внутренней части базальной мембраны наблюдали в мозге млекопитающих. Изгиб шириной 64 нм этих волокон позволил идентифицировать коллагеновый состав этого микрососудистого фиброза, расположенного между эндотелием и перицитами или на внутренней стороне базальной мембраны. Утолщение базальной мембраны и коллагеновые отложения сходным образом усиливаются с возрастом у крыс и человека, и эти процессы фиброзной склеротической дегенерации микроциркуляторного русла мозга рассматривают в качестве анатомической основы процессов, как правило, ведущих к деменции. Протекание этих заболеваний клинически ухудшается при прогрессировании окклюзии сетей артериол, в конечном итоге делая невозможными любые социальные взаимоотношения и когнитивную активность.
Роль сосудистого заболевания в патогенезе деменции в настоящее время переосмысливается, так как предполагают, что более 50% пациентов с деменцией обладают каким-либо признаком сосудистого заболевания мозга. Существуют другие нейромозговые, не относящиеся к деменции Альцгеймера процессы, опосредующие серьезное снижение памяти, обучаемости и общих навыков. Наиболее подходящим примером является церебральная аутосомно-доминантная артериопатия с подкорковыми инфарктами и лейкоэнцефалопатией (CADASIL). Это заболевание нуждается в прояснении на молекулярном и клеточном уровнях. Тем не менее, артериопатии, возникающие в результате прогрессирующего отложения осмофильного гранулярного материала, в последствии приводят к окклюзии просвета артерий, вызывая возникновение ишемических очагов в мозге с последующими случаями инфаркта. Утрата жизнеспособности нейронов в результате микроинфаркта нарушает основную нервную активность в мозге, приводя к состоянию старости и деменции (Nakanao I. The function and integrity of the neurovascular unit rests upon the integration of the vascular and inflammatory cell systems. Curr Neurovasc Res. 2005 Dec;2(5):409-23. Mott RT. Neuropathology of Alzheimer's disease. Neuroimaging Clin N Am. 2005 Nov;15(4):755-65).
Другие дегенеративные процессы. Отложение бета-амилоида
Болезнь Альцгеймера является наиболее распространенной формой деменции и одной из основных причин смерти пожилых людей в возрасте старше 65 лет. В то время как причина заболевания неизвестна, в мозге пациентов с болезнью Альцгеймера показано связанное с заболеванием отложение нескольких типов белков внутри и снаружи нейронов. Бета-амилоид является одним из белков, образующих внеклеточные отложения в мозге и стволе мозга. Бляшки состоят из компактной сердцевины из бета-амилоидного белка, возникающего из белка-предшественника. Риск развития деменции сильно ассоциирован с полиморфизмами аполипопротеина E (Apo-E). В мозге Apo-E взаимодействует с бета-амилоидным белком, при этом Apo-E4 связывается с усиливающимися отложениями бета-амилоида и увеличением количества нейрофибриллярных клубков.
Процессы внимания, обучаемости и памяти находятся среди способностей мозга, поражаемых при болезни Альцгеймера; это состояние рассматривают в качестве модельного среди заболеваний с деменцией, характеризующихся отложением бета-амилоида. До настоящего времени существует только одно лекарственное средство, одобренное FDA для лечения когнитивной дисфункции при болезни Альцгеймера. Бета-амилоид белок вызывает развитие некрогенных эффектов, опосредованных свободными радикалами в клетках мозга. Отложение бета-амилоида в паренхиме мозга является отличительным маркером патогенеза при болезни Альцгеймера, хотя и наблюдается в меньшем количестве при нормальном физиологическом старении.
Снижение синтеза бета-амилоидного нейротоксичного варианта белка может ослабить процессы, способствующие повреждению нейронов при болезни Альцгеймера. Сходным образом, удаление его из мозга и дальнейшая экскреция могут внести вклад в восстановление основных функций нервной системы у пациентов. Болезнь Альцгеймера в значительной степени снижает качество жизни пациентов и до сих пор она неизлечима (Gurol ME. Plasma beta-amyloid and white matter lesions in AD, MCI, and cerebral amyloid angiopathy. Neurology. 2006 Jan 10;66(1):23-9.; Han HS. The function and integrity of the neurovascular unit rests upon the integration of the vascular and inflammatory cell systems. Curr Neurovasc Res. 2005 Dec;2(5):409-23; Anderson E. The Oorganic Brain Syndrome (OBS) scale: a systematic review. Int J Geriatr Psychiatry. 2006 Jan 27).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к применению стимулирующих секрецию пептидов в фармацевтической композиции, содержащей GRHP-6, GRHP-2, гексарелин и/или грелин, где указанная фармацевтическая композиция предотвращает, контролирует и устраняет патологические внутри- и внеклеточные отложения гиалинового материала, амилоида, гранулярных форм эозинофильного и осмофильного материала во внутренних органах, наружных органах и органах сосудистой сети, таких как печень, легкие, пищевод, кишечник, почки, кровеносные сосуды, суставы и остальная часть системных кожных вариантов фиброза любого этиопатогенеза, где указанную композицию применяют в организме реципиента. Фармацевтическая композиция по настоящему изобретению представляет собой жидкую, полутвердую или твердую композицию, пригодную для введения внутривенным, внутримышечным, внутрибрюшинным, подкожным, интратекальным, ректальным и местным способами, местной инфильтрацией в кожу или слизистую оболочку, эпителии или органы, более конкретно внутрь очага и/или вокруг очага. Фармацевтическая композиция по настоящему изобретению содержит пептиды GHRP-6, GHRP-2, гексарелин и/или грелин в концентрациях 5 микрограммов-1 миллиграмм, более конкретно в концентрации 30-500 микрограммов на дозу, и фармакологически приемлемый носитель.
КРАТКОЕ ОПИСАНИЕ ФИГУР
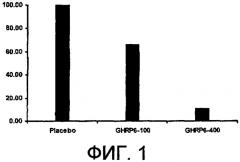
Фиг. 1. Процентная доля животных, пораженных фиброзом почек, в группе в конце лечения посредством GHRP-6. Следует обратить внимание на существующие различия между группой с плацебо, которая получала солевой раствор, и группами, получавшими GHRP-6. Наибольшее различие наблюдали при сравнении группы с плацебо с группой, получавшей дозировку 400 мкг/кг, что позволяет предположить дозозависимый эффект. Гистологическая оценка фибропролиферативной реакции почечного интерстиция включает фиброзную инкапсуляцию канальцев и также фиброз клубочков. Таким образом, установлена градация общего почечного фиброза, применяемая для определения процентной доли животных, пораженных или непораженных в конце лечения. (a) - Статистические различия с p<0,001 между группой, получавшей дозировку 400 мкг/кг GHRP-6, и группой с плацебо.
ПРИМЕРЫ
Пример 1. Обратное развитие фиброза печени у крыс
Настоящий эксперимент осуществляли для оценки эффекта фармацевтической композиции на основе GHRP-6 на обратное развитие фиброза печени у крыс. Фиброз печени индуцировали у самцов крыс Wistar со средней массой тела 250 г наложением лигатуры на наружный желчный проток. Для этой цели крыс анестезировали сочетанием кетамина/ксилазина и подвергали лапаротомии для получения доступа к общему желчному протоку. На проток накладывали двойную лигатуру с помощью хромированного кетгута 4-0. После хирургической операции животных случайным образом распределяли по 3 экспериментальным группам из 20 крыс в каждой: (1) контрольная группа с плацебо, получавшая физиологический солевой раствор, (2) группа, получавшая GHRP-6 в дозировке 100 мкг/кг, и (3) группа, получавшая GHRP-6 в дозировке 400 мкг/кг. Обработки проводили ежесуточно в течение трех недель после индуцирования фиброза паренхимы печени. Все обработки начинали спустя три недели после появления фиброза. Отслеживание повреждения печени проводили с помощью еженедельного ультразвукового обследования проекционной области этого органа, динамики уровней трансаминаз GOT и GPT в сыворотке, уровней гамма-глутамилтрансферазы (GGT) и объема асцита. Обработки посредством GHRP-6 или плацебо осуществляли внутрибрюшинным способом один раз в сутки. После окончания обработок животных забивали и осуществляли забор сыворотки крови и печени. Фрагменты печени фиксировали в нейтральном формалине и проводили окрашивание гематоксилином/эозином или трихромное окрашивание по Массону для оценки общего повреждения и тяжести фиброзных уплотнений. Другие фрагменты тканей печени хранили при -70°C до обработки для определения содержания гидроксипролина путем кислотного гидролиза в 1 Н HCl и также внутрипеченочных уровней маркеров окислительно-восстановительного метаболизма. Биохимические определения выполняли путем подсчета содержания общего белка способом по Бредфорд.
| Таблица 1 | |||||
| Шкала градации процесса: (0) - *отсутствие, (1) - умеренное, (2) - ограниченное, (3) - тяжелое, (4) - очень тяжелое. | |||||
| Экспериментальная группа | Степень 0 | Степень 1 | Степень 2 | Степень 3 | Степень 4 |
| Плацебо (N=14) | 0 | 0 | 2 | 5* | 7 (50%) |
| Дозировка I (N=16) | 5 | 9 | 2 | 0 | 0 |
| Дозировка II (N=20) | 8 | 11 | 1 | 0 | 0 |
| *p<0,001. Критерий хи-квадрат. |
| Таблица 2 | |
| Оценка уровней гидроксипролина в печенив конце трех недель лечения | |
| Экспериментальная группа | Содержание OH-P(мкг/г общего белка) |
| Плацебо (N=14) | 133,25±21,69** |
| Дозировка (N=16) | 56,71±8,11 |
| Дозировка (N=20) | 16,15±1,025 |
| **p=0,00021. Плацебо по сравнению с обработанными. *p=0,001 Дозировка I по сравнению с дозировкой II. Двусторонний t-критерий Стьюдента. |
| Таблица 3 | |||
| Уровни GOT, GPT и GGT в сыворотке во всех группахв конце трех недель лечения | |||
| Экспериментальная группа | GOT (МЕ/л) | GPT (МЕ/л) | GGT (МЕ/л) |
| Интактные животные | 32,56±9,27 | 20,93±7,74 | 23,62±5,21 |
| Плацебо (N=14) | 115,84±27,80** | 155,30±11,63** | 143,18±25,36** |
| Дозировка I (N=16) | 61,58±16,10* | 81,71±30,90* | 71,53±22,14* |
| Дозировка II (N=20) | 30,41±6,11 | 60,64±19,87 | 25,56±8,63 |
| ** p=0,0003. Плацебо по сравнению с обработанными исходя из дозировки II и интактными животными. *p=0,0002 Дозировка I по сравнению с дозировкой II и интактными животными. Никаких различий не обнаружено между интактными животными и животными с дозировкой II. Двусторонний t-критерий Стьюдента. |
| Таблица 4 | ||||
| Уровни маркеров оксидативного стресса в образцах печени в конце третьей недели лечения | ||||
| Экспериментальные группы | SODt | Каталаза | HPT | MDA |
| Интактная группа | 28261,08± 1260,94 | 16,40±3,95 | 27,25±2,47 | 0,06±0,01 |
| Группа с солевым раствором - плацебо | 573,83± 645,93** | 580,58± 57,39** | 108,66± 15,82** | 0,25±0,04** |
| Группа с дозировкой I | 11058,07± 744,61* | 68,50± 12,73* | 43,06±1,83* | 0,14±0,02* |
| Группа с дозировкой II | 21029,87± 498,28 | 31,50±4,3 | 21,16±1,71 | 0,08±0,01 |
| **p=0,0001. Плацебо по сравнению с обработанными исходя из дозировки II и интактными. *p=0,0003 Дозировка I по сравнению с дозировкой II и интактными. Никаких различий не обнаружено между интактными и дозировкой II. Двусторонний t-критерий Стьюдента. |
Обработка GHRP-6 ясно показывает способность пептида устранять и контролировать отложение коллагенового и внеклеточного материала в паренхиме печени, которое вызывается наложением лигатуры на общий печеночный проток. Пригодность лечения показывает согласованность морфологических и биохимических данных, что подтверждает коррекцию далеко зашедшего перидуктального и перипортального фиброзного состояния. Важно отметить, что у животных в группе с плацебо не отмечали спонтанной ремиссии.
Пример 2. Обратное развитие фиброза печени у крыс
Этот эксперимент проводили для оценки эффекта фармацевтической композиции, содержащей GHRP-6, на обратное развитие фиброза печени у крыс, где указанный фиброз печени индуцировали тетрахлоридом углерода (ССl4). Он представляет собой гепатотоксическое вещество, которое вызывает хронический гепатит и фиброз после длительного введения. Фиброз печени индуцировали у самцов крыс Wistar массы тела 250 г внутрибрюшинным введением ССl4 в оливковом масле 50%/50% (об./об.) два раза в неделю в течение четырех недель. После этого времени 25% крыс забивали и подвергали исследованиям на биохимию крови и патологическую анатомию. Процесс фиброза печени обнаружили у всех исследованных животных. Оставшихся животных случайным образом распределили по трем экспериментальным группам из 15 крыс в каждой: (1) контрольная группа с плацебо, получавшая физиологический солевой раствор, (2) группа, получавшая GHRP-6 в дозировке 100 мкг/кг, и (3) группа, получавшая GHRP-6 в дозировке 400 мкг/кг. Обработки осуществляли один раз в сутки в течение четырех недель после детектирования фиброзного процесса в паренхиме печени. Обработки начинали непосредственно после развития фиброза и введения суспензии ССl4. После окончания обработок животных забивали и осуществляли забор сыворотки крови и печени. Фрагменты печени фиксировали в нейтральном формалине и проводили окрашивание гематоксилином/эозином или трихромное окрашивание по Массону для оценки общего повреждения и тяжести фиброзных уплотнений. Другие фрагменты тканей печени хранили при -70°C до обработки для определения содержания гидроксипролина путем кислотного гидролиза в 1 Н HCl и также внутрипеченочных уровней маркеров окислительно-восстановительного метаболизма. Биохимические определения выполняли путем подсчета содержания общего белка способом по Бредфорд. Ответ на лечение фармацевтической композицией характеризовали определением уровней трансаминаз GOT и GPT в сыворотке, гистологическими критериями по количественной шкале и некоторыми маркерами, характеризующими уровни перекисного окисления липидов.
| Таблица 5 | |||||
| Шкала градации процесса: (0) - отсутствие, (1) - умеренное, вплоть до 25% препарата, (2) - ограниченное, вплоть до 50% препарата, (3) - тяжелое, вплоть до 75% препарата, (4) - очень тяжелое, более 75% препарата. Гистологическая оценка мостовидных структур фибропролиферативной реакции, включая сопутствующий некроз в зоне III. Животные на группу согласно степени поражения в конце лечения. | |||||
| Экспериментальная группа | Степень 0 | Степень 1 | Степень 2 | Степень 3 | Степень 4 |
| Плацебо | 0 | 0 | 0 | 5* | 10** |
| Дозировка I | 0 | 9 | 6* | 0 | 0 |
| Дозировка II | 8* | 7 | 0 | 0 | 0 |
| *p<0,001. Критерий хи-квадрат. Степень 0. Группа II по сравнению с плацебо и дозировкой I. Степень 1. Дозировка I и II по сравнению с плацебо. Плацебо, степени 3 и 4 по сравнению с обработанными животными. |
| Таблица 6Оценка уровней гидроксипролина в печени в конце лечения | |
| Экспериментальная группа (N=15) | Содержание OH-P (мкг/г общего белка) |
| Плацебо | 86,19±11,43** |
| Дозировка I | 40,21±3,54* |
| Дозировка II | 10,22±4,33 |
| **p=0,00021. Плацебо по сравнению с обработанными.*p=0,001 Дозировка I по сравнению с дозировкой II. Двусторонний t-критерий Стьюдента. |
| Таблица 7Уровни GOT и GPT в сыворотке во всех группах в конце лечения | ||
| Экспериментальная группа | GOT (МЕ/л) | GPT (МЕ/л) |
| Интактные животные | 31,56±6,55 | 18,77±6,53 |
| Плацебо | 111,97±36,50** | 274,14±21,75** |
| Дозировка I | 56,31±12,19* | 77,15±22,66* |
| Дозировка II | 28,18±4,71 | 26,94±12,42 |
| **p=0,0005 Плацебо по сравнению с обработанными исходя из дозировки II и интактными животными. *p=0,001 Дозировка I по сравнению с дозировкой II и интактными животными. Никаких различий не обнаружено между интактными животными и животными с дозировкой II. Двусторонний t-критерий Стьюдента. |
| Таблица 8Уровни маркеров оксидативного стресса в образцах печенив конце третьей недели лечения | ||||
| Экспериментальные группы | SODt | Каталаза | HPT | MDA |
| Интактная группа | 28261,08± 1260,94 | 14,84±1,24 | 18,72±3,22 | 0,09±0,02 |
| Группа с плацебо-солевым раствором | 289,2± 116,1** | 560,59± 44,28** | 257,84± 86,14** | 0,56±1,04** |
| Группа с дозировкой I | 17632,08± 321,55** | 60,43± 11,81* | 55,11±2,77 | 0,16±1,16* |
| Группа с дозировкой II | 20187,87± 245,13 | 22,67±3,56 | 26,44±2,43 | 0,09±0,01 |
| **p=0,0002 Плацебо по сравнению с обработанными: дозировка I и II и интактные животные. *p=0,0005 Дозировка I по сравнению с дозировкой II, плацебо и интактными животными. Никаких различий не обнаружено между интактными животными и животными с дозировкой II. Двусторонний t-критерий Стьюдента. |
Лечение GHRP-6 говорит в целом о способности этого пептида устранять и контролировать отложение материала коллагенового и внеклеточного матрикса в паренхиме печени вследствие повторного введения ССl4. Лечение также предотвращает индивидуальную, очаговую и перицентролобулярную гибель гепатоцитов. Пригодность лечения показывают согласующиеся морфологические, ферментативные и биохимические данные, подтверждающие обратное развитие установленного и вызывающего нарушение функций тяжелого диффузного фиброза печени с образованием сливающихся мостовидных структур до практически недетектируемых уровней без ремиссии. Стоит отметить еще раз, что у животных группы с плацебо не наблюдали спонтанных ремиссий.
Пример 3. Обратное развитие фиброза почек у крыс с нефросклерозом. Третий эксперимент.
Этот эксперимент проводили для оценки эффекта фармацевтической композиции, содержащей GHRP-6, на обратное развитие фиброза почек у крыс. В этом случае процесс индуцировали длительным введением противоопухолевого средства доксорубицина (DX) в дозировке 2,5 мг/кг два раза в неделю в течение 8 недель. Возникновение фиброзного отложения в перипортальном, перибронхиальном и во всем интерстиции почек с образованием кистозно-узелковой структуры показано гистопатологическими исследованиями этих органов в 25% популяции крыс, подвергшихся интоксикации доксорубицином. После этого момента введение DX прекращали и начинали обработку фармацевтической композицией, содержащей GHRP-6. Обработку осуществляли один раз в сутки из расчета 100 и 400 мкг/кг в объеме 1 мл внутрибрюшинным способом в течение 4 недель. Оставшихся животных случайным образом распределяли по трем экспериментальным группам из 20 крыс в каждой: (1) контрольная группа с плацебо, получавшая физиологический солевой раствор, (2) группа, получавшая GHRP-6 в дозировке 100 мкг/кг, и (3) группа, получавшая GHRP-6 в дозировке 400 мкг/кг. После окончания обработок животных забивали передозировкой анестезии и осуществляли забор печени, почек, легких и сывороток крови. Фрагменты тканей фиксировали в нейтральном формалине и проводили окрашивание гематоксилином/эозином или трихромное окрашивание по Массону для оценки общего повреждения и тяжести фиброзных уплотнений. Другие фрагменты хранили при -70°C до обработки для определения содержания гидроксипролина путем кислотного гидролиза в 1 Н HCl и также уровней креатинина и маркеров оксидативного стресса. Биохимические определения выполняли путем подсчета содержания общего белка способом по Бредфорд.
| Таблица 9Количество животных в группе для каждого уровня тяжести фиброзного поражения. Шкала градации фиброзного процесса в почках:Степень (0) - отсутствие;степень (1) - умеренная, поражение интерстиция без деформации или инкапсуляции канальцев или клубочков;степень (2) - интенсивная, поражение всего интерстиция с деформацией канальцев, облитерацией их просвета и наружной инкапсуляцией клубочков;степень (3) - очень интенсивная, инкапсуляция и спадение канальцев, и спадение клубочков. Также включает мезангиальные отложения. | ||||
| Экспериментальная группа (N=20) | Степень 0 | Степень 1 | Степень 2 | Степень 3 |
| Плацебо | 0 | 1 | 4 | 15* |
| Дозировка I | 6 | 9 | 5 | 0 |
| Дозировка II | 5 | 15* | 0 | 0 |
| *р<0,001. Критерий хи-квадрат |
| Таблица 10Оценка уровней гидроксипролина в почках в конце лечения | |
| Экспериментальная группа(20 животных в группе) | Содержание OH-P (мкг/г общего белка) |
| Плацебо | 65,21±22,16** |
| Дозировка I | 46,15±2,73* |
| Дозировка II | 8,66±1,02 |
| **p=0,0001 Плацебо по сравнению с обработанными.*p=0,05 Дозировка I по сравнению с дозировкой II.Двусторонний t-критерий Стьюдента. |
| Таблица 11Уровни GOT и GPT в сыворотке во всех группах в конце лечения. Целостность паренхимы печени | ||
| Экспериментальная группа | GOT (МЕ/л) | GPT (МЕ/л) |
| Плацебо | 124,12±28,3** | 188,77±16,98** |
| Дозировка I | 64,82±23,71* | 81,0±10,25* |
| Дозировка II | 26,22±4,1 | 28,25±5,66 |
| **p=0,0005 Плацебо по сравнению с обработанными.*p=0,042 Дозировка I по сравнению с дозировкой II.Двусторонний t-критерий Стьюдента |
| Таблица 12Уровни маркеров оксидативного стресса в образцах ткани почек в конце четвертой недели лечения | ||||
| Экспериментальные группы | SODt | Каталаза | HPT | MDA |
| Группа с плацебо-солевым раствором | 199,7± 6,81** | 356,2±18,15** | 287,11± 20,02** | 0,981±1,1** |
| Группа с дозировкой I | 665,08± 28,42* | 126,02±12,23* | 73,2±6,92 | 0,56±2,23* |
| Группа с дозировкой II | 1287,64± 112,63 | 45,38±8,27 | 16,14±3,67 | 0,087±0,02 |
| **p=0,0002 Плацебо по сравнению с обработанными: дозировки I и II и интактные животные.*p=0,0005 Дозировка I по сравнению с дозировкой II, плацебо и интактными животными. Никаких различий не обнаружено между интактными животными и животными с дозировкой II. Двусторонний t-критерий Стьюдента. |
Пример 4. Контроль фиброза легких
Этот эксперимент проводили для оценки эффекта фармацевтической композиции, содержащей GHRP-6, на обратное развитие фиброза почек у крыс. В этом случае процесс индуцировали длительным введением противоопухолевого средства блеомицина (Ble) в дозировке 2,5 Ед/кг два раза в неделю в течение 4 недель. При гистопатологическом анализе фиброз выявляли в легких 25% животных, подвергнутых интоксикации Ble. После этого момента введение Ble приостанавливали и начинали обработку фармацевтической композицией, содержащей GHRP-6. Обработку осуществляли один раз в сутки из расчета 100 и 400 мкг/кг в объеме 1 мл внутрибрюшинным способом в течение 4 недель. Животных случайным образом распределяли по трем экспериментальным группам из 10 крыс в каждой: (1) контрольная группа с плацебо, получавшая физиологический солевой раствор, (2) группа, получавшая GHRP-6 в дозировке 100 мкг/кг, и (3) группа, получавшая GHRP-6 в дозировке 400 мкг/кг. После окончания обработок животных забивали передозировкой анестезии и осуществляли забор легких и сыворотки крови. Фрагменты тканей фиксировали в нейтральном формалине и проводили окрашивание гематоксилином/эозином или трихромное окрашивание по Массону для оценки общего повреждения и тяжести фиброзных уплотнений. Другие фрагменты тканей легких хранили при -70°C до обработки для определения содержания гидроксипролина путем кислотного гидролиза в 1 Н HCl и также внутрипеченочных уровней маркеров окислительно-восстановительного метаболизма. Биохимические определения выполняли путем подсчета содержания общего белка способом по Бредфорд. Гистологическая оценка фибропролиферативной реакции в легких включает процесс периваскулярного, перибронхиального и септального фиброза. Общую степень фиброза легких устанавливали согласно распространенности и интенсивности процесса в этих трех сегментах для определения процентной доли пораженных или непораженных животных в конце обработки посредством GHRP-6. Количества животных в каждой группе с фиброзом легких согласно тяжести фиброза составляют:
Степень 0 - отсутствие признаков фиброза или только наличие очагов материала из тонких и диффузных волокон или ареолярного материала, без легочной недостаточности.
Степень 1 - преимущественно сосудистый фиброз в более 75% артериол и капилляров.
Степень 2 - преимущественно сосудистый фиброз в более 75% артериол и капилляров с дополнительным перибронхиальным поражением.
Степень 3 - преимущественно сосудистый фиброз в более 75% артериол и капилляров с дополнительным перибронхиальным поражением. Фиброзный материал также детектируют в межальвеолярной перегородке.
| Таблица 13Животные, классифицируемые согласно тяжести фиброза легких в каждой группе | ||||
| Экспериментальная группа (N=15) | Степень 0 | Степень 1 | Степень 2 | Степень 3 |
| Плацебо | 0 | 0 | 5 | 10* |
| Дозировка I | 3 | 10 | 2 | 0 |
| Дозировка II | 8 | 7 | 0 | 0 |
| *p<0,05 Точный критерий Фишера |
Как можно видеть, в группе с плацебо отсутствовали животные, соответствующие степени 0 или степени 1 по шкале. Их большую часть классифицировали по тяжести как степень 3. В то же время дозировка II обладала мощным защитным эффектом, при которой более 50% животных классифицировали как степень 0.
| Таблица 14Оценка уровней гидроксипролина |