Способ получения 2,3-дизамещенных индолов
Иллюстрации
Показать всеИзобретение относится к способу получения 2,3-дизамещенных индолов общей формулы (I):
где способ включает стадии: а) введения в реакцию броминдола (i):
с диалкоксибораном в присутствии лиганда, палладиевого катализатора, предпочтительно выбранного из Pd(OAc)2, PdCl2, PdBr2, Pd2(dba)3, Pd2(dba)3.CHCl3, [Pd(ally)Cl]2; Pd(CH3CN)2Cl2, Pd(PhCN)2Cl2, Pd/C и капсулированного Pd и основания с получением соединения общей формулы ii;
или, альтернативно, введения в реакцию соединения (i) с соединением магния, содержащим 3 алкильные группы, с последующей обработкой боратом с получением соединения приведенной выше общей формулы ii; b) введения в реакцию продукта, полученного на стадии (а), с: R2-Hal с получением соединения общей формулы I, где R означает (С1-С6)алкил; R2 означает:
, , , , ,
, , , , ;
R3 означает циклопентил: Х означает карбоксиметил; Hal означает Вr или I; или его фармацевтически приемлемой соли. 3 н. и 7 з.п. ф-лы, 4 схемы, 2 табл., 14 пр.
Реферат
РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет по предварительной заявке US No. 60/652072, поданной 11 февраля 2005 г., содержание которой включено в настоящее описание.
УРОВЕНЬ ТЕХНИКИ
1. ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к способу получения 2,3-дизамещенных индолов, применимых в качестве фармацевтических средств, и в особенности фармацевтических средств, предназначенных для лечения инфекции вирусом гепатита С (ВГС).
2. ИНФОРМАЦИЯ ПО ОБЛАСТИ ТЕХНИКИ
Замещенные индолы применяют в качестве фармацевтических средств. Примеры замещенных индолов, применяющихся в качестве фармацевтических средств, включают противовоспалительные средства индометацин и тропесин, антигистаминное средство метгидролин и сосудорасширяющее средство винпоцетин. Другими примерами индолов, применяющихся в качестве фармацевтических средств, являются такие индолы, как раскрытые в заявке US No. 10/198384, поданной 7 июля 2002 г., и в предварительной заявке U.S. 60/546213, поданной 20 февраля 2004 г.
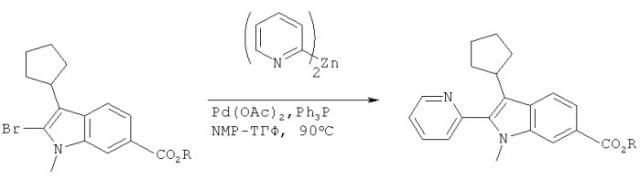
Одной из ключевых стадий синтеза дизамещенных индолов является проведение реакции сочетания с заместителями в положениях 2, 3 индола и для проведения этого сочетания предложен целый ряд общих методик. Примером одной методики является использование промежуточного дипиридилцинка и палладиевого катализатора, как это показано в предварительной заявке US No. 60/551107, поданной 8 марта 2004 г. Эта методика в настоящем изобретении обозначена, как методика А.
МЕТОДИКА А
В другом подходе используется катализируемое Pd индолирование 2-бром- или хлоранилинов алкинами, содержащими тройную связь внутри цепи, и оно описано в предварительной заявке US No. 60/553596, поданной 16 марта 2004 г. Эта методика в настоящем изобретении обозначена, как методика В
МЕТОДИКА В
Хотя методики А и В можно использовать для получения 2,3-дизамещенных индолов, обе методики характеризуются некоторыми ограничениями. Если продукт содержит арилбромидный фрагмент, как в представленном ниже случае, то методика А может привести к образованию продукта полимеризации по конкурентной побочной реакции искомого продукта с нуклеофильным реагентом, т.е. с реагентом, содержащим цинк.
Аналогичным образом, если заместители алкинов, содержащих тройную связь внутри цепи, содержат винилбромидный, винилйодидный, арилбромидный или арилйодидный фрагмент, который будет конкурировать с 2-галогенанилинами за включение в палладиевый катализатор, то методика В может привести к низкому выходу.
Пути синтеза арилбороновых сложных эфиров 1-3 посредством катализируемого палладием борилирования разработали Miyaura and Murata и синтез проводят по реакции бис(пинаколято)дибора 1-1 с арилгалогенидами [Ishiyama, Т.; Murata, M.; Miyaura, N. J. Org. Chem. 1995, 60, 7508] или по реакции диалкоксигидроборана 1-2 с арилгалогенидами или трифлатами [Murata, M.; Oyama, Т.; Watanabe, S., Masuda, Y. J. Org. Chem. 2000, 65, 164]. Однако в зависимости от структуры субстратов оптимальные условия проведения реакции часто существенно различаются.
Поэтому в данной области техники требуется способ получения 2,3-дизамещенных индолов.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу получения 2,3-дизамещенных индолов общей формулы (I):
указанный способ включает стадии
а) введения в реакцию броминдола (i):
с диалкокси-С1-С5-бораном в присутствии лиганда, палладиевого катализатора и основания с получением соединения общей формулы (ii);
или, альтернативно, введения в реакцию соединения (i) с соединением магния, содержащим 3 алкильные группы, с последующей обработкой боратом с получением соединения общей формулы (ii), указанной выше;
b) введения в реакцию продукта, полученного на стадии (а), с:
R2-Hal с получением искомого продукта общей формулы I:
в которой:
R1, R2 и R3, Х и Hal определены в настоящем изобретении.
Настоящее изобретение также относится к способу получения соединений общей формулы III:
в которой R1-R10 определены в настоящем изобретении.
Настоящее изобретение также относится к соединениям, которые являются активными в виде фармацевтических средств, таких как средства, подавляющие ВГС, и применимы в качестве промежуточных продуктов для синтеза средств, подавляющих ВГС.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения и термины
Терминам, специально не определенным в настоящем изобретении, следует придавать такие значения, которые им придал бы специалист в данной области техники с учетом описания и контекста. Однако при использовании в настоящем описании, если не указано иное, приведенные ниже термины обладают указанными значениями и используются указанные ниже обозначения.
В определенных ниже группах, радикалах или фрагментах, перед группой часто указано количество атомов углерода, например, (С1-С8)алкил означает алкильную группу или радикал, содержащий от 1 до 8 атомов углерода, и (С3-С7)циклоалкил означает циклоалкильную группу, содержащую в кольце от 3 до 7 атомов углерода. Обычно в группах, состоящих из двух или большего количества подгрупп, последняя названная группа является положением присоединения радикала, например, "циклоалкилалкил" означает одновалентный радикал формулы циклоалкил-алкил- и фенилалкил означает одновалентный радикал формулы фенил-алкил-. Если ниже не указано иное, то во всех формулах и группах используются обычные определения терминов и обычные валентности атомов.
Термин "алкил" при использовании в настоящем изобретении по отдельности или в комбинации с другим заместителем означает ациклические, обладающие линейной или разветвленной цепью алкильные заместители, содержащие указанное количество атомов углерода.
Термин "алкоксигруппа" при использовании в настоящем изобретении по отдельности или в комбинации с другим заместителем означает алкильную группу, определенную выше, в качестве заместителя присоединенную через атом кислорода: алкил-O-.
Если в названии или структуре соединения не указана конкретная стереохимическая или изомерная форма, то обычно подразумеваются все таутомерные формы и изомерные формы и смеси, как отдельные геометрические изомеры или оптические изомеры, так и рацемические или нерацемические смеси изомеров химической структуры или соединения.
Термин "фармацевтически приемлемая соль" при использовании в настоящем изобретении включает соли, образованные из фармацевтически приемлемых оснований. Примеры подходящих оснований включают холин, этаноламин и этилендиамин. Соли Na+, K+ и Са++ также входят в объем настоящего изобретения (см. также публикацию Pharmaceutical Salts. Birge, S.M. et al., J. Pharm. Sci., (1977), 66, 1-19, которая включена в настоящее изобретение в качестве ссылки).
Термин "фармацевтически приемлемый сложный эфир" при использовании в настоящем изобретении по отдельности или в комбинации с другим заместителем означает сложные эфиры соединения формулы I, в котором любая из карбоксигрупп молекулы, но предпочтительно концевая карбоксигруппа, заменена на алкоксикарбонильную группу:
,
в которой фрагмент Re сложного эфира выбран из группы, включающей алкил (например, метил, этил, н-пропил, трет-бутил, н-бутил), алкоксиалкил (например, метоксиметил), алкоксиацил (например, ацетоксиметил), арилалкил (например, бензил), арилоксиалкил (например, феноксиметил), арил (например, фенил), необязательно замещенный галогеном, (С1-С4)алкилом или (C1-С4)алкоксигруппой. Другие подходящие сложные эфиры пролекарств приведены в публикации Design ofProdrugs. Bundgaard, H.Ed.Elsevier (1985), которая включена в настоящее изобретение в качестве ссылки. Такие фармацевтически приемлемые сложные эфиры после инъекции млекопитающему обычно гидролизуются in vivo и превращаются в кислотную форму соединения формулы I.
В описанных выше сложных эфирах, если не указано иное, любой содержащийся алкильный фрагмент предпочтительно включает от 1 до 16 атомов углерода, более предпочтительно - от 1 до 6 атомов углерода. Любой арильный фрагмент, содержащийся в таких сложных эфирах, предпочтительно включает фенильную группу.
В частности, эти эфиры могут представлять собой (С1-С16)алкиловый эфир, незамещенный бензиловый эфир или бензиловый эфир, замещенный по меньшей мере одним галогеном, (С1-С6)алкилом, (С1-С6)алкоксигруппой, нитрогруппой или трифторметилом.
Указанные ниже соединения могут быть обозначены приведенными ниже аббревиатурами:
| Таблица I | |
| Аббревиатура | Химическое название |
| NMP | 1-Метил-2-пирролидинон |
| ДМА | N,N'-Диметилацетамид |
| Рh3Р | Трифенилфосфин |
| Net3 или Et3N, или ТЭА | Триэтиламин |
| ИПС | Изопропиловый спирт |
| ДМАП | Диметиламинопиридин |
| ДМФ | N,N-Диметилформамид |
| TBTU | O-(Безотриазол-1-ил)-N,N,N',N'-тетраметилуронийтетрафторборат |
| МТБЭ | Метил-трет-бутиловый эфир |
| ЭГН | 2-Этилгексаноат натрия |
| ТГФ | Тетрагидрофуран |
| EDAC | 1-(3-Диметиламинопропил)-3-этилкарбодиимидгидрохлорид |
| ДМЭ | Диметоксиэтан |
| ТФФ | Три(2-фурил)фосфин |
| HATU | O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилуронийгексафторфосфат |
| ВОР | Бензотриазол-1-илокси-трис-(диметиламино)-гексафторфосфат |
| ВrOР | Бром-трис(диметиламино)фосфонийгектафторфосфат |
| ДЦК | N,N'-дициклогексилкарбодиимид |
ОБЩИЕ МЕТОДИКИ СИНТЕЗА
На приведенных ниже схемах синтеза, если не указано иное, все замещающие группы в химических формулах обладают такими же значениями, как и в общей формуле (I). Реагенты, использующиеся в описанных ниже схемах синтеза, можно получить так, как описано в настоящем изобретении, или, если это не описано в настоящем изобретении, то или они имеются в продаже, или их можно получить из имеющихся в продаже веществ по методикам, известным в данной области техники. Например, некоторые исходные вещества можно получить по методикам, описанным в заявке U.S. 60/546213, поданной 20 февраля 2004 г.
Оптимальные условия проведения и длительность проведения реакций могут меняться в зависимости от использующихся реагентов. Если не указано иное, то растворители, температуру, давление и другие условия проведения реакции без затруднений может выбрать специалист с общей подготовкой в данной области техники. Конкретные методики приведены в разделе, посвященном примерам синтеза. Обычно за протеканием реакции при необходимости можно следить с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) и продукты можно очистить с помощью хроматографии на силикагеле и/или перекристаллизации.
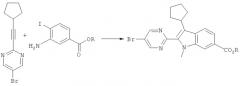
I. Получение броминдолов
На приведенной ниже схеме представлена общая методика получения исходных броминдолов, предназначенных для способа, предлагаемого в настоящем изобретении.
Конденсацию производного индола (1) можно провести с циклоалкилоном (2), таким как циклопропанон или циклогексанон, в присутствии водного раствора основания. Подходящие основания включают водный раствор гидроксида натрия, который можно использовать для получения 3-циклоалкенила R3'(3), который затем можно гидрировать в присутствии каталитического количества палладия на угле и получить соответствующее производное циклоалкилиндола (4). В случае, если заместитель Х содержит активные группы, может потребоваться защита активных групп. Например, если Х обозначает карбоксигруппу, то можно провести метилирование карбоксигруппы. На этой стадии также можно провести метилирование атома азота индольного кольца. Затем проводят бромирование производного индола бромом в ацетонитриле и получают 2-бром-3-циклоалкилиндол (6).
II. Общая методика получения 2,3-дизамещенных индолов из броминдолов
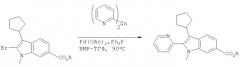
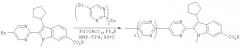
Производное броминдола (1) можно превратить в производное диалкилборонатиндола (2) по методике А, в которой используется диалкоксиборан в присутствии лиганда, такого как ТФФ, палладиевого катализатора и основания. Предпочтительными являются следующие условия проведения реакции: 1,2 экв. пинаколборана, 1,5 экв. Et3N, каталитическое количество Pd(OAc)2 (3 мол.%) и три(2-фурил)фосфин (12 мол.%) в растворителе, таком как ДМЭ или ТГФ. Реакцию проводят при температуре 70-80°С.
Альтернативно, для получения продукта (2) можно использовать методику В. Методика В включает реакцию с соединением магния, содержащим 3 алкильные группы, с последующей обработкой боратом. Диапазон приемлемых условий проведения этой реакции является следующим: обработка броминдола 1 соединением магния, содержащим 3 алкильные группы, таким как iso-PrHex2MgLi (от 0,5 до 0,7 экв.) при температуре от -20 до 0°С с последующим прибавлением бората, такого как 2-изопропокси-4,4,5,5-тетраметил-1,3,2-диоксаборолан, при 0°С. Затем производное индола (2) можно ввести в реакцию с йод- или бромпроизводным гетероцикличесвого соединения общей формулы R2-Hal с получением искомого продукта общей формулы I.
Лиганды - лиганд, который можно использовать в способе, предлагаемом в настоящем изобретении, включает три(2-фурил)фосфин, позволяющий проводить реакцию сочетания типа Судзуки в мягких условиях. Использование три(2-фурил)фосфина также позволяет использовать простые неорганические соли, такие как К2СО3 или К3РО4. Кроме того, три(2-фурил)фосфин также может катализировать первую стадию способа (борилирование) и тем самым позволяет провести две стадии реакции в одном реакторе.
Соединение магния - другой особенностью настоящего изобретения является проведение обмена Вr-металл в 2-броминдоле с помощью соединения магния. Примеры соединений магния, которые можно использовать, включают (G1-G3)MgLi, в котором G обозначает любую (С1-С6)алкильную группу. Предпочтительным соединением магния является i-Pr(n-Hex)2MgLi или i-Pr(n-Bu)2MgLi и т.п. Применение соединения магния в методике В может обеспечить легкое образование 2-индольного аниона при температуре выше -20°С в присутствии карбоксилатной группы в положении X.
Основания - другой особенностью настоящего изобретения является применение водных растворов оснований. Основания, которые можно применять в способе, предлагаемом в настоящем изобретении, включают К2СО3 и К2РO4.
Проведение реакций в одном реакторе - в некоторых вариантах осуществления способ, предлагаемый в настоящем изобретении, можно осуществить в виде однореакторного получения 2,3-дизамещенных индолов из промежуточных 2-броминдолов посредством катализируемого палладием борилирования и реакций сочетания по Судзуки. Такая методика позволяет получить различные 2,3-дизамещенные индолы без двукратного использования дорогостоящего палладиевого катализатора. Три(2-фурил)фосфин можно использовать в качестве общего лиганда на двух стадиях способа (т.е. борилирования и реакций сочетания по Судзуки), и он является предпочтительным лигандом для способа, предлагаемого в настоящем изобретении.
Получение соединений общей формулы III
Производные индола общей формулы III, такие как описанные в предварительной заявке U.S. 60/546213, и в частности, приведенные в таблице 1 указанной заявки, можно синтезировать в контексте настоящего изобретения и предпочтительно - по общей методике, представленной ниже на схеме 1.
Схема 1
Соединения общей формулы III, в которой R1, R2, R3, R4, R5, R6, R7, R8, R9 и R10 являются такими, как определено выше в настоящем изобретении, предпочтительно получать путем сочетания карбоновых кислот общей формулы I' с аминами общей формулы II, как это показано выше на схеме 1, с использованием реагентов, активирующих карбоксигруппу, хорошо известных специалистам в данной области техники. Такие реагенты включают, но не ограничиваются только ими, TBTU, HATU, БОФ, BrOP, EDAC, ДЦК, изобутилхлорформиат и т.п. Альтернативно, карбоновые кислоты общей формулы I' можно превратить в соответствующие хлорангидриды с использованием стандартных реагентов, а затем ввести в реакцию сочетания с аминопроизводными общей формулы II. В случаях, когда R5 или R6 содержит фрагмент карбоновой кислоты со сложноэфирной защитной группой, проводят омыление (по методикам, хорошо известным специалистам в данной области техники) и получают конечный ингибитор в виде свободной карбоновой кислоты.
Промежуточные карбоновые кислоты общей формулы I' можно получить по методикам, описанным в WO 03/010141, или по методикам, описанным в приведенных ниже примерах. Промежуточные амины формулы II можно получить по общим методикам, представленным ниже на схемах 2 и 3.
Схема 2
Соединения, указанные на схеме 1, можно получить из соответствующих диаминовых предшественников общей формулы IV' по реакции сочетания с подходящими гидрохлоридами хлорангидридов α,α-дизамещенных аминокислот. Подходящие гидрохлориды хлорангидридов α,α-дизамещенных аминокислот можно получить из соответствующих α,α-дизамещенных аминокислот так, как это описано в WO 03/007945 или WO 03/010141, или по методике, описанной в публикации Е. S. Uffelman et al. (Org. Lett. 1999, 7, 1157), или с помощью измененного варианта указанной методики. Затем промежуточные амиды, полученные по реакции сочетания, циклизуют и получают промежуточные амины общей формулы II.
Схема 3
Альтернативно, промежуточные амины общей формулы II, приведенной на схеме 1, можно получить из соответствующих диаминовых предшественников общей формулы IV по реакции сочетания с подходящей содержащей защитную группу Воc α,α-дизамещенной аминокислотой, как это показано на схеме 3, с использованием реагентов реакции сочетания, хорошо известных специалисту в данной области техники, таких как TBTU, HATU, БОФ, BrOP, EDAC, ДЦК, изобутилхлорформиат и т.п. Соответствующие содержащие защитную группу Воc α,α-дизамещенные аминокислоты можно получить из свободных α,α-дизамещенных аминокислот при стандартных условиях, хорошо известных специалисту в данной области техники, таких как реакция с Вос2О в присутствии третичного амина, такого как триэтиламин, и т.п. Затем промежуточный амид, полученный по реакции сочетания, циклизуют путем нагревания в присутствии кислоты, такой как уксусная кислота или хлористоводородная кислота. Удаление защитной группы Воc с получением промежуточного амина общей формулы II, приведенной на схеме 1, проводят с использованием стандартных реагентов, хорошо известных специалисту в данной области техники. Такие реагенты включают, но не ограничиваются только ими, трифторуксусную кислоту, раствор НСl в диоксане и т.п.
Диаминовые предшественники общей формулы IV, приведенной на схемах 2 и 3, предпочтительно получают по методикам, описанным в примерах, включая любые измененные методики, и/или путем проведения дополнительных стадий синтеза, известных специалисту в данной области техники.
Промежуточные амины общей формулы II, приведенной на схеме 1, в которой один из R5 и R6 обозначает -CH=C(R50)-COOR, где R50 выбран из группы, включающей (С1-С6)алкил и галоген, и где R, например, обозначает метил или этил, можно получить из соответствующих промежуточных аминов общей формулы III, или их соответствующим образом защищенных производных, где один из R5 и R6 обозначает -COOR, где R обозначает, например, метил или этил, по методикам, представленным ниже на схеме 4. Хотя на схеме 4 специально проиллюстрировано получение промежуточных аминов общей формулы II, в которой R5 обозначает -CH=C(R50)-COOR, специалист в данной области техники должен понимать, что, если R обозначает -COOR, то представленные методики или их измененные варианты приведут к продукту, в котором R6 обозначает -CH=C(R50)-COOR. Специалист в данной области техники также должен понимать, что методики, представленные на схеме 4, или их измененные варианты также можно использовать для превращения диаминового предшественника общей формулы IV', приведенной выше на схемах 2 и 3, или его соответствующим образом защищенного производного, или промежуточного продукта, подходящего для его получения, в котором один из R5 и R6 обозначает -COOR, в диаминовый предшественник общей формулы IV', или его соответствующим образом защищенное производное, или промежуточный продукт, подходящий для его получения, в котором один из R5 и R6 обозначает -CH=C(R50)-COOR, a R50 и R являются такими, как определено выше в настоящем изобретении.
Схема 4
Подходящий защищенный промежуточный амин общей формулы IIIa', приведенной выше на схеме 4, можно превратить в промежуточный спирт общей формулы IIIb' путем обработки подходящим восстановительным реагентом, таким как диизобутилалюминийгидрид и т.п. Подходящие защитные группы (ЗГ) включают, но не ограничиваются только ими, карбаматные защитные группы, такие как Воc (трет-бутоксикарбонил) и т.п. Получение защищенных промежуточных аминов общей формулы IIIa из промежуточных аминов общей формулы II, приведенной выше на схеме 1, можно выполнить по стандартным методикам, хорошо известным специалисту в данной области техники.
Промежуточный спирт IIIb' можно превратить в промежуточный альдегид IIIс' с использованием стандартных окислительных реагентов, хорошо известных специалисту в данной области техники, таких как 1,1,1-трис(ацетокси-1,1-дигидро-1,2-бензйодоксол-3-(1Н)-он (так же известный, как перйодинан Десса-Мартина) и т.п.
Промежуточный альдегид IIIс' можно превратить в промежуточный амин общей формулы IIId' по стандартной методике Хорнера-Эммонса или по аналогичным методикам, таким как реакция Виттига и т.п., хорошо известным специалисту в данной области техники, с последующим удалением ЗГ по стандартным методикам. В случае, когда ЗГ означает Воc, такие методики включают, но не ограничиваются только ими, обработку в кислой среде, такой как трифторуксусная кислота, раствор НСl в диоксане и т.п.
Фармацевтически приемлемые соли соединений, раскрытых в настоящем изобретении, включают соли, полученные с помощью фармацевтически приемлемых неорганических и органических кислот и оснований. Примеры подходящих кислот включают хлористоводородную, бромистоводородную, серную, азотную, хлорную, фумаровую, малеиновую, фосфорную, гликолевую, молочную, салициловую, янтарную, толуол-п-сульфоновую, винную, уксусную, лимонную, метансульфоновую, муравьиную, бензойную, малоновую, нафталин-2-сульфоновую и бензолсульфоновую кислоты. Другие кислоты, такую как щавелевая кислота, которая не является фармацевтически приемлемой, можно использовать для получения солей, применимых в качестве промежуточных продуктов при получении соединений и их фармацевтически приемлемых солей присоединения с кислотами. Соли, полученные с помощью подходящих оснований, включают соли щелочных металлов (например, натрия), щелочноземельных металлов (например, магния), аммония и содержащие N-((С1-С4)алкил)4 +.
Варианты осуществления изобретения
Первый вариант осуществления настоящего изобретения относится к способу получения 2,3-дизамещенных индолов общей формулы (I):
указанный способ включает стадии
а) введения в реакцию броминдола (i):
с диалкокси-С1-С5-бораном в присутствии лиганда, палладиевого катализатора и основания с получением соединения общей формулы ii;
или, альтернативно, введения в реакцию соединения (i) с соединением магния, содержащим 3 алкильные группы, с последующей обработкой боратом с получением соединения общей формулы (ii), указанной выше;
b) введения в реакцию продукта, полученного на стадии (а), с:
R2-Hal
с получением соединения общей формулы I;
в которой:
R1 обозначает Н или (С1-С6)алкил;
R2 обозначает Het или арил, содержащий в кольце 5 или 6 атомов, и Het или арил необязательно замещены с помощью R21;
в которой R21 обозначает 1, 2 или 3 заместителя, выбранные из группы, включающей -ОН, -CN, -N(RN2)RN1, галоген, (С1-С6)алкил, (С1-С6)алкоксигруппу, (С1-С6)алкилтиогруппу, Het и -CO-N(RN2)RN1;
где указанные алкил, алкоксигруппа и алкилтиогруппа все необязательно замещены одним, двумя или тремя атомами галогенов;
R3 обозначает (С5-С6)циклоалкил, необязательно замещенный одним - четырьмя атомами галогенов;
Х обозначает: Н, (С1-С6)алкил, (С1-С6)алкоксигруппу;
Hal обозначает Вr или I;
L обозначает Н или группу общей формулы iii:
в которой
R4 и R7 все независимо выбраны из группы, включающей Н, (С1-С6)алкил, (С1-С6)алкоксигруппу, (С1-С6)алкилтиогруппу, -NH2, -NН(С1-С6)алкил, -n((c1-С6)алкил)2 и галоген;
один из R5 и R6 выбран из группы, включающей СООН, -CO-N(RN2)RN1, Het1 и (С2-С6)алкенил, где Het1, (С2-С6)алкенил и RN1 или любой гетероцикл, образованный между RN2 и RN1, необязательно замещен с помощью R50;
где R50 обозначает 1, 2 или 3 заместителя, выбранные из группы, включающей (С1-С6)алкил, -СООН, -N(RN2)RN1, -CO-N(RN2)RN1 и галоген;
и другой из R5 и R6 выбран из группы, включающей Н, (С1-С6)алкил, (C1-С6)алкоксигруппу, (С1-С6)алкилтиогруппу и N(RN2)RN1;
R8 обозначает (С1-С6)алкил, (С3-С7)циклоалкил или (С3-С7)циклоалкил-(С1-С6)алкил-;
где указанные алкил, циклоалкил и циклоалкилалкил необязательно содержат 1, 2 или 3 заместителя, выбранные из группы, включающей галоген, (С1-С6)алкоксигруппу и (С1-С6)алкилтиогруппу;
R9 и R10 все независимо выбраны из группы, включающей (С1-С6)алкил; или R9 и R10 ковалентно связаны друг с другом с образованием (С3-С7)циклоалкила, (С5-С7)циклоалкенила или 4-, 5- или 6-членного гетероцикла, содержащего 1-3 гетероатома, выбранных из группы, включающей О, N и S;
где указанные циклоалкил, циклоалкенил или гетероцикл необязательно замещены (С1-С4)алкилом;
RN1 выбран из группы, включающей Н, (С1-С6)алкил, (С3-С7)циклоалкил, (С3-С7)циклоалкил-(С1-С6)алкил-, -СО-(С1-С6)алкил, -СО-O-(С1-С6)алкил и Het1;
где все указанные алкилы и циклоалкилы необязательно содержат 1, 2 или 3 заместителя, выбранные из группы, включающей галоген, (С1-С6)алкоксигруппу и (С1-С6)алкилтиогруппу; и
RN2 обозначает Н или (С1-С6)алкил, или
RN2 и RN1 могут быть ковалентно связаны друг с другом с образованием 4-, 5-, 6-или 7-членного насыщенного или ненасыщенного N-содержащего гетероцикла или 8-, 9-, 10- или 11-членного N-содержащего бициклического гетероцикла, каждый из которых дополнительно содержит 1-3 гетероатома, выбранных из группы, включающей О, N и S;
где гетероцикл или бициклический гетероцикл, образованный с помощью RN2 и RN1, необязательно содержит 1, 2 или 3 заместителя, выбранных из группы, включающей галоген, (С1-С6)алкил, (С1-С6)алкоксигруппу и (С1-С6)алкилтиогруппу;
где Het определен как 4-, 5-, 6- или 7-членный гетероцикл, содержащий 1-4 гетероатома, выбранных из группы, включающей О, N и S, который может быть насыщенным, ненасыщенным или ароматическим, или 8-, 9-, 10- или 11-членный бициклический гетероцикл, содержащий 1-5 гетероатомов, если это возможно, выбранных из группы, включающей О, N и S, который может быть насыщенным, ненасыщенным или ароматическим;
или его фармацевтически приемлемой соли.
Второй вариант осуществления настоящего изобретения относится к способу получения 2,3-дизамещенных индолов общей формулы (I), в которой
R1 обозначает Н или (С1-С6)алкил;
R2 обозначает Het или арил, содержащий в кольце 5 или 6 атомов, и Het или арил необязательно замещены с помощью R21;
в которой R21 обозначает 1, 2 или 3 заместителя, выбранные из группы, включающей -ОН, -CN, -N(RN2)RN1, галоген, (С1-С6)алкил, (C1-С6)алкоксигруппу, (С1-С6)алкилтиогруппу, Het и -CO-N(RN2)RN1;
где указанные алкил, алкоксигруппа и алкилтиогруппа все необязательно замещены одним, двумя или тремя атомами галогенов;
R3 обозначает циклопентил;
Х обозначает Н, (С1-С6)алкил, (С1-С6)алкоксигруппу,
Hal обозначает I или Вr;
L обозначает Н или группу общей формулы iii:
в которой
R4 и R7 все независимо выбраны из группы, включающей Н, (С1-С6)алкил, (С1-С6)алкоксигруппу, (С1-С6)алкилтиогруппу, -NH2, -NН(С1-С6)алкил, -N((C1-С6)алкил)2 и галоген;
один из R5 и R6 выбран из группы, включающей СООН, -CO-N(RN2)RN1, Het1 и (С2-С6)алкенил, где Het1, (С2-С6)алкенил и RN1 или любой гетероцикл, образованный между RN2 и RN1, необязательно замещен с помощью R50;
где R50 обозначает 1, 2 или 3 заместителя, выбранные из группы, включающей (С1-С6)алкил, -СООН, -N(RN2)RN1, -CO-N(RN2)RN1 и галоген;
и другой из R5 и R6 выбран из группы, включающей Н, (С1-С6)алкил, (C1-С6)алкоксигруппу, (С1-С6)алкилтиогруппу и N(RN2)RN1;
R8 обозначает (С1-С6)алкил, (С3-С7)циклоалкил или (С3-С7)циклоалкил-(С1-С6)алкил-;
где указанные алкил, циклоалкил и циклоалкилалкил необязательно содержат 1, 2 или 3 заместителя, выбранные из группы, включающей галоген, (С1-С6)алкоксигруппу и (С1-С6)алкилтиогруппу;
R9 и R10 все независимо выбраны из группы, включающей (С1-С6)алкил; или R9 и R10 ковалентно связаны друг с другом с образованием (С3-С7)циклоалкила, (С5-С7)циклоалкенила или 4-, 5- или 6-членного гетероцикла, содержащего 1-3 гетероатома, выбранных из группы, включающей О, N и S;
где указанные циклоалкил, циклоалкенил или гетероцикл необязательно замещены (С1-С4)алкилом;
RN1 выбран из группы, включающей Н, (С1-С6)алкил, (С3-С7)циклоалкил, (С3-С7)циклоалкил-(С1-С6)алкил-, -СО-(С1-С6)алкил, -СО-O-(С1-С6)алкил и Het1;
где все указанные алкилы и циклоалкилы необязательно содержат 1, 2 или 3 заместителя, выбранные из группы, включающей галоген, (С1-С6)алкоксигруппу и (С1-С6)алкилтиогруппу; и
RN2 обозначает Н или (С1-С6)алкил, или
RN2 и RN1 могут быть ковалентно связаны друг с другом с образованием 4-, 5-, 6-или 7-членного насыщенного или ненасыщенного N-содержащего гетероцикла или 8-, 9-, 10- или 11-членного N-содержащего бициклического гетероцикла, каждый из которых дополнительно содержит 1-3 гетероатома, выбранных из группы, включающей О, N и S;
где гетероцикл или бициклический гетероцикл, образованный с помощью RN2 и RN1, необязательно содержит 1, 2 или 3 заместителя, выбранных из группы, включающей галоген, (С1-С6)алкил, (С1-С6)алкоксигруппу и (С1-С6)алкилтиогруппу;
где Het определен как 4-, 5-, 6- или 7-членный гетероцикл, содержащий 1-4 гетероатома, выбранных из группы, включающей О, N и S, который может быть насыщенным, ненасыщенным или ароматическим, или 8-, 9-, 10- или 11-членный бициклический гетероцикл, содержащий 1-5 гетероатомов, если это возможно, выбранных из группы, включающей О, N и S, который может быть насыщенным, ненасыщенным или ароматическим.
Третий вариант осуществления настоящего изобретения относится к способу получения 2,3-дизамещенных индолов общей формулы (I), в которой
R1 обозначает Н или (С1-С6)алкил;
R2 выбран из группы, включающей , , , , , , , , , ;
R3 обозначает (С5-С6)циклоалкил, необязательно замещенный одним - четырьмя атомами галогенов;
Х обозначает: Н, (С1-С6)алкил, (С1-С6)алкоксигруппу,
Hal обозначает Вr или I;
L обозначает Н или группу общей формулы iii:
в которой
R4 и R7 все независимо выбраны из группы, включающей Н, (С1-С6)алкил, (С1-С6)алкоксигруппу, (С1-С6)алкилтиогруппу, -NH2, -NН(С1-С6)алкил, -N((C1-С6)алкил)2 и галоген;
один из R5 и R6 выбран из группы, включающей СООН, -CO-N(RN2)RN1, Het1 и (С2-С6)алкенил, где Het1, (С2-С6)алкенил и RN1 или любой гетероцикл, образованный между RN2 и RN1, необязательно замещен с помощью R50;
где R50 обозначает 1, 2 или 3 заместителя, выбранные из группы, включающей (С1-С6)алкил, -СООН, -N(RN2)RN1, -CO-N(RN2)RN1 и галоген;
и другой из R5 и R6 выбран из группы, включающей Н, (С1-С6)алкил, (C1-С6)алкоксигруппу, (С1-С6)алкилтиогруппу и N(RN2)RN1;
R8 обозначает (С1-С6)алкил, (С3-С7)циклоалкил или (С3-С7)циклоалкил-(С1-С6)алкил-;
где указанные алкил, циклоалкил и циклоалкилалкил необязательно содержат 1, 2 или 3 заместителя, выбранные из группы, включающей галоген, (С1-С6)алкоксигруппу и (С1-С6)алкилтиогруппу;
R9 и R10 все независимо выбраны из группы, включающей (С1-С6)алкил; или R9 и R10 ковалентно связаны друг с другом с образованием (С3-С7)циклоалкила, (С5-С7)циклоалкенила или 4-, 5- или 6-членного гетероцикла, содержащего 1-3 гетероатома, выбранных из группы, включающей О, N и S;
где указанные циклоалкил, циклоалкенил или гетероцикл необязательно замещены (С1-С4)алкилом;
RN1 выбран из группы, включающей Н, (С1-С6)алкил, (С3-С7)циклоалкил, (С3-С7)циклоалкил-(С1-С6)алкил-, -СО-(С1-С6)алкил, -СО-O-(С1-С6)алкил и Het1;
где все указанные алкилы и циклоалкилы необязательно содержат 1, 2 или 3 заместителя, выбранные из группы, включающей галоген, (С1-С6)алкоксигруппу и (С1-С6)алкилтиогруппу; и
RN2 обозначает Н или (С1-С6)алкил, или
RN2 и RN1 могут быть ковалентно связаны друг с другом с образованием 4-, 5-, 6-или 7-член