Конъюгаты интерферонов и способ их получения
Иллюстрации
Показать всеИзобретение относится к соединению, представляющему собой ковалентный конъюгат интерферона с производным N-оксида политриэтилендиамина, и может использоваться для приготовления препаратов противовирусного действия, обладающих противовирусной и иммунотропной активностью. Соединение представляет собой новый стабильный противовирусный препарат интерферона пролонгированного действия. За счет детоксицирующих и антиоксидантных свойств носителя препарат обладает расширенным спектром фармакологического применения. 4 н. и 2 з.п. ф-лы, 1 ил., 2 табл., 12 пр.
Реферат
Изобретение относится к области медицины и может быть использовано и фармакологии для получения препаратов противовирусного назначения.
Интерферон, в частности интерферон α2 (далее IFN), представляет собой биологически активный белок, обладающий иммуномодулирующим, антивирусным, противоопухолевым и антипролиферативным действием. Препятствует вирусному инфицированию клеток, изменяет свойства клеточной мембраны, предотвращает адгезию и проникновение вируса внутрь клетки. Инициирует синтез ряда специфических ферментов, тем самым нарушает синтез вирусной РНК и белков вируса в клетке. Благодаря своим свойствам IFN широко применяется в медицине. Вместе с этим доступность терапий с использованием различных белков, в частности терапия IFN, ограничена коротким периодом полураспада (Т1/2) в плазме, что препятствует их лечебному действию. Так, период полураспада Т1/2 IFN в плазме составляет около 4 часов (в зависимости от вариабельности адсорбции).
Относительно короткий период "естественной" полужизни таких препаратов в организме предусматривает их многократное введение для достижения требуемого терапевтического эффекта. Еще одним важным негативным фактором, ограничивающим применение нативных или рекомбинантных белковых препаратов, является их высокая реактогенность, иммуногенность и связанные с ней реакции сенсибилизации. Отдельно следует отметить технологические и практические проблемы, сопряженные с производством и хранением таких препаратов.
В последние годы для улучшения стабильности и увеличения Т1/2 IFN широко исследуется возможность создания его конъюгатов на основе различных полимерных соединений.
Известны конъюгаты интерферона (патент РФ 2180595, МПК7 A61К 38/21, он. 2002 г.), в которых в качестве субстрата для конъюгации интерферона и его аналогов используют полиэтиленгликоль (ПЭГ).
ПЭГ и производные ПЭГ применяются для модификации разнообразных биомолекул. При связывании с такими молекулами ПЭГ повышает молекулярную массу и образует гелеобразные макромолекулярные структуры. Преимущество конъюгатов ПЭГ с биомолекулами заключается в том, что они характеризуются повышенным удерживанием активного вещества и замедленным метаболизмом в организме. ПЭГилированные интерфероны характеризуются более продолжительным временем полужизни в сыворотке крови по сравнению с немодифицированным интерфероном.
В то же время полиэтиленгликоль не деградирует в организме, накапливается в нем, что может вызывать нежелательные побочные эффекты, что является существенным недостатком его использования.
Наиболее близким из известных аналогов к настоящему изобретению является интерферон, конъюгированный с производным полиэтиленгликоля (патент РФ №2311930, МПК А61К 47/48, оп. 2007 г.), для борьбы с вирусной инфекцией и может быть использован для лечения вирусных заболеваний.
Используемые в известном соединении полиэтиленгликоль (ПЭГ) и его производные, представляющие собой прямые или разветвленные нейтральные полиэфиры, как было отмечено выше, не распадаются в организме на низкомолекулярные соединения и не выводятся из него, накапливаясь, что может вызывать серьезные побочные эффекты, в том числе и новообразования.
Известен способ получения конъюгата интерферона с производным полиэтиленгликоля (патент РФ №2311930, МПК А61К 47/48, оп. 2007 г.) путем многостадийного синтеза, включающего получение полиэтиленоксида (при взаимодействии окиси этилена с метилатом натрия в течение 12 дней при повышении температуры от 120°С до 170°С под давлением 4-5 атм), затем получение ПЭГ-производных с концевыми трезилатными группами (синтез проводится в безводном 1,2-дихлорэтане в присутствии триэтиламина с последующим выделением продукта в избытке серного эфира), заключительная стадия синтеза - пегилирование интерферона (реакция проводится в фосфатно-карбонатном буфере при рН 9,95).
Процесс получения известного соединения, как и синтез его производных, представляет собой сложный многоэтапный процесс, связанный с высоким расходом опасных химических реактивов (например, серный эфир), низким выходом конечного продукта, не превышающим 40% (из-за недостаточного количества активированных групп в ПЭГ-производном), существенным снижением специфической активности с сохранением не более 20% от активности исходного нативного интерферона, также потому, что для очистки целевого продукта необходимо использовать сложную препаративную ионообменную хроматографию
Использование различных производных ПЭГ в качестве полимерных носителей для конъюгации с белками выявило существенные недостатки их применения. Эти недостатки ПЭГ обусловлены химическим строением и свойствами полимера. ПЭГ - жесткоцепной, не биодеградируемый полимер, что накладывает существенные ограничения по возможности его введения в живой организм. Вместе с этим применяемые в настоящее время ПЭГ-носители для конъюгации различных белков имеют в своем составе только две функциональные «якорные» группы, что приводит к неизбирательности протекания реакции конъюгации и, как следствие, к серьезным техническим проблемам, связанным с очисткой и выделением продуктов конъюгации. Многостадийный, технически сложный (препаративная хроматографическая очистка целевых продуктов) процесс очистки и выделения приводит к существенному уменьшению выходов и, что не менее важно, к значительной потере нативной активности белков в составе конъюгатов. Значительная потеря удельной специфической активности белков в составе конъюгатов приводит к снижению эффективности проведения терапии с применением пролонгированных препаратов. Как следствие всего вышеперечисленного, получаемые конъюгаты на основе ПЭГ-носителей, крайне дороги и малодоступны при лечении и профилактике различных заболеваний.
Помимо технологических проблем, необходимо учитывать ряд клинических аспектов безопасности. К основным недостаткам ПЭГ-конъюгированных пептидов, используемых и в качестве уже разрешенных лекарственных форм, и в продолжающихся клинических исследованиях, можно отнести: существенное уменьшение активности белка, связанное с модификацией его ПЭГ; получение вязких гелеобразных макромолекулярных структур, существенно ограничивающих циркуляцию препарата в кровотоке. По сути, при использовании ПЭГилированных препаратов реализуется механизм стабилизации белка по принципу «депо».
Кроме того, имеют место ограничения и новые клинические аспекты безопасности применения ПЭГилированных препаратов, которые включают:
- токсичность пероксидов и промежуточных продуктов;
- вакуолизацию почек и селезенки;
- аккумуляцию высокомолекулярных ПЭГов в организме;
- наличие и образование нейтрализующих антител;
- при введении некоторых препаратов регистрируют активацию системы комплемента;
- потенциальная нестабильность in vitro и in vivo из-за окисления, гемодинамического стресса и т.д.
Технический результат настоящего изобретения состоит в создании новых стабильных препаратов интерферона противовирусного действия, долговременно циркулирующих в кровотоке, в расширении спектра фармакологического действия препаратов на основе интерферона за счет детоксидирующих и антиоксидантных свойств носителя, повышении безопасности препаратов за счет резкого снижения антигенности (иммуногенности), токсичности и, следовательно, вероятности побочных эффектов, снижении частоты инъекций и режима дозирования, а также в возможности проведения синтезов в водных растворах, повышении технологичности, экономичности и экологической безопасности производства.
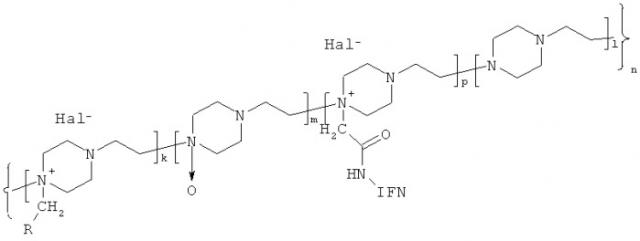
Указанный технический результат достигается соединением, представляющим ковалентный конъюгат белка, обладающего активностью интерферона, с производными N-оксида политриэтилендиамина, имеющим общую формулу (1):
где IFN - белок, обладающий активностью интерферона и представляющий собой интерферон α2;
R - (-СООН,-CONHNH2)
Hal- - Вr-, Сl-;)
k - количество звеньев, содержащих функциональную группу R - 10, 30 и от 40 до 100;
m - количество звеньев, содержащих N-оксид триэтилендиамина, от 50 до 350;
р - количество звеньев, содержащих IFN, от 1 до 5;
l - количество звеньев, содержащих триэгилендиамин, от 9 до 155;
n=k+l+m+p=80-610.
Указанный технический результат достигается также тем, что способ получения соединения по п.1 включает стадию предварительного образования электростатического комплекса при рH 5,7 - 6,0 между белком и активированной формой полимерного носителя на основе N-окиси политриэтилендиамина общей формулы (2):
m - количество звеньев, содержащих N-оксид триэтилендиамина, от 30 до 350;
l - количество звеньев, содержащих триэтилендиамин, от 50 до 260,
n=l+m=80-610,
полученной путем введения реакционно-способных групп с алкилирующим реагентом, после чего проводят реакцию ковалентного связывания с белком, обладающим активностью интерферона.
При этом стадию образования межмолекулярного электростатического комплекса целесообразно проводить при рН 5,7 - 6,0 при температуре 4-6°С в течение 2 часов между белком и активированной формой носителя, полученной по реакции алкилирования бромуксусной кислотой N-оксида политриэтилендиамина общей формулы (2), затем реакцию конъюгации осуществляют карбодиимидным методом при рН 6,5-6,7, температуре 4-6°С в течение 2 часов.
Возможно стадию образования межмолекулярного электростатического комплекса проводить при рН 5,7-6,0 между белком и активированной формой носителя, полученной на основе N-окиси политриэтилендиамина общей формулы (2) по реакции алкилирования N-гидроксисукцинимидным эфиром бромуксусной кислоты, затем реакцию конъюгации завершают сукцинимидным методом при рН 6,5-6,7 и температуре 4-6°С в течение 2 часов.
Указанный технический результат достигается также тем, что в способе получения соединения по п.1 ковалентное связывание белка, обладающего активностью интерферона, проводят азидным методом с активированной формой полимерного носителя на основе N-окиси политриэтилендиамина общей формулы (2):
m - количество звеньев, содержащих N-оксид триэтилендиамина, от 30 до 350;
l - количество звеньев, содержащих триэтилендиамин, от 50 до 260,
n=l+m=80-610,
полученной путем введения гидразидной группы по реакции алкилирования с гидразидом бромуксусной кислоты.
Указанный технический результат достигается также тем, что фармацевтическая композиция, обладающая противовирусной и иммунотропной активностью, содержит соединения по п.1, для приготовления растворов для подкожного введения, в которой для получения конъюгатов используют интерферон альфа-2 человеческий рекомбинантный, активность препарата характеризуют в ME (международные единицы противовирусной активности интерферона), при этом одна доза (1 мл) содержит 0,5×106 ME, 1,5 ×106 ME или 3,0×106 ME, вспомогательные вещества - натрия хлорид, натрия ацетат, Полисорбат 80, вода для инъекций.
Известно, что при использовании водорастворимых носителей достижение многоточечного связывания между белком и полимерным носителем резко повышает конформационную стабильность молекулы белка. Производные N-оксида политриэтилендиамина (ПNO) являются ионогенными носителями, и за счет использования в качестве промежуточной стадии рH 5,7-6,0 происходит образование электростатического комплекса между белком и макромолекулой носителя, поскольку поверхность белковой глобулы оказывается комплементарной поверхности полимера, что позволяет существенно повысить не только уровень стабилизации, но и количественный выход конечного продукта при проведении реакции ковалентной конъюгации путем образования амидной связи между молекулами белка и носителя.
Представляется особенно важным различие в механизме обеспечения доставки стабилизированных препаратов к органам-мишеням, т.к. конъюгаты ПNО с активными белками образуют истинные растворы в физиологических средах и, циркулируя в кровотоке, обеспечивают высокую биодоступность стабилизированного препарата, значительно превышающую биодоступность гелеобразных ПЭГелированных структур. При этом сравнительные исследования показывают, что определенная эффективность достигается при значительно меньших концентрациях ПNО-конъюгатов, чем ПЭГ-конъюгатов. Таким образом, дозировки ПNО-конъюгатов могут быть существенно снижены, и, как следствие, становятся очевидными преимущества в безопасности и фармакоэкономике.
Создание пролонгированных интерферонов в соответствии с изобретением решает основную задачу - стабилизацию интерферонов, а именно:
1. В результате модификации интерферона, обладающего определенной специфической активностью, растворимым полимером, который одновременно и стабилизирует активную конформацию белка и замедляет его выведение из системы циркуляции, получены долговременно циркулирующие в кровотоке стабильные препараты.
2. Для стабилизации интерферона используют носитель, обладающий полезной биологической активностью и способный усиливать действие белка, что является наиболее перспективным подходом для создания комплексных безбалластных активных биопрепаратов.
3. Поскольку ПNO представляет собой объемную и достаточно жесткую полимерную матрицу, не оказывающую существенного влияния на специфические свойства белка, то обеспечивается резкое повышение его стабильности по отношению к различным инактивирующим воздействиям. В организме такие препараты по сравнению с нативным белком обладают не только увеличенным временем активного функционирования, но и повышенной безопасностью, резко сниженными антигенностью и токсичностью, нередко осложняющих применение нативных физиологически активных белков в качестве лекарственных препаратов.
Под IFN понимают природный или рекомбинантный протеин, предпочтительно человеческий, получаемый, например, из лейкоцитов донорской крови человека или получаемый генно-инженерными методами путем микробиологического синтеза белка из культуры клеток с использованием нативных и (или) рекомбинантных клеток. Методика получения и выделения IFN из природных или рекомбинантных источников хорошо известна (Pestka, Arch. Biochem. Biophys. 221,1, (1983).
Конъюгаты в соответствии с настоящим изобретением обладают активностью, превосходящей нагивный интерферон, резко сниженной токсичностью и иммуногенностью. Вместе с этим полученные конъюгаты являются пролонгированными препаратами, характеризуются резко увеличенным периодом полураспада в кровотоке и временем нахождения в плазме и могут найти широкое применение в медицине для профилактики и лечения вирусных и бактериальных инфекций.
Исключительной особенностью пролонгированных интерферонов в соответствии с изобретением является то, что они получены на основе биодеградируемых сополимеров производных N-оксида политриэтилендиамина (ПNО) с общей формулой (2).
Наличие свободного третичного атома азота в основной цепи макромолекулы позволяет использовать ПNО в качестве носителя белковых молекул, что открывает широкие возможности модификации и введения различных высокореакционных функциональных групп, таких как -СООН и -NH2, с последующим образованием природных пептидных связей в конъюгате с белком. Данная структура носителя ПNО является отличием от ПЭГ, который имеет в своей структуре две конечные слабореакционные ОН-группы.
Благодаря наличию в составе ПNО N-оксидных функциональных групп они легко деструктируют в организме на олигомерные и низкомолекулярные соединения, способные полностью выводиться из организма после выполнения своей полезной функции. Производные ПNO обладают высокой реакционной способностью, позволяющей получать конъюгаты с белковыми молекулами в мягких условиях и с высоким выходом. Кроме того, производные ПNO обладают физиологической и фармакологической активностью, проявляя противовирусные, антиоксидантные, детоксицирующие и антибактериальные свойства, чем существенно отличаются от абсолютно нейтрального полиэтиленгликоля. Таким образом, ковалентная конъюгация ПNO, обладающего собственной физиологической активностью с физиологически активным белковым агентом, решает проблему создания безбаластного фармакологического средства.
Конъюгат в соответствии с изобретением отличает резко сниженная иммуногенность.
Конъюгат по настоящему изобретению имеет те же или большие области применения, что и INF, например, в качестве средств, обладающих противовирусным и иммунотропным действием.
Создание нового пролонгированного препарата на основе конъюгатов ПNО с белковым лекарственным препаратом IFN позволяет:
1. Улучшить фармакокинетическое поведение препарата в организме и обеспечить высокие локальные концентрации в органе-мишени за счет изменения физических и химических особенностей биомедицинских молекул, в частности их конформации, электростатического связывания и растворимости.
2. Снизить частоту инъекций и изменить режим дозирования препарата за счет повышения стабильности и времени нахождения препарата в сыворотке крови, снижения протеолиза и инактивации белка сывороточными ингибиторами, а также почечной экскреции.
3. Существенно повысить специфическую и общетоксическую безопасность препарата (снижение аллергизирующих свойств, токсичности, иммуногенности).
4. Повысить эффективность проводимой терапии, особенно в условиях организма, ослабленного хроническим заболеванием, за счет наличия собственной активности носителя ПNО, обладающего антиоксидантным и детоксицирующим действием.
Пролонгированные препараты, получаемые но настоящему изобретению, представляют собой вещества с заданной молекулярной структурой. Они получены контролируемой и направленной химической модификацией протеинов с помощью оригинального полимерного носителя. При этом управление процессами осуществляют как на этапе получения необходимого носителя, так и при химическом манипулировании функциональными группами белков для создания амидных связей между белком и синтетическим носителем. В новой молекуле белковая компонента защищена от денатурирующего воздействия среды, чем преимущественно достигается пролонгированное действие разрабатываемых лекарственных средств. Применяемые в патенте технологические способы получения путем конъюгирования ПNО с IFN позволяет получать гораздо более эффективные новые лекарственные средства.
Физиологически активные конъюгаты формулы 1 обладают активностью IFN, под которой понимают любую известную специфическую активность IFN, определяемую различными известными способами. При получении конъюгатов IFN с производными ПNO специфическая активность белка в субстанции конъюгата составляет не менее 1,8x108 МЕ/мг белка из исходного 2×108 МЕ/мг. При традиционном подходе (препарат ПЭГ-Интрон, Швейцария) специфическая активность белка в составе пегилированного конъюгата не выше 0,7×108 МЕ/мг белка из исходного 2,6×108 МЕ/мг (падение активности примерно в 3,5 раза) [Grace MJ, 2004; United States Patent, Application Number: 12/095335, 2009].
Результаты, полученные в ходе синтеза конъюгатов интерферонов с ПNО, свидетельствуют о значительных преимуществах разработанных способов по сравнению с известными методами. Прежде всего, это касается практически количественного выхода конечного продукта с полным сохранением специфической активности. Достижение количественного выхода конечного продукта стало возможным благодаря образованию предреакционного кооперативного комплекса между молекулами белка и полимерного носителя. Следует отметить также, что реакция конъюгации протекает в мягких условиях, преимущественно в гомогенных водных растворах. Разработанные способы синтеза позволяют получать конъюгаты с высокой эффективностью, безопасностью, с выгодными фармакоэкономическими показателями по сравнению с существующими препаратами.
Способ получения конъюгатов ПNO с белками IFN осуществляют следующим образом:
Предварительно получают активированную форму ПNO путем введения реакционно-способных групп по реакции взаимодействия с алкилирующими реагентами (в частности, бромуксусной кислотой ВrСН2СООН, гидразидом бромуксусной кислоты ВrСН2СОNHNН2), после чего добавляют раствор IFN в фосфатном буферном растворе (рH 5,8-6,0) и выдерживают при комнатной температуре в течение 1 часа. В этих условиях происходит электростатическое связывание двух противоположно заряженных макромолекул и образование устойчивого межмолекулярного комплекса. 3aтем проводят непосредственно реакцию конъюгации.
Для активации реакции конъюгации АФ-ПNO с интерфероном вводят любые известные, предназначенные для этой цели реагенты, например, из группы водорастворимых карбодиимидов и/или N-гидроксисукцинимидов.
Ход реакции конъюгации контролируют по данным высокоэффективной жидкостной хроматографии (ВЭЖХ). Соотношение сополимер/интерферон выбирают таким образом, чтобы в конъюгате получить преимущественно р=1-3. После завершения реакции реакционную смесь подвергают очистке методом ультрафильтрации, целевой продукт выделяют лиофильным высушиванием.
Нижеследующие примеры 1-6 иллюстрируют способы получения конъюгатов интерферонов в соответствии с описываемым изобретением, а 7-11 - изучение их фармакологических свойств, где примеры 7-8 иллюстрируют специфическую противовирусную активность пролонгированного интерферона, примеры 9-10 - сохранение специфической иммунотропной активности, свойственной нативным интерферонам, пример 11 посвящен оценке фармакокинетики, примеры 12-14 - различным аспектам доклинического исследования безопасности.
Пример 1. Получение пролонгированных интерферонов путем конъюгации с ПNО карбодиимидным методом (синтез образца КИ-1).
1,0 г политриэтилендиамина (ПТЭДА, ММ 50000Д) растворяют в 30 мл 0,1 М раствора уксусной кислоты и добавляют 0,7 мл 30% перекиси водорода. Реакцию окисления ПТЭДА проводят в течение 20 час при температуре 20°С.
Полученный поли-N-оксид (ПNО) идентифицируют и анализируют с помощью методов ИК-спектроскопии (характеристическая полоса 960 см-1) и комплекса методов анализа, сочетающего ВЭЖХ с детекцией малоуглового лазерного рассеяния, рефрактометрии. В результате определены следующие характеристики ПNО согласно формуле 2: m=300, l=150, n=500.
Для синтеза сополимера N-оксида триэтилендиамина и N-(карбоксиметил)-триэтилендиамина (С-ПNО) к полученному поли-N-оксиду добавляют 0,25 мл бромуксусной кислоты и при нагревании (40°С) и энергичном перемешивании реакцию проводят в течение 48 часов. Раствор диализуют, проводят ультрафильтрационную очистку.
В раствор, содержащий 100 мг С-ПNО, при температуре 4-6°С добавляют при перемешивании раствор интерферона, содержащий 100 мг IFN в 20 мл 0,05 м фосфатного буферного раствора рH 5,7-6,0 (специфическая активность исходного интерферона 2×108 МЕ/мг белка). Смесь перемешивают при температуре 4-6°С в течение 2 часов. Затем добавляют 1.02 мг водорастворимого карбодиимида (1-этил-3-3-диметиламинопропил) карбодиимида гидрохлорида) и перемешивают раствор при рH 6,5-6,7, температура 4-6°С в течение 2 часов при контроле степени конъюгации методом ВЭЖХ. После чего раствор очищают ультрафильтрацией на кассете с фильтрами с номинальным удерживанием молекулярных масс 5 кДа при температуре 4-6°С (12,5М ацетатный буфер), наличие примесей контролируют ВЭЖХ.
Получены следующие характеристики препарата формулы (1): выход конъюгата в расчете на белок 97%; конъюгат имеет чистоту более 99%, не содержит свободного интерферона, р=1, специфическая активность белка в субстанции конъюгата составляет не менее 1,8×108 МЕ/мг белка. Препарат характеризуется следующими параметрами: m=350, k=30, l=120, n=500, р=1.
Характеристики полученного конъюгата определяют следующими методами.
А. Количественное определение немодифицированного интерферона α2 проводят методом ионообменной хроматографии.
Анализируют 10 мкл препарата. Время удерживания конъюгата (10,5±1) минут. Оборудование и условия анализа: Насос для хроматографии при высоких давлениях в градиентном режиме; хроматографическая колонка: TSK SP-5PW, 75×7,5 мм; программно-аппаратный комплекс для сбора и обработки хроматографических данных «МультиХром 1,5х». Скорость потока 1 мл/мин. Температура колонки комнатная. На хроматограмме измеряют площадь пика индивидуального IFN со временем удерживания (5,0±0,5) минут и площадь пика конъюгата. Процентное содержание немодифицированного IFN, а также конъюгата рассчитывают по формуле
где ωх - процентное содержание IFN, Sx - площадь пика IFN, S0 - суммарная площадь IFN и конъюгата.
Б. Количественное определение конъюгата осуществляют путем измерения площади пика INF на хроматограмме, полученной согласно разделу А «Количественное определение немодифицированного IFN». Концентрацию конъюгата (CТ) в растворе препарата пролонгированного интерферона, в мг/мл, рассчитывают по формуле
где SТ - площадь пика конъюгата на хроматограмме препарата, мВ·с;
SS - площадь пика IFN на хроматограмме стандартного образца, мВс;
CS - концентрация IFN в стандартном образце, мг/мл.
Пример 2. Получение пролонгированных иитерферонов путем конъюгации IFN с ПNО гидразидным методом (синтез образца КИ-2).
20 мг ПNO, полученного, как описано в примере 1, имеющего следующие характеристики: m=350, l=260, n=610, растворяют в 50 мл смеси диметилформамида и воды (в соотношении 3:1 по объему), при нагревании (40°С) и энергичном перемешивании добавляют 1,5 мл гидразида бромуксусной кислоты. Реакцию проводят в течение 72 часов. Затем раствор подвергают ультрафильтрационной очистке. Выход 90%. Содержание гидразидных групп k=90 (метод титрования первичных аминогрупп 2,4,6 тринитробензол сульфокислотой).
2 мл 1н. НСl добавляют к 1 мл водного раствора, содержащего 10,0 мг гидразидного производного ПNO. Раствор охлаждают до 0-2°С. Затем при перемешивании и охлаждении добавляют 0,15 мл 3% раствора нитрита натрия. Через 15 минут доводят рН раствора до 8,5 добавлением 2н. NaOH.
Раствор 2,0 мг интерферона в 1,0 мл 0,05 М фосфатного буфера рН 8,5 добавляют к реакционному раствору. Поддерживают рН реакционной смеси равным 8,5 добавлением 2н. NaOH. Реакция продолжается в течение 12 часов при перемешивании и охлаждении (0-2°С). Для выделения и очистки конъюгата реакционную смесь наносят на колонку (2,6×90), заполненную Сефадекс G-100, в качестве элюента используют фосфатный буфер 0,05М рН 7,5, содержащий 0,05М NaCl. Выход конъюгата контролируют с помощью проточного спектрофотометра при 226 нм. Определение содержания белка и анализ конъюгата проводят методами флуоресцентной спектроскопии, электрофореза в ПААГ.
Получены следующие характеристики препарата методами, описанными в примере 1: выход конъюгата в расчете на белок 97%; конъюгат имеет чистоту более 99%, не содержит свободного интерферона, m=350, k=90, l=155, n=610, р=5.
Пример 3. Получение пролонгированных интерферонов путем конъюгации IFN с ПNO сукцинимидным методом (синтез образца КИ-3).
Получение ПNO проводят по методу, изложенному в примере 1, с характеристиками m=80, l=40, n=120.
2,08 мг ПNO растворяют в 5,0 мл воды, добавляют 1,04 мкмоль бромуксусной кислоты, затем добавляют 1,15 мг (1,0 мкмоль) N-гидроксисукцинимида и после растворения доводят рН до 4,5 - 5,0. Затем вводят 1,92 мг (1,0 мкмоль) 1-этил-3-(3-диметиламинопропил)-карбодиимида гидрохлорида (EDAC) и перемешивают 30 минут при температуре 4-6°С.
После этого полученный раствор вводят при перемешивании и температуре 0-2°С в раствор IFN (1,2 мг в 5 мл 25 мМ фосфатного буферного раствора, pH 5,7-6,0). Реакционную смесь перемешивают в течение 2 часов при pH 5,7-6,0. Реакцию конъюгации завершают при pH 6,5-6,7, температуре 4-6°С в течение 2 часов. Затем реакционную массу переносят в диализную трубку с номинальным удерживанием молекулярных масс 3500 Да и диализуют против 12,5 мМ ацетатного буферного раствора. Наличие примесей и характеристики конъюгата контролируют по данным ВЭЖХ, как описано в примере 1. Полученный конъюгированный интерферон имеет выход 96% (в расчете на белок), имеет чистоту более 99%, не содержит свободного интерферона, m=80, k=30, l=9, n=120, р=3.
Пример 4. Синтез образца КИ-4 проводят согласно методике, описанной в примере 1.
20 мг ПNO, имеющего характеристики m=50, l=50, n=100, конъюгируют с 4 мг IFN и получают препарат КИ-4, характеризующийся следующими параметрами: m=50, k=40, l=10, n=100, р=2.
Пример 5. Синтез образца КИ-5 проводят согласно методике, описанной в примере 2.
20 мг ПNO, имеющего характеристики m=160, l=40, n=200, конъюгируют с 32 мг IFN и получают препарат КИ-5, характеризующийся следующими параметрами: m=160, k=30, l=9, n=200, р=4.
Пример 6. Синтез образца КИ-6 проводят согласно методике, описанной в примере 3.
20 мг ПNO, имеющего характеристики m=210, l=90, n=300, конъюгируют с 12,4 мг IFN и получают препарат КИ-6, характеризующийся следующими параметрами: m=210, k=10, l=80, n=300, р=1.
Пример 7. Оценка специфической противовирусной активности.
Противовирусную активность препаратов интерферона определяют в культурах диплоидных или перевиваемых линий клеток, чувствительных к IFN (в частности, на культуре MDBK). В качестве тестового вируса, в соответствии с рекомендацией Европейской фармакопеи, используют вирус везикулярного стоматита либо вирус энцефаломиокардита мышей.
Определение специфической активности проводят с использованием 2-3-суточного монослоя культуры клеток MDBK. Противовирусную активность препаратов интерферона определяют в сравнении с отраслевым стандартным образцом активности человеческого лейкоцитарного IFN (ОСО 42-28-90-97), активность которого составляет 4 тыс. МЕ/мл для препаратов природного происхождения и в сравнении с отраслевым стандартным образцом активности человеческого рекомбинантного IFN (ОСО 42-28-119-96), противовирусная активность которого составляет 2 млн МЕ/мл для препаратов генно-инженерного происхождения соответственно.
Для определения активности препарата интерферона готовят двукратные разведения испытуемых образцов и ОСО активности в поддерживающей среде (на 4 разведения ниже и выше предполагаемого титра). Учет результатов опыта возможен при отсутствии признаков дегенерации в контрольной культуре клеток. За титр интерферона принимают величину, обратную разведению препарата, при котором клеточная культура в 50% лунок оказалась полностью защищенной от цитопатического действия вируса, внесенного в дозе 100 ТЦД50/0,1 мл.
Титр интерферона вычисляют методом Спирмена-Кербера по формуле
log2ED50=Dmax+d/n×(р-n/2),
где Dmax - двоичный логарифм разведения, выше которого произошла 100% защита клеток (-);
d - двоичный логарифм шага разведения (1,0);
n - число лунок на каждую дозу (4);
р - число лунок, давших защиту (-) в Dmax и последующих разведениях.
Показано, что все серии образцов синтезированных конъюгатов КИ-1-КИ-6 оказывают защитное действие на клетки от цитопатогенного влияния вируса. Для дальнейших исследований были использованы все образцы синтезированных конъюгатов.
Пример 8. Результаты изучения специфической противовирусной активности конъюгатов интерферона в отношении вируса гепатита С.
Вирусные гепатиты относятся к категории наиболее опасных и распространенных инфекционных заболеваний человека. Ежегодно в мире от патологий, связанных с вирусными гепатитами, погибает до 2 миллионов человек. На сегодняшний день вирусные гепатиты рассматриваются как угроза в недалеком будущем (через 20-30 лет) демографической, экономической и социальной ситуации мирового масштаба. Таким образом, разработка отечественного интерферона пролонгированного действия является актуальной и очень важной задачей.
Изучение противовирусного действия конъюгатов интерферона (КИ-1-КИ-6) проводили в отношении инфекции, вызванной вирусом гепатита С (ВГС) двух генотипов (1b и 2) на клеточной линии легких эмбриона человека (ЛЭЧ). Оценку специфической активности препаратов проводили по способности ВГС индуцировать цитопатогенный эффект в культурах клеток ЛЭЧ в присутствии или в отсутствие препаратов (конъюгированных образцов и препарата сравнения) при внесении препаратов в культуру клеток за 24 ч и в момент инфицирования. Все препараты предварительно были разведены до сопоставимых концентраций - 0,7×106 МЕ/мл. Результаты учитывали на 5 день после заражения культур клеток, когда наблюдали максимальное проявление цитопатических изменений (гибели клеток) в контрольных ВГС инфицированных культурах клеток (без добавления препарата). Процент погибших клеток подсчитывали под микроскопом после обработки монослоя метиленовым синим.
Полученные данные свидетельствуют о высоком химиотерапевтическом индексе исследуемых конъюгатов (ХТИ=500). Наибольшей активностью обладал препарат КИ-6, который при разведении в 2 раза повышал количество выживших от цитопатогенного действия вируса клеток ЛЭЧ в 6 раз, а при разведении в 4 раза - в 5 раз. Показана способность и других препаратов конъюгированного интерферона (образцы КИ-1-КИ-5), а также рекомбинантного интерферона защищать культуры клеток ЛЭЧ от цитопатогенного действия вируса гепатита С: IFN и конъюгаты, разведенные в 2 раза, повышали процент жизнеспособных инфицированных ВГС клеток в 3,5 - 4 раза, а при разведении в 4 раза повышали процент выживших клеток в 3 раза. Способность препаратов защищать инфицированные клетки ЛЭЧ от цитопатогенного действия ВГС увеличивалась при двукратной обработке клеток - за 24 часа до заражения вирусом и в момент инфицирования. Эффект противовирусной активности конъюгатов в соответствии с изобретением достигается при концентрациях, в 2-4 раза меньших по сравнению с нативным интерфероном. Следует отметить, что наблюдаемое усиление противовирусной активности препаратов при их двукратном применении свидетельствует о необходимости многократного внесения интерферонсодержащих препаратов для получения максимального лечебно-профилактического эффекта при гепатите С.
Пример 9. Результаты изучения способности конъюгатов интерферона усиливать продукцию цитокинов клетками крови человека.
Проведено исследование активности всех конъюгатов интерферона (образцы КИ-1-КИ-6) в индукции выработки интерферона-гамма, фактора некроза опухоли альфа (ФНО-альфа), интерлейкина-6 (ИЛ-6) и интерлейкина-1 (ИЛ-1 бета) мононуклеарными клетками крови человека. Исследуемым материалом являлась гепаринизированная кровь 10 здоровых людей.
Выявлена выраженная способность конъюгатов в концентрациях 100, 1000 и 10000 МЕ/мл дозозависимо усиливать продукцию интерферона гамма мононуклеарными клетками крови человека в присутствии митогена. В дозе 10000 МЕ/мл костимулирующий эффект КИ более чем в 2 раза превышает таковой для соответствующей дозы рекомбинантного IFN. Поскольку различия в индукции интерферона гамма между конъюгатами выявлены не были, на фиг.1 приведены объединенные данные по конъюгатам в сравнении с рекомбинантным интерфероном.
В отношении индукции ФНО-альфа в присутствии митогена показан сходный костимулирующий эффект конъюгатов и рекомбинантного IFN. Так же, как и при индукции интерферона гамма, эффект был зависим от дозы. Существенных различий в активности двух типов препаратов (рекомбанантного интерферона и конъюгатов) выявлено не было.
Костимулирующего эффекта на продукцию ИЛ-6 и ИЛ-1 β в присутствии митогена в данном исследовании выявлено не было как для конъюгатов, так и рекомбинантного IFN.
Пример 10. Результаты изучения способности конъюгатов интерферона усиливать экспрессию активационных рецепторов на антигенпрезентирующих клетках.
Известно, что интерфероны I типа, в т.ч. интерферон альфа, способны оказывать активирующее влияние на основные типы антигенпрезентирующих клеток (дендритные клетки (ДК) и макрофаги (МФ). Усиление способности ДК и МФ представлять антигены в форме, которая может распознаваться лимфоцитами, выражается, в частности, в повышении экспрессии молекул главного комплекса гистосовместимости и костимулирующих молекул CD80 и CD86. Результаты изучения потенциального влияния конъюгации на данный