Вектор для экспрессии полипептидов с сиалидазной активностью, способ обеспечения сиалидазной активности в культуре клеток и способ регулирования свойств fc-содержащих молекул, экспрессируемых в линии клеток
Иллюстрации
Показать всеИзобретение относится к области биоинженерии и молекулярной биологии. Предложен способ обеспечения сиалидазной ферментативной активности в культуре клеточной линии на основе трансфекции клетки вектором для экспрессии полипептида, имеющего сиалидазную ферментативную активность и включающего последовательность, кодирующую каталитический домен фермента сиалидазы с пониженным количеством остатков сиаловой кислоты, где полипептид секретируется в среду вместе с Fc-содержащим белком. Так же предложен соответствующий вектор. Изобретение применимо при лечении заболеваний или состояний, при которых желательно регулировать аффинность в отношении одного или нескольких рецепторов FcγRI, FcγRIIA и FcγRIIIA, активность ADCC, активацию макрофагов или моноцитов, время полужизни в сыворотке и авидность. 3 н. и 11 з.п. ф-лы, 14 ил., 4 табл., 9 пр.
Реферат
Предпосылки создания изобретения
Область техники, к которой относится изобретение
Изобретение относится к способам получения лечебных белков, взаимодействующих с Fc-рецепторами, например антител, в которых состав олигосахаридных цепей оптимизирован для авидности антител в отношении своей мишени, а также аффиности связывания Fc-рецепторов, причем посредством этого оптимизируется эффекторная функциональная активность указанных антител по сравнению с неоптимизированными методами получения гликозилированных антител.
Описание родственных технических решений
Антитела представляют собой растворимые сывороточные гликопротеины, которые играют существенную роль в наследственном иммунитете. Углеводная структура всех продуцируемых в природе антител в консервативных позициях в константных областях тяжелой цепи изменяется с изотипом. Каждый изотип обладает определенным порядком N-соединенных олигосахаридных структур, который вариабельно влияет на сборку белка, секрецию или функциональную активность (Wright A. and Morrison S.L., Trends Biotech., 15: 26-32 (1997). При обращении к фиг.1 и 2 видно, что структура присоединенных N-соединенных олигосахаридов существенно изменяется в зависимости от степени процессинга и может включать много маннозных звеньев, а также комплекс биантеннальных олигосахаридов с или без рассекающего GlcNAc и коровых остатков фукозы (Wright A. and Morrison S.L., цит. выше). Типично происходит гетерогенный процессинг коровых олигосахаридных структур, связанный с определенным сайтом гликозилирования, так что даже моноклональные антитела существуют в виде многих гликоформ. Подобным образом, показано, что основные различия в гликозилировании антител имеют место между клеточными линиями, продуцирующими антитела, и даже видны небольшие различия для данной клеточной линии, растущей в различных условиях культивирования.
Известно, что сиаловая кислота в гликанах (статические группы) важна для пролонгирования времени полужизни в сыворотке гликопротеинов иных, чем антитела (Stockert R.J. (1995), Physiol. Rev., 75, 591-609). До сих пор роль сиаловой кислоты в моноклональных антителах (Mab) непонятна. Время полужизни Mab в сыворотке является особенно длительным, и конструирование Fc-слитых белков дает применимую стратегию при разработке лечебных белков, например белкового энтерацептика (protein enteracept).
Антитела и молекулы Т-клеточных рецепторов обладают участками, которые ответственны за специфическое связывание с клеточной поверхностью, которое модулирует клеточную реакцию. В иммунной системе такие функции классифицируют как гуморальные и клеточные. Антитела часто относят к адаптерным молекулам, связывающим гуморальный и клеточный иммунные механизмы: гуморальные реакции связывают, главным образом, с зрелыми секретированными циркулирующими антителами, способными к связыванию с высокой аффинностью с антигеном-мишенью. Клеточные реакции связывают с результатами клеточной активации за счет связывания комплексов Аг-Ат (ab-ag) и за счет последствий, вызванных высвобождением клеточных медиаторов в результате связывания комплекса Аг-Ат с эффекторными клетками. Такие клеточные реакции включают нейтрализацию мишени, опсонизацию и сенсибилизацию (если антиген отображается на поверхности клетки), сенсибилизацию тучных клеток и активацию комплемента. Для клеточных мишеней, т.е. антигенов клеточной поверхности, такие эффекторные функции ведут к тому, что обычно известно как антителозависимая клеточная цитотоксичность (ADCC) и комплементзависимая цитотоксичность (CDC).
Среди изотипов антител (например, IgE, IgD, IgA, IgM и IgG) IgG являются наиболее распространенными с подклассами IgG1, обнаруживающими наибольшие степень и ряд эффекторных функций. Антитела типа IgG1 являются наиболее используемыми антителами в иммунотерапии рака, где активность ADCC и CDC часто считается важной. Структурно-шарнирная область IgG и домены СН2 играют важную роль в эффекторных функциях антител. Присутствующие в Fc-области N-соединенные олигосахариды влияют на эффекторные функции. Ковалентно-связанные олигосахариды являются комплексными структурами биантенниального типа и являются высокогетерогенными (см. фиг.1 и 2). Консервативный N-связанный сайт гликозилирования в Asn297 размещен в каждом домене СН2. В зрелом антителе два комплексных биантенниальных олигосахарида скрываются между доменами СН2, образуя экстенсивные контакты с главной цепью полипептида. Обнаружено, что их присутствие существенно для антител, опосредующих эффекторные функции, такие как ADCC (Lifely M.R. et al., Glycobiology, 5: 813-822 (1995); Jefferis R. et al., Immunol. Rev., 163: 59-76 (1998); Wright A. and Morrison S.L., цит. выше).
Гетерогенные олигосахариды, декорирующие антитело Fc-части, или образованные антителами структуры, включая продуцированные различными клетками-хозяевами, содержат преимущественно остатки сиаловой кислоты, фукозы, галактозы и GlcNA как концевые сахара (Raju T.S. et al., Glycobiology, 2000, 10(5): 477-86). Показано, что некоторые такие концевые сахара, в частности, подвергнутые воздействию галактозы, остатки коровой фукозы и рассекающего GlcNA, влияют на структуру Fc-части молекулы и посредством этого изменяют эффекторные функции антител. Эффекторные функции, такие как активность ADCC и активность CDC, которые опираются на связывание с рецепторами клеточной поверхности, известными как Fc-рецепторы, а также на связывание с различными лигандами, включая комплементный белок C1q, могут быть изменены из-за состава присоединенного гликана (Presta L., 2003, Curr. Opin. Struct. Biol., 13(4): 519-25). Большинство N-соединенных гликанов, присоединенных к Fc, не являются сиалилированными в значительной степени (Idusogie E.E. et al., 2000, J. Immunol., 15: 164(8): 4178-84).
Основные структуры, обнаруженные в человеческом IgG и других полученных рекомбинантно IgG, представляют собой комплексные биантенниальные структуры с подвергнутыми воздействию остатками Gal или без них (фиг.1). Существует ряд клеток-хозяев млекопитающих, которые в настоящее время используются для экспрессии рекомбинантных антител для исследовательских целей, а также получения биофармацевтических препаратов. Виды клеток-хозяев, в зависимоти от происхождения, а также условий культивирования могут быть причиной изменения степени и структуры гликанов, присоединенных к рекомбинантно экспрессированным молекулам. Двумя обычно используемыми клеточными линиями для рекомбинантной экспрессии антител являются клетки яичников китайского хомячка (СНО) и клетки миеломы мыши (sp2/0, 653, Ns0). Хотя клетки СНО экспрессируют рекомбинантные антитела, которые фактически лишены гликана сиаловой кислоты, гликаны на 99% фукозилированы. Показано, что присутствие фукозы является основным фактором, вносящим вклад в восстановленный рецептор Fc-гамма-III и, следовательно, в ADCC. Клетки миеломы мыши экспрессируют рекомбинантные антитела с содержанием сиаловой кислоты до 50%, но, как правило, с меньшим содержанием фукозы. Как установлено выше, такие различия могут оказывать существенное влияние на активность антител in vivo.
Поэтому желательна возможность уменьшения сиалилирования гликанов, ассоциированных с лечебными антителами, способом, который устраняет необходимость процессинга после сбора и в то же время обеспечивает разумно гомогенную структуру в отношении содержания сиаловой кислоты.
Сущность изобретения
Настоящее изобретение относится к способам, линиям клеток-хозяев и экспрессирующим векторам и плазмидам, применимым для получения Fc-содержащих молекул, в частности лечебных средств на основе антител, с уменьшенным содержанием сиаловой кислоты. Конкретнее, изобретение относится к экспрессирующей плазмиде, кодирующей созданную инженерией сиалидазную кодирующую последовательность, и указанная плазмида, однажды включенная в секретирующую антитела клеточную линию, вызывает способность клетки-хозяина секретировать полипептид, обладающий сиалидазной активностью. В одном воплощении кодирующая последовательность в плазмиде кодирует каталитический домен сиалидазы Arthrobacter ureafaciences. В другом аспекте изобретения клетка-хозяин, включающая каталитический домен сиалидазы Arthrobacter ureafaciences, секретирует транслированный каталитический домен в культуральную среду.
Настоящее изобретение относится к способу регулирования свойств Fc-содержащей молекулы, включая минимизированное сиалилирование олигосахаридов, соединенных с Fc-участком, посредством чего оптимизируются авидность молекулы в отношении множества локализованных белков-мишеней и аффинность в отношении к одному или нескольким рецепторам Fc-гамма, например, FcγRI, FcγRIIA и FcγRIIIA; активность ADCC; макрофаговая или моноцитарная активация и время полужизни в сыворотке.
Изобретение также относится к получению высокогомогенных партий Fc-содержащих молекул, таких как антитела, содержащих максимально сиалилированные N-соединенные олигосахариды в Fc-домене. Изобретение также относится к очистке партий антител, обогащенных антителами, содержащими сиаловую кислоту в Fc-олигосахариде, а также антителами, не содержащими сиаловой кислоты в Fc-олигосахариде.
Краткое описание чертежей
Фиг.1 представляет собой схематическое изображение самой крупной структуры олигосахаридов, обнаруженной в человеческом IgG.
Фиг.2 отображает основные структуры олигосахаридов, обнаруженные в рекомбинантном IgG, продуцированном в клетках яичника китайского хомячка (СНО).
Фиг.3 показывает результаты анализов ВЭЖХ Fc-олигосахаридов. Сначала N-соединенные олигосахариды высвобождают из антител обработкой ферментом PNGase F. Высвобожденные олигосахариды метят антраниловой кислотой и меченые олигосахариды очищают гель-фильтрацией. Очищенные меченые олигосахариды анализируют ВЭЖХ, получая приведенную хроматограмму.
Фиг.4А и 4В представляют собой графики, показывающие связывание различных иммунных комплексов Ab1:TNF с человеческим FcγRII на клетках К562 двумя различными путями. (А) Конкурентное связывание, измеренное добавлением различных количеств немеченых комплексов Ab1 и TNF к клеткам в присутствии фиксированного количества Ab5 - меченого 125I человеческого IgG в комплексе с Ab6 - мышиными моноклональными антителами, специфичными для Ab5. (В) Прямое связывание, измеренное добавлением к клеткам К562 различных количеств Ab1 в комплексе с меченым 125I TNF.
Фиг.5, А-D, представляют собой графики исследований связывания FcγRIIIA с различными препаратами испытываемых Ab, используемых для конкурентных меченых радиоизотопами mAb против FcγRIIIA 3G8 при фиксированной концентрации, для связывания NK-клеточных FcγRIIIA: варианты природного гликозилирования Ab1 (A); варианты природного гликозилирования Ab5 (B); фракции Ab1 из колонки с лектином (С); и фракции Ab2 из колонки с лектином (D).
Фиг.6, А-D, представляют собой графики, показывающие результаты анализов ADCC in vitro, выполненных с использованием Ab1, различающихся содержанием сиаловой кислоты, клеток-мишеней К2, сверхэкспрессирующих TNF на своей клеточной поверхности, и человеческих эффекторных клеток РВМС, экспрессирующих FcγR. (А) Варианты природного гликозилирования Ab1, (В) варианты природного гликозилирования Ab2; (С) сравнение трех субпартий Ab1, различающихся содержанием сиаловой кислоты, после фракционирования на основе аффинности лектина к WGA, и ферментативно дегликозилированных (Gno) Ab1, (D) сравнение образца необработанных Ab1 и образца полностью сиалилированных Ab1 G2S2 или отрицательного контроля Ab, соответствующего изотипу Ab7. Образцы анализируют при трехкратном повторе (величина ошибки представлена ср.-кв. откл. (s.d.)), и приведенные результаты представляют три независимых эксперимента для каждой пары вариантов. Различие в активности между указанными испытываемыми образцами является значимым (P<0,0001 для графиков А, С и D; P=0,0016 для графика В), что определяют по F-критерию дополнительной суммы квадратов (extra sum of squares F-test).
Фиг.7, А и В, представляют собой графики, показывающие конкурентное связывание различных образцов антител IgG с человеческим рецептором FcγRI (CD64) на клетках U-937: (A) Ab1 G2 (полностью гликозилированные и несиалилированные) и Ab1 G2S2(hi) (полностью гликозилированные и полностью сиалилированные), различающихся только по отсутствию и присутствию сиаловой кислоты, (В) двух различных партий Ab3, различающихся по количеству загруженных видов олигосахаридов (видов, содержащих сиаловую кислоту), составляющих или 2% или 42% от всех олигосахаридов.
Фиг.8 представляет собой график, показывающий соотношение между временем после введения и сывороточной концентрацией Fc-части слитого белка (FcP1), который полностью сиалилирован (G2S2) или немодифицирован.
Фиг.9 представляет собой график, показывающий соотношение между временем после введения и сывороточной концентрацией Fc-части полностью сиалалированных Ab2 G2S2 или полностью асиалалированных Ab2 G2 описанными ферментативными способами.
Фиг.10, A-D, представляют собой графики, показывающие влияние сиаловой кислоты в препаратах Ab на аффинность в отношении лиганда-мишени на клеточной поверхности посредством конкурентного связывания с радиомечеными Ab: (A) природные варианты Ab1, (В) природные варианты Ab5, (С) варианты фракций Ab1 из колонки с лектином и (D) варианты фракций Ab2 из колонки с лектином. Образцы испытывают при двукратном повторе или четырехкратном повторе, и показанные результаты представляют 3 или 4 независимых эксперимента. Различие в связывании между указанными испытываемыми образцами является значимым (P<0,0001 для графиков А, С и D), что определяют по F-критерию дополнительной суммы квадратов.
Фиг.11, А-В, представляют собой графики, показывающие влияние сиаловой кислоты в препаратах Ab на аффинность в отношении лиганда-мишени, нанесенного на пластины EIA: (A) связывание природных вариантов Ab1 с TNF, (В) связывание Ab2 с анти-Id антителами.
Фиг.12, А-С, представляют собой графики, показывающие влияние сиаловой кислоты в препаратах Ab на аффинность в отношении лиганда-мишени, представленного в виде меченого радиоизотопом растворимого антигена к связанным с поверхностью Ab: (A) природные варианты Ab1, (В) варианты фракций Ab1 из колонки с лектином и (С) варианты фракций Ab2 из колонки с лектином. Осуществляют параллельные инкубации с меченым радиоизотопом Ag и 100-кратным избытком немеченого Ag для определения неспецифического связывания. Образцы испытывают при троехкратном повторе.
Фиг.13 является схематическим представлением экспрессирующей плазмиды р3629, сконструированной для экспрессии каталитического домена сиалидазы А из Arthrobacter ureafaciences, соединенного с сигнальной последовательностью hGH (человеческий фактор роста), с сайтами рестриктаз, используемыми для клонирования в исходный указанный вектор р2815.
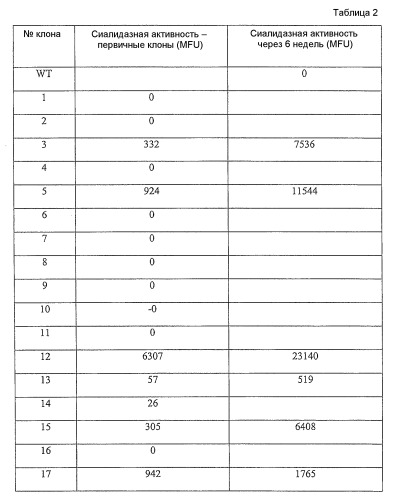
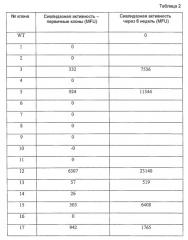
Фиг.14 представляет собой график, представляющий антителозависимую клеточную цитотоксичность (ADCC) очищенных антител из клеточных линий, эксперессирующих секретированный каталитический домен сиалидазы; клоны 3, 5, 12, 13 и 17.
Подробное описание изобретения
Аббревиатуры
α1,3GT - α-1,3-галактозилтрансфераза; α2,3ST - α-2,3-сиалилтрансфераза; β1,4GT - β-1,4-галактозилтрансфераза; ADCC - антителозависимая клеточная цитотоксичность; АТСС - Американская коллекция типовых культур; BATDA - бис(ацетоксиметил)-2,2':6',2”-терпиридин-y,y”-дикарбоксилат; BSA - бычий сывороточный альбумин; CD-среда - химически определенная культуральная среда; CDC - комплементнаправленная цитотоксичность; CMP-Sia - цитидинмонофосфат-N-ацетилнейраминовая кислота; DMEM - модифицированная по Дульбекко среда Игла; Е:Т - отношение эффекторных клеток к клеткам-мишеням; FBS - сыворотка плода коровы; ESI-MS - масс-спектрометрия с ионизацией электронным распылением; NK-клетки - естественные клетки-киллеры; IgG - иммуноглобулин G; IMDM - среда Дульбекко, модифицированная по Искову; MALDI-TOF-MS - времяпролетная масс-спектрометрия с ионизацией с участием лазерной десорбции; МНХ - микофенольная кислота, гипоксантин, ксантин; NANA - N-ацетилнейраминовая кислота, изомерсиаловой кислоты; NGNA - N-гликолилнейраминовая кислота, изомерсиаловой кислоты; РВМС - одноядерные клетки периферической крови; РВМС - одноядерная клетка периферической крови; PBS - забуференный фосфатом физиологический раствор; PNGase F - пептид N-гликозидаза F; ОФ-ВЭЖХ (RP-HPLC) - высокоэффективная жидкостная хроматография с обращенной фазой; RT - комнатная температура; Sia - сиаловая кислота; UDP-Gal - уридиндифосфатгалактоза; UDP-GlcNAc - уридиндифосфат-N-ацетилглюкозамин.
Определения
Термин «активность ADCC» обозначает антителозависимую клеточную цитотоксичность и относится к явлению опосредуемого антителами разрушения клетки-мишени несенсибилизированными эффекторными клетками. Идентичность клетки-мишени изменяется, но она должна иметь связанный с поверхностью иммуноглобулин G, имеющий Fc-домен или часть Fc-домена, способную к активации Fc-рецептора. Это может быть, например, лимфоцит, лишенный обычных В- или Т-клеточных маркеров, или моноцит, макрофаг или многоядерный лейкоцит, в зависимости от идентичности клетки-мишени. Реакция является комплементнезависимой. Активность ADCC антител или другого Fc-содержащего белка по настоящему изобретению «усиливается», если его способность демонстрировать ADCC-опосредуемый киллинг клеток превышает способность антител или белка, по существу, с подобной последовательностью и Fc-доменом продуцироваться альтернативной клеткой-хозяином. Активность ADCC можно определить в стандартном анализе in vivo или in vitro киллинга клеток, таких как анализы, обсуждаемые в данном описании. Предпочтительно антитела с усиленной активностью добиваются такого же эффекта (предотвращения или ингибирования роста опухолевых клеток) при меньшей дозе и/или за более короткое время, чем ссылочные антитела, продуцируемые в альтернативной клетке-хозяине. Предпочтительно различие между возможностями антител в объеме настоящего изобретения и ссылочных антител составляет, по меньшей мере, примерно 1,5 раза, предпочтительнее, по меньшей мере, примерно 2 раза, даже предпочтительнее, по меньшей мере, примерно 3 раза, наиболее предпочтительно, по меньшей мере, примерно 5 раз, при определении, например, при сравнении рядом в выбранном стандартном анализе ADCC с высвобождением хрома.
Термин «аффинность», используемый в данном описании, предназначен для обозначения величины константы связывания простого одновалентного лиганда с его родственным партнером по связыванию, например, связывания Fab с антигеном или эпитопом. Аффинность можно измерить несколькими способами, включая измерение on- и off-rates (уровни связывания и уровни высвобождения kon и koff, соответственно), например, плазмонным резонансом (BiaCore), и выразить в виде константы общей ассоциации (Kass) или диссоциации (KD), где Kass представляет собой kon/koff, и KD представляет собой koff/kon. Kd также можно оценить эмпирически, например, измеряя концентрацию, при которой связывание лиганда с партнером по связыванию является полунасыщенным. Другим способом измерения KD является измерение конкурентным анализом, в котором один связующий агент или лиганд метят или превращают в мишень и выдерживают при постоянной концентрации, в то время как испытываемый связующий агент или лиганд добавляют в переменных концентрациях для устранения от конкуренции меченого вещества с его родственным партнером по связыванию и определения концентрации, при которой метка уменьшается вдвое.
Термин «авидность», используемый в данном описании, предназначен для оценки меры стремления лиганда оставаться связанным с партнером по связыванию, постольку поскольку как лиганд, так и партнер по связыванию может быть поливалентным, и стремление к нескольким событиям ассоциации и диссоциации для специфического лиганда может иметь место одновременно. Таким образом, авидность можно измерить по возрастанию кажущейся аффинности поливалентных конформаций партнера по связыванию с известной аффинностью.
Термин «Fc-содержащий белок» или «Fc-содержащая молекула», используемый в данном описании, относится к мономерному, димерному или гетеродимерному белку, имеющему лигандсвязывающий домен и, по меньшей мере, домен иммуноглобулина СН2 или СН3. Домены СН2 или СН3 могут образовывать, по меньшей мер, часть димерного участка белка/молекулы (например, антитела).
Предполагается, что термин «антитело» охватывает антитела, фрагменты расщепления, определенные белки и их варианты, в том числе, без ограничения, миметики антител или составляющие части антител, которые имитируют структуру и/или функцию антитела или определенных фрагментов или их частей, и сохраняют Fc-опосредуемые функции, в том числе, но без ограничения, связывание с Fc-рецепторами (например, FcγRI (CD64), FcγRIIA (CD32A), FcγRIIIA (CD16A) и FcRn), связывание комплемента (например, C1q), ADCC и CDC.
Термин «моноклональное антитело», используемый в данном описании, отражает специфическую форму Fc-содержащего слитого белка, в котором лигандсвязывающий домен остается, по существу, гомологичным, по меньшей мере, одному вариабельному домену тяжелой или легкой цепи антитела, по меньшей мере, одного вида антител животного.
Термин «эффекторные функции» антител или аналогов антител, используемый в данном описании, относится к процессам, посредством которых патогены или анормальные клетки, например, опухолевые клетки, разрушаются и удаляются из организма. Врожденные и адаптивные иммунные реакции используют большинство одних и тех же эффекторных механизмов для устранения патогенов, включая ADCC, CA (активацию комплемента), связывание C1q и опсинизацию.
Используемый в данном описании термин «клетка-хозяин» относится к любому виду клеточной системы, которую можно создать для получения белков, фрагментов белков или пептидов, представляющих интерес, в том числе, антител и фрагментов антител. Клетки-хозяева включают, без ограничения, культивированные клетки, например, культивированные клетки млекопитающего, такие как клетки СНО, клетки ВНК, клетки NSO, клетки SP/20, или гибридомные клетки, клетки дрожжей и клетки насекомых, но также клетки, являющиеся клетками трансгенного животного или культивированной ткани.
Термин «сиаловая кислота» относится к любому члену семейства содержащих девять атомов углерода карбоксилированных сахаров. Наиболее важным членом семейства сиаловой кислоты является N-ацетилнейраминовая кислота (2-кето-5-ацетамидо-3,5-дидезокси-D-глицеро-D-галактононулопираноз-1-оновая I кислота (часто сокращенно обозначаемая Neu5Ac, NeuAc или NANA). Вторым членом семейства является N-гликолилнейраминовая кислота (NGNA, Neu5Ge или NeuGe), в которой N-ацетильная группа NeuAc гидроксилирована. Такая форма является преимущественной в гликопротеинах от грызунов или микробных источников. Третьим членом семейства сиаловой кислоты является 2-кето-3-дезоксинонулозоновая кислота (KDN) (Nadano et al. (1986), J. Biol. Chem., 261: 11550-11557; Kanamori et al., J. Biol. Chem., 265: 21811-21819 (1990)). Также включаются 9-замещенные сиаловые кислоты, такие как 9-О-С-С6-ацил-Neu5Ac, подобные 9-О-лактил-Neu5Ac или 9-О-ацетил-Neu5Ac, 9-дезокси-9-фтор-Neu5Ac и 9-азидо-9-дезокси-Neu5Ac. Для представления о статическом семействе сиаловой кислоты см., например, Varki, Glycobiology, 2: 25-40 (1992); Sialic Acids: Chemistry, Metabolism and Function, R. Schauer, Ed. (Springer Verlag, New York (1992)).
Описание
Между тем авторы настоящего изобретения неожиданно обнаружили, что уровень сиалилирования Fc-олигосахаридов изменяет аффинность полученных рекомбинантно лечебных антител в отношении Fcγ-рецепторов, что приводит к модуляции различных аспектов биологических действий указанных антител. Конкретнее, обнаружилось, что Ab с высоким уровнем сиалилирования имеют существенно сниженную аффинность в отношении низкоаффинных рецепторов FcγRIIA (CD32A) и FcγRIIIA (CD16A) и имеют существенно пониженную активность в анализах ADCC in vitro, в которых, как полагают, FcγRIIIA является релевантным рецептором. Также обнаружилось, что Ab с высоким уровнем сиалилирования имеют повышенную аффинность в отношении высокоаффинного Fcγ-рецептора FcγRI (CD64) и что полностью сиалилированные Fc-содержащие белки имеют пониженное время полужизни в сыворотке по сравнению с асилилированными или частично сиалилированными Fc-содержащими белками. Также обнаружилось, что удаление (или отсутствие или пониженные уровни) сиаловой кислоты из Fc-олигосахаридов усиливает авидность полученных рекомбинантно лечебных антител в отношении их молекулы-мишени. Такие открытия и подтверждающие их сведения описаны в одновременно рассматриваемых предварительных заявках на патент США №60/695769, 60/809106, 60/841153.
Без желания привязываться к какой-либо теории, удаление заряженной статической группы из олигосахарида можно интерпретировать как придание большей жесткости всей структуре антитела, что расширяет сферу возможного взаимодействия для двух связывающих доменов друг относительно друга. Способность Ab связываться бивалентно с двумя эпитопами также будет зависеть от доступности, ориентации, плотности и подвижности эпитопа. Следует отметить, что антигенсвязывающее действие сиалилирования также может касаться Ab, узнающих вирусные или бактериальные поверхностные антигены и даже растворимые антигены, которые являются гомополимерами, так как жесткость Ab может определить, до какой степени отдельные молекулы Ab связываются бивалентно в растворимом иммунном комплексе, где не только некоторые из Ab могут связываться с более чем одним антигеном, но некоторые антигены могут связываться с более чем одним Ab.
Настоящее изобретение относится к способу регулирования свойств Fc-содержащей молекулы путем изменения сиалилирования Fc-олигосахаридов и измененных Fc-содержащих молекул. Сиаловая кислота имеет суммарный отрицательный заряд при физиологическом рН, и, таким образом, можно ожидать, что присутствие сиаловой кислоты в Fc-связанном углеводе может изменить трехмерную структуру и, следовательно, конформацию домена СН2 и посредством этого воздействовать на связывание Fc с различными лигандами или рецепторами. Измененная Fc-содержащая молекула влияет на аффинность в отношении одного или нескольких рецепторов FcγRI, FcγRIIA и FcγRIIIA, активность ADCC, активацию макрофагов или моноцитов и время полужизни в сыворотке.
Обогащение сиалилированных форм Fc-содержащих белков
Один подход к получению субпартий определенного Fc-содержащего белка, отличающихся содержанием сиаловой кислоты, должен состоять в получении Fc-содержащего белка с помощью гетерогенных Fc-олигосахаридов, включающих как сиалилированные, так и асилилированные молекулы, и пропускании его через колонку, содержащую иммобилизованный лектин, который имеет различную аффинность в отношении сиалилированных и асилилированных олигосахаридов. Несвязывающуюся прошедшую (Т, прошедшая) или несвязывающуюся в колонке фракцию можно отделить от связанной фракции (В, связанная), причем последнюю собирают в то время как через колонку пропускают буфер для элюирования. Также можно отдельно собрать слабосвязанную фракцию или фракцию, замедленную в колонке (R, замедленная), например, собирая Fc-содержащий белок, который элюируется во время продолжающегося промывания колонки исходным буфером для образца. В зависимости от используемого лектина несвязывающаяся фракция может иметь большее или меньшее содержание сиаловой кислоты, чем фракция, которая связывается.
Примерами лектинов, которые могут повысить концентрацию сиалилированных или асилилированных Fc-содержащих белков, является лектин из Maackia amurensis (MAA), который специфически связывает олигосахариды с концевой сиаловой кислотой, и лектин агглютинин из проростков пшеницы (WGA), который специфически связывает олигосахариды или с концевой сиаловой кислотой или с концевым N-ацетилглюкозамином (GlcNAc). Другим примером является лектин рицин I (RCA), который связывает олигосахариды с концевой галактозой. В последнем примере несвязывающаяся проходящая фракция может быть обогащена сиалилированными Fc-содержащими молекулами.
Ферментативная модификация Fc-содержащих белков
Альтернативным подходом к получению субпартий Fc-содержащего белка, различающихся по содержанию сиаловой кислоты, является обработка части препарата Fc-содержащего белка ферментом сиалидазой, причем посредством этого сиаловые кислоты удаляются. Полученный асиалилированный материал можно сравнить с исходным, частично сиалилированным материалом на различия в биологической активности. Чем выше содержание сиаловой кислоты в партии исходного Fc-содержащего белка, тем больше возможность обнаружения любых различий в биологической активности. Например, если только 10% Fc-олигосахаридов в исходном белковом препарате содержат сиаловую кислоту, может быть затруднительно обнаружить различия в биологической активности после обработки сиалидазой, когда сиаловую кислоту содержат 0-1% олигосахаридов. Сравнение биологической активности Fc-содержащего белка до и после обработки сиалидазой будет более трудным, если обработка сиалидазой приводит к различному разрушению фукозилированных и афукозилированных олигосахаридов, так как уровни фукозы оказывают глубокое влияние на некоторые виды биологической активности, такие как аффинность в отношении человеческого FcγRIIIA и активность ADCC. Например, если уменьшение содержания сиаловой кислоты от 30% олигосахаридов до 0% приводит к возрастанию доли афукозилированных олигосахаридов от 5% до 15%, тогда будет невозможно объяснить различия в активности ADCC только уменьшением содержания сиаловой кислоты. Такое влияние обработки сиалидазой на относительную долю фукозилированных и афукозилированных олигосахаридов возможно (и наблюдалось) из-за различия в сиалилировании фукозилированных и афукозилированных олигосахаридов до обработки сиалидазой для удаления остатков сиалиловых кислот.
Сиалилирования олигосахаридов, присутствующих в Fc-области, также можно достичь с использованием способов гликозилирования in vitro. С использованием таких способов возможно получение максимально сиалилированных гликоформ образцов антител. На основании открытия по настоящему изобретению максимально сиалилированные гликоформы антител или других Fc-содержащих конструкций будут иметь уменьшенное время полужизни в сыворотке по сравнению с асилилированными или малосилилированными антителами. Таким образом, способ по изобретению дает оптимальное средство регулирования как однородности гликоформ, включая антитела или другие рекомбинантные белковые конструкции, содержащие Fc-участок иммуноглобулина, так и функциональных аспектов in vivo указанных антител или конструкций.
Гликозилтрансферазы функционируют в природе, синтезируя олигосахариды. Они продуцируют специфические продукты с превосходной стереохимической и региохимической геометрией. Перенос гликозильных остатков приводит к наращиванию или синтезу олиго- или полисахаридов. Описано несколько типов гликозилтрансфераз, включая сиалилтрансферазы, фукозилтрансферазы, галактозилтрансферазы, N-ацетилгалактозилтрансферазы, N-ацетилглюкозаминилтрансферазы и т.п. Гликозилтрансферазы, применимые в настоящем изобретении, включают, например, α-сиалилтрансферазы, α-глюкозилтрансферазы, α-галактозилтрансферазы, α-фукозилтрансферазы, α-маннозилтрансферазы, α-ксилосилтрансферазы, α-N-ацетилгексозаминилтрансферазы, β-сиалилтрансферазы, β-глюкозилтрансферазы, β-галактозилтрансферазы, β-фукозилтрансферазы, β-маннозилтрансферазы, α-ксилосилтрансферазы и β-N-ацетилгексозаминилтрансферазы, такие как из Neisseria meningitidis или других бактериальных источников, и от крысы, мыши, кролика, коровы, свиньи, человека и насекомых как источников или вирусных источников. Предпочтительно гликозилтрансфераза представляет собой процессированный вариант фермента гликозилтрансферазы, в котором делитирован мембрансвязывающий домен.
Примеры галактозилтрансфераз включают α(1,3)-галактозилтрансферазу (E.C. No. 2.4.1.151, см., например, Dabkowski et al., Transplant. Proc., 25: 2921 (1993), и Yamamoto et al., Nature, 345: 229-233 (1990)) и α(1,4)-галактозилтрансферазу (E.C. No. 2.4.1.38). Можно использовать другие гликозилтрансферазы, такие как сиалилтрансфераза. Часто называемую сиалилтрансферазой α(2,3)-сиалилтрансферазу можно использовать при получении сиалиллактозы или других структур более высокого порядка. Данный фермент переносит сиаловую кислоту (NeuAc) из СМР-сиаловой кислоты в остаток Gal с образованием α-связи между двумя сахаридами. Связывание (соединение) между сахаридами находится между положением 2 NeuAc и положением 3 Gal. Являющаяся примером α(2,3)-сиалилтрансфераза, называемая α(2,3)-сиалилтрансферазой (ЕС 2.4.99.6), переносит сиаловую кислоту в невосстанавливающий концевой Gal дисахарида Galβ → 3Glc или гликозида. См. Van den Eijnden et al., J. Biol. Chem., 256: 3159 (1981), Weinstein et al., J. Biol. Chem., 257: 13845 (1982), и Wen et al., J. Biol. Chem., 267: 21011 (1992). Другой пример α-2,3-сиалилтрансферазы (ЕС 2.4.99.4) переносит сиаловую кислоту в невосстанавливающий концевой Gal дисахарида или гликозида. См. Rearick et al., J. Biol. Chem., 254: 4444 (1979), и Gillespie et al., J. Biol. Chem., 267: 21004 (1992). Другие примеры ферментов включают α-2,6-сиалилтрансферазу Galβ-1,4-GlcNAc (см. Kurosawa et al., Eur. J. Biochem., 219: 375-381 (1994)).
Другими глюкозилтрансферазами, особенно применимыми при получении олигосахаридов по изобретению, являются маннозилтрансферазы, в том числе, α(1,2)-маннозилтрансфераза, α(1,3)-маннозилтрансфераза, β(1,4)-маннозилтрансфераза, Dol-P-Man-синтаза, OCh1 и Pmt1.
Еще другие глюкозилтрансферазы включают N-ацетилгалактозаминилтрансферазы, в том числе, α(1,3)-N-ацетилгалактозаминилтрансферазу, β(1,4)-N-ацетилгалактозаминилтрансферазы (Nagata et al., J. Biol. Chem., 267: 12082-12089 (1992), и Smith et al., J. Biol. Chem., 269: 15162 (1994)), и полипептид N-ацетилгалактозаминилтрансферазу (Homa et al., J. Biol. Chem., 268: 12609 (1993)). Подходящие N-ацетилглюкозаминилтрансферазы включают GnTI (2.4.1.101, Hull et al., BBRC, 176: 608 (1991), GnTII и GnTIII (Ihara et al., J. Biochem., 113: 692 (1993)), GnTV (Shoreiban et al., J. Biol. Chem., 268: 15381 (1993)).
В случае тех воплощений, в которых способ должен осуществляться на практике в коммерческом масштабе, может быть выгодна иммобилизация гликозилтрансферазы на носителе. Такая иммобилизация облегчает удаление фермента из партии продукта и последующее повторное использование фермента. Иммобилизацию гликозилтрансфераз можно осуществить, например, удалением из трансферазы ее мембрансвязывающего домена и присоединение на его месте целлюлозсвязывающего домена. Специалистам в данной области техники будет понятно, что также можно использовать другие способы иммобилизации, и они описаны в доступной литературе.
Поскольку акцепторные субстраты могут, по существу, представлять собой любой моносахарид или олигосахарид с концевым сахаридным остатком, в отношении которого определенная гликозилтрансфераза показывает специфичность, субстрат может быть замещен в положении своего невосстанавливающего конца. Таким образом, гликозидный акцептор может представлять собой моносахарид, олигосахарид, сахарид с флуоресцентной меткой или производное сахарида, такое как аминогликозидный антибиотик, ганглиозид или гликопротеин, в том числе антитела и другие Fc-содержащие белки. В одной группе предпочтительных воплощений гликозидный акцептор представляет собой олигосахарид, предпочтительно, Galβ(1-3)GlcNAc, Galβ(1-4)GlcNAc, Galβ(1-3)GalNAc, Galβ(1-4)GalNAc, Man-α(1-3)Man, Man-α(1,6)Man или GalNAcβ(1-4)маннозу. В особенно предпочтительном воплощении олигосахаридный акцептор присоединяется к домену СН2 Fc-содержащего белка.
Применения субстрата активированного сахара, т.е. сахар-нуклеозидфосфата, можно избежать использованием любой реакции восстановления одновременно с реакцией гликотрансферазы (что также известно как рецикловая система). Например, как утверждается в, например, пат. США 6030815, в рецикловой системе с СМР-сиаловой кислотой используют синтазу СМР-сиаловой кислоты для восполнения СМР-сиаловой кислоты (СМР-NeuAc), так как она взаимодействует с акцептором сиалилтрансферазой в присутствии α(2,3)сиалилтрансферазы с образованием сиалилсахарида. Система, восстанавливающая СМР-сиаловую кислоту, применимая в изобретении, включает цитидинмонофосфат (СМР), нуклеозидтрифосфат (например, аденозинтрифосфат (АТФ), донор фосфата (например, фосфоенолпируват или ацетилфосфат), киназу (например, пируваткиназу или ацетаткиназу), способную переносить фосфат от донора фосфата к нуклеозиддифосфатам, и нуклеозидмонофосфаткиназу (например, миокиназу), способную переносить концевой фосфат от нуклеозидтрифосфата к СМР. α(2,3)Сиалилтрансферазу и синтазу СМР-сиаловой кислоты также можно рассматривать как часть системы регенерации СМР-сиаловой кислоты, т