Фармацевтические композиции и способ лечения воспаления у крупного рогатого скота и других животных
Иллюстрации
Показать всеИзобретение относится к медицине. Описаны новые трансдермальные препараты, объединяющие нестероидное противовоспалительное средство (НПВС), такое как флуниксин. Также описаны способы применения и введения такого препарата при лечении воспалительных состояний у крупного рогатого скота, включая респираторное заболевание крупного рогатого скота. Трансдермальный жидкий препарат, содержащий: а) первый и второй усилитель кожного проникновения; b) апротонный первичный растворитель; и с) терапевтически эффективное количество флуниксина или его фармацевтически приемлемой соли. Трансдермальный жидкий препарат содержит комбинацию двух средств, улучшающих проникновение. 2 н. и 23 з.п. ф-лы, 5 ил., 9 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к композициям и способам лечения воспаления у животных. Конкретнее, данное изобретение относится к трансдермальному введению животным нестероидного противовоспалительного средства (НПВС).
УРОВЕНЬ ТЕХНИКИ
Все патенты, заявки, публикации, способы исследования и другие процитированные в данном тексте материалы включены в виде ссылки.
Воспаление представляет собой процесс, начинающийся в ответ на повреждение или другое аномальное воздействие физических, химических или биологических агентов, с целью содействия преодолению аномального воздействия. Воспаление включает в себя местные реакции ткани и морфологические изменения, разрушение или удаление опасного материала и запуск восстановления и/или заживления. Основные признаки активного воспаления включают покраснение, жар, опухоль, боль и снижение или потерю функции; данные признаки могут проявляться местно и/или системно.
Хотя цель воспалительной реакции заключается в том, чтобы помочь субъекту преодолеть аномальное воздействие, приступы воспаления могут оказывать вредные воздействия. В краткосрочной перспективе у животных, страдающих от лихорадки или боли, может снижаться потребление пищи и воды, что создает риск развития проблем, связанных с отрицательным энергетическим балансом или обезвоживанием. Кроме того, некоторые приступы воспаления могут оставлять долгосрочные остаточные дефекты, рубцы и снижение функциональности.
Например, респираторное заболевание крупного рогатого скота (BRD) возникает у молочных и мясных пород крупного рогатого скота (КРС) и является одной из основных причин убытков в скотопромышленности во всем мире. Убытки связаны с повышенной смертностью, расходами на лечение и профилактику и со сниженной производительностью - молочные породы скота с клинической или субклинической формой BRD не набирают массу или не дают молоко в той же степени, как здоровые животные, а мясные породы скота с BRD хуже набирают массу, имеют пониженную эффективность кормления и при убое обычно дают тушу более низкого сорта. У крупного рогатого скота с субклинической формой BRD инфекции была обнаружена прямая связь между обнаруженными при убое легочными повреждениями и сниженным набором веса. Возбудителями BRD являются бактериальные микроорганизмы, такие как Mannheimia haemolytica, Pasteurella multocida и Histophilus somni. Однако при BRD инфекциях легочное повреждение, приводящее к смерти или заболеваемости, часто обусловлено чрезмерной воспалительной реакцией субъекта на инвазивные патогены. В краткосрочной перспективе у животных, страдающих от лихорадки или боли, снижается потребление еды и питья. Кроме того, возникает длительное повреждение тканей хозяина, которое приводит к длительному снижению производительности, даже после устранения BRD инфекции.
Воспаление вымени (мастит) считается наиболее дорогостоящей производственной болезнью, встречающейся в молочной промышленности, которая обходится в сотни миллионов долларов ежегодно. Воспаление вымени (мастит) обычно вызывают такие инфекционные агенты, как Staphylococcus aureus, виды рода Streptococcus и Escherichia coli. В ответ на инфекцию в молочной железе протекает воспалительный процесс, характеризующийся повышением температуры, болью, покраснением, опуханием и ухудшением работы. У пораженного животного часто наблюдается жар и снижение потребления еды и питья. На стадии острого воспаления наблюдается временное снижение производства молока, и последующее производство молока на протяжении остального периода лактации снижено в результате остаточного воспалительного повреждения.
Помимо крупного рогатого скота другие виды также подвержены кратковременным и долговременным воздействиям приступов воспаления, вызванных различными причинами. Вне зависимости от вида или возбудителя, повреждение, вызванное воспалением, возникает в форме нейтрофилов, а другие воспалительные клетки разрушают поврежденные ткани. Вследствие повреждения клеточных мембран высвобождается арахидоновая кислота. Арахидоновая кислота является субстратом для образования различных простагландинов и других эйкозаноидов. Высвобождение этих биологически активных веществ является решающим в осуществлении воспалительной реакции, которая приводит к дополнительному воспалительному нарушению и повреждениям. Нестероидные противовоспалительные средства (НПВС) эффективно модулируют воспаление за счет прерывания каскада арахидоновой кислоты.
Применение НПВС является краеугольным камнем регулирования воспалительных процессов в медицине и ветеринарии. Вне зависимости от вида или пораженной системы органов, или причины, фармакологическое модулирование воспаления обеспечивает важное качество уровня жизни для животных, страдающих от боли или лихорадки, позволяя пораженному животному есть и пить и, таким образом, повышают вероятность выздоровления. Кроме того, применение НПВС помогает уменьшить чрезмерный ущерб, приводящий к долгосрочному снижению функциональности, принося, таким образом, экономическую выгоду животноводам.
Флуниксин меглюмин является действующим веществом в FINADYNE® и BANAMINE® (оба доступны в Schering-Plough Animal Health Corporation). Он проявил себя как один из лучших НПВС в ветеринарии крупных животных и является НПВС первого выбора для смежной терапии BRD и мастита у крупного рогатого скота. Флуниксин меглюмин подробно изучали на предмет его применения совместно с антибиотиками для лечения BRD и мастита.
Флуниксин меглюмин и свободное основание флуниксина обладают очень низкой жирорастворимостью. Традиционно соединение должно обладать средней степенью жирорастворимости, чтобы проходить через липидные слои кожи. В связи с ненадлежащими показателями растворимости флуниксин меглюмина возникают трудности при создании эффективного трансдермального жидкого препарата на его основе.
В настоящее время флуниксин меглюмин выпускают в форме внутривенных инъекций для крупного рогатого скота с использованием шприца и иглы, что обуславливает некоторые затруднения. Иглы приводят к трудностям вследствие накопления и необходимости утилизации острых биологических отходов, связанных с иглами опасностей для животноводов и дополнительного дискомфорта для подвергающихся лечению животных. Также, необходимость внутривенной инъекции требует технической компетентности для правильного введения. Как результат перечисленных требований правильного введения флуниксин меглюмина крупному рогатому скоту некоторые нуждающиеся в лечении животные могут не получать достаточного лечения в интересах уменьшения количества использованных игл, защиты животноводов или ввиду технических ограничений.
Таким образом, существует потребность в улучшенной готовой форме и способе введения, таких как препарат для трансдермальной доставки лекарства, который предназначен для решения данных проблем. Однако трудностью при попытке разработать трансдермальный препарат является тот факт, что кожу определяют как "черный ящик" в отношении доставки лекарств. Это обусловлено отсутствием знания механизмов прохождения лекарства через эпидермис и распределения в низлежащих слоях. До сих пор не определены границы данных свойств; вследствие чего сложно предсказать, какие соединения можно доставлять трансдермально. Трансдермальные системы, эффективные для доставки одного соединения, почти всегда оказываются неэффективными в отношении других соединений и систем, и приспособления, которые эффективны для одного вида, практически совершенно неэффективны для других видов. Кроме того, из-за наличия барьера рогового слоя массоперенос через кожу обычно слишком медленный для быстрой, массивной системной абсорбции. Это объясняет, почему очень мало (или вообще никакие) коммерчески доступных трансдермальных продуктов, выпускаемых для людей, предназначены для немедленной доставки лекарства.
Соответственно, существует потребность в устойчивом трансдермальном жидком препарате, обеспечивающем безопасное и удобное введение флуниксина животным, нуждающимся в данном лечении для уменьшения воспаления, минимизируя при этом связанные с лечением боль и стресс у животного и вероятность повреждения ткани в области инъекции.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение удовлетворяет данную потребность за счет предоставления улучшенных препаратов и способов доставки флуниксина и других НПВС крупному рогатому скоту и другим животным.
Соответственно, раскрываются фармацевтически приемлемые препараты для трансдермального введения животным и способы их применения. Такие препараты содержат флуниксин или его фармацевтически приемлемую соль, фармацевтически приемлемую систему-носитель, содержащую растворитель, и комбинацию двух средств, улучшающих проникновение. В необязательных вариантах изобретения трансдермальные жидкие препараты могут включать стабилизирующее средство или снижающее вязкость средство, такое как вода, этанол, изопропанол, пропиленгликоль, диметилизосорбид или триацетин.
Один предпочтительный объект изобретения включает трансдермальный жидкий препарат, содержащий:
a) флуниксин или его фармацевтически приемлемую соль;
b) первый и второй усилители кожного проникновения; и
c) один или более апротонный первичный растворитель.
Во втором предпочтительном объекте настоящего изобретения один или более дополнительных растворителей или носителей (в данном тексте обозначаемые как "вторые" или "вторичные" растворители или носители) также могут включаться в трансдермальный жидкий препарат.
По первому и второму объекту настоящего изобретения первый усилитель кожного проникновения может присутствовать в количестве от около 2% до около 20% трансдермального жидкого препарата, в то время как второй усилитель проникновения через кожу может присутствовать в количестве от около 2% до около 50% трансдермального жидкого препарата. В частности, один первый усилитель кожного проникновения представляет собой ментол, в то время как ксилол, D-лимонен, изопропилмиристат, пропиленгликоль дикаприлат/дикапрат, декановая кислота, дециловый спирт, олеиновая кислота или их смеси представляют собой частные примеры второго усилителя кожного проникновения.
Количество лекарства, включенного в трансдермальные жидкие препараты, описанные в данном тексте, может представлять собой количество от около 1 до около 20% по массе (вычислено из расчета на флуниксин в виде свободной кислоты), в то время как количество апротонного первичного растворителя может широко варьироваться от около 5 до около 90% по массе. В частности, апротонные первичные растворители, которые могут использоваться в настоящем изобретении, представляют собой 2-пирролидон, N-метил-2-пирролидон, этиллактат и гликолевые эфиры, такие как моноэтиловый эфир этиленгликоля, моноэтиловый эфир диэтиленгликоля или моноэтиловый эфир дипропиленгликоля, в то время как частные примеры вторичных растворителей включают этанол, изопропиловый спирт и бензиловый спирт.
В другом объекте настоящего изобретения описаны способы лечения воспалительных состояний. Некоторые из данных способов включают введение эффективного количества трансдермального препарата, описанного выше, животному, такому как млекопитающее, такое как жвачное животное (например, корова), нуждающемуся в таком лечении.
Настоящая композиция может также необязательно включать другие НПВС помимо флуниксина, а также другие действующие фармацевтические вещества, такие как, например, противомикробные вещества, гормоны для репродукции, усиления роста или другого физиологического воздействия, анксиолитические средства, антигистамины, иммуностимуляторы, вакцины и тому подобные.
В другом объекте настоящего изобретения описаны способы введения трансдермального жидкого препарата флуниксина, включающие помещение трансдермального жидкого препарата в приспособление для нанесения, представляющее собой флакон нажимного действия, и нанесение эффективного количества трансдермального жидкого препарата животному, нуждающемуся в таком лечении.
С учетом указанных выше и других задач, преимуществ и признаков настоящего изобретения, которые разъясняются ниже по тексту, суть настоящего изобретения можно понять более четко с помощью последующего детального описания настоящего изобретения и прилагаемой формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
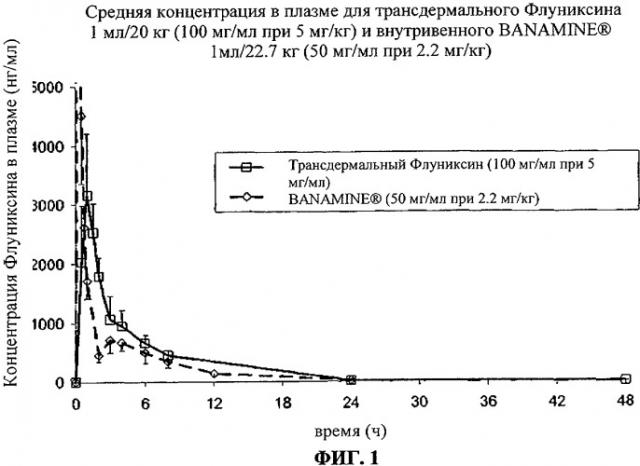
Фиг.1 представляет собой график, демонстрирующий результаты тестов, проведенных в примере 2, на котором график зависимости средней концентрации в плазме (-1 SD) флуниксина (свободная кислота) от времени после однократной 2.2 мг/кг внутривенной дозы Banamine® (флуниксин меглюмин) (ромбы, соединенные пунктирной линией) сравнивается с однократной 5 мг/кг трансдермальной дозой композиции по настоящему изобретению (+1 SD, квадраты, соединенные сплошной линией).
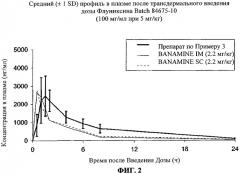
Фиг.2 представляет собой график, демонстрирующий результаты тестов, проведенных в примере 4, на котором график зависимости средней концентрации в плазме флуниксина (свободная кислота) от времени после однократной 2.2 мг/кг внутримышечной (IM, сплошная линия) или подкожной (SC, пунктирная линия) дозы Banamine® (флуниксин меглюмин) сравнивается с однократной 5 мг/кг трансдермальной дозой композиции по настоящему изобретению (±1 SD, квадраты, соединенные сплошной линией).
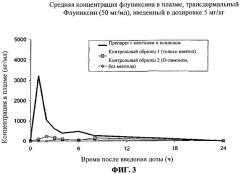
Фиг.3 представляет собой график, демонстрирующий результаты тестов, проведенных в эксперименте, описанном в примере 6, где показаны данные средней концентрации в плазме флуниксина (свободная кислота) после введения доз 3 различных трансдермальных препаратов флуниксин меглюмина в количестве 5 мг/кг, чтобы продемонстрировать некоторые различия разных усилителей кожного проникновения.
Фиг.4 представляет собой график, демонстрирующий результаты тестов, проведенных в эксперименте, описанном в примере 7, где продемонстрирована эффективность жаропонижающего действия трансдермального флуниксин меглюмина (свободная кислота) при встречающемся в природе респираторном заболевании крупного рогатого скота. Показано среднее изменение температуры (±1 SD) после лечения противомикробным средством плюс трансдермальный флуниксин в количестве 0 мг/кг (плацебо), 2.5 мг/кг или 5 мг/кг.
Фиг.5 представляет собой график, демонстрирующий результаты тестов, проведенных в примере 8, на котором показана средняя концентрация в плазме (±1 SD) флуниксина (свободная кислота) относительно времени после введения однократной 2.5 мг/кг трансдермальной дозы композиции по настоящему изобретению.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Было обнаружено, что эффективные концентрации флуниксина или его фармацевтически приемлемых солей в большом круге кровообращения для обеспечения системного противовоспалительного действия могут быть достигнуты при трансдермальном способе введения. Данный способ может включать различные виды нанесения, включая обливание, точечное нанесение, опрыскивание, погружение, втирание и т.д.
Настоящее изобретение относится к НПВС продукту для обеспечения системного противовоспалительного (включая снижение жара и аналгезию) действия у животных, особенно млекопитающих, таких как коровы. Настоящее изобретение демонстрирует, что посредством улучшенных композиций и способов доставки флуниксин может эффективно диффундировать через кожу и затем распределяться в низлежащих слоях для быстрой абсорбции. Было обнаружено, что фармакокинетические параметры по настоящему изобретению сравнимы с параметрами, продемонстрированными соответствующими препаратами для внутримышечных инъекций. Полученные высокие Смакс и низкие Тмакс значения указывают на достаточный перенос лекарства через кожный барьер при высоком уровне потока. Большая область под кривой время-концентрация в плазме (AUC) указывает на полную абсорбцию действующего вещества в большой круг кровообращения. Фармакокинетические данные показывают высокую эффективность проникновения через кожный барьер, а также распределения в тканях, для обсуждаемых препаратов.
Также было обнаружено, что когда выбранные усилители проникновения применяют совместно, они действуют синергетично, обеспечивая повышенную системную активность. Фактически показано, что комбинация двух усилителей проникновения является значительно более предпочтительной по отношению к использованию только одного усилителя проникновения. Композиции по настоящему изобретению можно использовать для профилактики или уменьшения воспаления, связанного с инфекционным заболеванием, хирургическим вмешательством, повреждением или другой причиной.
При использовании в данном тексте, если не указано иное, следующие термины должны пониматься как имеющие следующие значения:
термин "трансдермальное введение" и/или "трансдермальный жидкий препарат" предназначается для охвата всех таких известных способов, которые позволяют доставлять фармацевтически активный ингредиент, по меньшей мере частично, через кожу, обычно посредством нанесения композиции, содержащей действующее вещество и наполнители, наружно на поверхность, т.е. кожу, мех и т.д. животного и отведение достаточного времени для абсорбции через дермальные слои животного, подвергающегося лечению. Способы введения включают обливание, точечное нанесение, опрыскивание, погружение, втирание или другие способы, известные специалистам в данной области техники;
термин "обливание" предназначен для охвата способов введения, при которых эффективное количество подходящего фармацевтически активного ингредиента наружно наносят на отдельный участок, позволяя эффективному количеству фармацевтически активного ингредиента диффундировать в пораженную область(и), или системное распределение на участке, облегчающее доставку фармацевтически активного ингредиента к пораженной области(ям) или системное распределение;
термин "композиция", "готовая форма" и/или "препарат" предназначен для охвата продукта, содержащего определенные ингредиенты, описанные в данном тексте, в определенных количествах, описанных в данном тексте, а также любого продукта, который получают, прямо или косвенно, из комбинации определенных ингредиентов, описанных в данном тексте, в определенных количествах, описанных в данном тексте; и
"эффективное количество" представляет собой дозу, необходимую для облегчения частного симптома инфекции или заболевания.
Согласно первому объекту настоящего изобретения, трансдермальный жидкий препарат содержит терапевтически эффективное количество флуниксина или его фармацевтически приемлемой соли, первый и второй усилители кожного проникновения и апротонный первичный растворитель.
В препаратах по настоящему изобретению концентрация флуниксина может составлять от около 1 до около 20% по массе от трансдермального жидкого препарата (из расчета на содержание флуниксина в виде свободной кислоты), или, в частности, от около 5% до около 15% по массе, или, в частности, в количествах от около 7.5% до около 12.5%, или, в частности, в количествах от около 9 до около 11% по массе. Флуниксин можно включать в готовую форму в форме фармацевтически приемлемой соли, в данном случае концентрацию соли регулируют для поддержания предпочтительной концентрации флуниксина.
Фармацевтически приемлемая соль флуниксина предпочтительно представляет собой флуниксин меглюмин. Флуниксин меглюмин в настоящее время одобрен во всем мире для применения при лечении BRD и мастита. В ветеринарной практике он стал основой для лечения воспалительных состояний. Флуниксин меглюмин коммерчески доступен, например, от ISP (Wayne, NJ), или его можно получать согласно способам, известным в данной области техники, например способам, описанным в патентах США 3,337,570, 3,478,040 и 3,839,344.
Трансдермальный жидкий препарат по настоящему изобретению также включает первый усилитель кожного проникновения. В частных вариантах выполнения настоящего изобретения, первый усилитель кожного проникновения присутствует в количествах от около 2 до около 20% мас./об трансдермального жидкого препарата, в частности, от около 5 до около 15% мас./об или, в частности, от около 7.5 до около 12.5% мас./об.
Неограничивающие примеры подходящего первого усилителя кожного проникновения включают, но не ограничены только ими: терпеноиды, такие как ментол, камфора, d-лимонен, неролидол, 1-8 цинеол и их смеси. В частности, первый усилитель кожного проникновения представляет собой ментол и используется в количестве 10% мас./об.
Второй усилитель кожного проникновения также присутствует в трансдермальном жидком препарате по настоящему изобретению. Второй усилитель кожного проникновения, в частности, присутствует в количестве от около 2 до около 50% мас./об трансдермального жидкого препарата, в частности, от около 5 до около 30% мас./об, или, в частности, от около 7.5 до около 12.5% мас./об.
Неограничивающие примеры подходящего второго усилителя кожного проникновения включают, но не ограничены только ими: второй терпеноид, насыщенные или ненасыщенные эфиры или диэфиры жирных кислот с пропиленгликолем или глицерином, насыщенные или ненасыщенные жирные кислоты, насыщенные или ненасыщенные жирные спирты и их смеси.
В частности, второй усилитель кожного проникновения используется в количестве 10% мас./об и представляет собой ксилол, D-лимонен, изопропилмиристат, пропиленгликоль дикаприлат/дикапрат, декановую кислоту, дециловый спирт, олеиновую кислоту или их смеси. В частности, второй усилитель кожного проникновения представляет собой пропиленгликоль дикаприлат/дикапрат, и/или ксилол, и/или D-лимонен, и/или изопропилмиристат.
В одной частном препарате по настоящему изобретению первый усилитель кожного проникновения представляет собой ментол, и второй усилитель кожного проникновения представляет собой пропиленгликоль дикаприлат/дикапрат, и/или ксилол, и/или D-лимонен, и/или изопропилмиристат.
В частности, соотношение первого усилителя кожного проникновения ко второму усилителю кожного проникновения составляет от около 4:1 до около 1:4.
Было обнаружено, что комбинация первого и второго усилителей кожного проникновения обеспечивает синергичное повышение системной доступности флуниксина или его фармацевтически приемлемой соли по сравнению с применением только одного усилителя проникновения. Как описано, например, в примере 6 и показано на Фиг.3, проникновение флуниксина в плазму значительно усиливается, когда первый усилитель кожного проникновения (ментол в примере 6) используют в комбинации со вторым усилителем кожного проникновения (ксилол в примере 6).
Трансдермальный жидкий препарат по настоящему изобретению также включает апротонный первичный растворитель. В частных готовых формах по настоящему изобретению апротонный первичный растворитель присутствует в количестве от около 5 до около 90% по массе трансдермального жидкого препарата, в частности, от около 10 до около 60% по массе, или, в частности, от около 20 до около 50% по массе.
Неограничивающие примеры подходящего апротонного первичного растворителя включают, но не ограничены только ими: апротонные растворители, такие как пирролидоновый растворитель, такой как 2-пирролидон, N-метил-2-пирролидон и/или их смеси, N,N-диметилацетамид, N,N-диметилформамид, ДМСО, ацетон, глицеринформаль, этиллактат и гликолевые эфиры, такие как моноэтиловый эфир этиленгликоля, моноэтиловый эфир диэтиленгликоля или моноэтиловый эфир дипропиленгликоля, или их смеси. В частности, апротонный первичный растворитель представляет собой 2-пирролидон, N-метилпирролидон, их смеси и тому подобные.
В готовых формах по настоящему изобретению могут присутствовать другие фармацевтически приемлемые вторичные носители или растворители.
Неограничивающие примеры подходящих вторичных носителей или растворителей включают, но не ограничены только ими: воду, этанол, изопропанол, 1,2-пропандиол, глицерин, бензиловый спирт, диметилизосорбид, триацетин, пропиленгликоль, этиллактат, эфиры гликолей, такие как моноэтиловый эфир этиленгликоля, моноэтиловый эфир диэтиленгликоля или моноэтиловый эфир дипропиленгликоля, и полиэтиленгликоли (PEG), имеющие среднюю молекулярную массу между около 200 и 400. В частности, вторичные носители или растворители включают изопропиловый спирт, бензиловый спирт и PEG, имеющий среднюю молекулярную массу между около 200 и около 400, триацетин, диметилизосорбид, этанол и воду, и их комбинации. Данные вторичные носители или растворители могут составлять до около 80% по массе готовой формы. Вторичные носители или растворители могут составлять от около 10% до около 75% по массе. В частности, вторичные носители или растворители составляют от около 20% до около 40% по массе готовой формы.
Добавление одного или более таких вторичных носителей или растворителей может быть желательным для изменения вязкости готовой формы в целях обеспечения характеристик продукта, подходящих для трансдермального применения.
Трансдермальный жидкий препарат по настоящему изобретению также может необязательно включать второе фармацевтически активное соединение или лекарства других терапевтических классов, такие как, например, противомикробные вещества, противовоспалительные средства, окситоцин, репродуктивные гормоны, соединения для усиления роста, соединения для физиологического воздействия, анксиолитические средства, антигистамины, иммуностимуляторы и вакцины, и тому подобные. Как понятно специалистам в данной области техники, в описанные в данном тексте трансдермальные готовые формы на основе флуниксина можно включать широкое многообразие фармацевтически активных соединений/средств. Единственное ограничение по типу добавляемого фармацевтического средства заключается в том, что второе средство не должно в значительной степени взаимодействовать или подавлять активность трансдермально вводимого флуниксина или фармацевтически приемлемой соли.
Неограничивающий список подходящих фармацевтически активных соединений включает соединения, находящиеся в категориях противовоспалительных средств, таких как НПВС и кортикостероиды, антибиотики, жаропонижающие средства, болеутоляющие средство и т.д., и тому подобные. В одном частном варианте, трансдермальные препараты включают антибиотик, такой как фторсодержащий аналог антибиотиков хлорамфеникола и триамфеникола, для которого была продемонстрирована антибиотическая активность по отношению к микроорганизмам как чувствительным, так и устойчивым к хлорамфениколу и триамфениколу. Смотри Schafer, Т.W. et al., "Novel Fluorine-Containing Analogs of Chloramphenicol and Thiamphenicol: Antibacterial and Biological Properties," в CURRENT CHEMOTHERAPY AND INFECTIOUS DISEASE PROCEEDINGS OF THE 11™ ICC AND THE 19™ ICAAC AMERICAN SOCIETY OF MICROBIOLOGY, 1980, 444-446. Примеры таких соединений и способы их получения описаны и заявлены в патенте США 4,235,892.
Подходящие НПВС включают, но не ограничены только ими: ацеметацин, ацетилсалициловую кислоту (аспирин), алминопрофен, беноксапрофен, буклоксовую кислоту, капрофен, целекоксиб, клиданак, деракоксиб, диклофенак, дифлунизал, дипирон, этодолак, фенопрофен, фентиазак, фирококсиб, флобуфен, флуфенамовую кислоту, флуфенизал, флуниксин, флупрофен, флурбипрофен, ибупрофен, индометацин, индопрофен, изоксикам, кетопрофен, кеторолак, меклофенамовую кислоту, мефенамовую кислоту, мелоксикам, микопрофен, набуметон, напроксен, нифлумовую кислоту, оксалроцин, оксепинак, фенилбутазон, пироксикам, пирпрофен, прамопрофен, судоксикам, сулиндак, супрофен, тепоксалин, тиапрофеновую кислоту, тиопинак, толфенамовую кислоту, толметин, триоксапрофен, зидометацин или зомепирак, их фармацевтически приемлемые соли и их смеси. Однако особенно предпочтительным является флуниксин, поскольку для него описано безопасное и эффективное применение при BRD и мастите. Подходящие противомикробные вещества включают, но не ограничены только ими: соединения таких классов, как аминогликозиды, бета-лактамы, цефалоспорины, фторхинолоны, линкозамиды, макролиды, сульфонамиды и сульфонамиды с усиленным действием, тетрациклины и фторсодержащие аналоги хлорамфеникола. Подходящие средства для усиления роста включают, но не ограничены только ими: соматотропин и зеранол. Подходящие анксиолитические соединения включают, но не ограничены только ими: агонисты NOP-1 рецептора, антагонисты NK-1 рецептора, бензодиазепины и фенотиазины. Подходящие антигистамины включают, но не ограничены только ими: дифенгидрамин и трипеленнамин.
При необходимости в настоящую композицию можно добавлять другие ингредиенты. Такие ингредиенты включают консерванты, хелатирующие агенты, антиоксиданты и средства, регулирующие вязкость. Примеры консервантов включают, но не ограничены только ими: метил n-гидроксибензоат (метилпарабен) и пропил n-гидроксибензоат (пропилпарабен), добавляемые в подходящем количестве, известном специалисту в данной области техники. Примеры хелатирующих агентов включают, но не ограничены только ими: динатрия эдетат и ЭДТА. Примеры антиоксидантов включают, но не ограничены только ими: бутилированный гидроксианизол, аскорбиновую кислоту и натрий монотиоглицерин, добавляемые в подходящем количестве, известном специалисту в данной области техники. Подходящие средства, регулирующие вязкость, включают, но не ограничены только ими: воду, этанол, изопропанол, пропиленгликоль, диметилизосорбид, триацетин или глицерин, добавляемые в подходящем количестве, известном специалисту в данной области техники.
Было обнаружено, что добавление, по меньшей мере, одного стабилизатора обеспечивает преимущество в отношении предотвращения разложения любого из действующих веществ в готовых формах по настоящему изобретению. Лимонная кислота и малеиновая кислота являются примерами стабилизаторов, которые могут применяться в настоящем изобретении.
Было обнаружено, что применение рН-регулирующего средства обеспечивает преимущество в отношении предотвращения разложения любого из действующих веществ в готовых формах по настоящему изобретению.
Количество действующего вещества (веществ) или любых других наполнителей можно варьировать для изменения объема вводимой дозы или физических свойств готовой формы. Количество второго фармацевтически или терапевтически активного средства зависит от трансдермальной биодоступности и фармакологического синергизма с другими активными ингредиентами готовой формы и устанавливается экспериментально.
В некоторых частных вариантах выполнения трансдермальные препараты по настоящему изобретению имеют профиль в плазме, идентичный наблюдаемому для инъецируемого Banamine® (флуниксин меглюмин) (быстрое проявление активности и клиренс из плазмы в течение 24 часов). Так как препараты по настоящему изобретению характеризуются быстрым проявлением активности, у животных наступает быстрое облегчение клинических симптомов. Также, поскольку препараты по настоящему изобретению выводятся из плазмы в течение 24 часов, требуется меньшее время ограничения продажи молока или мяса подвергавшихся лечению животных.
Также понятно, что настоящее изобретение охватывает, в одном объекте, способы лечения воспаления путем трансдермального введения животному, например, фармацевтически приемлемой композиции, содержащей, например, флуниксин или его фармацевтически приемлемую соль. Композицию можно наносить различными способами, такими как обливание, опрыскивание или втирание на любой участок кожи животного, включая спину, уши или вымя, предпочтительно на спину. Количество вводимого флуниксина или его фармацевтически приемлемой соли составляет от около 1 до около 5 мг/кг активной формы флуниксина.
При разработке препарата продукта по настоящему изобретению усилия были направлены на достижение для флуниксина или его фармацевтически приемлемых солей такого фармакокинетического профиля после трансдермального применения, который был бы как можно ближе к профилю инъецируемого Banamine®. Препарат, содержащий 100 мг/мл флуниксина, был разработан и трансдермально введен в дозировке 5 мг/кг флуниксина. Данные, представленные на Фиг.1, показывают, что профиль флуниксина в плазме сходен с известным эффективным профилем. Например, концентрации флуниксина в плазме после однократного трансдермального введения около 5 мг/кг флуниксина достигали значения Смакс более 3000 нг/мл за время Тмакс около 60 минут. Данные, представленные на Фиг.5, показывают профиль в плазме после трандермального введения флуниксина в дозировке 2.5 мг/кг. После однократного трандермального введения дозы 2.5 мг/кг Смакс около 1500 нг/мл была достигнута за время Тмакс около 90 минут. В данном примере п(Фиг.5), биодоступность трансдермального раствора флуниксина составляла более 50%.
Настоящее изобретение также включает трансдермальную композицию для лечения воспалительных состояний у животного. В частности, трансдермальная композиция содержит от около 5% до около 15% по массе первого усилителя кожного проникновения, от около 2% до около 50% по массе второго усилителя кожного проникновения, от около 5% до около 15% флуниксина или его фармацевтически приемлемой соли, из расчета на содержание флуниксина в форме свободной кислоты, от около 5% до около 90% алротонного первичного растворителя; и до около 80% второго носителя или растворителя, где трансдермальная композиция демонстрирует в отношении флуниксина Смакс от около 1600 до около 4800 нг/мл и Тмакс от около 30 минут до около 2 часов при трансдермальном введении жвачным животным при дозировке флуниксина около 5 мг/кг. Трансдермальная композиция демонстрирует в отношении флуниксина Смакс от около 1000 до около 2500 нг/мл и Тмакс от около 60 минут до около 2 часов, и биодоступность более 50% при трансдермальном введении жвачным животным при дозировке флуниксина около 2.5 мг/кг.
Авторы полагают, что помимо большего удобства и легкости применения однократное ежедневное введение трансдермального продукта согласно настоящему изобретению способствует более гуманному уходу за животными за счет сокращения количества инъекций, необходимых для лечения животных, и обеспечения быстрого облегчения симптомов заболевания. За счет сокращения количества инъекций также могут быть значительно снижены трудозатраты.
В частном способе получения композиции по настоящему изобретению в сосуд для смешивания добавляют носитель(и) или часть носителя(ей), а затем оставшиеся наполнители и действующие вещества. Полученную смесь перемешивают до растворения всех твердых веществ. При необходимости можно добавлять дополнительное количество растворителя для доведения композиции до конечного объема. Добавки, такие как перечисленные выше, также можно добавлять в сосуд и смешивать с готовой формой. Порядок добавления вышеуказанных носителей, наполнителей, растворителей и добавок не является существенным.
Композиции по настоящему изобретению обычно вводят крупному рогатому скоту в дозировке от около 1 мг до около 5 мг флуниксина на килограмм массы тела в сутки. В частности, композиции по настоящему изобретению вводят крупному рогатому скоту в дозировке около 2.5 мг флуниксина на килограмм массы тела.
Композиции можно вводить один раз в день или разделять на несколько доз. При определенных обстоятельствах для лечения животного необходимы ежедневные дозы. Точная доза зависит от стадии и тяжести состояния, которое подвергается лечению, и индивидуальных особенностей вида животных, подвергающихся лечению, как понятно специалисту в данной области техники.
Композиции по настоящему изобретению можно вводить животному, нуждающемуся в таком лечении, с помощью приспособления для нанесения, представляющего собой флакон нажимного действия (PIBA). Такое приспособление позволяет специалисту здравоохранения легко распределять жидкости из флаконов в (пероральные) шприцы. При нанесении композиции специалист открывает флакон и вставляет в открытый флакон пластиковый адаптер, а затем подсоединяет пероральный шприц к входу адаптера. Затем специалист может набрать дозу препарата из бутылки и ввести данную дозу. Затем на флакон можно надеть крышку для использования в дальней