Диарилалканы в качестве эффективных ингибиторов двухъядерных ферментов
Иллюстрации
Показать всеНастоящее изобретение относится к новым индивидуальным диарилалканам, к способу предупреждения лечения заболеваний и состояний, связанных с тирозиназами, способу предупреждения лечения заболеваний и состояний, связанных со сверхпроизводством или неравномерным распределением меламина, способу ингибирования активности тирозиназы и способу супрессии синтеза меламина, в которых используются предлагаемые диарилалканы, а также к композиции для местного применения на основе новых диарилалканов. 6 н. и 24 з.п. ф-лы, 5 табл., 14 ил., 18 пр.
Реферат
Перекрестная ссылка на родственную заявку
Настоящая заявка претендует на приоритет предварительной заявки на патент США сер. №60/575599, поданной 28 мая 2004 г., озаглавленной «Диарилалканы в качестве эффективных ингибиторов двухъядерных ферментов», которая полностью включена в настоящее описание в качестве ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится в целом к предупреждению и лечению заболеваний и состояний, опосредуемых двухъядерными ферментами. Более конкретно настоящее изобретение относится к способу ингибирования активности фермента, имеющего двухъядерный активный сайт. Настоящее изобретение относится к новым композициям, содержащим один или несколько диарилалкан(ов). Диарилалканы, предлагаемые в настоящем изобретении, можно выделять из одного или нескольких источников растительного происхождения или их можно получать с помощью органического синтеза. Настоящее изобретение относится также к способам выделения указанных соединений из источников естественного происхождения и способам синтеза указанных соединений. В одном из вариантов осуществления изобретения диарилалканы получают путем синтетической модификации встречающегося в естественных условиях соединения, выделенного из источника растительного происхождения.
Предпосылки создания изобретения
Существует большая потребность в продуктах, обладающих способностью ингибировать или предупреждать избыточную пигментацию кожи. Меланин, естественный пигмент кожи, является азотсодержащим полимером, синтезируемым в меланосомах, которые представляют собой связанные с мембраной органеллы, присутствующие в меланоцитах. В зависимости от типа кожи (генетический признак) и условий окружающей среды образуются различные концентрации меланина. Меланоциты представляют собой клетки, присутствующие в базальной мембране эпидермиса, и на их долю приходится от 5 до 10% общего содержания клеток (примерно 1200-1500 меланоцитов на см2). При стимуляции такими факторами как ультрафиолетовый (УФ) свет, происходит быстрое деление меланоцитов, что приводит к производству больших количеств меланина. Затем меланин транспортируется зрелыми меланосомами к кератиноцитам внутри эпидермиса, где проявляется в виде коричневого цвета кожи.
Количество меланоцитов в человеческой коже является более или менее одинаковым вне зависимости от цвета кожи. Цвет кожи зависит в основном от количества и типа продуцируемого меланина (коричневый эумеланин или феомеланин, имеющий цвет от желтого до красновато-коричневого). У азиатов и людей с белой кожей более низкие уровни эумеланина по сравнению с темнокожими людьми и соответственно меньшая защита от воздействия излучения. У людей с рыжими волосами пигментация осуществляется с помощью феомеланина и для них характерен низкий уровень или отсутствие фотопротекции (защита от УФ-облучения). Кроме того, варьируется также распределение меланина в коже. У людей со светлой кожей большая часть пигмента находится в базальном слое, а у людей с темной кожей меланин распространен в коже повсеместно, достигая рогового слоя.
Сверхпроизводство меланина может вызывать различные типы аномальной окраски кожи, окраски волос и другие кожные заболевания и состояния. Известно два основных состояния, связанных с нарушениями пигментации кожи. Потемнение кожи, включающее аномальное повышение уровня меланина, вызванное УФ-облучением и старением; и аномальное распределение кожных пигментов, приводящее к появлению возрастных пятен, печеночных пятен и индуцируемая лекарственным средством и ранением/заболеванием гиперпигментация (Seiberg и др., J. Invest. Dermatol. 115, 2000, с.162; Paine и др., J. Invest. Dermatol. 116, 2001, с.587).
Можно создавать или выбирать модуляторы меланогенеза (производство меланина), обладающие различными механизмами действия, что проиллюстрировано на фиг.1. Как видно из фиг.1, они могут непосредственно вызывать модуляцию структуры и функции меланосомы до синтеза меланина, они могут ингибировать производство или функцию ферментов, таких как тирозиназа, которые участвуют в синтезе меланина, они могут изменять соотношение эумеланина/феомеланина или их функция может заключаться в торможении механизмов, ответственных за перенос меланосом от меланоцитов к кератиноцитам (Briganti и др., Pigment Cell Research 16, 2003, с.101-110).
Тирозиназа представляет собой фермент, имеющий решающее значение для производства меланина. Она катализирует три реакции: гидроксилирование тирозина с образованием 3,4-дигидрофенилаланина (ДОФА), окисление ДОФА с образованием ДОФА-хинона и окисление ДГИ (5,6-дигидроксииндол) с образованием индолхинона (Hearing и др., FASEB, 53, 1991, с.515). Было установлено, что для проявления каталитической активности тирозиназы необходимы как субстрат, так и ионы двухвалентного металла. Процессы, которые в настоящее время используют для ингибирования синтеза меланина с целью отбеливания кожи, основаны прежде всего на применении субстанций, которые ингибируют тирозинкиназную активность либо непосредственно путем взаимодействия с самой тирозинкиназой, либо косвенно, например, путем образования комплекса с требуемыми ионами металлов.
Тирозиназа принадлежит к семейству типа 3 медьсодержащих белков, которые содержат два иона меди в активном сайте. Изучение структуры активного сайта тирозинкиназы показало, что два иона меди имеют близкое пространственное расположение и каждый ион координирован с тремя остатками гистидана через N-ε-атом азота боковой цепи, что проиллюстрировано на фиг.2 (Pfiffner и Lerch, Biochem. 20, 1981, с.6029; Cuff и др., J. Mol. Biol. 278, 1998, с.855). Двухъядерные ионы меди могут находиться в трех основных окислительно-восстановительных формах: восстановленная форма CuI-CuI, форма CuII-О2-CuII, обратимо связанная с О2 в виде пероксида, и покоящаяся форма фермента, в которой ионы Cu2+ обычно связаны небольшим лигандом. Установлено, что окислительно-восстановительное состояние CuII-O2-CuII имеет решающее значение для ферментативной активности тирозиназы. В этом состоянии тирозиназа катализирует интродукцию второй гидрокисльной группы в орто-положение монофенола (такого как тирозин), эта реакция имеет решающее значение для биосинтеза меланина.
Любое соединение, которое препятствует доступу, формированию лиганда или окислению монофенолов в активном сайте тирозиназы, может представлять собой эффективный ингибитор тирозиназы, который может приводить к снижению производства меланина и осветлению цвета кожи. В целом, ионы меди в активном сайте тирозинкиназы можно легко хилатировать с помощью одной пары электронов кислорода, азота, серы и галогенов (Weder и др., Inorg. Chem. 38, 1999, с.1736). На фиг.3 представлены структуры и механизмы действия нескольких известных ингибиторов тирозинкиназы (Briganti и др., Pigment Cell Research 16, 2003, c.101-110; Seo и др., J. Agric. Food Chem. 51, 2003, c.2837).
Из фиг.3 видно, что соединения, имеющие структуры, аналогичные 3,4-дигидроксифенилаланину (ДОФА), такие как гидрохинон, являются как ингибиторами тирозинкиназы, так и меланоцитолитическими агентами (U.S. 5523077). Например, арбутин, выделенный из листьев толокнянки обыкновенной, Uvae ursi, представляет собой встречающийся в естественных условиях бета-глюкопиранозид гидрохинона, который ингибирует тирозинкиназу и оказывает воздействие на синтез меланина в человеческих меланоцитах (Chakraborty и др.. Pigment Cell Res. 11. 1998, с.206; U.S. 5980904). Механизм действия арбутина включает конкуренцию с L-тирозином или L-ДОФА за связывание с активным сайтом тирозинкиназы. Он не подавляет экспрессию или синтез белка (Maeda и Fukuda, J. Pharmacol. Exp.276, 1996, с.765). Синтетические соединения типа арбутина также являются сильными ингибиторами человеческой тирозинкиназы (Sugimoto и др., Chem. Pharm. Bull. 51, 2003, с.798). Кинобеон А, новый дихинон, выделенный из культивируемых клеток сафлора красильного (Carthamus tinctorius L), обладает более высокой ингибирующей активностью в отношении тирозинкиназы, чем койевая кислота (Kanehira и др., Planta Med. 69, 2003, с.457). При применении в течение длительных периодов времени или в высокий концентрациях гидрохиноны обладают серьезными побочными действиями. Кроме того, гидрохиноны могут приводить к депигментации и в результате повышать светочувствительность кожи к воздействию УФ-света.
Наиболее хорошо переносимые отбеливающие субстанции, применяемые в настоящее время, имеют естественное происхождение. Например, койевая кислота представляет собой встречающийся в естественных условиях гидроксил-γ-пирон, получаемый из углеводных растворов, содержащих определенные бактерии. Как видно из фиг.3, койевая acid представляет собой окисленный орто-дигидроксифенол. Известно, что койевая кислота обладает выраженной способностью образовывать хелаты с ионами металлов, прежде всего CuII. (Gerard and Hugel Bull. Soc. Chim, Fr. 42, 1975, с.2404). Она представляет собой выраженный конкрентный ингибитор тирозиназы, но обладающий низкой способностью к связыванию (Cabanes и др., J. Pharm. Pharmacol. 46, 1994, с.982). В современных исследованиях установлено, что койевая кислота действует в качестве образующего мостик лиганда, обладая выраженной способностью к связыванию как с комплексом димеди(II), так и с аддуктом димедь-дикислород, препятствуя тем самым связыванию катехольного субстрата с ферментом (Battaini и др., JBIC 5, 2000, с.262). В указанных ниже патентах заявлено применение койевой кислоты и ее эфиров в качестве отбеливателей кожи (см. U.S. 4369174; 4771060; 5824327; 5427775; 4990330).
Флавоноиды представляют собой другой класс встречающихся в естественных условиях веществ, которые описаны в качестве ингибиторов тирозиназы (Shimizu и др., Planta Med. 66, 2000, с.11; Xie и др., Biochem. 68, 2003, с.487). Активными ингибиторами тирозиназы являются флавоны (Likhitwitayawuid и др., Planta Med. 66, 2002, с.275), флавонолы (Kubo и Kinst-Hori, J. Agric. Food Chem. 47, 1999, с.4121), пренилированные флавоноиды (Kuniyoshi и др., Planta Med. 68, 2002, с.79; Son, Planta Med. 69, 2003, с.559; Kim Biol. Pharm. Bull. 26, 2003, c.1348), флаваны (No, Life Sci. 65, 1999, PL241; Kim, Biomacromolecules 5, 2004, с.474) и дигидрохалконы (Shoji, Biosci. Biotechnol. Biochem. 61, 1997, с.1963).
Другие типы ингибиторов тирозиназы включают: фенольные производные (Sakuma Arch. Pharm. Res. 22, 1999, с.335; Kerry и Rice-Evans, J. Neurochem. 73, 1999, с.247; Battaini, J. Biol. Chem. 277, 2002, с.144606), бензальдегиды (Kubo и Kinst-Hori, Plant Medica 65, 1999, с.19; Chen, J. Enzyme Inhib. Med. Chem. 18, 2003, с.491; Nihei, Bioorg. Med. Chem. 14, 2004, с.681), производные бензойной кислоты (Curto, Biochem Pharmacol. 57, 1999, с.663; Chen и др., J. Protein Chem. 22, 2003, с.607; Miyazawa и др., J. Agric. Food Chem. 51, 2003, с.9653; Kubo и др., Z. Naturforsch [С] 58, 2003, с.713), купферрон (Xie и др., Int. J. Biochem. Cell Biol. 35, 2003, с.1658), бензодипиран из корней Glycyrrhiza uralensis (Yokota и др., Pigment Cell Res. 11, 1998, с.335), тиогидроксильные производные (Park и др., J. Protein Chem. 22, 2003, с.613), терпеноиды (Oh и др., Planta Med. 68, 2002, с.832) и оксазолдинетионы (Seo и др., Planta Med. 65, 1999, с.683). Наиболее эффективными известными встречающимися в естественных условиях ингибиторами тирозиназы являются стилбены (IC50=0,3-5 мкМ) (Shin и др. Biochem Biophys. Res. Commun. 243, 1998, с.801; Ohguchi и др., Biosci. Biotechnol. Biochem. 67, 2003, с.1587), стилбеновые гликозиды (Iida и др., Planta Med. 61, 1995, с.425) и 4-замещенные резорцинолы (Shimizu и др., Planta Med. 66, 2000, с.11).
Изучение зависимости активности от структуры 4-замещенных резорцинолов позволило установить, что гидрофобные и имеющие меньшие по объему заместители, такие как -CH2C6H5, и алкильные группы, т.е. -СН2СН2СН3, обладают наиболее высокой эффективностью, характеризующейся значениями IC50 менее 10 мкМ (Shimizu и др., Planta Med. 66, 2000, с.11). Механизм действия 4-замещенных резорцинолов описан как характеризующееся медленным связыванием конкурентное ингибирование окисления DL-β-(3,4-дигидроксифенил)аланина (DL-ДОФА) (Jimenez и Garcia-Carmona, J. Agric. Food Chem. 45, 1997, с.2061) без какого-либо дополнительного рассмотрения хелатирующих воздействий на металлы, в том числе на двухъядерные ионы меди.
Aloe, представитель семейства лилейных (Lily), является обладающим важными свойствами растением, которое содержит многие биологически активные субстанции (Cohen и др. в: Wound Healing/Biochemical and Clinical Aspects, 10-ое изд. 1992 г., W В Saunders, Philadelphia). Известно около 360 видов Aloe, многие из которых произрастают только в Африке. Исторически получаемые из Aloe продукты применяли в дерматологии для лечения ожогов, язв и других ран. Такое применение стимулировало целый ряд исследований, касающихся идентификации соединений из растений Aloe, которые обладали бы активностью в клинических условиях (см., например, Grindlay и Reynolds, J. of Ethnopharmacology 16, 1986, с.117-151; Hart и др. J. of Ethnopharmacology 23, 1988, c.61-71).
Yagi с соавторами описали группу соединений, выделенных из Aloe, прежде всего алоэзин и одно из его производных 2''-O-ферулоилалоэзин, которые являются эффективными ингибиторами тирозиназы (Yagi и др., Plant Medica, 1987, c. 515-517; Yagi и др., Z. Naturforsch 32 с, 1977, с.731-734). Алоэзин, т.е. С-глюкозилированный 5-метилхромон, ингибирует гидроксилазную активность человеческой тирозиназы в зависимости от дозы, при этом значение IC50 составляет 0,92 мМ, а также ингибирует оксидазную активность в отношении ДОФА в зависимости от дозы, при этом значение IC50 составляет 0,70 мМ, для сравнения значение IC50 койевой кислоты составляет 0,41 мМ, а значение IC50 арбутина составляет 3,02 мМ. Ингибирование алоэзином ферментативной активности тирозиназы и последующего образования меланина подтверждали с помощью клеточного анализа с использованием клеток мышиной меланомы В16 F1. Алоэзин ингибировал биосинтез меланина (IC50=0,167 мМ) в зависимости от дозы (Jones и др.. Pigment. Cell Res. 15, 2002, с.335). Вероятно, механизм действия хромонов алоэ в отношении ингибирования тирозиназы связан с восстановлением ионов меди. Запатентованы как встречающиеся в естественных условиях (U.S. 6451357), так и полусинтетические (U.S. 5801256; U.S. 6083976) хромоны алоэ, а также препаративные формы на основе хромонов алоэ (U.S. 6123959) в качестве отбеливателей кожи.
Для отбеливания кожи применяют также аскорбиновую кислоту (витамин С из синтетических и встречающихся в естественных условиях источников, таких как плоды цитрусовых) и ее производные. Во многих случаях витамин С включают в препаративную форму в сочетании с койевой кислотой или другими ингибиторами тирозиназы (U.S. 4919921; 6458379 и 5916915). Другие известные отбеливатели кожи включают экстракты растений оливы (U.S. 6682763), ненасыщенные жирные кислоты с длинной цепью (U.S. 6669932), куркумины (U.S. 6641845), обладающие ферментативной активностью экстракты (U.S. 6514506), коуместрол (U.S. 6503941), гидроксикарбоновые кислоты (U.S. 6417226; 6365137; 5609875; 5262153), бета-глюканы (U.S. 6251877), хромоны алоэ (U.S. 6083976), фенилаланиновые производные (U.S. 5767158), рутин (U.S. 5145782), эсцинол (U.S. 5728683), салициловые кислоты (U.S. 5700784), ангиогенин (U.S. 5698185), меркаптодекстран (U.S. 6077503), эллаговую кислоту (U.S. 6066312), фосфиновые кислоты (U.S. 6280715), борсодержащие соединения (U.S. 5993835), растительные экстракты (из Pueraria, U.S. 6352685; Morus, U.S. 6197304; 6066312; и 5872254; продукт ферментации мальпигии гранатолистной U.S. 5747006; фураноны U.S. 5602256; и другие соединения U.S. 5773014).
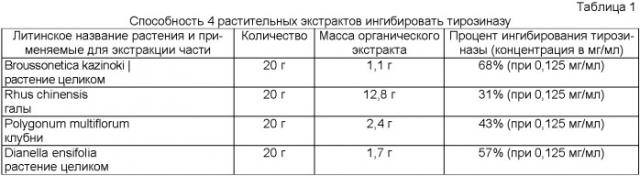
Диарилалканы представляют собой редкий класс встречающихся в естественных условиях веществ. К настоящему времени более 179000 встречающихся в естественных условиях соединений перечислены в Dictionary of Natural Products на CD-ROM (Chapman и Hall/CRC, версия 12:2, январь 2004 г.), из которых только 82 относятся к диарилпропанам (n=3). Broussonetia papyrifera представляет собой лиственное растение семейства тутовых (Moracea) и только из этого рода выделено более 20 диарилпропанов (Keto и др., Chem. Pharm. Bull. 34, 1986, с.2448; Ikuta и др., Chem. Pharm. Bull. 34, 1986, с.1968; Takasugi и др., Chem, Lett. 1984, с.689; Gonzalez и др., Phytochem. 32, 1993, с.433). Биологический анализ, целью которого являлось фракционирование экстракта Broussonetia papyrifera, позволили выявить четыре диарилпропана, которые не обладали способностью ингибировать ароматазу (Lee и др., J. Nat. Prod. 64, 2001, с.1286). Однако два пренилированных диарилпропана, выделенных из этого растения, обладали цитотоксичностью в отношении нескольких раковых клеточных линий (Ко и др., J. Nat. Prod. 62, 1999, с.164), а броуссонин А обладал противогрибковой активностью (Iida и др., Yakugaku Zasshi. 119, 1999, с.964).
Ряд диарилалканов также был выделен из видов р. Iryanthera (Myristicaceae, мускатниковые) (Alvea и др., Phytochem. 14, 1975, с.2832; de Almeida и др., Phytochem. 18, 1979, с.1015; Braz и др., Phytochem. 19, 1980, с.1195; Diaz и др., Phytochem. 25, 1986, с.2395). Четыре дигидрохалкона, выделенные из Iryanthera lancifolia, обладали антиоксидантной активностью (Silva и др., J. Nat. Prod. 62, 1999, с.1475). Ряд диарилпропанов был выделен также из видов р. Virola Myristicaceae (Braz и др., Phytochem. 15, 1976, с.567; Hagos и др., Plant Med. 53, 1987, с.57; Gonzalez и др., Phytochem. 32, 1993, с.433; Kijjoa и др., Phytochem. 20, 1981, с.1385; Talukdar и др., Phytochem. 53, 2000, c.155).
К другим диарилпропанам, выделенным их встречающихся в естественных условиях источников, относятся диарилпропаны, выделенные из Pterocarpus marsupium (Fabaceae, бобовые) (Rao и др., Phytochem. 23, 1984, с.897; Maurya и др., J. Nat. Prod. 48, 1985, с.313), Lindera umbellate (Lauraceae, лавровишня) (Morimoto и др., Chem. Pharm. Bull. 33, 1985, с.2281), Helichrysum mundii (Compositae, сложноцветные) (Bohlmann и др., Phytochem. 17, 1978, с.1935), Viscum angulatum (Loranthaceae, ремнецветниковые) (Lin и др., J. Nat. Prod, 65, 2002, с.638), из Acacia tortilis (Leguminosae, бобовые), которые обладают расслабляющим действием на гладкие мышцы (Hagos и др., Planta Med. 53, 1987, с.27), Xanthocercis zambesiaca (Leguminosae) (Bezuidenhout и др., Phytochem. 27, 1988, с.2329), а также цитотоксические соединения из Knema glomerata (Myristicaceae) (Zeng и др., J. Nat. Prod. 57, 1994, с.376).
В японском патенте JP 05213729 A описано применение синтетических дигидрохалконов в качестве ингибиторов меланина для лечения кожных воспалений, пятен, веснушек и пигментации в результате солнечного ожога. Заявлены соединения, имеющие следующую общую формулу:
в которой X выбирают из Н, ОН или =O; R обозначает Н или Me; и R1-R5 независимо друг от друга выбирают из Н, OR и NH2. Таким образом, описанные дигидрохалконы содержат один гидроксильный/метоксильный заместитель на первом фенильном кольце и пять неспецифических заместителей (R1-R5) на втором кольце. Никакую ингибирующую в отношении ферментов активность не выявляли ни для одной из заявленных композиций, в то время как ингибирование меланина определяли по количеству меланина, продуцируемого культивируемыми кожными клетками, и по изменению цвета кожи животных после УФ-стимуляции. При создании настоящего изобретения синтезировали одно из соединений, описанных в JP 05213729 A, а именно 1-(4-гидроксифенил)-3-(4'-гидроксифенил)-1-пропанол, и определяли его способность ингибировать тирозиназу. У этого соединения обнаружена лишь умеренная способность ингибировать тирозиназу (IC50=305 мкМ, таблица 2.) В настоящем изобретении описаны новые диарилалканы, имеющие уникальную схему замещения, в которой по меньшей мере одно из двух ароматических колец Ar1 или Ar2 замещены 1-5 R'-группами и в которой по меньшей мере две из -групп не обозначают Н. При создании изобретения у этих соединений неожиданно обнаружена способность ингибировать активность тирозиназы в 4-600 раз более высокая по сравнению с соединениями, заявленными в JP 05213729. Вероятно, к настоящему времени отсутствуют данные о каких-либо соединениях, предложенных в настоящем описании.
Краткое изложение сущности изобретения
Настоящее изобретение относится к способу ингибирования активности фермента с двухъядерным активным сайтом, который обозначен в настоящем описании как двухъядерный фермент, заключающемуся в том, что пациенту (хозяину), который нуждается в этом, вводят в эффективном количестве один или несколько диарилалкан(ов), где диарилалканы синтезируют и/или выделяют из одного или нескольких видов растений. Примерами двухъядерных ферментов в контексте настоящего описания являются (но не ограничиваясь ими) тирозиназа, аргиназа, уреаза, цитохром-с-оксидаза, оксидаза протонного насоса гема-меди, бифункциональная дегидрогеназа окиси углерода/ацетил-СоА-синтаза, рибонуклеотидредуктаза, метало-бета-лактамаза, Н(+)-АТФаза и другие оксидазы и бактериальная фосфотриэстераза. В одном из вариантов осуществления изобретения двухъядерный фермент представляет собой тирозиназу.
Настоящее изобретение относится также к способу предупреждения и лечения заболеваний и состояний, связанных с активностью двухъядерных ферментов. Способ предупреждения и лечения, предлагаемый в настоящем изобретении, заключается в том, что вводят внутрь или наносят местно пациенту, нуждающемуся в этом, один или несколько диарилалкан(ов) в терапевтически эффективном количестве. В зависимости от ингибируемого двухъядерного фермента диарилалкан можно применять в качестве антимикробного, противогрибкового, антималярийного или антивирусного агента, регулятора производства оксида азота в качестве средств, контролирующих сексуальное возбуждение у мужчин и женщин, противовоспалительного лекарственного средства, антиоксиданта, регулятора метаболизма лекарственных средств и ингибитора роста различных типов рака и плотных опухолей. Диарилалкан можно применять также для предупреждения и лечения болезней периодонта, предракововых состояний ротовой полости, различных типов рака ротовой полости и других злокачественных заболеваний ротовой полости, чувствительности десен и зубов, осложнения после болезни, пульпита, болезненной чувствительности, боли и воспаления, вызванных физической имплантацией оральных зубных протезов, травмой, повреждениями, бруксизмом и другими небольшими ранениями в полости рта, на деснах или на языке, зубным налетом и зубным камнем, декальцификацией зубов, протеолизом и кариесом (кариесный распад).
Настоящее изобретение относится также к способам предупреждения и лечения заболеваний и состояний, связанных со сверхпроизводством или неравномерным распределением меланина, который заключается в том, что вводят внутрь или наносят местно пациенту, нуждающемуся в этом, один или несколько диарилалкан(ов) в терапевтически эффективном количестве. Болезни и состояния, связанные со сверхпроизводством или неравномерным распределением меланина, включают (но не ограничиваясь ими) загар, гиперпигментированные пятна, связанные со старением кожи, болезнями печени, термическими ожогами и местными ранами, пигментацию кожи, связанную с воспалительными состояниями, обусловленными грибными, микробными и вирусными инфекциями, витилиго, карциному, меланому, а также другие состояния кожи млекопитающих.
Способ можно применять также для предупреждения и лечения потемнения и повреждения кожи в результате воздействия ультрафиолетового (УФ) облучения, химических агентов, нагревания, ветра и сухости окружающей среды. И, наконец, способ можно применять для предупреждения и лечения морщин, кожи, напоминающей крупу саго, полос и темных кругов вокруг глаз, смягчения чувствительной кожи и предупреждения и лечения дерматитов и других родственных аллергии состояний кожи. Помимо их применения для предупреждения и лечения указанных выше заболеваний и состояний кожи терапевтические композиции, представленные в настоящем описании, представляют собой эффективные композиции, которые оказывают благоприятное воздействие на гладкость и омоложение кожи, что сопровождается улучшением цвета кожи, повышенной эластичностью, снижением и замедлением старения, заметным омоложением и улучшением текстуры кожи и повышением эластичности, плотности, гладкости и мягкости.
Путем хелатирования с ионами металлов диарилалканы можно применять также для введения важных ионов металлов в кровоток пациента и/или переноса ионов металлов через кожный или гематоэнцефалический барьер, а также через другие мембраны. В этом варианте осуществления изобретения способ заключается в том, что пациенту, нуждающемуся в этом, вводят в терапевтически эффективном количестве один или несколько диарилалкан(ов) в сочетании с ионами металлов, подлежащих введению. Эту способность диарилалканов можно использовать для лечения заболеваний и состояний, включающих (но не ограничиваясь ими) анемию и другие состояния, связанные с дефицитом железа, воспаление; ожирение и сахарный диабет, болезни периодонта, предракововые состояния ротовой полости, различные типы рака ротовой полости и другие злокачественные заболевания ротовой полости, чувствительность десен и зубов, осложнение после болезни, пульпит, болезненную чувствительность, боль и воспаление, вызванные физической имплантацией оральных зубных протезов, травмой, повреждениями, бруксизмом и другими небольшими ранениями в полости рта, на деснах или на зубах, зубным налетом и зубным камнем, декальцификацией зубов, протеолизом и кариесом (кариесный распад), вирусные инфекции, бессонницу, подавленную иммунную функцию, остеопороз, аменорею, дисменорею, эпилепсию, гипертензию, холестеринемию, коронарные и церебральные вазоспазмы, диарею, болезнь Паркинсона, болезнь Альцгеймера, разные типы рака, ревматоидный артрит, мужское бесплодие и дегенерацию желтого пятна. Ионы металлов выбирают из группы, включающей (но не ограничиваясь ими) медь, хром, железо, цинк, бор, литий, селен, кальций, марганец, молибден, магний ионы других металлов.
Согласно следующему варианту осуществления изобретения диалкилалканы и диалкилалканолы можно применять в пищевой промышленности для предупреждения побурения и изменения цвета фруктов, грибов и других пищевых продуктов.
Настоящее изобретение относится также к новой композиции, содержащей один или несколько диарилалканов, где диарилалканы выбирают из группы соединений, представленных следующей общей структурой:
в которой
Ar1 и Ar2 независимо друг от друга выбирают из группы, включающей замещенное 5- или 6-членное ароматическое или гетероароматическое кольцо, где каждое 6-членное ароматическое или гетероароматическое кольцо независимо замещено 1-5 R'-группами , а каждое 5-членное ароматическое или гетероароматическое кольцо замещено 1-4 R'-группами за исключением варианта, когда Ar1 и Ar2 оба обозначают 6-членное ароматическое кольцо, т.е. фенильная группа по меньшей мере одного Ar1 и Ar2 замещена 1-5 R'-группами , причем по меньшей мере 2 группы из не обозначают Н,
где
R' независимо выбирают из группы, включающей -H, -ОН, -SH, -OR, -CN, -SR, -NH2, -NHR, -NR2, X и гликозид моносахарида или олигосахарида, состоящего из 2-6 моносахаридов, где моносахарид(ы) независимо выбирают из группы, включающей альдопентозу, метилальдопентозу, альдогексозу, кетогексозу и их химические производные; где R обозначает алкильную группу, имеющую от 1 до 20 атомов углерода, и Х обозначает галоген, выбранный из группы, включающей Cl, Br, F, I;
R6 и R7 независимо выбирают из группы, включающей -Н, -ОН, -OR, -CN, -NHR, -NH2 и -X, где R обозначает алкильную группу, имеющую от 1 до 20 атомов углерода, и Х обозначает галоген, выбранный из группы, включающей Cl, Br, F, I; и
n обозначает 1-10. В предпочтительном варианте осуществления изобретения n обозначает 2-4.
В одном из вариантов осуществления изобретения диарилалканы выбирают из группы, включающей соединения, представленные следующей общей структурой:
в которой
R1, R2, R3, R4, R5, , , , и независимо друг от друга выбирают из группы, включающей -Н, -ОН, -SH, -OR, -CN, -SR, -NH2, -NHR, -NR2, Х и гликозид моносахарида или олигосахарида, состоящего из 2-6 моносахаридов, где моносахарид(ы) независимо выбирают из группы, включающей альдопентозу, метилальдопентозу, альдогексозу, кетогексозу и их химические производные; где R обозначает алкильную группу, имеющую от 1 до 20 атомов углерода, и Х обозначает галоген, выбранный из группы, включающей Cl, Br, F, I, и где по меньшей мере 2 группы из R1-R5 или по меньшей мере 2 группы из не обозначают Н;
R6 и R7 независимо друг от друга выбирают из группы, включающей -Н,
-ОН, -OR, -CN, -NHR, -NH2 и -X, где R обозначает алкильную группу, имеющую от 1 до 20 атомов углерода, и Х обозначает галоген, выбранный из группы, включающей Cl, Br, F, I; и
n обозначает 1-10. В предпочтительном варианте осуществления изобретения n обозначает 2-4.
В одном из вариантов осуществления изобретения диарилалканы, предлагаемые в настоящем изобретении, выделяют из одного или нескольких растений, выбранных из семейств растений, включая (но не ограничиваясь ими) семейства Compositae, Fabaceae, Lauraceae, Leguminosae, Liliaceae, Loranthaceae, Moracea и Myristicaceae. Диарилалканы, предлагаемые в настоящем изобретении, можно также экстрагировать, концентрировать и очищать из родов высших растений, включая (но не ограничиваясь ими) Acacia, Broussonetia, Dianella, Helichrysum, Iryanthera, Knema, Lindera, Pterocarpus, Viscum и Xanthocercis. Диарилалканы могут находиться в различных частях растений, включая (но не ограничиваясь ими) стебли, кору стеблей, сердцевину деревьев, стволы, кору стволов, ветки, клубни, корни, кору корней, молодые побеги, семена, корневища, цветки и другие репродуктивные органы, листья и другие надземные части. В предпочтительном варианте осуществления изобретения диарилалканы выделяют из растения или растений родов Broussonetia, Dianella и Iryanthera.
В другом варианте осуществления изобретения диарилалканы, предлагаемые в настоящем изобретении, получают с помощью методов синтеза. Под объем настоящего изобретения подпадает способ синтеза диарилалканов и диарилалканолов, заключающийся в восстановлении соединения, которое имеет следующую общую структуру:
в которой
R1-R5 и и n имеют указанные выше значения и R6 и R7 вместе образуют одну или несколько карбонильную(ых) группу(пп). Восстановитель можно выбирать из любого известного восстановителя, предназначенного для восстановления кетонов до спиртов, включая (но не ограничиваясь ими) борогидриды, H2 в присутствии катализатора, NaH и LiAlH4. В одном из вариантов осуществления изобретения восстановитель представляет собой NaBH4.
В другом варианте осуществления изобретения диарилалканы получают путем синтетической модификации встречающегося в естественных условиях соединения, выделенного из растительного источника. Например, встречающийся в естественных условиях бутеин выделяют из растительного источника, дегидратируют и восстанавливают с получением соответствующего диарилалканола.
В следующем варианте осуществления изобретения диарилалканы получают путем взаимодействия двух соответствующим образом замещенных ароматических соединений. Приемлемыми химическими реакциями для синтеза этих соединений из двух замещенных ароматических соединений являются (но не ограничиваясь ими) альдольная конденсация замещенного бензальдегида и замещенного ацетофенона; реакция Кляйзена-Шмидта или перекрестная альдольная конденсация альдегида и кетона; реакция Гриньяра с использованием галогенида органического магния одного замещенного ароматического кольца для связи с вторым замещенным ароматическим кольцом путем дополнительного взаимодействия карбонильной группы молекулы; перегруппировка Кляйзена путем внутримолекулярной изомеризации, при которой этерифицированный до сложного эфира фенол с соответствующими группами-заместителями должен быть изомеризован для связи с вторыми ароматическими кольцами в орто-положении фенола с последующей реакцией восстановления; и реакция сочетания Сузуки, в которой два замещенных ароматических кольца превращают в арилбороновые кислоты, а затем связывают с помощью галоидного алкила с использованием тщательно подобранного палладиевого катализатора. Эти реакции хорошо известны специалистам в данной области, а условия таких реакций можно определять на основе приведенной в настоящем описании информации, касающейся синтеза указанных соединений.
В настоящем изобретении предложена стратегия объединения анализа ингибирования и химического процесса дерепликации для идентификации активных растительных экстрактов и конкретных соединений среди тех экстрактов, которые специфически ингибируют двухъядерные ферменты. Этот подход включает объединение методов выделения встречающегося в естественных условиях продукта, органического синтеза, молекулярного моделирования и анализов ингибирования ферментов для оптимизации структуры и максимального увеличения эффективности лекарственного средства. Этот метод описан в заявке на патент США сер. №10/185758, поданной 27 июня 2002 г., озаглавленной «Способ получения, скрининга и дерепликации библиотек встречающихся в естественных условиях продуктов для создания терапевтических агентов» («Method for Generating, Screening and Dereplicating Natural Product Libraries for the Discovery of Therapeutic Agents»), которая полностью включена в настоящее описание в качестве ссылки. Эффективность этого метода продемонстрирована с помощью анализа ингибирования тирозиназы, описанного ниже в разделе «Примеры». Чистота диарилалканов, оцененная с помощью способа, предлагаемого в настоящем изобретении, составляет от 0,01 до 100% в зависимости от метода, применяемого для получения соединения(ий).
В предпочтительном варианте осуществления изобретения доза диарилалкана, вводимая пациенту, который нуждается в этом, представляет собой эффективное нетоксичное количество, как правило, составляющее от 0,001 до 100% в пересчете на общую массу конечной композиции и/или от 0,01 до 200 мг на килограмм в пересчете на вес пациента. Специалисты в данной области с помощью обычных клинических тестов могут определять оптимальные дозы для конкретного недомогания, подлежащего лечению. В настоящем изобретении предложены коммерчески приемлемые пути синтеза и/или выделения, очистки и приготовления препаративных форм диарилалканов с получением композиции, предлагаемой в изобретении, которая обладает требуемой физиологической активностью. Композиции, предлагаемые в настоящем изобретении, можно вводить любым методом, известным обычному специалисту в данной области. Пути введения включают (но не ограничиваясь ими) энтеральное (оральное) введение, парентеральное (внутривенное, подкожное и внутримышечное) введение и местное нанесение. Способ лечения, предлагаемый в настоящем изобретении, заключается в том, что пациенту, который нуждается в этом, вводят внутрь или наносят местно в терапевтически эффективном количестве чистые диарилалканы или смесь диарилалканов, синтезированных и/или выделенных из одного растения или нескольких видов растений. В предпочтительном варианте осуществления изобретения композицию применяют местно.
Должно быть очевидно, что как вышеизложенное краткое описание, так и приведенное ниже подробное описание и примеры, даны только с целью иллюстрации и не направлены на ограничение формулы изобретения.
Краткое описание чертежей
На чертежах показано:
на фиг.1 проиллюстрирован процесс меланогенеза, а также различные возможные механизмы регуляции этого процесса;
на фиг.2 - проиллюстрировано строение активного сайта тирозиназы. Как видно из этого чертежа, два иона меди имеют близкое пространственное расположение и каждый ион координирован с тремя остатками гистидана через N-ε-атом азота боковой цепи;
на фиг.3 (а,б) - структура, название, механизм действия и другие эффекты известных ингибиторов тирозиназы;
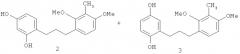
на фиг.4 - иллюстрации ЖХВР/УФ-хроматограмм ВПО-фракции, которая содержит UP288 (1-(2-метокси-4-гидроксифенил)-3-(2'-гидрокси-5'-метоксифенил)пропан (1) в качестве основного компонента;
на фиг.5 - химическое строение и 13С-ЯМР-спектр UP288 (1);
на фиг.6 - кривые зависимости ингибирующей активности в отношении тирозиназы от дозы и значения IC50 UP288 и койевой кислоты;
на фиг.7 - схема выделения с проведением биологического анализа двух активных соединений (UP302a и UP302b) из Dianella ensifolia (P0389) (все растение целиком);
на фиг.8 - ЖХВР/УФ-хроматограмма обогащенной UP302-фракции после нескольких разделений на колонке;
на фиг.9 - gHSQC-спектр UP302a (2), иллюстрирующий связи между протонами и углеродами;
на фиг.10 - графическая иллюстрация ингибирования активности тирозиназы при использовании различных концентраций ингибитора UP302a и су