Белки шелка
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению белков шелка различных насекомых, и может быть использовано в медицине для создания фармацевтически приемлемого носителя. Получают полипептиды шелка, имеющие двуспиральную структуру и происходящие от медоносной пчелы, шмеля, муравья-бульдога, муравья-портного и златоглазки. Рекомбинантным путем получают клетку-хозяина, трансгенное растение и животное, которые продуцируют полипептид шелка. К полученным полипептидам создают антитела. Изобретение позволяет использовать полученные полипептиды шелка в различных областях промышленности: для создания шелкового волокна, сополимера, продукта - средства личной гигиены, текстиля, пластика и биомедицинского продукта - фармацевтически приемлемого носителя. 14 н. и 7 з.п. ф-лы, 14 ил., 14 табл., 10 пр.
Реферат
Область техники
Изобретение относится к белкам шелка, а также к нуклеиновым кислотам, кодирующим эти белки. Настоящее изобретение также относится к рекомбинантным клеткам и/или организмам, которые синтезируют белки шелка. Белки шелка по изобретению могут применяться для разнообразных целей, таких как производство средств личной гигиены, пластиков, тканей и медико-биологических продуктов.
Предпосылки изобретения
Шелк представляет собой волокнистые белковые секреты, которые проявляют исключительную прочность и сопротивляемость, и поэтому представляют собой мишень для интенсивных исследований. Шелк продуцируют более чем 30000 видов пауков и многие другие насекомые. Из этих типов шелка было охарактеризовано очень мало, причем исследования были в основном сконцентрированы на шелке кокона одомашненного шелкопряда, Bombyx mori и шелке ячеек паука-кругопряда, Nephila clavipes.
У чешуекрылых и пауков гены фиброинов шелка кодируют белки, которые обычно имеют большой размер с выделяющимися гидрофильными концевыми доменами на любом конце, охватывающими обширную область перемежающихся гидрофобных и гидрофильных блоков (Bini et al., 2004). Обычно эти белки содержат различные комбинации кристаллических структур из β-складчатых листов, свободно связанных с β-листами, β-спиралями, α-спиралями и аморфными областями (в качестве обзора, см. Craig and Riekel, 2002).
Поскольку волокна шелка представляют один из наиболее известных природных волокон, они являются предметом интенсивного исследования для того, чтобы попытаться воспроизвести их синтез. Однако существующей проблемой при экспрессии фиброиновых генов чешуекрылых и пауков являются низкие уровни экспрессии в различных рекомбинантных системах экспрессии из-за комбинации повторяющихся нуклеотидных мотивов в гене шелка, которые приводят к разрушающим событиям рекомбинации, большого размера гена и малого числа кодонов, используемых для каждой аминокислоты в гене, что приводит к истощению пулов тРНК в клетках-хозяевах. Рекомбинантная экспрессия приводит к трудностям в ходе трансляции, таким как трансляционные паузы в результате выбора кодонов и потребности в кодонах, и повышенные скорости рекомбинации, приводящие к укорочению генов. Резюмируя, благодаря последовательностям с меньшим количеством повторов, можно было бы избежать множества проблем, связанных с экспрессией гена шелка на сегодняшний день.
В отличие от обширных знаний, накопленных о чешуекрылых (в частности, о шелке кокона Bombyx mori) и пауков (в частности, ячеистом шелке Nephila clavipes), мало известно о химической композиции и молекулярной организации шелков других насекомых.
В начале 1960-х годов с помощью рентгеновских дифракционных изображений из волокон шелка, вытянутых из слюнных желез личинки медоносной пчелы, было показано, что шелк жалящих перепончатокрылых имеет альфа-спиральную структуру (Rudall, 1962). Также показывая, что такой шелк является спиральным, полученные изображения указывали на наличие двойной спиральной системы из альфа-спиральных цепей (Atkins, 1967). Похожие рентгеновские дифракционные изображения были получены для шелка коконов из других видов Aculeata, включая осу, Pseudopompilus humbolti (Rudall, 1962) и шмеля, Bombus lucorum (Lucas and Rudall, 1967).
В отличие от альфа-спиральной структуры, описанной для шелков жалящих перепончатокрылых, шелки филогенетической ветви, родственной жалящим перепончатокрылым, Ichneumonoidea, имеют параллельные β-структуры. Рентгенограммы четырех примеров этой структуры были описаны у Braconidae (Cotesia(=Apenteles) glomerate; Cotesia(=Apenteles) gonopterygis; Apenteles bignelli) и для трех у Ichneumonidae (Dusona sp.; Phytodietris sp.; Branchus femoralis) (Lucas and Rudall, 1967). Кроме того, была описана единственная последовательность шелка Braconidae (Cotesia glomerate) (номер доступа в базе данных Genbank - AB 188680; Yamada et al., 2004). Эта частичная белковая последовательность состоит из высоко консервативного 28-членного Х-аспарагинового повтора (где Х представляет собой аланин или серин) и, предположительно, не содержит двойной спирали, образующей гептадные повторы. Расширенный анализ аминокислотной композиции шелка кокона Braconidae показал, что типы шелка подсемейства Microgastrinae являются уникальными по своему высокому содержанию серина и аспарагина (Lucas et al., 1960; Quicke et al., 2004). Родственные подсемейства продуцируют типы шелка со значительно отличающимися аминокислотными композициями, что позволяет предположить, что шелки Microgastrinae образовались только в этом подсемействе (Yamada et al., 2004). Была выделена частичная кДНК из Cotesia glomerate с использованием ПЦР-праймеров, разработанных на основе последовательности, полученной из внутренних пептидов, полученных из выделенных белков шелка кокона. Предсказанная аминокислотная композиция этой частичной аминокислотной последовательности близко напоминает аминокислотную композицию тщательно промытого шелка из этих видов.
Структура множества шелков из других нежалящих Apocrita и у оставшихся Hymenoptera (Symphata) представляет собой наиболее часто параллельные β-листы с как коллагено-подобными, так и полиглициновыми шелками, продуцируемыми Tenthredinidae (Lucas and Rudall, 1967).
Белки шелка медоносной пчелы синтезируются в середине последней возрастной стадии личинки в виде смеси деполимеризованных белков шелка (Silva-Zacarin et al., 2003). После развития возрастной стадии, вода удаляется из железы и дегидратация приводит к полимеризации белка шелка с образованием высокоорганизованных и нерастворимых шелковых волокон, меченных тактоидами (Silva-Zacarin et al., 2003). Возрастающая дегидратация приводит к дальнейшей реорганизации тактоидов (Silva-Zacarin et al., 2003) и, возможно, к образованию новых связей между филаментами (Rudall, 1962). На изображениях фибрилл из шелковых желез медоносной пчелы, полученных с помощью электронной микроскопии, показаны структуры, приблизительно, 20-25 ангстрем в диаметре (Flower and Kenchington, 1967). Это значение согласуется с трех-, четырех- или пятинитевыми двойными спиралями.
Аминокислотная композиция шелков из различных видов жалящих перепончатокрылых была определена Lucas and Rudall (1967), и было найдено, что они имеют высокое содержание аланина, серина и кислых остатков, аспарагиновой и глутаминовой кислот, и пониженное число остатков глицина по сравнению с классическими фиброинами. Полагают, что спиральное содержание шелка жалящих перепончатокрылых является следствием сниженного содержания глицина и повышенного содержания кислых остатков (Rudall and Kenchington, 1971).
Мало известно о шелке личинок сетчатокрылых (отряд: Neuroptera). Кокон состоит из двух слоев, внутреннего твердого слоя и внешнего волокнистого слоя. Ранее кокон был описан, как содержащий кутикулиновый шелк (Rudall and Kenchington, 1971), описание, относящееся только к внутреннему твердому слою. В 1988 LaMunyon описал вещество, выделяющееся из мальпигиевых сосудов и образующее внешние волокна. После отложения этого слоя создавалась твердая внутренняя стенка из выделений из эпителиальных клеток в сильно ворсинчатом просвете (LaMunyon, 1988).
Также известно, что личинки сетчатокрылых продуцируют клейкое вещество из мальпигиевых сосудов в течение всех возрастных стадий для прикрепления личинки к субстратам, для скрепления предметов маскировки на спине личинки или для ловли добычи (Speilger, 1962). В роде Lomamyia (Bethothidae), личинка продуцирует шелк и адгезивное вещество одновременно, и было высказано предположение, что эти два вещества вполне могут быть одним и тем же продуктом (Speilger, 1962). Адгезивное вещество является высоко растворимым веществом, и полагают, что оно связано с защитой против хищников (LaMunyon & Adams, 1987).
Поскольку шелк, производимый насекомыми, обладает уникальными свойствами, то существует необходимость в идентификации новых нуклеиновых кислот, кодирующих белки шелка из этих организмов.
Краткое изложение сущности изобретения
Авторы изобретения идентифицировали многочисленные белки шелка из насекомых. Эти белки шелка значительно отличаются от известных белков шелка по своей первичной структуре, вторичной структуре и/или аминокислотному составу.
Поэтому, первый аспект настоящего изобретения представляет по существу очищенный и/или рекомбинантный полипептид шелка, где по крайней мере часть полипептида имеет структуру двойной спирали.
Как известно в науке, двуспиральные структуры полипептидов отличаются гептадными повторами, представленными консенсусной последовательностью (abcdefg) n, обычно с гидрофобными остатками в положениях a и d, и, обычно, полярными остатками в других положениях. Удивительно, но при комплексном изучении гептады полипептидов по настоящему изобретению имеют новую композицию с необычно высоким присутствием аланина в «гидрофобном» положении в гептадах, a и d. Дополнительно в этих положениях присутствуют высокие уровни полярных остатков небольшого размера. Кроме того, положение е также имеет высокие уровни аланина и гидрофобных остатков небольшого размера.
Соответственно, в особенно предпочтительном варианте осуществления изобретения часть полипептида, которая имеет двуспиральную структуру, содержит по крайней мере 10 копий гептадной последовательности abcdefg, и по крайней мере 25% аминокислот в положениях a и d являются остатками аланина.
В дальнейшем предпочтительном варианте осуществления изобретения часть полипептида, которая имеет двуспиральную структуру, содержит по крайней мере 10 копий гептадной последовательности abcdefg, и по крайней мере 25% аминокислот в положениях a, d и е являются остатками аланина.
В дальнейшем предпочтительном варианте осуществления изобретения часть полипептида, которая имеет двуспиральную структуру, содержит по крайней мере 10 копий гептадной последовательности abcdefg, и по крайней мере 25% аминокислот в положении a являются остатками аланина.
В дальнейшем предпочтительном варианте осуществления изобретения часть полипептида, которая имеет двуспиральную структуру, содержит по крайней мере 10 копий гептадной последовательности abcdefg, и по крайней мере 25% аминокислот в положении d являются остатками аланина.
В дальнейшем предпочтительном варианте осуществления изобретения часть полипептида, которая имеет двуспиральную структуру, содержит по крайней мере 10 копий гептадной последовательности abcdefg, и по крайней мере 25% аминокислот в положении е являются остатками аланина.
В особенно предпочтительном варианте осуществления изобретения по крайней мере 10 копий гептадной последовательности являются непрерывными.
В дальнейшем предпочтительном варианте осуществления изобретения часть полипептида, которая имеет двуспиральную структуру, содержит по крайней мере 5 копий гептадной последовательности abcdefg, и по крайней мере 15% аминокислот в положениях a и d являются остатками аланина.
В дальнейшем предпочтительном варианте осуществления изобретения часть полипептида, которая имеет двуспиральную структуру, содержит по крайней мере 5 копий гептадной последовательности abcdefg, и по крайней мере 15% аминокислот в положениях a, d и е являются остатками аланина.
В дальнейшем предпочтительном варианте осуществления изобретения часть полипептида, которая имеет двуспиральную структуру, содержит по крайней мере 5 копий гептадной последовательности abcdefg, и по крайней мере 15% аминокислот в положении a являются остатками аланина.
В дальнейшем предпочтительном варианте осуществления изобретения часть полипептида, которая имеет двуспиральную структуру, содержит по крайней мере 5 копий гептадной последовательности abcdefg, и по крайней мере 15% аминокислот в положении d являются остатками аланина.
В дальнейшем предпочтительном варианте осуществления изобретения часть полипептида, которая имеет двуспиральную структуру, содержит по крайней мере 5 копий гептадной последовательности abcdefg, и по крайней мере 15% аминокислот в положении e являются остатками аланина.
В особенно предпочтительном варианте осуществления изобретения по крайней мере 5 копий гептадной последовательности являются непрерывными.
В одном варианте осуществления изобретения полипептид содержит последовательность, выбранную из:
i) аминокислотной последовательности, такой как представленная в любой одной из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:40, SEQ ID NO:41, SEQ ID NO:56 и SEQ ID NO:57;
ii) аминокислотной последовательности, которая по крайней мере на 30% идентична любой одной или нескольким из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:40, SEQ ID NO:41, SEQ ID NO:56 и SEQ ID NO:57; и
iii) биологически активного фрагмента из i) или ii).
В другом варианте осуществления изобретения полипептид содержит последовательность, выбранную из:
i) аминокислотной последовательности, такой как представленная в любой одной из SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:42, SEQ ID NO:43, SEQ ID NO:58 и SEQ ID NO:59;
ii) аминокислотной последовательности, которая по крайней мере на 30% идентична любой одной или нескольким из SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:42, SEQ ID NO:43, SEQ ID NO:58 и SEQ ID NO:59; и
iii) биологически активного фрагмента из i) или ii).
В другом варианте осуществления изобретения полипептид содержит последовательность, выбранную из:
i) аминокислотной последовательности, такой как представленная в любой одной из SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:26, SEQ ID NO:27, SEQ ID NO:44, SEQ ID NO:45, SEQ ID NO:60 и SEQ ID NO:61;
ii) аминокислотной последовательности, которая по крайней мере на 30% идентична любой одной или нескольким из SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:26, SEQ ID NO:27, SEQ ID NO:44, SEQ ID NO:45, SEQ ID NO:60 и SEQ ID NO:61; и
iii) биологически активного фрагмента из i) или ii).
В другом варианте осуществления изобретения полипептид содержит последовательность, выбранную из:
i) аминокислотной последовательности, такой как представленная в любой одной из SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:28, SEQ ID NO:29, SEQ ID NO:46, SEQ ID NO:47, SEQ ID NO:62 и SEQ ID NO:63;
ii) аминокислотной последовательности, которая по крайней мере на 30% идентична любой одной или нескольким из SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:28, SEQ ID NO:29, SEQ ID NO:46, SEQ ID NO:47, SEQ ID NO:62 и SEQ ID NO:63; и
iii) биологически активного фрагмента из i) или ii).
В дальнейшем варианте осуществления изобретения полипептид содержит последовательность, выбранную из:
i) аминокислотной последовательности, такой как представленная в SEQ ID NO:72 или SEQ ID NO:73;
ii) аминокислотной последовательности, которая по крайней мере на 30% идентична SEQ ID NO:72 и/или SEQ ID NO:73; и
iii) биологически активного фрагмента из i) или ii).
Далее были идентифицированы белки шелка, которые связаны с белками из первого аспекта. По предсказанию c помощью PROFseс один из этих белков (SEQ ID NO:10) имеет вторичную структуру, состоящую на 41% из альфа-спиралей, на 8% из бета-листов и на 50% из петель и, таким образом, классифицируется как белок со смешанной структурой. MARCOIL анализ этого белка предсказал только короткую область гептадных повторов, характерных для белков с двуспиральной структурой.
Соответственно, второй аспект изобретения представляет по существу очищенный и/или рекомбинантный полипептид шелка, который содержит последовательность, выбранную из:
i) аминокислотной последовательности, такой как представленная в любой одной из SEQ ID NO:9, SEQ ID NO:10 и SEQ ID NO:30;
ii) аминокислотной последовательности, которая по крайней мере на 30% идентична любой одной или нескольким из SEQ ID NO:9, SEQ ID NO:10 и SEQ ID NO:30; и
iii) биологически активного фрагмента из i) или ii).
Без желания быть ограниченным предположением, представляется, что четыре белка из первого аспекта скручиваются, образуя узел со спиральными осями, практически параллельными друг другу, и этот узел вытягивается по оси в фибриллу. Кроме того, предсказано, что по крайней мере у некоторых видов, таких как медоносная пчела и шмель, белки второго аспекта действуют как «клей», помогая в связывании различных узлов двуспиральных белков первого аспекта вместе, образуя волокнистый белковый комплекс. Однако еще шелковые волокна и сополимеры могут образоваться без полипептида второго аспекта.
В предпочтительном варианте осуществления изобретения полипептид по изобретению может быть очищен из или представлять собой мутант полипептида, очищенного из видов Hymenoptera или Neuroptera. Предпочтительно, видом Hymenoptera являются Apis mellifera, Oecophylla smaragdina, Myrmecia foricata или Bombus terrestris. Предпочтительно, видом Neuroptera является Mallada signata.
В другом аспекте настоящее изобретение представляет полипептид по изобретению, слитый по крайней мере с одним другим полипептидом.
В предпочтительном варианте осуществления изобретения по крайней мере один другой полипептид выбирается из группы, состоящей из: полипептида, который усиливает стабильность полипептида по настоящему изобретению, полипептида, который помогает в очистке слитого белка, и полипептида, который помогает секреции полипептида по изобретению из клетки (например, секреции из растительной клетки).
В другом аспекте, настоящее изобретение представляет выделенный и/или экзогенный полинуклеотид, который кодирует полипептид шелка, где по крайней мере часть полипептида имеет двуспиральную структуру.
В одном варианте осуществления изобретения полинуклеотид содержит последовательность, выбранную из:
i) последовательности нуклеотидов, такой как представленная в любой одной из SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:31, SEQ ID NO:32, SEQ ID NO:48, SEQ ID NO:49, SEQ ID NO:64 и SEQ ID NO:65;
ii) последовательности нуклеотидов, кодирующей полипептид по изобретению,
iii) последовательности нуклеотидов, которая по крайней мере на 30% идентична любой одной или нескольким из SEQ ID NO:11, SEQ ID NO: 12, SEQ ID NO:31, SEQ ID NO:32, SEQ ID NO:48, SEQ ID NO:49, SEQ ID NO:64 и SEQ ID NO:65, и
iv) последовательности нуклеотидов, которая гибридизируется с любой одной из i)-iii) при жестких условиях.
В другом варианте осуществления изобретения полинуклеотид содержит последовательность, выбранную из:
i) последовательности нуклеотидов, такой как представленная в любой одной из SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:33, SEQ ID NO:34, SEQ ID NO:50, SEQ ID NO:51, SEQ ID NO:66 и SEQ ID NO:67;
ii) последовательности нуклеотидов, кодирующей полипептид по изобретению,
iii) последовательности нуклеотидов, которая по крайней мере на 30% идентична любой одной или нескольким из SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:33, SEQ ID NO:34, SEQ ID NO:50, SEQ ID NO:51, SEQ ID NO:66 и SEQ ID NO:67, и
iv) последовательности нуклеотидов, которая гибридизируется с любой одной из i)-iii) при жестких условиях.
В другом варианте осуществления изобретения полинуклеотид содержит последовательность, выбранную из:
i) последовательности нуклеотидов, такой как представленная в любой одной из SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:35, SEQ ID NO:36, SEQ ID NO:52, SEQ ID NO:53, SEQ ID NO:68 и SEQ ID NO:69;
ii) последовательности нуклеотидов, кодирующей полипептид по изобретению,
iii) последовательности нуклеотидов, которая по крайней мере на 30% идентична любой одной или нескольким из SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:35, SEQ ID NO:36, SEQ ID NO:52, SEQ ID NO:53, SEQ ID NO:68 и SEQ ID NO:69, и
iv) последовательности нуклеотидов, которая гибридизируется с любой одной из i)-iii) при жестких условиях.
В дальнейшем варианте осуществления изобретения полинуклеотид содержит последовательность, выбранную из:
i) последовательности нуклеотидов, такой как представленная в любой одной из SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:37, SEQ ID NO:38, SEQ ID NO:54, SEQ ID NO:55, SEQ ID NO:70, SEQ ID NO:71 и SEQ ID NO:76;
ii) последовательности нуклеотидов, кодирующей полипептид по изобретению,
iii) последовательности нуклеотидов, которая по крайней мере на 30% идентична любой одной или нескольким из SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:37, SEQ ID NO:38, SEQ ID NO:54, SEQ ID NO:55, SEQ ID NO:70, SEQ ID NO:71 и SEQ ID NO:76, и
iv) последовательности нуклеотидов, которая гибридизируется с любой одной из i)=iii) при жестких условиях.
В другом варианте осуществления изобретения полинуклеотид содержит последовательность, выбранную из:
i) последовательности нуклеотидов, такой как представленная в SEQ ID NO:74 или SEQ ID NO:75;
ii) последовательности нуклеотидов, кодирующей полипептид по изобретению,
iii) последовательности нуклеотидов, которая по крайней мере на 30% идентична SEQ ID NO:74 и/или SEQ ID NO:75, и
iv) последовательности нуклеотидов, которая гибридизируется с любой одной из i)-iii) при жестких условиях.
В дальнейшем аспекте изобретение представляет выделенный и/или экзогенный полинуклеотид, полинуклеотид, содержащий последовательность, выбранную из:
i) последовательности нуклеотидов, такой как представленная в любой одной из SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21 и SEQ ID NO:39;
ii) последовательности нуклеотидов, кодирующей полипептид по изобретению,
iii) последовательности нуклеотидов, которая по крайней мере на 30% идентична любой одной или нескольким из SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21 и SEQ ID NO:39, и
iv) последовательности нуклеотидов, которая гибридизируется с любой одной из i)-iii) при жестких условиях.
В предпочтительном варианте осуществления изобретения полинуклеотид может быть выделен из или представлять собой мутант полинуклеотида, выделенного из видов Hymenoptera или Neuroptera. Предпочтительно, видом Hymenoptera являются Apis mellifera, Oecophylla smaragdina, Myrmecia foricata или Bombus terrestris. Предпочтительно, видом Neuroptera является Mallada signata.
В дальнейшем аспекте настоящее изобретение представляет вектор, содержащий по крайней мере один полинуклеотид по изобретению.
Предпочтительно, вектор представляет собой экспрессионный вектор.
В другом аспекте, настоящее изобретение представляет клетку-хозяина, содержащую по крайней мере один полинуклеотид по изобретению и/или по крайней мере один вектор по изобретению.
Клетка-хозяин может представлять собой любой тип клетки. Примеры включают, но не ограничены этим, бактериальную, дрожжевую или растительную клетку.
Также представлен процесс для получения полипептида по изобретению, процесс, содержащий культивирование клетки-хозяина по изобретению или вектора по изобретению при условиях, которые позволяют экспрессию полинуклеотида, кодирующего полипептид, и выделение экспрессированного полипептида.
Предусмотрено, что трансгенные растения будут особенно пригодными для получения полипептидов по изобретению. Поэтому, в еще одном аспекте настоящее изобретение представляет трансгенное растение, содержащее экзогенный полинуклеотид, полинуклеотид, кодирующий по крайней мере один полипептид по изобретению.
В другом аспекте настоящее изобретение представляет трансгенное животное, кроме человека, содержащее экзогенный полинуклеотид, полинуклеотид, кодирующий по крайней мере один полипептид по изобретению.
В еще одном аспекте настоящее изобретение представляет антитело, которое специфично связывает полипептид по изобретению.
В дальнейшем аспекте настоящее изобретение представляет шелковое волокно, содержащее по крайней мере один полипептид по изобретению.
Предпочтительно, полипептид представляет собой рекомбинантный полипептид.
В варианте осуществления изобретения по крайней мере некоторые из полипептидов являются кросс-сшитыми. В варианте осуществления изобретения по крайней мере некоторые из остатков лизина полипептида являются кросс-сшитыми.
В другом аспекте настоящее изобретение представляет сополимер, содержащий по крайней мере два полипептида по изобретению.
Предпочтительно, полипептиды являются рекомбинантными полипептидами.
В варианте осуществления изобретения сополимер содержит по крайней мере четыре различных полипептида из первого аспекта. В другом варианте осуществления изобретения сополимер далее содержит полипептид второго аспекта.
В варианте осуществления изобретения по крайней мере некоторые из полипептидов являются кросс-сшитыми. В варианте осуществления изобретения по крайней мере некоторые из остатков лизина полипептидов являются кросс-сшитыми.
Специалисту будет ясно, что полипептиды по изобретению имеют широкий спектр приложений, известных в этой области для других типов белков шелка. Поэтому, в дальнейшем аспекте настоящее изобретение представляет продукт, содержащий по крайней мере один полипептид по изобретению, шелковое волокно по изобретению и/или сополимер по изобретению.
Примеры продуктов включают, но не ограничены этим, средства личной гигиены, пластики, ткани и медико-биологические продукты.
В еще одном дальнейшем аспекте настоящее изобретение представляет композицию, содержащую по крайней мере один полипептид по изобретению, шелковое волокно по изобретению и/или сополимер по изобретению и один или более приемлемых носителей.
В одном варианте осуществления изобретения композиция содержит лекарство.
В другом варианте осуществления изобретения композиция используется как лекарственное средство в медицинском устройстве или косметическом средстве.
В другом аспекте настоящее изобретение представляет композицию, содержащую по крайней мере один полипептид по изобретению и один или более приемлемых носителей.
В предпочтительном варианте осуществления изобретения композиция, шелковое волокно, сополимер и/или продукт по изобретению не содержат белок маточного молочка пчел, продуцируемый насекомыми.
В дальнейшем аспекте настоящее изобретение представляет способ лечения или предотвращения болезни, способ, содержащий введение композиции, содержащей лекарство для лечения или предотвращения болезни и фармацевтически приемлемый носитель, где фармацевтически приемлемый носитель выбирается из по крайней мере одного полипептида по изобретению, шелкового волокна по изобретению и/или сополимера по изобретению.
В еще одном аспекте настоящее изобретение представляет применение по крайней мере одного полипептида по изобретению, шелкового волокна по изобретению и/или сополимера по изобретению и лекарства для изготовления лекарственного средства для лечения или предотвращения болезни.
В дальнейшем аспекте настоящее изобретение представляет набор, содержащий по крайней мере один полипептид по изобретению, по крайней мере один полинуклеотид по изобретению, по крайней мере один вектор по изобретению, по крайней мере одно шелковое волокно по изобретению и/или сополимер по изобретению.
Предпочтительно, чтобы набор содержал информацию и/или инструкции для применения набора.
Как будет ясно, предпочтительные свойства и характеристики одного аспекта изобретения являются применимыми для многих других аспектов изобретения.
В этой спецификации слово «содержать» или его вариации, такие как «содержит» или «содержащий» следует понимать, как предполагающее включение указанного элемента, целого или дробного, или группы элементов, целых или дробных, но не как исключение любого другого элемента целого или дробного, или группы элементов, целых или дробных.
Изобретение далее описано путем нижеследующих неограничивающих примеров со ссылками на сопровождающие фигуры.
Краткое описание сопровождающих чертежей
Фиг.1. Фурье инфракрасный спектр амидных областей I и II шелков: 1) шелка медоносной пчелы, 2) шелка шмеля, 3) шелка муравья-бульдога, 4) шелка муравья-портного, 5) шелка личинки златоглазки. Все шелки имеют спектры, ожидаемые для спиральных белков. Шелки перепончатокрылых (муравьев и пчел) имеют спектральный максимум при 1645-1646 см-1 (отмечен), сдвинутый, приблизительно, на 10 см-1 ниже, чем классический альфа-спиральный сигнал и расширенный, что типично для белков с двойной спиралью (Heimburg et al., 1999).
Фиг.2. Сравнение аминокислотной композиции, промытой ДСН шелка сот с расплодом медоносной пчелы с аминокислотной композицией белков Ксеноспира (а именно, Ксеноспира1, Ксеноспира2, Ксеноспира3 и Ксеноспира4) (эквимолярные количества в сумме составляют 65%) и Ксенозина (35%).
Фиг.3. Сравнение аминокислотной композиции шелка с аминокислотной композицией, предсказанных для белков, кодируемых генами шелка.
Фиг.4. Предсказание областей двойной спирали белков шелка медоносной пчелы. COILS представляет собой программу, которая сравнивает последовательность с базой данных известных параллельных двухцепочечных двойных спиралей и получает оценку сходства. Путем сравнения этой оценки с распределением оценок в глобулярных и двуспиральных белках, программа затем вычисляет вероятность того, что последовательность примет конформацию двойной спирали, описанную в Lupas et al. (1991). С использованием размера окна 28 эта программа предсказывает следующее число остатков, существующих в каждом белке в двуспиральных доменах: Ксеноспира3: 77; Ксеноспира4: 35; Ксеноспира1: 28; Ксеноспира2: 80.
Фиг.5. Выравнивание белков шелка медоносной пчелы, показывающее предсказание с помощью MARCOIL главных гептад, которые образуют структуру двойной спирали. Последовательности гептад показаны над аминокислотами, остатки аланина в положениях a и d выделены.
Фиг.6. Выравнивание Marciol предсказанных областей двойных спиралей белков шелка перепончатокрылых (пчел и муравьев), показывающее позиционное распределение гептад. Amel, медоносная пчела; ВВ, шмель; ВА, муравей-бульдог; WA, муравей-портной; F1-4, фиброины шелка 1-4. Гептадные последовательности показаны над аминокислотами, и остатки аланина в положениях a, d и е выделены.
Фиг.7. Аминокислотная характеристика положения гептад в предсказанных областях двойных спиралей белка шелка личинки Mallada signata и ортологичных кластерах белков шелка перепончатокрылых.
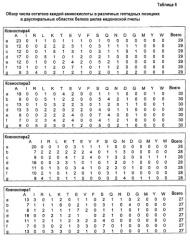
Фиг.8. Электрофорез в ДСН-полиакриламидном геле белков слюнных желез поздней последней возрастной стадии личинки. Белки были идентифицированы после расщепления трипсином и анализа совокупности данных масс-спектра с использованием программного обеспечения Spectrum Mill компании Agilent, чтобы совместить данные с предсказанными белковыми последовательностями из белков, идентифицированных из последовательностей кДНК. Программа генерировала счет для оценки качества каждого совпадения между экспериментально наблюдаемыми группами масс фрагментов пептидов и предсказанными фрагментами, которые могут образоваться в соответствии с последовательностями белков в предоставленной базе данных. Все совпадения последовательностей, показанные на фигуре, получили оценку больше 20 при помощи программного обеспечения Spectrum Mill, где оценка 20 была бы достаточной, чтобы автоматически уверенно принять действительное совпадение.
Фиг.9. Экономный анализ двуспиральной области белков шелка. Родство четырех двуспиральных белков позволяет предположить, что гены возникли из общего предшественника, предваряя расхождение Euaculeata. Область, связанная пунктирной линией, указывает на изменение, произошедшее перед расхождением муравьев и ос (Vespoidea) от пчел (Apoidea) в позднем Юрском периоде (155 млн л.; Grimaldi and Engel, 2005). Приведены числа, указывающие начальную загрузку от 1000 итераций.
Фиг.10. А) Белки шелка из Apis mellifera, идентифицированные с помощью масс-спектрометрии пептидов, полученных из шелка пчел после трипсинового гидролиза. Штриховка указывает пептиды, идентифицированные с помощью масс-спектрометрии. Все показанные в этой фигуре совпадения по последовательности получили оценки выше 20 при помощи программного обеспечения Spectrum Mill, где оценка 20 была бы достаточной, чтобы автоматически уверенно принять действительное совпадение.
В) Полноразмерные аминокислотные последовательности белков шелка шмеля, муравья-бульдога, ткача и златоглазки.
Фиг.11. Открытые рамки считывания, кодирующие белки шелка медоносной пчелы, шмеля, муравья-бульдога, муравья-портного и златоглазки.
Фиг.12. Последовательность гена, кодирующего Ксенозин. Приведена полная кодирующая последовательность, которая прерывается единственным интроном (выделен).
Фиг.13. Экспрессия белка шелка в табаке. Детекция меченных гистидинами белков после анализа методом Вестерн-блота белков из: 1. E. coli, трансформированных пустым экспрессионным вектором, 2. E. coli, трансформированных экспрессионным вектором, содержащим участок, кодирующий AmelF4 (Ксеноспира4), 3. табака, трансформированного пустым экспрессионным вектором, 4. табака, трансформированного экспрессионным вектором, содержащим участок, кодирующий AmelF4 (Ксеноспира4).
Фиг.14. Волокна, изготовленные из рекомбинантных белков шелка медоносной пчелы, показывающие двойное лучепреломление нитей. Двойное лучепреломление указывает на то, что структура присутствует в нитях. Различные рекомбинантные нити медоносной пчелы показаны на каждой панели А-D, а рекомбинантная нить златоглазки показана на панели Е.
Описание списка последовательностей
SEQ ID NO:1 - белок шелка медоносной пчелы, именуемый в настоящем описании Ксеноспира1 (также именуемый в настоящем описании AmelF1) (без сигнального пептида).
SEQ ID NO:2 - белок шелка медоносной пчелы, именуемый в настоящем описании Ксеноспира1.
SEQ ID NO:3 - белок шелка медоносной пчелы, именуемый в настоящем описании Ксеноспира2 (также именуемый в настоящем описании AmelF2) (без сигнального пептида).
SEQ ID NO:4 - белок шелка медоносной пчелы, именуемый в настоящем описании Ксеноспира2.
SEQ ID NO:5 - белок шелка медоносной пчелы, именуемый в настоящем описании Ксеноспира3 (также именуемый в настоящем описании AmelF3) (без сигнального пептида).
SEQ ID NO:6 - белок шелка медоносной пчелы, именуемый в настоящем описании Ксеноспира3.
SEQ ID NO:7 - белок шелка медоносной пчелы, именуемый в настоящем описании Ксеноспира4 (также именуемый в настоящем описании AmelF4) (без сигнального пептида).
SEQ ID NO:8 - белок шелка медоносной пчелы, именуемый в настоящем описании Ксеноспира4.
SEQ ID NO:9 - белок шелка медоносной пчелы, именуемый в настоящем описании Ксенозин (также именуемый в настоящем описании AmelSA1) (без сигнального пептида).
SEQ ID NO:10 - белок шелка медоносной пчелы, именуемый в настоящем описании Ксенозин.
SEQ ID NO:11 - нуклеотидная последовательность, кодирующая белок шелка медоносной пчелы Ксеноспира1 (без области, кодирующей сигнальный пептид).
SEQ ID NO:12 - нуклеотидная последовательность, кодирующая белок шелка медоносной пчелы Ксеноспира1.
SEQ ID NO:13 - нуклеотидная последовательность, кодирующая белок шелка медоносной пчелы Ксеноспира2 (без области, кодирующей сигнальный пептид).
SEQ ID NO:14 - нуклеотидная последовательность, кодирующая белок шелка медоносной пчелы Ксеноспира2.
SEQ ID NO:15 - нуклеотидная последовательность, кодирующая белок шелка медоносной пчелы Ксеноспира3 (без области, кодирующей сигнальный пептид).
SEQ ID NO:16 - нуклеотидная последовательность, кодирующая белок шелка медоносной пчелы Ксеноспира3.
SEQ ID NO:17 - нуклеотидная последовательность, кодирующая белок шелка медоносной пчелы Ксеноспира4 (без области, кодирующей сигнальный пептид).
SEQ ID NO:18 - нуклеотидная последовательность, кодирующая белок шелка медоносной пчелы Ксеноспира4.
SEQ ID NO:19 - нуклеотидная последовательность, кодирующая белок шелка медоносной пчелы Ксенозин (без области, кодирующей сигнальный пептид).
SEQ ID NO:20 - нуклеотидная последовательность, кодирующая белок шелка медоносной пчелы Ксенозин.
SEQ ID NO:21 - последовательность гена, кодирующего белок шелка медоносной пчелы Ксенозин.
SEQ ID NO:22 - белок шелка шмеля, именуемый в настоящем описании BBF1 (без сигнального пептида).
SEQ ID NO:23 - белок шелка шмеля, именуемый в настоящем описании BBF1.
SEQ ID NO:24 - белок шелка шмеля, именуемый в настоящем описании BBF2 (без сигнального пептида).
SEQ ID NO:25 - белок шелка шмеля, именуемый в настоящем описании BBF2.
SEQ ID NO:26 - белок шелка шмеля, именуемый в настоящем описании BBF3 (без сигнального пептида).
SEQ ID NO:27 - белок шелка шмеля, именуемый в настоящем описании BBF3.
SEQ ID NO:28 - белок шелка шмеля, именуемый в настоящем описании BBF4 (без сигнального пептида).
SEQ ID NO:29 - белок шелка шмеля, именуемый в настоящем описании BBF4.
SEQ ID NO:30 - частичная аминокислотная последовательность белка шелка шмеля, именуемого в настоящем описании BBSA1.
SEQ ID NO:31 - нуклеотидная последовательность, кодирующая белок шелка шмеля BBF1 (без области, кодирующей сигнальный пептид).
SEQ ID NO:32 - нуклеотидная последовательность, кодирующая белок шелка шмеля BBF1.
SEQ ID NO:33 - нуклеотидная последовательность, кодирующая белок шелка шмеля BBF2 (без области, кодирующей сигнальный пептид).
SEQ ID NO:34 - нуклеотидная последовательность, кодирующая белок шелка шмеля BBF2.
SEQ ID NO:35 - нуклеотидная последовательность, кодирующая белок шелка шмеля BBF3 (без области, кодирующей сигнальный пептид).
SEQ ID NO:36 - нуклеотидная последовательность, кодирующая белок шелка шмеля BBF3.
SEQ ID NO:37 - нуклеотидная последовательность, кодирующая белок шелка шмеля BBF4 (без области,