Способ конструирования массы миокардиальных клеток и применение массы миокардиальных клеток
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, клеточной технологии, медицине и трансплантологии. Предложен способ получения клеточных масс кардиомиоцитов, получаемых из плюрипотентных стволовых клеток. Способ предусматривает дифференцировку и индукцию плюрипотетных стволовых клеток с получением клеточных масс кардиомиоцитов. Далее проводят диспергирование клеточных масс до отдельных клеток и их культивирование в культуральной среде в условиях отсутствия сыворотки для их повторной агрегации. Способ позволяет получать кардиомиоциты высокой степени очистки, свободных от клеток, не являющихся кардиомиоцитами, и от любых компонентов, полученных из другого вида, которые обладают повышенной пост-трансплантационной приживляемостью. 2 н. и 9 з.п. ф-лы, 34 ил., 15 пр.
Реферат
Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится, главным образом, к способу получения клеточных масс путем агрегации очищенных кардиомиоцитов, полученных из плюрипотентной стволовой клетки, полученной путем диспергирования до отдельных клеток, а также настоящее изобретение относится к способу лечения болезней сердца путем приживления полученных клеточных масс кардиомиоцитов в сердечной ткани и к способу получения пластов клеточных масс с использованием клеточных масс кардиомиоцитов.
УРОВЕНЬ ТЕХНИКИ
Кардиомиоциты взрослых утрачивают пролиферативную активность, и трансплантация сердечной ткани является единственным путем для лечения серьезных болезней сердца, таких как инфаркт миокарда и кардиомиопатия. На самом деле при этом из-за проблемы отсутствия доноров сердечной ткани имеется срочная необходимость в разработке способа лечения, кроме трансплантации сердечной ткани.
Напротив, ожидается, что использование кардиомиоцитов, полученных вне живого организма, для замены ими пораженной части кардиомиоцитов станет наиболее многообещающим способом спасения пациентов, ожидающих трансплантацию сердечной ткани. Этот подход к лечению называют клеточной терапией сердца. Для того чтобы эта терапия стала реальностью, были проведены различные способы проб и ошибок. Эти способы включают: использование кардиомиоцитов или скелетных миобластов и клеток костного мозга или им подобных клеток, которые были экстрагированы из тканей эмбриона, новорожденного или взрослого; использование дифференцированных эмбриональных стволовых клеток; и получение стволовых клеток (таких как соматические стволовые клетки), которые, как полагают, существуют в живом организме, и индуцирование их дифференцировки (непатентный документ 1: Zhonghua Yi Xue Za Zhi 2003, 83, 1818-22).
Такие способы могут быть разделены на два типа подходов. Один из подходов включает трансплантацию кардиомиоцитов в виде клеток, и в этом способе кардиомиоциты, диспергированные до отдельных клеток, непосредственно вводят в ткань посредством иглы для инъекции (этот способ в настоящем документе обозначен как "инъекционный способ"). Другой подход включает конструирование ткани или органа вне живого организма (способ, который в настоящем документе обозначен как "способ тканевой инженерии"), и эту искусственную ткань или орган переносят в организм.
Для проведения способа тканевой инженерии были предприняты различные попытки, и они включают: 1) способ, в котором кардиомиоциты образуют подобную пласту структуру, которая затем прикрепляется на ткани (непатентный документ 2: Circulation Research 2002, 90(3):e-40); 2) способ, в котором кардиомиоциты и другие типы клеток, смешивают в такой же пропорции, в какой они находятся в сердечной ткани, и трехмерная структура, образованная из смеси, используется для замены ткани; 3) способ, в котором трехмерная структура образуется из кардиомиоцитов, диспергированных до отдельных клеток, с последующим конструированием сосудистой структуры, и трехмерной структурой заменяют ткань; и 4) способ, в котором вместо замены сердечной ткани новый вспомогательный орган, который принимает участие в осуществлении присущей органу функции, эктопически трансплантируют в мишеневый сайт (непатентный документ 3: Circulation Research 2007 2, 100: 263-272).
Однако в настоящее время, когда разнообразные способы проб и ошибок используются на пути разработки клинического терапевтического применения, ни один из способов не применяется на практике. Это связано с тем, что с трансплантацией кардиомиоцитов в сердце связано несколько проблем, таких как включение клеток, не являющихся кардиомиоцитами, низкая степень приживления трансплантированных кардиомиоцитов и неспособность удаления компонентов, полученных из других видов.
Для использования кардиомиоцитов в качестве клеточных масс при трансплантации известны способы, с помощью которых возможно конструирование клеточных масс, включающих эмбриональные и неонатальные кардиомиоциты грызунов, и согласно недавней публикации клеточные массы были сконструированы с использованием всех клеток (включая не только кардиомиоциты), которые были получены из сердца эмбриона (непатентный документ 4: Developmental Dynamics 235; 2200-2209, 2006). Что касается трансплантации кардиомиоцитов, то сообщался случай, когда было подтверждено приживление эмбриональных кардиомиоцитов мыши, трансплантированных в сердце взрослых мышей (непатентный документ Science 1994, 264(5155): 98-101). Однако этот способ трансплантации кардиомиоцитов включал использование всех клеток, до которых были диспергированы эмбриональные сердца под действием коллагеназы, поэтому трансплантированные клетки состояли из популяции клеток, включающей смесь кардиомиоцитов и других типов клеток. Также известно, что неочищенные кардиомиоциты, полученные из живого организма, могут быть трансплантированы в сердце (непатентный документ 5: Science 1994, 264(5155): 98-101; и непатентный документ 1: Zhonghua Yi Xue Za Zhi 2003, 83, 1818-22).
Также известен способ, в котором в процессе дифференцировки эмбриоидных тел из клеток ES эмбриоидные тела не полностью обрабатывали протеолитическим ферментом, посредством чего получали популяцию, содержащую клеточные массы, насыщенные и не насыщенные кардиомиоцитами, и затем подвергали их центрифугированию в градиенте плотности, получая, таким образом, клеточные массы, которые содержали кардиомиоциты в количестве, составляющем примерно до 70% (патентный документ 1: US 2005-0214938 A).
Однако каждый из этих способов включает использование популяции клеток, которая также содержит клетки, не являющиеся кардиомиоцитами, и загрязнение такими клетками, не являющимися кардиомиоцитами, может вызывать серьезные непредсказуемые побочные эффекты, угрожающие жизни пациента после трансплантации. При данных обстоятельствах существует необходимость использовать в трансплантационной терапии кардиомиоциты, подвергшиеся очистке.
В нескольких публикациях описаны результаты трансплантации в сердце неочищенных, полученных из клеток ES кардиомиоцитов и возможность их последующей трансплантации (непатентный документ 6: Cardiovasc Res. 2007 May 17; непатентный документ 7: Stem Cells. 2007 May 31; и непатентный документ 8: FASEB J. 2007 Apr 13). Однако согласно недавней публикации, в которой описана очистка полученных из клеток ES кардиомиоцитов и их инъекция в сердце, степень приживления трансплантированных кардиомиоцитов была крайне низкой, и не было обнаружено прижившихся кардиомиоцитов (т.e. кардиомиоцитов, выживших в органе-хозяине и оставшихся прикрепленными на нем на протяжении продолжительного периода времени); как оказалось, очищенные полученные из клеток ES кардиомиоциты не способны к приживлению после трансплантации индивидууму (в живой организм) (непатентный документ 9: J Exp Med. 2006; 203:2315-27.)
Эта публикация пролила свет на трудности приживления очищенных кардиомиоцитов после трансплантации. Для решения этой проблемы в той же публикации был описан способ, который включает трансплантацию полученных из клеток ES кардиомиоцитов вместе с эмбриональными фибробластами мышей, для усиления степени их приживления после трансплантации (непатентный документ 9: J Exp Med. 2006 Oct 2; 203(10): 2315-27). Это подтверждает, что не существует способов, способных обеспечить трансплантацию очищенных, полученных из клеток ES кардиомиоцитов, и их приживление, при этом сохраняя чистоту клеток.
Кроме того, для получения клеточных трансплантатов, предназначенных для использования в терапии человека, должны быть удалены сывороточные и другие факторы, полученные из других животных. В способе получения кардиомиоцитов, используемых для трансплантации, культивирование обычно осуществляют в присутствии сыворотки; но известно также, что в условиях культивирования в среде, не содержащей сыворотку, клетки ES человека могут образовывать эмбриоидные тела, которые содержат кардиомиоциты в количествах, сравнимых с кардиомиоцитами, полученными обычным культивированием в присутствии сыворотки (непатентный документ 10: Stem cells and development 15:931-941, 2006). Однако нет публикаций, включая и эту публикацию, описывающих случай трансплантации кардиомиоцитов, полученных без использования таких факторов, как сыворотка, полученных из других животных.
Таким образом, для успешной трансплантации кардиомиоцитов в сердце должны быть решены некоторые проблемы, такие как включение клеток, не являющихся кардиомиоцитами, низкая степень приживления трансплантированных кардиомиоцитов и невозможность удаления компонентов, полученных из других видов.
Более того, в связи с трансплантацией кардиомиоцитов в сердечную ткань предполагается трансплантировать их в форме так называемых "клеточных пластов". Что касается получения клеточных пластов, то известно, что неонатальные кардиомиоциты используют для образования однослойного пласта, и in vitro могут наслаиваться до трех таких пластов (непатентный документ 11: FASEB J. 2006 Apr; 20(6): 708-10). Однако в указанном документе также утверждается, что вследствие ограниченной проницаемости кислорода клеточные пласты не могут быть сделаны любой толщины без неоваскуляризации клеточного пласта, и до сих пор невозможно получить желаемый клеточный пласт, который бы соответствовал размеру пораженной сердечной ткани.
Как описано выше, данные, известные из уровня техники, указывают на то, что получение кардиомиоцитов, используемых при трансплантации, и собственно трансплантация кардиомиоцитов нуждается в дополнительном улучшении с точки зрения практической реализации.
Патентный документ 1: US 2005-0214938 A
Непатентный документ 1: Zhonghua Yi Xue Za Zhi 2003, 83, 1818-22
Непатентный документ 2: Circulation Research 2002, 90(3):e-40
Непатентный документ 3: Circulation Research 2007 2, 100: 263-272
Непатентный документ 4: Developmental Dynamics 235; 2200-2209, 2006
Непатентный документ 5: Science 1994, 264(5155): 98-101
Непатентный документ 6: Cardiovasc Res. 2007 May 17 (Flk1(+) cardiac stem/progenitor cells derived from embryonic stem cells improve cardiac function in a dilated cardiomyopathy mouse model)
Непатентный документ 7: Stem Cells. 2007 May 31 (Differentiation in vivo of Cardiac Committed Human Embryonic Stem Cells in Post-Myocardial Infarcted Rats)
Непатентный документ 8: FASEB J. 2007 Apr 13 (Identification and selection of cardiomyocytes during human embryonic stem cell differentiation)
Непатентный документ 9: J Exp Med. 2006 Oct 2; 203(10): 2315-27
Непатентный документ 10: Stem Cell and Development 15: 931-941, 2006
Непатентный документ 11: FASEB J. 2006 Apr; 20(6): 708-10
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ПРОБЛЕМЫ, РЕШАЕМЫЕ ИЗОБРЕТЕНИЕМ
Следовательно, авторы настоящего изобретения исследовали необходимые условия, которые допустимы, по меньшей мере в настоящее время, для клинического использования культивированных кардиомиоцитов, и обнаружили в результате следующие трудности.
(1) Очистка кардиомиоцитов: при получении кардиомиоцитов из живого организма или из плюрипотентных стволовых клеток их безопасность не может быть гарантирована, если они загрязнены неизвестными клетками, поэтому в любом случае кардиомиоциты обязательно должны иметь высокую степень чистоты. Для поддержания постоянного уровня очистки таких имеющих высокую степень чистоты кардиомиоцитов необходимо, чтобы кардиомиоциты полученные из живого организма или из плюрипотентных стволовых, клеток, были диспергированы до дискретных клеток (таких как отдельные клетки), причем отдельные клетки должны отличаться друг от друга так, что можно было выбрать только кардиомиоциты.
(2) Природа кардиомиоцитов: Различия в свойствах кардиомиоцитов, которые существуют у разных видов, не только вызывают проблему иммунного отторжения и этические проблемы, но также серьезно влияют на клиническую безопасность и эффективность, поэтому важно использовать клетки доноров того же вида, что и реципиент.
(3) Удаление факторов, полученных из животных других видов: для того чтобы исключить иммуногенность и загрязнение неизвестными патогенами, должны быть удалены примеси, такие как сыворотка, полученные из животного другого вида.
(4) Приживление трансплантированных кардиомиоцитов: для функционирования трансплантированных кардиомиоцитов таким же образом, как кардиомиоцитов в организме-хозяине, в первую очередь они должны приживиться в кардиомиоцитах хозяина (поддерживаться приживленными в течение продолжительного периода времени).
(5) На следующей стадии клетки должны созреть (вырасти до большего размера).
Коротко, целью настоящего изобретения являются средства, с помощью которых кардиомиоциты, которые были очищены так, что являются свободными от клеток, не являющихся кардиомиоцитами, и от любых компонентов, полученных из другого вида, могут быть трансплантированы и иметь высокую степень приживления, что стимулирует их созревание.
СРЕДСТВА, РЕШАЮЩИЕ УКАЗАННЫЕ ЗАДАЧИ
Для повышения степени приживления кардиомиоцитов, которые были выделены из живого организма или плюрипотентных стволовых клеток и которые очищены до той степени, когда они свободны от клеток, не являющихся кардиомиоцитами, и от любых компонентов, полученных из другого вида, авторы настоящего изобретения исследовали возможность конструирования клеточных масс из очищенных кардиомиоцитов. В результате было обнаружено, что проблема, указанная выше, может быть решена благодаря способу получения клеточных масс кардиомиоцитов, полученных из плюрипотентных эмбриональных стволовых клеток (клеток ES) или из индуцированных плюрипотентных стволовых клеток (клеток iPS), отличающихся тем, что клеточные массы, содержащие кардиомиоциты, которые были дифференцированы и индуцированы из клеток ES или из клеток iPS, были диспергированы до отдельных клеток, с получением таким образом очищенных кардиомиоцитов, которые затем культивируют в культуральной среде без сыворотки, таким образом, чтобы они повторно агрегировали.
Авторы настоящего изобретения сначала использовали кардиомиоциты, полученные из живого организма, и исследовали возможность решения проблемы, указанной выше. Более конкретно, используя кардиомиоциты, полученные из живого организма, которые были очищены до такой степени, что они свободны от клеток, не являющихся кардиомиоцитами, и от любых компонентов, полученных из другого вида, авторы настоящего изобретения исследовали возможность повышения степени приживления таких кардиомиоцитов после трансплантации.
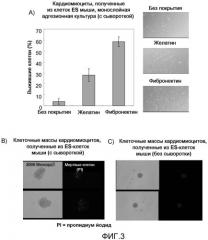
Как оказалось, очищенные кардиомиоциты, полученные из живого организма, не способны к образованию клеточных масс даже после культивирования в течение 24 часов в культуральной среде, содержащей 10%-сыворотку. Этот результат подтвердил, что известный способ формирования клеточных масс кардиомиоцитов, при получении их из живого организма, которые эффективны в неочищенном состоянии, жестко зависит от вспомогательного действия клеток, не являющихся кардиомиоцитами. В другом экспериментальном исследовании, проведенном для исследования, каким образом очищенные кардиомиоциты, полученные из живого организма, будут себя вести в условиях без сыворотки, такие клетки были не способны к образованию клеточных масс; напротив, они сами подвергались клеточной смерти. Эти результаты ведут к выводу, что "конструирование клеточных масс неочищенных кардиомиоцитов, полученных из сердца живого организма", является неосуществимым способом и что невозможно предсказать поведение в условиях без сыворотки очищенных кардиомиоцитов, полученных из сердца живого организма.
Кроме того, в известных способах получения клеточных масс, агрегированных кардиомиоцитов, использовали клетки, полученные из сердца новорожденных животных или из сердца эмбриона, которые культивировали в культуральной среде, содержащей сыворотку. Этот способ основан на известном факте, что сыворотка, по существу, обладает сильным протективным эффектом, независимо от типа клеток. Однако, как указано ниже, в случае терапии человека необходимо избегать использования факторов (таких как сыворотка), полученных из других животных. Следовательно, используя вместо сыворотки бессывороточную среду, которая содержит различные добавки, содержащие заместители сыворотки, авторы настоящего изобретения исследовали способность агрегации кардиомиоцитов, полученных из живого организма. Однако при любых тестированных условиях в отсутствие сыворотки кардиомиоциты, полученные из живого организма, были не способны формировать желаемые клеточные массы, и степень их выживаемости также была низкой.
Учитывая данные об известном способе, заключающиеся в том, что при культивировании кардиомиоцитов, полученных из живого организма, в виде клеточных масс, выживаемость кардиомиоцитов сохраняется в течение длительного периода времени, авторы настоящего изобретения сделали попытку получить клеточные массы очищенных кардиомиоцитов, полученных из живого организма, в условиях отсутствия сыворотки. Однако, как оказалось, никаких клеточных масс не образовалось даже после пяти дней культивирования. В результате проведения этого эксперимента были получены новые данные о том, что в условиях отсутствия сыворотки очищенные кардиомиоциты, полученные из живого организма, не способны формировать клеточные массы.
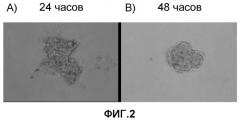
Следовательно, авторы настоящего изобретения предположили, что решением этого технологического затруднения может стать изменение источника получения кардиомиоцитов. В результате проведения подобных исследований с различными источниками получения клеток авторы настоящего изобретения обнаружили, что кардиомиоциты, полученные из очищенных эмбриональных стволовых клеток, присоединяются друг к другу даже в условиях отсутствия сыворотки достаточно быстро в течение 12 часов, в результате чего могут быть получены трехмерные клеточные массы, и что кардиомиоциты в это время начинали агрегировать синхронно.
Это демонстрирует, что кардиомиоциты, полученные из эмбриональных стволовых клеток, способны к эффективному конструированию клеточной адгезии между очищенными кардиомиоцитами, и это также демонстрирует, что очищенные кардиомиоциты, полученные из эмбриональных стволовых клеток, обладают высокой способностью агрегировать в условиях отсутствия сыворотки. Поскольку эти результаты воспроизводились с клетками более чем одного вида, используя эмбриональные стволовые клетки, полученные из соответствующих видов, свойство, описанное выше, по-видимому, является естественным, то есть обычным для кардиомиоцитов, полученных у человека, и, в другом случае, полученных из эмбриональных стволовых клеток. На основании этого естественного свойства, характерного для этой эмбриональной стволовой клетки в условиях отсутствия сыворотки, авторы настоящего изобретения впервые в данной области успешно сформировали клеточные массы очищенных кардиомиоцитов в условиях отсутствия сыворотки.
Более того, на основании известного сообщения ожидалось, что кардиомиоциты, полученные из эмбриональных стволовых клеток, обладающие низкой степенью приживления, также обладают низкой способностью к повторной агрегации (Transplantation 70:1310-1317, 2000); с другой стороны, было сделано предположение, что попытки агрегации очищенных кардиомиоцитов, полученных из эмбриональных стволовых клеток, являются едва ли осуществимыми и сделан вывод о том, что они не могут агрегировать. Тем не менее, несмотря на сделанное предположение, авторы настоящего изобретения впервые продемонстрировали в данной области, что очищенные кардиомиоциты, полученные из эмбриональных стволовых клеток, могут формировать клеточные массы без помощи других клеток и что благодаря сконструированным клеточным массам может быть достигнуто значительное улучшение степени приживления клеток при трансплантации. Коротко, авторы настоящего изобретения обнаружили, что кардиомиоциты, полученные из эмбриональных стволовых клеток, обладают абсолютно другими характеристиками по сравнению с кардиомиоцитами, полученными из сердца живого организма, а именно они могут быть очищены до отдельных клеток и могут формировать клеточные массы даже в условиях отсутствия сыворотки.
Более того, для создания способа, с помощью которого из кардиомиоцитов, полученных из эмбриоанальных стволовых клеток, могут быть получены клеточные массы, более подходящие для трансплантации, авторы настоящего изобретения исследовали примеси, которые могут быть добавлены в культуральную среду в качестве средства, с помощью которого кардиомиоциты, полученные из эмбриональных стволовых клеток, могут более эффективно создавать клеточные массы в условиях отсутствия сыворотки. В результате при добавлении в качестве примеси инсулина, трансферрина и селена (ITS) было показано, что клеточные массы сильнее спонтанно пульсируют, чем клеточные массы, к которым не добавляли ITS, и это явление имело достаточную воспроизводимость. Коротко, было показано, что добавление ITS (конкретно, инсулина) является желательным для получения клеточных масс с использованием очищенных кардиомиоцитов, полученных из эмбриональных стволовых клеток. Следует отметить, что инсулин представляет собой наиболее важный фактор среди ITS, при этом трансферрин и селен играют вспомогательную роль.
Затем авторы настоящего изобретения добавляли ITS к базальной культуральной среде, не содержащей сыворотки (в настоящем документе обозначен как базальная культуральная среда), и дополнительно добавляли основной фактор роста фибробластов (bFGF) и/или инсулиноподобный фактор роста 1 (IGF1) к базальной культуральной среде; как оказалось, при добавлении только bFGF клеточные массы существенно увеличивались в диаметре на 5 день после их образования, что указывает на то, что клетки, представляющие интерес, были защищены. Это явление не было обнаружено при культивировании в среде, содержащей сыворотку, и оно представляет собой эффект защиты и пролиферации клеток, который являлся характерным для условий культивирования в отсутствие сыворотки при добавлении только bFGF. Известно, что bFGF обладает функцией защиты клеток, функцией стимулирования роста клеток и аналогичными функциями в отношении кардиомиоцитов, культивированных в таких экспериментальных условиях, при которых формирование монослойной культуры осуществляли при добавлении сыворотки (J Mol Cell Cardiol. 2007 Jan; 42(1): 222-33; и Cardiovasc Res. 2004; 64:516-25), но было абсолютно неизвестно, что продолжительный рост и защита кардиомиоцитов могут происходить и в условиях отсутствия сыворотки.
Этот эффект был сильнее, чем эффект, который наблюдался при формировании клеточных масс с использованием культуральной среды с добавлением 10%-сыворотки; с другой стороны, в случае добавления bFGF, но отсутствия образования клеточных масс до монослойной культуры, эффект, представляющий интерес, был слабее, чем эффект, наблюдаемый, когда клеточные массы формировались с использованием культуральной среды с добавлением 10% сыворотки. На основании результатов этих двух экспериментов было сделано предположение, что для обеспечения продолжительного перспективного эффекта bFGF на клетки и стимулирования роста свыше эффекта, полученного для формирующихся клеточных масс с использованием культуральной среды с добавлением 10% сыворотки, необходимо получить клеточные массы.
Следовательно, для подтверждения того, что конструирование клеточных масс является обязательным условием для осуществления указанных эффектов, авторы настоящего изобретения провели культивирование монослойной адгезионной культуры кардиомиоцитов, полученных из очищенных эмбриональных стволовых клеток мыши, с добавлением bFGF к культуральной среде и проанализировали эффекты добавления bFGF.
В монослойной культуре, в которой не образовывались клеточные массы, очищенные кардиомиоциты едва ли могли выжить, поэтому к базальной культуральной среде добавляли ITS. Однако при добавлении bFGF было обнаружено, что выживает и прикрепляется к культуральному планшету большее количество клеток. Этот эффект был слабее эффекта, который наблюдали, когда клеточные массы образовывались с использованием культуральной среды с добавлением 10% сыворотки.
При конструировании клеточных масс очищенных кардиомиоцитов, полученных из эмбриональных стволовых клеток, сравнивали влияние культивирования при отсутствии сыворотки+ITS+bFGF с влиянием продолжительного культивирования в присутствии 10% сыворотки; в культуральной среде, содержащей 10% сыворотку, размер клеточных масс существенно уменьшался, при этом он значительно увеличивался в группе с условиями культивирования в отсутствие сыворотки+ITS+bFGF. Это указывает на то, что влияние bFGF, как обнаружено авторами настоящего изобретения, является синергическим эффектом всех трех элементов: очистки, отсутствия сыворотки и наличия клеточных масс.
На основании этого результата авторы настоящего изобретения обнаружили, что влияние ITS и/или bFGF на культуральную среду, не содержащую сыворотки, обеспечивает клеточным массам кардиомиоцитов возможность поддерживать их состояние в течение продолжительного периода времени. На основании этого обнаружено, что степень выживаемости кардиомиоцитов может быть увеличена до 90% или более, исключительно положительное улучшение до значения, составляющего более чем 60-70% для стандартного способа культивирования монослойной культуры.
Перед осуществлением настоящего изобретения клеточные массы кардиомиоцитов не могли быть получены в условиях высокой чистоты и отсутствия сыворотки; однако на основании вышеизложенного авторы настоящего изобретения решили эту проблему благодаря использованию кардиомиоцитов, полученных из эмбриональных стволовых клеток; также было обнаружено, что клеточные массы кардиомиоцитов могли быть получены наиболее эффективно в присутствии добавленных ITS и bFGF.
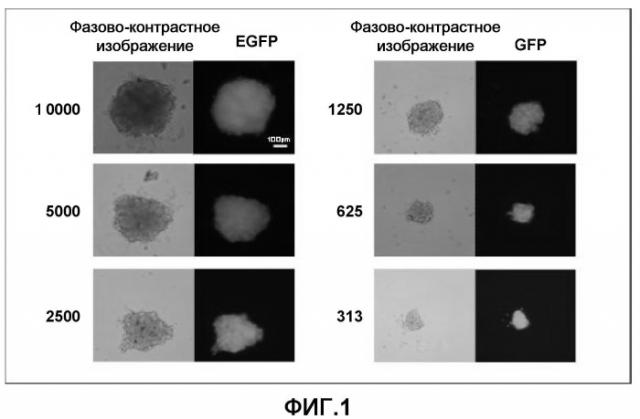
Таким образом, в одном из вариантов осуществления изобретения авторами настоящего изобретения также предлагается способ получения клеточных масс кардиомиоцитов, полученных из эмбриональных стволовых клеток, отличающийся тем, что очищенные кардиомиоциты, полученные из эмбриональных стволовых клеток, полученных путем диспергирования агрегированных клеточных масс, содержащих кардиомиоциты, дифференцированные и индуцированные из эмбриональных стволовых клеток до отдельных клеток, культивируют в культуральной среде в условиях отсутствия сыворотки так, что они повторно агрегируют. Культуральная среда, используемая для культуры, описанной выше, предпочтительно также содержит по меньшей мере инсулин из ITS и в более предпочтительном варианте осуществления изобретения также может содержать bFGF. В способе, описанном выше, клеточные массы, диспергированные до отдельных клеток, необязательно культивировать в отдельной зоне, как это делают в известных способах, но они могут быть разделены на группы, максимально состоящие из 10000 клеток, и культивировать в соответствующем количестве независимых зон.
При загрязнении пролиферирующими клетками, не являющимися кардиомиоцитами, клеточные массы агрегированных клеток будут расти до исключительно большого размера, а также изменят морфологию. Кроме того, может быть использовано окрашивание флуоресцентным красителем, который накапливается в митохондриях, для идентификации пролиферирующих клеток, которые идентифицируют как клетки, в которых затруднено накопление красителя. Клеточные массы, загрязненные клетками, не являющимися кардиомиоцитами, могут быть удалены при применении в трансплантационной терапии или в подобной терапии, для гарантии, что малейшее загрязнение пролиферирующими клетками, не являющимися кардиомиоцитами, удалено в имплантированных клетках.
Кроме того, ранее было опубликовано, что очищенные кардиомиоциты, полученные из эмбриональных стволовых клеток, диспергированных до отдельных клеток (индивидуальных клеток), не приживлялись при трансплантации сами по себе в сердечную ткань индивидуума (живого организма), и авторами настоящего изобретения получен такой же результат. Из уровня техники известно, что эта проблема решалась путем смешивания очищенных кардиомиоцитов, полученных из эмбриональных стволовых клеток, вместе с вспомогательными клетками, что указывает, что в живом организме защитная функция клеток, не являющихся кардиомиоцитами, является необходимой для выживания кардиомиоцитов. Однако загрязнение клетками, не являющимися кардиомиоцитами, может вызывать тяжелые непредсказуемые побочные эффекты, которые могут подвергать угрозе жизнь пациента после трансплантации, поэтому авторы настоящего изобретения предполагают, что будет обеспечена большая безопасность и более сильный терапевтический эффект, если очищенные кардиомиоциты будут трансплантировать индивидууму (живому организму) без смешивания с вспомогательными клетками, но с поддерживанием высокой степени чистоты кардиомиоцитов.
Следовательно, авторам настоящего изобретения пришла идея создания клеточных масс очищенных кардиомиоцитов, полученных из эмбриональной стволовой клетки, полученной способом, описанным выше, и авторы настоящего изобретения обнаружили, что при трансплантации таких клеточных масс в сердечную ткань индивидуума (живого организма) степень приживления после трансплантации может быть существенно увеличена. Другими словами, авторы настоящего изобретения обнаружили, что при культивировании очищенных кардиомиоцитов, полученных из эмбриональной стволовой клетки, полученной путем диспергирования клеточных масс до отдельных клеток, в культуральной среде в условиях отсутствия сыворотки так, чтобы они повторно агрегировали с формированием клеточных масс, степень приживления после трансплантации очищенных кардиомиоцитов, полученных из эмбриональной стволовой клетки, может быть существенно увеличена.
Следовательно, другой вариант осуществления настоящего изобретения относится к способу лечения болезней сердца, отличающемуся тем, что клеточные массы, полученные с помощью повторно агрегированных кардиомиоцитов, полученных из эмбриональных стволовых клеток, и которые были очищены путем диспергирования до отдельных клеток, трансплантируют в сердечную ткань (в частности, в пораженную часть сердечной ткани) индивидуума (живого организма) так, чтобы они приживились. При использовании в настоящей заявке термин "приживление" обозначает выживаемость в органе-хозяине и сохранение в нем в прикрепленном состоянии в течение продолжительного периода времени.
Кроме того, как описано выше, существует известный способ, который обеспечивает возможность наслаивания до трех монослойных пластов неонатальных кардиомиоцитов, но более толстые пласты кардиомиоцитов не могут быть получены.
Для решения этой проблемы авторам настоящего изобретения пришла идея создания клеточных масс очищенных кардиомиоцитов, полученных из эмбриональной стволовой клетки, полученных способом, описанным выше. Клеточные массы, представляющие интерес, конструировали способом, описанным выше, и полученные клеточные массы извлекали и высевали на разбитую на секции поверхность культуральной посуды, не обладающей способностью к адгезии клеток, в отсутствие пространства между клеточными массами, так чтобы соседние клеточные массы находились в постоянном контакте друг с другом, с последующим поддержанием суспензионной культуры. В результате клеточные массы конъюгируют вместе с течением времени с образованием пласта клеточных масс кардиомиоцитов толщиной 50-300 мкм; таким образом, было обнаружено, что вне живого организма может быть получен так называемый "пласт клеток", имеющий большую толщину, чем максимальная толщина, известная из уровня техники. Таким образом, понятно, что в реальных способах применения желательное количество клеточных масс очищенных кардиомиоцитов желательного размера, полученных из эмбриональных стволовых клеток, может использоваться для получения пласта клеток желаемого размера.
Следовательно, следующим вариантом осуществления настоящего изобретения является способ получения пласта клеточных масс кардиомиоцитов (пласта клеток), причем способ отличается тем, что клеточные массы очищенных кардиомиоцитов, полученных из эмбриональных стволовых клеток, подвергаются суспензионному культивированию, поскольку они помещаются с небольшими интервалами в один и тот же планшет, и отличается тем, что суспензионную культуру поддерживают до тех пор, пока клеточные массы не конъюгируют вместе с получением желаемой толщины, которая находится в интервале 50-300 мкм.
Авторы настоящего изобретения обнаружили, что клеточные массы очищенных кардиомиоцитов, полученных из эмбриональной стволовой клетки, имеющей свойства, описанные выше, могут быть трансплантированы в сердечную ткань так, чтобы они приживлялись. Эти клеточные массы могут использоваться в качестве медицинского устройства для трансплантации, которой может быть трансплантация в организм животных, включая организм человека.
Следовательно, в другом варианте осуществления настоящее изобретение относится к медицинскому устройству, содержащему клеточные массы кардиомиоцитов, полученных из эмбриональной стволовой клетки, которая была получена способом, который включает получение клеточных масс агрегированных клеток, которые содержат кардиомиоциты, дифференцированные и индуцированные из эмбриональных стволовых клеток, диспергирование клеточных масс до отдельных клеток с получением, таким образом, очищенных кардиомиоцитов, полученных из эмбриональной стволовой клетки, и культивирование кардиомиоцитов в культуральной среде в условиях отсутствия сыворотки так, чтобы они повторно агрегировали. Такое медицинское устройство предназначено для применения в трансплантации, когда это средство трансплантируется в сердечную ткань индивидуума, и при этом приживляется; демонстрирует значительный эффект в приживлении и может использоваться у пациента, нуждающегося в трансплантации сердечной ткани.
Таким образом, авторы настоящего изобретения провели интенсивные исследования условий культивирования, которые могут значительно повысить степени выживаемости кардиомиоцитов, полученных из эмбриональных стволовых клеток, которые были диспергированы до отдельных клеток (отдельных клеток) для их полной очистки; в результате было обнаружено, что кардиомиоциты обладают новыми характеристиками, заключающимися в агрегации с образованием клеточных масс при культивировании в культуральной среде при условии, когда среда не содержит сыворотки животного происхождения (т.e. в условиях отсутствия сыворотки), предпочтительно в культуральной среде, содержащей инсулин, более предпочтительно в культуральной среде, содержащей трансферрин, селен и/или основной фактор роста фибробластов, кроме инсулина. Авторы настоящего изобретения трансплантировали эти клетки в сердечную ткань индивидуума (живого организма) и получили новые данные о том, что степень приживления этих клеток в ткани была значительно повышена. Авторы настоящего изобретения получили другие данные о том, что, используя эти клетки, можно получить пласт клеточных масс кардиомиоцитов большей толщины, чем толщина, ожидаемая в результате использования известного способа, а также можно получить медицинское устройство, содержащее эти клеточные массы; эти данные привели в результате к созданию настоящего изобретения.
Эти данные были получены путем культивирования эмбриональных стволовых клеток, и аналогичные данные также могут быть получены при использовании других плюрипотентных стволовых клеток вместо эмбриональных стволовых клеток. Более подробно, когда плюрипотентные стволовые клетки, которые для их полной очистки были диспергированы до состояния суспензии отдельных клеток (индивидуальных клеток), культивировали в культуральной среде при условии отсутствия в среде сыворотки животного происхождения (т.e. в условиях отсутствия сыворотки), предпочтительно в культуральной среде, содержащей инсулин, более предпочтительно в культуральной среде, содержащей трансферрин, селен, и/или основной фактор роста фибробластов дополнительно к инсулину, эти клетки были способны агрегировать с образованием клеточных масс, и степень выживаемости кардиомиоцитов могла значительно повышаться. Плюрипотентные стволовые клетки, которые могут быть использованы, включают не только эмбриональные стволовые к