Растительная клеточная линия, полученная из камбия травянистого растения с запасающим корнем, и способ ее выделения
Иллюстрации
Показать всеИзобретение относится к области биохимии. Способ выделения гомогенной камбиальной клеточной линии предусматривает: получение ткани запасающего корня, обработку ткани осмотическим стрессом, снятие осмотического стресса, индукцию пролиферации камбиальной клеточной линии путем культивирования полученной камбий-содержащей ткани корня в среде индукции, включающей специфический гормон деления клеток камбия и сбор индуцированной камбиальной клеточной линии. Представлена гомогенная камбиальная клеточная линия, полученная описанным способом из камбия травянистого растения с запасающим корнем и/или камбия корня женьшеня. Раскрыта композиция, содержащая полученную гомогенную камбиальную клеточную линию для ингибирования экспрессии УФ-индуцированной матриксной металлопротеиназы в клетках человека. Представлен способ получения антиоксиданта, включающий: культивирование полученной гомогенной камбиальной клеточной линии, отделение клеток от среды, а также получение экстракта клеток или извлечение среды, в которой растили клетки. Изобретение позволяет получить гомогенную камбиальную клеточную линию, с помощью которой можно получать большие количества полезных растений, которые сложно культивировать на открытом воздухе. 5 н. и 22 з.п. ф-лы, 11 ил., 14 табл., 5 пр.
Реферат
Область техники
Настоящее изобретение относится к клеточной линии, полученной из камбия травянистого растения с запасающим корнем, и к способу ее выделения, а более конкретно изобретение относится к способной делиться камбиальной гомогенной клеточной линии, выделение которой из камбий-содержащей ткани травянистого растения с запасающим корнем не связано с применением отдельного процесса дедифференцировки, и к способу выделения этой линии.
Уровень техники
Panax Ginseng CA. Meyer содержит большое количество полезных веществ, таких как гинзенозиды, соединения полиацетиленов, соединения полифенолов, полисахаридосодержащие белки с иммунозащитными функциями, полисахариды с антикомплементарной активностью и кислые полисахариды. Однако его культивация связана с проблемами такими, как загрязнение пестицидами, разрушение окружающей среды и т.п. Кроме того, это очень дорого, т.к. для использования корня в медицинских целях растение необходимо культивировать, по меньшей мере, в течение 4 лет, что, следовательно, связано с большими издержками и с использованием большого количества людских ресурсов.
По этой причине проводятся исследования с применением биоинженерных подходов для получения большого количества клеток женьшеня in vitro или для получения в больших количествах его придаточных корней, волосатых корней и т.п. Сообщалось, что скорость роста клеточной массы (которая называется каллюс), полученной культивацией клеток женьшеня in vitro, с помощью культуральных подходов, выше, чем у растений женьшеня, выращиваемых в полях (Korean Patent Registration 10-0333559), и что содержание сапонина в культивируемых клетках женьшеня не намного ниже, чем в корнях женьшеня (Asaka et al., Plant Med, 59:345, 1993).
Соответственно, полученный культивацией придаточных корней женьшеня материал (женьшень, или настоящий дикий женьшень - Korea Forest Service, CBN Biotech, Neobio, KT&G Research Institute, Microplants Bioscience & Biotechnology, и пр.) или клетки женьшеня (Nitto Denko, Japan, и пр.) используются в качестве сырья при производстве продуктов питания и косметики (Korean Patent Registration 10-0601903, Korean Patent Registration 10-0637342, Korean Patent Registration 10-2004-0014584). По причине редкости и дороговизны настоящего дикого женьшеня, в различных компаниях и исследовательских центрах активно проводятся исследования, сфокусированные на культивации придаточных корней и саженцев женьшеня для получения в больших количествах женьшеньсодержащих продуктов (Korean Patent Registration 10-2005-0078372).
При получении культуры травянистых растений, таких как женьшень, настоящий дикий женьшень и т.п., тканью, используемой в качестве материала для выведения культуры, является корень, а именно запасающий корень. Ткань запасающего корня является частью <растения>, которая, будучи погруженной в почву в течение продолжительного периода времени, формирует различные взаимодействия с почвенными микроорганизмами, вбирает воду и неорганические питательные вещества в почве в течение жизни <растения>. Для того чтобы использовать ткань запасающего корня для получения культуры растительных клеток или для получения культуры ткани, необходима стерилизация ткани. Однако сообщается о множестве проблем, связанных с удалением поверхностной стерилизацией микроорганизмов с ткани корня, т.к. высокая концентрация стерилизующего раствора разрушает ткань, а низкая концентрация стерилизующего раствора приводит к контаминации препарата ткани различными грибами и бактериями. Феномен контаминации становится серьезной проблемой, особенно в случае культивируемого дикого женьшеня и настоящего дикого женьшеня, которые выращиваются в почве в течение длительного периода времени (Korean Patent Registration 10-0478213; Teng, W.L. и др., Plant Cell Tissue Organ Cult., 68:233, 2002).
Кроме того, для получения большого количества клеток из запасающего корня женьшеня, так же как и из запасающих тканей других растений, в любом из известных в настоящее время способов необходимо подвергнуть ткань запасающего корня женьшеня (дифференцированной ткани) процессу дедифференцировки в недифференцированную ткань. При этом процессе неизбежна сомаклональная изменчивость. Другими словами, для того чтобы производить клетки женьшеня в больших количествах с помощью культуры растительной ткани, в целях уменьшения сомаклональной изменчивости в качестве исходного материала необходимо использовать генетически стабильные образцы. В Korean Patent Registration 10-2005-0078372 сообщалось, что сомаклональная изменчивость происходит при использовании любой ткани женьшеня.
Между тем камбий является тканью, которая утолщает ствол и корень, помогая растению увеличиваться в объеме. Ранее сообщалось, что быстрое и массовое получение клеток возможно при использовании камбия, меристемы, в которой происходит наиболее активное деление клеток, в качестве эксплантата для получения культуры растительных клеток (Korean Patent Registration 10-0533120). Исследования структуры и ультраструктуры камбия продвигаются медленно из-за технических сложностей при использовании материала для исследований. Ранее сообщалось, что камбий легко разрушается при выделении, т.к. состоит из нескольких узких, удлиненных и тонкостенных клеточных слоев. Также ранее сообщалось, что сильно вакуолизированные, активные меристемные клетки сложно фиксировать как традиционными способами, используемыми в электронной микроскопии, так и недавно разработанными способами для изучения локализации белков, РНК и других молекул in situ (Lachaud Suzanne et al., Life Science, 633, 1999).
Кроме того, механическое изготовление срезов сплошного камбия не получило широкого распространения, что, как полагают, происходит из-за технических трудностей, связанных с выделением длинных и тонкостенных клеток камбия. Во многих работах форма, размер и расположение клеток камбия характеризовались косвенно, на основе структуры производных камбия, исходя из предположения, что структура вторичной сосудистой ткани отражает структуру камбия (Kitin, P. et al., Ann. Bot, 86:1109, 2000). Другими словами, некоторые исследования подтверждают факты существования множества трудностей, возникающих при использовании камбия непосредственно в качестве материала для исследований в различных областях.
Korean Patent Registration 10-0533120, в разработке которой приняли участие некоторые из авторов настоящего изобретения, раскрывает способ индуцирования каллюса с помощью камбия, полученного из стебля растения. Этот зарегистрированный патент относится к способу культивации растительных клеток для быстрого получения их в больших количествах и упоминает способ культивирования растительных клеток для индукции каллюса с помощью камбия, полученного из стебля растения, а не с помощью общепринятого способа культивации семян. Зарегистрированный патент предлагает способ индукции клеток камбия с помощью камбия из стебля древесного растения с добавлением высоких концентраций ауксина пиклорама и гиббереллиновой кислоты, но в этом зарегистрированном патенте каллюс индуцируется лишь из камбия стебля древесного растения. Т.к. каллюс является тканью, сформированной путем дедифференцировки, то и в случае этого зарегистрированного патента проблема изменчивости, вызванная дедифференцировкой, остается нерешенной.
Кроме того, некоторые из авторов настоящего изобретения работали над разработкой изобретения PCT/KR 2006/001544, которое решает вызванную дедифференцировкой проблему изменчивости, и относится к способу получения стабильно пролиферирующих клеточных линий с высокой генетической стабильностью. В способе, раскрытом в заявке РСТ, используется камбий стебля древесного растения, но, по причине морфологических и физиологических различий травянистых (таких, как женьшень) и древесных растений, появилась необходимость разработать более совершенное изобретение, в котором учтены особенности травянистых растений, необходимые для индукции клеточных линий из камбия ткани запасающего корня травянистого растения.
Соответственно, авторы настоящего изобретения затратили максимум усилий для получения растительной клеточной линии, которая, с одной стороны, являясь гомогенной клеточной линией и обладая способностью к делению, с другой стороны, не претерпела дедифференцировки и, таким образом, не подверглась сомаклональной изменчивости в процессе культивирования. В итоге, авторы настоящего изобретения выделили из камбия клеточную линию путем применения осмотического стресса к камбий-содержащей ткани запасающего корня с последующей культивацией ткани запасающего корня в специфической гормон-содержащей среде для растений и обнаружили, что выделенная клеточная линия гомогенна, способна неограниченно делиться, была изолирована без дедифференцировки, следовательно, не подверглась сомаклональной изменчивости и обладает, таким образом, высокой генетической стабильностью и физиологической однородностью, что делает настоящее изобретение целостным.
Сущность изобретения
Задача настоящего изобретения заключается в предоставлении полученной из камбия запасающего корня травянистого растения клеточной линии, способной делиться, гомогенной, способной стабильно пролиферировать в процессе культивирования.
Следующая задача настоящего изобретения заключается в предоставлении способа выделения упомянутой клеточной линии без применения процесса дедифференцировки.
Для достижения вышеуказанных задач в одном аспекте настоящее изобретение предоставляет способ для выделения клеточной линии, полученной из камбия травянистого растения с запасающим корнем, состоящий из следующих этапов:
(а) получение ткани запасающего корня, содержащей камбий травянистого растения с запасающим корнем;
(б) индукция камбиальной клеточной линии путем культивации полученной камбий-содержащей ткани запасающего корня в среде, содержащей IAA (индолил-3-уксусную кислоту) или IBA (индолил-3-масляную кислоту), в процессе которой к камбий-содержащей ткани запасающего корня прилагается осмотический стресс в течение, до или после культивирования; и
(в) сбор индуцированной камбиальной клеточной линии.
В другом аспекте настоящее изобретение предоставляет клеточную линию, полученную из камбия травянистого растения с запасающим корнем и обладающую следующими характеристиками:
(а) клеточная линия находится в естественно недифференцированном состоянии;
(б) клеточная линия является гомогенной и
(в) клеточная линия морфологически характеризуется многочисленными вакуолями.
В еще одной задаче настоящее изобретение предоставляет способ для сохранения клеточной линии травянистого растения, содержащий этап замораживания клеточной линии, полученной из камбия травянистого растения с запасающим корнем.
Другие особенности и аспекты настоящего изобретения будут видны из последующего детального описания и приложенной формулы изобретения.
Краткое описание чертежей
На фиг.1 представлено изображение типичного культивируемого в открытом грунте женьшеня, использованного в настоящем изобретении.
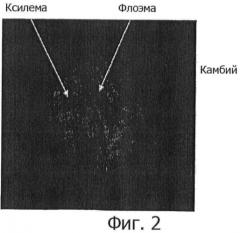
На фиг.2 представлено изображение приготовленного эксплантата, содержащего камбий запасающего корня женьшеня среди растительных запасающих тканей.
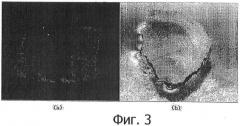
На фиг.3(a) продемонстрирована обладающая способностью к делению гомогенная клеточная линия, которая была специфично индуцирована в эксплантате, содержащем камбий корня женьшеня, а на фиг.3(b) показано, что при использовании общей системы культивирования клетки индуцировались по всему сечению эксплантата.
На фиг.4(a) перед выделением из среды представлена клеточная линия, полученная из камбия корней женьшеня, который индуцировали, выделяли и наращивали в питательной среде; на фиг.4(b) представлена полученная из камбия клеточная линия, которую выделили и нарастили в большом количестве; на фиг.4(c) представлено оптическое микроизображение полученной из камбия клеточной линии на одноклеточном уровне; и на фиг.4(d) представлено оптическое микроизображение полученного из семядоли женьшеня каллюса на одноклеточном уровне (КСТС 10224).
На фиг.5(a) представлено изображение гомогенной клеточной линии, обладающей способностью к делению, которую специфично индуцировали в камбий-содержащем эксплантате настоящего дикого женьшеня, на фиг.5(b) представлено изображение полученной из камбия клеточной линии, которую выделили и нарастили в больших количествах, и на фиг.5(c) представлена оптическая микрофотография полученной из камбия клеточной линии на одноклеточном уровне.
На фиг.6 представлено изображение гомогенной клеточной линии, полученной из индуцированного камбия камбий-содержащего эксплантата корня моркови.
На фиг.7 показаны кривые роста клеточной линии, полученной из камбия женьшеня (A) и клеточной линии, полученной из семядоли женьшеня (B) за соответствующий культуральный период.
На фиг.8(a) представлено микроскопическое изображение, демонстрирующее одноклеточную популяцию клеточной линии, полученной из камбия женьшеня, а на фиг.8(b) представлено микроскопическое изображение находящейся в виде больших клеточных агрегатов популяции гетерогенной клеточной линии, полученной из семядоли женьшеня.
На фиг.9 представлены фотографии культуры клеточной линии, полученной из камбия настоящего дикого женьшеня: в культуральной колбе (фиг.9(a)), в 3-литровом биореакторе (фиг.9(b)) и в 20-литровом биореакторе (фиг.9(c)).
На фиг.10 представлена диаграмма, демонстрирующая, как ингибируется экспрессия ММР-1, обычно возрастающая в ответ на облучение ультрафиолетовыми лучами (УФВ), в нормальных человеческих кожных фибробластах (NHF), обработанных перед облучением УФВ различными концентрациями экстракта гомогенной клеточной линии, полученной из камбия настоящего дикого женьшеня, или различными концентрациями ее культуры. Обозначения фиг.10: сырая биомасса клеток женьшеня, сухая биомасса клеток женьшеня, среда для культивирования клеток женьшеня, Е1: стадия элиситации 1; Е2: стадия элиситации 2; G - стадия роста и RA: ретиноевая кислота.
На фиг.11 представлена графическая диаграмма, демонстрирующая как ингибируется активный кислород, обычно возрастающий в ответ на облучение ультрафиолетовыми лучами (УФВ), экстрактом гомогенной клеточной культуры, полученной из камбия истинно дикого женьшеня или его культуры, в нормальных человеческих фибробластах кожи (NHF), обработанных перед облучением УФВ различными концентрациями экстракта гомогенной клеточной линии, полученной из камбия настоящего дикого женьшеня, или различными концентрациями ее культуральной среды. Обозначения фиг.11: сырая биомасса клеток женьшеня, сухая биомасса клеток женьшеня, среда для культивирования клеток женьшеня, Е1: стадия элиситации 1; Е2: стадия элиситации 2; G - стадия роста.
Подробное описание изобретения и предпочтительных вариантов воплощения
Если иное не определено, то все использованные здесь технические и научные термины имеют тот же смысл, который вкладывается в них обычным специалистом в данной области. Как правило, определения используемых здесь различных терминов хорошо известны и традиционно используются в данной области.
В одном аспекте настоящее изобретение относится к способу для выделения клеточной линии из камбия травянистого растения с запасающим корнем.
Для формирования каллюса, при использовании листьев, стеблей и корней, уже являющихся дифференцированными тканями, необходимо подвергнуть их процессу дедифференцировки, при котором дифференцированная ткань превращается в недифференцированную. В процессе дедифференцировки происходит сомаклональная изменчивость, ведущая к клеточной нестабильности.
Поэтому авторы настоящего изобретения провели исследования на системе растительных клеток либо с небольшой сомаклональной изменчивостью, либо вообще без нее. В результате настоящие исследователи обнаружили, что при индукции клеточной линии только из являющегося меристемой камбия отпадает необходимость проведения дедифференцировки, т.к. меристема сама по себе способна активно делиться, что приводит к отсутствию сомаклональной изменчивости, и, таким образом, в камбии может быть индуцирована высокостабильная генетически и физиологически однородная гомогенная клеточная линия. На основании этих данных авторы настоящего изобретения выделили из камбия клеточную линию. Способ выделения по настоящему изобретению состоит из следующих этапов: (а) получение ткани содержащих камбий запасающих корней травянистого растения; (б) индукция камбиальной клеточной линии путем культивации полученной камбий-содержащей ткани запасающего корня в среде, содержащей IAA (индолил-3-уксусную кислоту) или IBA (индолил-3-масляную кислоту), в процессе которой к камбий-содержащей ткани запасающего корня прилагается осмотический стресс в течение, до или после культивирования; и (в) сбор индуцированной камбиальной клеточной линии.
На этапе (б) предложенного способа применение осмотического стресса проводится в целях индукции клеточной линии именно в камбии. Предпочтительно, чтобы стресс применялся перед культивацией ткани в среде, содержащей IAA или IBA, так чтобы основные ткани (т.е. первичная кора, флоэма, ксилема и паренхима), за исключением камбия, потеряли способность к делению, после чего превратились в некротическую ткань до обработки камбиальными гормонами для деления, такими как IAA или IBA.
Предпочтительно, если этап (в) проводится наращиванием индуцированной камбиальной клеточной линии в среде, содержащей одно или более из перечисленных соединений: 2,4-D (2,4-дихлорфеноксиуксусная кислота), picloram и IBA, с последующим сбором камбиальной клеточной линии.
Далее способ по настоящему изобретению будет описан подробно.
(1) Стерилизация и обработка осмотическим стрессом.
Во-первых, готовят содержащую камбий ткань запасающего корня травянистого растения и затем подвергают ее стерилизации. При этом стерилизацию осуществляют в два этапа. Затем стерильную камбий-содержащую ткань запасающего корня подвергают обработке осмотическим стрессом таким образом, чтобы в экстремальных условиях основные ткани (т.е. первичная кора, флоэма, ксилема и паренхима), за исключением камбия, потеряли способность к делению и превратились в некротическую ткань до обработки камбиальными гормонами деления, такими как IAA или IBA, и способная делиться гомогенная клеточная линия специфически индуцировалась только в камбии. Здесь в качестве неограничивающих примеров осмотических агентов рассматриваются сахара, такие как сахароза, сахарные спирты, такие как сорбитол, и соли, такие как хлорид натрия.
Здесь, предпочтительно, если осмотический агент используется в концентрации 0,5-2 М, а осмотический стресс применяется на холоде или при комнатной температуре в течение 16-24 часов, после чего вызывающий его агент удаляется. Однако сфера данного изобретения не ограничивается указанным выше, т.к. концентрация, время обработки и температура осмотического агента могут различаться в зависимости от типа растения и состояния ткани.
При этом настоящее изобретения отличается тем, что после обработки осмотическим стрессом проводятся этапы устранения осмотического стресса и адаптации клеток к индуцирующей среде. В целях освобождения от осмотического стресса концентрация осмотического агента резко уменьшается до, например, 0,03-0,05 М и затем применяется к эксплантату. Здесь время обработки предпочтительно составляет 1-15 минут. Также, если эксплантат продолжительно экспонируется при вышеописанной низкой концентрации осмотического агента и низкая концентрация осмотического агента отличается от его концентрации в среде, индуцирующей камбиальную клеточную линию, то это различие может также действовать как осмотический стресс в процессе культивирования. По этой причине желательно в дальнейшем проводить этап адаптации эксплантатов к индукционной среде. Этап адаптации эксплантата к индукционной среде проводят обработкой эксплантата, после снятия осмотического стресса, осмотическим агентом в концентрации подобной концентрации индуцирующей среды. При этом эксплантат предпочтительно обрабатывают осмотическим агентом в концентрации 0,08-0,1 М в течение 1-15 минут.
В одном примере настоящего изобретения обработанную осмотическим стрессом группу сравнивали с контрольной группой, которую не обрабатывали осмотическим стрессом. При этом в контрольной, не обработанной осмотическим стрессом, группе не была выявлена индукция камбиальной клеточной линии, что подтверждает факт того, что этап обработки осмотическим стрессом является необходимым для индукции клеточной линии из камбия травянистого растения с запасающим корнем.
(2) Индукция клеточной линии из камбия травянистого растения с запасающим корнем.
После обработки осмотическим стрессом, в целях индукции клеточной линии из камбия травянистого растения, подвергшуюся осмотическому стрессу ткань помещают в культуральную среду, содержащую IAA и IBA, так чтобы для получения камбиальной клеточной линии клеточное деление специфично индуцировалось только в камбии. Предпочтительно, если содержащие камбий эксплантаты размещаются в среде, содержащей 0,5-3,0 мг/л IAA или IBA.
Если IAA добавляют в среду для индукции клеточной линии, то происходит объединение с содержащейся в растениях эндогенной IAA, что дает синергидный эффект на камбиальную активность. В результате синергидного эффекта гомогенная клеточная линия специфично индуцируется только в камбии, из-за разницы в активности клеточного деления между дифференцированной тканью и меристемой, которой является камбий. Между тем, ранее сообщалось, что IAA является первичным естественным ауксином, в то время как IBA является вторичным естественным ауксином (Andrew et al., Ann. Bot, 95:707, 2005).
В одном примере настоящего изобретения после обработки осмотическим стрессом эксплантат обрабатывали другими растительными гормонами-ауксинами, такими как пиклорам, 2,4-D, CPA и NAA. Однако было показано, что только IAA и IBA эффективны при индукции клеточной линии из камбия травянистого растения с корнем хранения.
(3) Пролиферация клеточной линии, полученной из камбия травянистого растения с корнем хранения.
Камбиальная гомогенная клеточная линия, индуцированная, как описано выше, может быть перенесена в оптимальную питательную среду, содержащую регулятор роста растений ауксин для наращивания гомогенной клеточной линии в больших количествах. При этом в качестве регуляторов роста предпочтительно используют отдельно или вместе 2,4-D (2,4-дихлорфеноксиуксусную кислоту), picloram и IBA. Любое из перечисленных, 2,4-D, picloram и IBA, предпочтительно используют в количестве 1-5 мг/л, а более предпочтительно - 2 мг/л.
Среда, используемая в настоящем изобретении, является обычной средой для культивирования растительной ткани, и примеры ее могут включать, не ограничиваясь перечисленным, среду N6, среду SH, среду MS, среду АА, среду LS, среду В5, среду WPM, среду LP, среду White, среду GD, среду DKW, среду DCR и т.д.
В другом аспекте настоящее изобретение относится к клеточной линии, полученной из камбия травянистого растения с запасающим корнем и обладающей следующими характеристиками:
(а) клеточная линия находится в естественно недифференцированном состоянии;
(б) клеточная линия является гомогенной и
(в) клеточная линия морфологически характеризуется многочисленными вакуолями.
Камбиальная клеточная линия по настоящему изобретению дополнительно характеризуется тем, что: (а) в суспензионной культуре находится в одноклеточном состоянии; (б) имеет слабую чувствительность к механическому стрессу в биореакторе по сравнению с клеточными линиями, полученными из тканей, отличных от камбия травянистого растения с запасающим корнем; и (в) обладает высокой скоростью роста и стабильно культивируется по сравнению с клеточными линиями, полученными из тканей, отличных от камбия травянистого растения с запасающим корнем.
В одном примере настоящего изобретения видно, что камбиальную клеточную линию по настоящему изобретению, можно культивировать в больших масштабах не только в 3-литровом биореакторе, но даже и в 20-литровом биореакторе. Также было отмечено, что камбиальная клеточная линия по настоящему изобретению обладает в 5-9 раз более низкой чувствительностью к механическому стрессу по сравнению с клеточными линиями, полученными из отличных от камбия тканей, и имеет в 3-5 раз более высокую скорость роста по сравнению с клеточными линиями, полученными из отличных от камбия тканей. При этом при культивировании камбиальной клеточной линии в течение 11 месяцев или более было показано, что ее скорость роста отличается максимум в 400 раз от скорости роста клеточных линий, полученных из отличных от камбия тканей.
В другом примере настоящего изобретения было показано, что экстракт клеточной линии и культуральная среда по настоящему изобретению обладают эффектом ингибирования экспрессии ММР-1 (деградирующей коллаген кожи и формирующей морщины на коже), таким образом наводя на мысль о том, что экстракт и среда обладают эффектами предотвращения образования и уменьшения морщин. В еще одном примере настоящего изобретения был подтвержден факт того, что экстракт клеточной линии и культуральная среда ингибируют индуцированный УФ-излучением активный кислород, наводя на мысль о том, что они обладают антиоксидантным эффектом.
В еще одной задаче настоящее изобретение относится к способу сохранения клеточной линии травянистого растения, содержащему этап замораживания клеточной линии, полученной из камбия травянистого растения с запасающим корнем.
В одном примере настоящего изобретения испытания по криоконсервации проводили для клеточной линии, полученной из семядоли женьшеня, и для гомогенной клеточной линии, полученной из камбия женьшеня. В результате было показано, что клеточная линия, полученная из семядоли женьшеня, не восстанавливается после разморозки, в то время как гомогенная клеточная линия, полученная из камбия женьшеня, после разморозки восстанавливается и начинает пролиферировать.
Возможность криоконсервации клеточных линий делает возможным стабильное снабжение сырьем и создание значительного банка клеточных линий. Таким образом, патентоспособная клеточная линия, полученная из камбия травянистого растения с запасающим корнем, позволяет продолжительное и стабильное снабжение клеточной линией травянистого растения.
Мир сейчас находится в состоянии войны за обеспечение безопасности исследовательских материалов (биологических ресурсов), а также за сохранение и идентификацию ставших важной государственной собственностью биологических ресурсов, таких как ткани человека, семена растений, микроорганизмы, клетки и гены, для разработки различных новых лекарственных средств и для улучшения качества пищи. Соответственно, поскольку обеспечение безопасности исследовательских материалов ведет к повышению национальной конкурентоспособности, необходимо создавать банки клеточных линий для развития, сбора, сохранения и распространения клеточных линий, используемых в качестве незаменимых материалов в исследованиях в области бионаук. Таким образом, после создания таких банков растительных клеток, снабжение исследовательскими материалами становится простым, а время исследований с использованием растительных клеточных линий сокращается.
Настоящее изобретение отличается использованием камбия запасающего корня и применимо ко всем видам травянистых растений с основными запасающими корнями. Другими словами, хотя в одном примере настоящего изобретения клеточные линии изолировали из камбия запасающего корня женьшеня, из камбия запасающего корня настоящего дикого женьшеня и из камбия запасающего корня моркови, специалисту в данной области будет очевидно, что способ настоящего изобретения может быть применен к любому травянистому растению, в том случае если травянистое растение обладает запасающим корнем. Примеры травянистых растений с запасающими корнями включают в том числе Codonopsis lanceolata, Ostericum koreanum KITAGAWA, Platycodon grandiflorum, Pueraria thunbergiaana, Aralia contonentalis Kitagawa, Ledebouriella seseloides, Angelica gigas NAKAI, морковь, сладкий картофель, мака, маниоку, женьшень, настоящий дикий женьшень, женьшень, культивируемый в открытом грунте, и т.д. Также под патентоспособной камбий-содержащей запасающей тканью травянистого растения с запасающим корнем подразумевается не только ткань запасающего корня грунтового растения, но и культуры тканей (придаточные корни и клеточные линии, полученные из придаточного корня).
Сведения, подтверждающие возможность осуществления изобретения
Далее по тексту настоящее изобретение будет описано более подробно с отсылкой на примеры. Для специалиста в данной области будет очевидно, что эти примеры приведены исключительно для иллюстративных целей и не должны трактоваться с ограничением сферы применения настоящего изобретения, т.к. эти примеры могут модифицироваться в другие различные формы.
Пример 1. Выделение клеточной линии, полученной из камбия травянистого растения с запасающим корнем: (I) - женьшень
1-1: Подготовка растительного материала
На фиг.1 представлено изображение типичного культивируемого в открытом грунте женьшеня, использованного в настоящем изобретении. Как видно по фиг.1, отобрали и собрали только гладкий и неповрежденный женьшень. Собранный женьшень отмыли в проточной воде для удаления с внешней поверхности женьшеня почвы и других загрязнителей. Затем тонкие корни женьшеня удаляли, чтобы оставить только главный корень и поверхность главного корня отмывали с помощью жидкого детергента и затем главный корень оставляли в проточной воде. Отмытую ткань помещали в ламинаре в стерильный флакон и стерилизовали 70% этанолом в течение от 30 секунд до 1 минуты. Затем ткань промывали стерильной дистиллированной водой и дезинфицировали в 1-1,5% растворе гипохлорита натрия (Junsei, Япония) в течение 5-8 минут. Затем дезинфицирующий раствор удаляли и ткань промывали один или несколько раз стерильной дистиллированной водой и затем вторично обрабатывали дезинфицирующим раствором в течение около 5-8 минут. При этом для проникновения дезинфицирующего раствора в ткань к дезинфицирующему раствору добавляли несколько капель TWEEN 20 (Полиоксиэтиленсорбитан монолаурат, Junsei, Япония), после чего обработанную ткань промывали 3-5 раз стерильной дистиллированной водой. Затем, в целях предотвращения потемнения стерилизованной ткани, стерилизованный основной корень помещали в содержащую антиоксиданты среду для ингибирования потемнения (BIM) и инкубировали со встряхиванием в течение от около 30 мин до 1 часа. Затем удаляли из ткани влагу с помощью стерилизованной фильтровальной бумаги.
| Таблица 1 | |
| Состав и концентрация среды для ингибирования потемнения (BIM) (соли добавляли в количестве, соответствующем 1/4 суммарной концентрации) | |
| Компонент | Концентрация |
| соль McCown WPM | 1/4 суммарной |
| Сахароза | 1% (в/о) |
| Поливинилпирролидон | 0,5% (в/о) |
| Аскорбиновая кислота | 100 мг/л |
| Лимонная кислота | 150 мг/л |
| pH до 5,8 |
Затем, в целях предотвращения потемнения материала, основной корень помещали в стерильную чашку, содержащую CS-раствор (cutting solution) с антиоксидантом, представленный в таблице 2 ниже, после чего основной корень тонко очищали и разрезали на две части. Заготовки нарезались тонкими слоями размером 0,5-0,7 см (ширина)×0,5-0,7 см (длина)×0,2-0,5 мм (высота), так чтобы в заготовки попадал способный активно делиться камбий. На фиг.2 показан содержащий камбий эксплантат, подготовленный нарезанием запасающего корня женьшеня в заданных выше размерах.
| Таблица 2 | |
| CS-раствор (cutting solution) | |
| Компонент | Концентрация |
| Поливинилпирролидон | 0,5% (в/о) |
| Аскорбиновая кислота | 100 мг/л |
| Лимонная кислота | 150 мг/л |
1-2: Обработка содержащего камбий эксплантата основного корня женьшеня с помощью осмотического агента
Подготовленный в примере 1-1 эксплантат подвергали осмотическому стрессу в целях некротизации дифференцированных тканей (флоэмы, ксилемы, паренхимы и т.д.) для исключительной индукции камбия (меристемы). Содержащий камбий эксплантат промокали в преинокуляционной среде (среда 1), размещали затем на фильтровальной бумаге и помещали во флакон, содержащий 1 М раствор сахарозы (Duchefa, Нидерланды), после чего подвергали осмотическому стрессу на холоде в течение 16-24 часов. Затем эксплантат обрабатывали 0,05 М раствором сахарозы в течение 5 минут и 0,1 М раствором сахарозы в течение 5 минут для снятия стресса, вызванного сильноконцентрированной сахарозой. Содержащий камбий эксплантат после осмотического стресса помещали в преинокуляционную среду (среда 1), после чего промокали фильтровальной бумагой для удаления влаги.
| Прекультуральная среда (среда 1) | |||
| Состав | мМ | мг/л | |
| Макроэлементы | Ca(NO3)2 | 2,35 | 471,26 |
| NH4NO3 | 5,00 | 400,00 | |
| MgSO4·7H2O | 1,50 | 180,54 | |
| K2SO4 | 5,68 | 990,00 | |
| CaCl2·2H2O | 0,65 | 72,50 | |
| KH2PO4 | 1,25 | 170,00 | |
| Состав | мкМ | мг/л | |
| Микроэлементы | MnSO4·4H2O | 131,94 | 22,3 |
| ZnSO4·7H2O | 29,91 | 8,60 | |
| Na2MoO4·2H2O | 1,03 | 0,25 | |
| H2BO3 | 100,27 | 6,20 | |
| CuSO4·5H2O | 1,00 | 0,25 | |
| FeNa-EDTA | 100,00 | 36,70 | |
| Витамины | Глицин | 26,64 | 2,00 |
| мио-инозитол | 554,94 | 100,00 | |
| Никотиновая кислота | 4,06 | 0,50 | |
| Пиридоксин-HCl | 2,43 | 0,50 | |
| Тиамин-HCl | 2,96 | 1,00 |
1-3: Индукция камбиальной гомогенной клеточной линии в камбий-содержащем эксплантате основного корня женьшеня
Для того чтобы индуцировать камбиальную гомогенную клеточную линию, обладающую способностью к делению, подвергнутый осмотическому стрессу в примере 1-2 эксплантат перенесли в среду для индукции клеточной линии (среда 2). Композиция использованной среды представлена в таблице 4 ниже. Перенесенный эксплантат культивировали в темноте при температуре 22±1°С.
| Таблица 4 | |
| Состав среды для индукции камбиальной гомогенной клеточной линии (среда 2) | |
| Компонент | Концентрация и состояние |
| Соль | полная концентрация WPM |
| Сахароза | 3% (в/о) |
| IAA (индолил-3-уксусная кислота) | 2 мг/л |
| pH | 5,8 |
| Гелрит | 0,3% (в/о) |
| Аскорбиновая кислота | 100 мг/л |
| Лимонная кислота | 150 мг/л |
После приложения и снятия описанного выше осмотического стресса было отмечено, что в инокулированном в среду для индукции камбиальной клеточной линии (среда 2) эксплантате гомогенная клеточная линия специфично индуцировалась исключительно в камбии, в отсутствие какой-либо индукции в других тканях. Это наблюдение представлено в таблице 5 ниже. В частности, было отмечено, что, после приложения и снятия осмотического стресса в перенесенном в среду эксплантате, камбий начинал принимать светло-желтый цвет после 3-7 дней культивирования, а через 7-14 дней после начала индукции круглоклеточной линии цвет части клеток изменился на светло-желтый. На фиг 3(a) представлено изображение гомогенной клеточной линии, специфически индуцированной в камбии камбий-содержащего эксплантата корня женьшеня.
Однако, как показано в таблице 5 ниже, в эксплантатах, перенесенных в среду для индукции камбиальной клеточной линии (среда 2) без проведения этапа обработки осмотическим стрессом примера 1-2, желтая цветная реакция развивалась в камбии на начальном этапе (2-3 дня) после переноса в среду, и затем с течением времени весь эксплантат желтел. Эксплантат с желтым камбием субкультивировали в оптимальной среде для выделения и пролиферации камбиальной клеточной линии (среда 3), для того чтобы индуцировать и нарастить камбиальную клеточную линию, но потемнение стало столь серьезным, что с течением времени не наблюдалось никакой другой цветной реакции, кроме коричневой. Это говорит о том, что этап обработки осмотическим стре