Электрохимический способ определения n-ацетил- -d-глюкозаминидазы
Иллюстрации
Показать всеИзобретение относится к области биосенсорных технологий, аналитической химии и касается электрохимического определения N-ацетил-β-D-глюкозаминидазы в биологических жидкостях путем амперометрического определения фенола, выделяющегося в процессе ферментативного гидролиза 1-фенил-N-ацетил-β-D-глюкозаминида в биологических жидкостях. Способ заключается в том, что к образцу биологической жидкости, содержащему N-ацетил-β-D-глюкозаминидазу, добавляют раствор 1-фенил-N-ацетил-β-D-глюкозаминида в цитратном буфере с последующей инкубацией, отделением образующегося осадка и получением содержащей фенол пробы, которую помещают в электрохимическую ячейку, содержащую буферный раствор и электрохимический тирозиназный биосенсор, представляющий собой планарный графитовый электрод, полученный методом трафаретной печати, с последовательно нанесенными на него чередующимися адгезивным(и) слоем(ями) полидиаллилдиметиламмоний хлорида и слоем(ями) тирозиназы, в качестве рабочего электрода, и осуществляют регистрацию амперометрического сигнала, по которому рассчитывают активность N-ацетил-β-D-глюкозаминидазы на основании градуировочной зависимости по заданному уравнению. Достигается повышение чувствительности и упрощение анализа. 1 з.п. ф-лы, 5 пр., 4 ил.
Реферат
Изобретение относится к области биосенсорных технологий, аналитической химии и касается электрохимического определения N-ацетил-β-D-глюкозаминидазы в биологических жидкостях, в частности в молоке, и диагностики субклинического мастита коров.
Мастит считают основной проблемой молочного животноводства. Его определяют как воспалительную реакцию молочной железы. В молочных стадах причиной заболевания маститом являются обычно микроорганизмы, проникающие и развивающиеся в тканях вымени, преимущественно стафилококки, стрептококки, бактерии кишечной группы и других видов, микоплазмы и др.
В зависимости от характера воспалительной реакции и степени поражения тканей молочной железы заболевание протекает в клинически выраженной форме и скрыто (субклинически). Субклинический мастит требует лабораторных исследований для выявления и по разным оценкам встречается в 5-40 раз чаще, чем клинический.
Воспалительный процесс сопровождается разрушением прилегающей к очагу ткани вымени, инфильтрацией лейкоцитов в молоко, фагоцитозом и высвобождением из фагоцитов гидролитических ферментов и окисляющих веществ, увеличением проницаемости сосудов, что приводит к изменению физико-химического состава получаемого молока. Увеличивается количество соматических клеток, альбумина и иммуноглобулинов, хлоридов, повышается щелочность, плотность, бактериальная обсемененность, уменьшается содержание жира, казеина, лактозы и др. Такое молоко теряет питательную ценность и технологические свойства, необходимые для производства молочнокислых продуктов и сыров. Употребление такого молока приводит к увеличению заболеваемости и гибели новорожденных телят и возможности развития аллергических реакций и пищевых токсикозов у людей.
Для борьбы с маститом коров и минимизации ущерба, наносимого этим заболеванием, наибольший интерес представляют те методы диагностики, которые позволяют как можно раньше выявить начало заболевания до появления клинических признаков. Самыми чувствительными из применяющихся в настоящее время способов являются способы, основанные на контроле содержания в молоке соматических клеток, нуклеиновых кислот АТФ (Kitchen B.J., J. Dairy Res., 1981, 48, 167-188). Но они требуют специальной подготовки образца и не всегда могут дать однозначный ответ. Установление стандартов на количественное содержание соматических клеток поставило проблему разработки более объективных методов анализа маститного молока.
В молоке был выявлен ряд веществ белковой природы, содержание которых заметно увеличивается при воспалительном процессе в вымени. Было установлено, что при заболевании животных уровень фермента N-ацетил-β-D-глюкозаминидазы (НАГаза) в молоке повышается в несколько раз и хорошо коррелирует с числом соматических клеток. Были разработаны методы колориметрического (патент США № 5155026, 13.10.1992), флюориметрического (Kitchen B.J., Middleton, Salmon M., J.Dairy Res., 1978, 45, 15-20) и спектрофотометрического (Kitchen B.J., Middleton, J.Dairy Res., 1976, 43, 491-494) определения НАГазы.
Флюориметрический метод основан на флюориметрическом определении 4-метилумбеллиферона, являющегося продуктом гидролиза 4-метилумбеллиферил-N-ацетил-β-глюкозаминида под действием НАГазы. Однако метод требует использования громоздкого дорогостоящего оборудования, длительной подготовки образца при невысоком коэффициенте корреляции с методом подсчета соматических клеток (0,85).
Спектрофотометрический метод основан на спектрофотометрическом определении п-нитрофенола, являющегося продуктом гидролиза п-нитрофенил-N-ацетил-β-D-глюкозаминида под действием НАГазы. Метод требует использования громоздкого дорогостоящего оборудования, длительной подготовки образца при невысоком коэффициенте корреляции с методом подсчета соматических клеток (0,90).
Известен электрохимический метод определения НАГазы с использованием графитовых планарных электродов (R.M.Pemberton, L.P.Hart, T.T.Mottram, SPCEs, Analyst, 2001, 126, 1866-1871). В качестве субстрата ферментативной реакции используют 1-нафтил-N-ацетил-β-D-глюкозаминид. Метод основан на амперометрическом определении 1-нафтола, выделяющегося в процессе ферментативной реакции на поверхности планарного графитового электрода при +650 мВ относительно каломельного электрода в трехэлектродной ячейке (вспомогательным электродом является платиновый электрод).
Такой подход позволяет определять НАГазу в буферных растворах при рН 5,4 в диапазоне концентраций от 3,1 до 108 мЕд/мл (RSD=15,4%). Время анализа после добавления в ячейку субстрата составляет 100 сек. К недостаткам данного метода следует отнести высокий потенциал измерения (+650 мВ) и использование трехэлектродной ячейки, что не позволяет миниатюризировать измерительную ячейку.
Целью настоящего изобретения является разработка простого, недорогого, чувствительного способа определения НАГазы в биологических жидкостях, в частности в молоке, и разработка электрохимического биосенсора для его осуществления.
В соответствии с изобретением описывается способ электрохимического определения N-ацетил-β-D-глюкозаминидазы (НАГазы) в биологических жидкостях, в частности в молоке, путем амперометрического определения фенола, выделяющегося в процессе ферментативного гидролиза 1-фенил-N-ацетил-β-D-глюкозаминида в биологических жидкостях, заключающийся в том, что к образцу биологической жидкости, содержащему N-ацетил-β-D-глюкозаминидазу, добавляют раствор 1-фенил-N-ацетил-β-D-глюкозаминида в цитратном буфере с последующей инкубацией, отделением образующегося осадка и получением содержащей фенол пробы, которую помещают в электрохимическую ячейку, содержащую буферный раствор и электрохимический тирозиназный биосенсор в качестве рабочего электрода, и регистрируют амперометрический сигнал, по которому рассчитывают активность N-ацетил-β-D-глюкозаминидазы, из градуировочной зависимости по уравнению
ANAG=I/16.1,
где ANAG - активность НАГазы, мЕд/мл,
I - значение электрохимического сигнала, нА,
16.1 - тангенс угла наклона градуировочной зависимости электрохимического сигнала от активности НАГазы, нА*мл/мЕд.
Электрохимический тирозиназный биосенсор для определения фенола представляет собой планарный графитовый электрод, полученный методом трафаретной печати, с последовательно нанесенными на него чередующимися адгезивным(и) слоем(ями) полиэлектролита и слоем(ями) тирозинназы. В качестве полиэлектролита использовали полидиаллилдиметиламмоний хлорид.
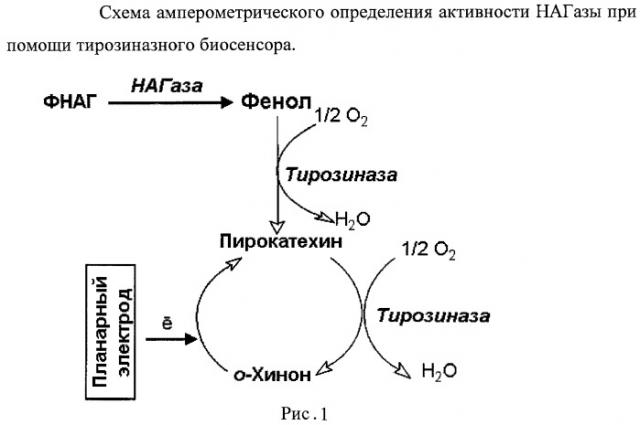
Описываемый способ определения содержания фермента - НАГазы в биологической жидкости, в частности в молоке, заключается в электрохимическом определении фенола, образующегося в результате ферментативного гидролиза 1-фенил-N-ацетил-β-D-глюкозаминида под действием присутствующего в биологической жидкости фермента - НАГазы, с помощью тирозиназного электрохимического биосенсора. При добавлении к образцу биологической жидкости, содержащей N-ацетил-β-D-глюкозаминидазу (НАГазу), раствора 1-фенил-N-ацетил-β-D-глюкозаминида в цитратном буфере и последующей инкубации происходит гидролиз 1-фенил-N-ацетил-β-D-глюкозаминида с выделением фенола, количество которого опосредованно характеризует содержание N-ацетил-β-D-глюкозаминидазы (НАГазы) в исходном образце. Количество выделяющегося фенола регистрируют амперометрически (Рис.1).
В описываемом электрохимическом тирозиназном биосенсоре включенный в полимерный композит фермент тирозиназа обеспечивает определение низких концентраций фенола и опосредованно фермента НАГазы за счет эффективного сопряжения соответствующих биокаталитических реакций и фарадеевских процессов на поверхности электрода.
Описываемый электрохимический тирозиназный биосенсор изготовляют методом послойного нанесения на поверхность графитового электрода полиэлектролитов и фермента тирозиназы. При этом формируются нанопленки полиэлектролитов, в состав которых включены молекулы тирозиназы. Тирозиназа, включенная в белок-полимерные нанопленки на поверхности планарного графитового электрода, обеспечивает специфичность и чувствительность определения фенола.
Разработанный на основе такого электрохимического биосенсора способ электрохимического определения НАГазы в биологических жидкостях, в частности в молоке, характеризуется высокой точностью, хорошей чувствительностью и экспрессивностью.
Описываемый способ обеспечивает определение НАГазы в биологической жидкости, в частности в молоке, с погрешностью менее 15% в диапазоне измеряемой активности фермента от 0.2 до 125 мЕд/мл за 25 минут.
Таким образом, очевидными преимуществами описываемого изобретения являются:
- низкий предел обнаружения НАГазы в молоке (0.1 мЕд/мл);
- низкий потенциал измерения (-150 мВ) обеспечивает возможность определения активности НАГазы в биологических жидкостях;
- простота и экспрессность метода, достигающаяся за счет использования малогабаритного и недорогого оборудования;
- возможность проведения анализа непосредственно на ферме и местах сбора молока.
Изобретение иллюстрируется следующими примерами.
Пример 1. Изготовление тирозиназного биосенсора.
Планарные электроды были изготовлены с использованием аппарата для полуавтоматической печати Winon модели WSC160B, трафаретной сетки (Mesh count = 200 нитей/см) и проводящих графитовых чернил (Gwent, Англия) на подложке из поливинилхлорида толщиной 0.2 мм. Каждый планарный графитовый электрод состоял из круглой рабочей поверхности диаметром 3 мм, проводящей полоски (30*1.5 mm2) и контактной площадки (3*7 mm2).
Перед нанесением полиэлектролитов рабочую поверхность электрода диаметром 2,5 мм ограничивали изолирующей пленкой. Далее на поверхность наносили каплю (5 мкл) полидиаллилдиметиламмоний хлорида в концентрации 5 мг/мл в 50 мМ фосфатном буфере, рН 7.0, выдерживали 50 мин, после чего 1 минуту промывали дистиллированной водой. Полученный слой поликатиона высушивали в эксикаторе над силикагелем в течение 30 мин при комнатной температуре, после чего наносили каплю раствора тирозиназы в концентрации 0,625 мг/мл (50 мМ фосфатном буфере, рН 7.0), объемом 5 мкл, выдерживали 10 мин и снова промывали водой 1 минуту. Нанесение всех компонентов проводилось в климатической камере при 25°С и относительной влажности воздуха 60%. После высушивания в течение 20 мин на открытом воздухе при комнатной температуре готовые электроды использовали для измерений.
Пример 2.
Построение градуировочного графика для определения концентрации фенола.
Электрохимические исследования проводили на потенциостате-гальваностате IPC-compact (Институт физической химии РАН, Москва, Россия). Амперометрические измерения проводили в 1 мл двухэлектродной ячейке с перемешиванием, снабженной Ag/AgCl электродом, относительно которого поддерживалась заданная разность потенциалов (-150 мВ) между электродом сравнения и рабочим электродом. В качестве рабочего электрода использовали тирозиназный биосенсор. Рабочий электрод погружали в ячейку, заполненную буферным раствором (50 мМ натрий фосфатный буфер, 0,1 М NaCl, pH 7,0). За отклик электрода принимали разницу стационарных токов до и после введения фенола.
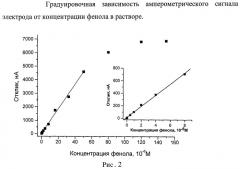
Зависимость величины аналитического сигнала от концентрации фенола была исследована в диапазоне 3.1·10-8-15·10-5 М. Из градуировочной зависимости были получены следующие аналитические характеристики: предел обнаружения по фенолу составил 1.2*10-8 М (3σ), линейный диапазон 3,1*10-8-5*10-5, чувствительность сенсора 440 мА/(М*см2) (Рис.2).
Пример 3. Электрохимическое определение активности НАГазы в растворе.
12 мкл субстрата 1-фенил-N-ацетил-β-D-глюкозаминида (ФНАГ) в 0.1 М цитратном буфере (pH 4.2) инкубировали с 4 мкл раствора НАГазы в 50 мМ фосфатном буфере, pH 7, содержащем 0,05% казеина, в течение 20 минут при 25°С. Затем в э/х ячейку добавляли аликвоту 10 мкл и измеряли разницу токов до и после введения образца.
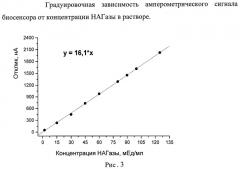
Зависимость величины аналитического сигнала от концентрации НАГазы была исследована в диапазоне 2-125 мЕд/мл. Из градуировочной зависимости были получены следующие аналитические характеристики: предел обнаружения по НАГазе, рассчитанный по уравнению у=16.1*х, составил 0.1 мЕд/мл (3σ), линейный диапазон 0.2-125 мЕд/мл (Рис.3).
Пример 4.
Электрохимическое определение активности НАГазы в молоке.
12 мкл субстрата 1-фенил-N-ацетил-β-D-глюкозаминида в 0.1 М цитратном буфере (pH 4.2) инкубировали с 4 мкл молока в течение 20 минут при 25°С. Свернувшийся осадок (белки молока) откручивали 5 минут на центрифуге при 4000 об./мин. Затем в э/х ячейку добавляли аликвоту 10 мкл и измеряли разницу токов до и после введения образца.
Пример 5.
Спектрофотометрическое измерение активности НАГазы в молоке проводили с использованием в качестве субстрата пара-нитрофенил-N-ацетил-β-D-глюкозаминида. Ферментативная реакция проводилась в 0,2 М цитратном буферном растворе с рН 4,5, а останавливалась м-глицином, доведенном до рН 10,5 NaOH. Спектрофотометрическое измерение концентрации накопившегося пара-нитрофенола проводилось на приборе Shimadzu UV-1800 при 410 нм при температуре 25°С.
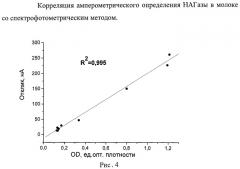
Результаты корреляции электрохимического определения активности НАГазы со спектрофотометрическим методом представлены на Рис.4 (R2=0.995).
1. Способ электрохимического определения N-ацетил-β-D-глюкозаминидазы в биологических жидкостях путем амперометрического определения фенола, выделяющегося в процессе ферментативного гидролиза 1-фенил-N-ацетил-β-D-глюкозаминида в биологических жидкостях, заключающийся в том, что к образцу биологической жидкости, содержащему N-ацетил-β-D-глюкозаминидазу, добавляют раствор 1-фенил-N-ацетил-β-D-глюкозаминида в цитратном буфере с последующей инкубацией, отделением образующегося осадка и получением содержащей фенол пробы, которую помещают в электрохимическую ячейку, содержащую буферный раствор и электрохимический тирозиназный биосенсор, представляющий собой планарный графитовый электрод, полученный методом трафаретной печати, с последовательно нанесенными на него чередующимися адгезивным(и) слоем(ями) полидиаллилдиметиламмоний хлорида и слоем(ями) тирозиназы, в качестве рабочего электрода, и осуществляют регистрацию амперометрического сигнала, по которому рассчитывают активность N-ацетил-β-D-глюкозаминидазы на основании градуировочной зависимости по уравнениюANAG=I/16,1,где ANAG - активность НАГазы, мЕд/мл,I - значение электрохимического сигнала, нА,16,1 - величина тангенса угла наклона градуировочной зависимости электрохимического сигнала от активности НАГазы, нА×мл/мЕд.
2. Способ по п.1, где биологической жидкостью является молоко.