Доставка активных веществ
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и представляет собой способ доставки активного вещества пациенту, нуждающемуся в этом, включающий выбор активного вещества, где это активное вещество подвергается деградации в организме указанного пациента при пероральном, подкожном или внутривенном введении и где эффективность указанного активного вещества уменьшается в результате указанной деградации; причем указанное активное вещество не является GLP-1; объединение указанного активного вещества с дикетопиперазином для получения фармацевтической композиции, подходящей для пульмональной ингаляции; и введение указанной фармацевтической композиции указанному пациенту. Изобретение обеспечивает предоставление системы доставки лекарственного средства, которая предотвращает дезактивацию или деградацию активного вещества, вводимого пациенту, испытывающему потребность в лечении. 2 н. и 17 з.п. ф-лы, 8 пр., 6 табл., 20 ил.
Реферат
Перекрестная ссылка на родственные заявки
Настоящая заявка испрашивает приоритет согласно §119(e) 35 U.S.C. предварительных заявок на патент США: 60/982368, поданной 24 октября 2007 года; 60/985620, поданной 5 ноября 2007 года; 61/033740, поданной 4 марта 2008 года; 61/052127, поданной 9 мая 2008 года; 61/022274, поданной 18 января 2008 года; и 61/094823, поданной 5 сентября 2008 года. Все содержание каждой из перечисленных заявок включено в настоящую заявку путем отсылки.
Область техники
В настоящей заявке раскрыт способ введения физиологически активного компонента в кровеносную систему млекопитающего. Способ включает систему быстрой доставки лекарственного средства, которая предотвращает или уменьшает дезактивацию или деградацию активного вещества, вводимого пациенту, испытывающему потребность в лечении. В частности, система доставки лекарственного средства разработана для пульмональной доставки лекарственного средства, например, путем ингаляции, для доставки активного вещества в легочное кровообращение терапевтически эффективным образом. Система доставки лекарственного средства обладает преимуществами по сравнению с другими способами доставки лекарственных средств, например пероральным, подкожным и внутривенным введением активных веществ, таких как белки и пептиды, которые являются чувствительными к ферментативной дезактивации или деградации в локальной периферической и сосудистой ткани перед достижением целевого сайта.
Уровень техники
Системы доставки лекарственного средства для лечения заболевания, которые позволяют вводить активные компоненты в кровоток, являются многочисленными и включают пероральное, трансдермальное, подкожное и внутривенное введение. Хотя указанные системы применяли в течение достаточно долгого времени и они позволяют доставлять достаточное количество лекарственного средства для лечения многих заболеваний, существуют многочисленные сложности, связанные с данными механизмами доставки лекарственного средства. В частности, доставка эффективных количеств белков и пептидов для лечения целевого заболевания являлась проблематичной. Многие факторы задействованы при введении необходимого количества активного вещества, например приготовление надлежащей лекарственной формы для доставки лекарственного средства, чтобы лекарственная форма содержала такое количество активного вещества, которое может достигать своего целевого сайта (сайтов) действия в эффективном количестве.
Активное вещество должно быть устойчивым в лекарственной форме для доставки лекарственного средства, при этом лекарственная форма должна обеспечивать абсорбцию активного вещества в кровоток и оставаться активной, чтобы она могла достигать места (мест) действия в эффективных терапевтических уровнях. Таким образом, в фармакологии системы доставки лекарственного средства, которые могут доставлять устойчивое активное вещество, имеют первостепенное значение.
Создание лекарственных форм для доставки лекарственного средства, терапевтически подходящих для лечения заболевания, зависит от свойств активного компонента или вещества, вводимого пациенту. Такие свойства могут включать, в неограничивающем порядке, растворимость, pH, устойчивость, токсичность, скорость высвобождения и легкость выведения из организма посредством нормальных физиологических процессов. Например, в случае перорального введения, если вещество чувствительно к кислоте, разработаны энтеросолюбильные покрытия, в которых применяются фармацевтически приемлемые материалы, которые могут препятствовать высвобождению активного вещества при низком (кислом) pH желудка. Таким образом, полимеры, которые не растворимы при кислом pH, применяются для приготовления и доставки дозы, содержащей кислоточувствительные вещества, в тонкую кишку, где pH нейтрален. При нейтральном pH полимерное покрытие может растворяться, высвобождая активное вещество, которое затем абсорбируется в энтеральный системный кровоток. Активные вещества, вводимые перорально, поступают в системный кровоток и проходят через печень. В определенных случаях некоторая часть дозы метаболизируется и/или дезактивируется в печени до того, как она достигает целевых тканей. В некоторых случаях метаболиты могут быть токсичными для пациента или могут приводить к нежелательным побочным эффектам.
Точно также при подкожном и внутривенном введении фармацевтически активные вещества не избегают деградации и инактивации. При внутривенном введении лекарственных средств лекарственные соединения или активные компоненты также могут метаболизироваться, например, в печени, перед достижением целевой ткани. При подкожном введением некоторых активных веществ, включающих различные белки и пептиды, происходит дополнительная деградация и дезактивация под действием ферментов периферических и сосудистых тканей в участке доставки лекарственного средства, а также в процессе движения через венозный кровоток. Для доставки дозы, которая обеспечивает приемлемое количество для лечения заболевания при подкожном и внутривенном введении активного вещества, схемы дозирования всегда должны учитывать инактивацию активного вещества периферийной и сосудистой венозной тканью и в конечном счете печенью.
Сущность изобретения
В настоящей заявке описан способ введения активного вещества в кровеносную систему млекопитающего. Способ включает систему доставки лекарственного средства, которая предотвращает дезактивацию или деградацию активного вещества, вводимого пациенту, испытывающему потребность в лечении. В частности, система доставки лекарственного средства разработана для пульмональной доставки лекарственного средства, например, путем ингаляции, для доставки активных веществ в легочное кровообращение терапевтически эффективным образом. Система доставки лекарственного средства обладает преимуществами по сравнению с другими способами доставки лекарственного средства, например пероральным, подкожным и внутривенным введением лекарственных препаратов, таких как белки и пептиды, которые являются чувствительными к ферментативной дезактивации или деградации в локальной периферической и сосудистой ткани перед достижением целевого сайта.
В одном варианте осуществления, раскрытом в настоящей заявке, описан способ доставки активного вещества пациенту, испытывающему в этом потребность, включающий отбор активного вещества, которое подвергается деградации в организме пациента, причем эффективность активного вещества при деградации уменьшается; соединение активного вещества с дикетопиперазином, с получением фармацевтической композиции, подходящей для пульмональной ингаляции; и доставку фармацевтической композиции пациенту.
В другом варианте осуществления деградация происходит в венозном кровотоке, в периферической ткани, в желудочно-кишечной системе или в печени.
Также в настоящей заявке раскрыт способ лечения заболевания, включающий отбор пациента, подвергаемого лечению, или пациента с патологическим состоянием, поддающимся лечению лабильным активным веществом; предоставление композиции, включающей лабильное активное вещество в комбинации с дикетопиперазином; и введение композиции пациенту посредством пульмональной ингаляции, с проведением таким образом лечения заболевания или патологического состояния.
В другом варианте осуществления дикетопиперазин является 2,5-дикето-3,6-ди(4-X-аминобутил)пиперазином, где X выбран из группы, состоящей из сукцинила, глутарила, малеила и фумарила; или его фармацевтически приемлемой солью. В другом варианте осуществления фармацевтическая композиция представляет собой сухую порошковую лекарственную форму для ингаляции. В еще одном варианте осуществления сухая порошковая лекарственная форма для ингаляции дополнительно включает фармацевтически приемлемый носитель или наполнитель.
В одном варианте осуществления сухую порошковую лекарственную форму для ингаляции вводят пациенту путем пульмональной ингаляции с применением системы для ингаляции сухим порошком.
В еще одном варианте осуществления активное вещество является белком, пептидом или аналогом перечисленного. В другом варианте осуществления активное вещество является эндокринным гормоном или его аналогом. Эндокринный гормон представляет собой гормон, ассоциированный с диабетом, гипергликемией и/или ожирением. В другом варианте осуществления диабет является сахарным диабетом II типа.
В другом варианте осуществления раскрытого способа стадия введения композиции пациенту включает пульмональное введение композиции с применением ингалятора сухого порошка, включающего картридж, такой как картридж разового дозирования.
КРАТКОЕ ОПИСАНИЕ ФИГУР
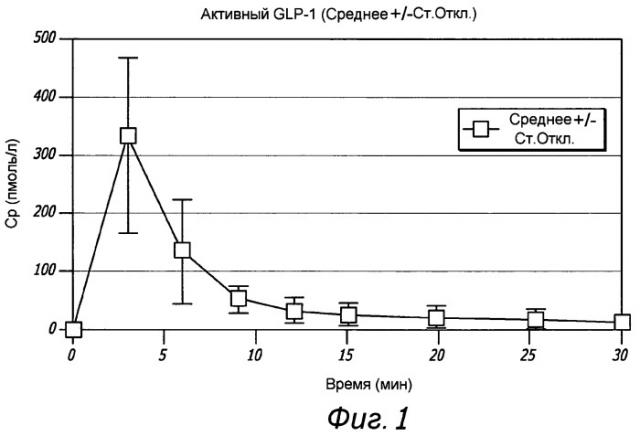
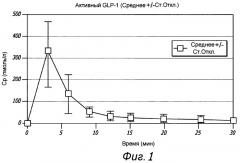
На Фиг. 1 показана средняя концентрация в плазме активного глюкагоноподобного пептида 1 (GLP-1) у субъектов, получивших сухую порошковую лекарственную форму для ингаляции, содержащую дозу GLP-1 в количестве 1,5 мг, измеренная в различные моменты времени после ингаляции.
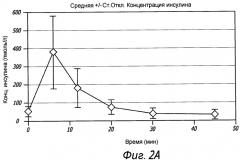
На Фиг. 2A показана средняя концентрация в плазме инсулина у субъектов, получивших сухую порошковую лекарственную форму для ингаляции, содержащую дозу GLP-1 в количестве 1,5 мг, измеренная в различные моменты времени после ингаляции.
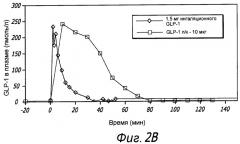
На Фиг. 2B показана концентрация в плазме GLP-1 у субъектов, получивших сухую порошковую лекарственную форму для ингаляции, содержащая дозу GLP-1 в количестве 1,5 мг, измеренная в различные моменты времени после ингаляции, в сравнении с субъектами, подвергнутыми подкожному введению GLP-1.
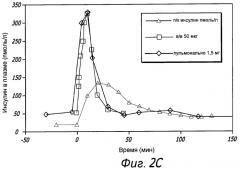
На Фиг. 2C показана концентрация в плазме инсулина у субъектов, получивших сухую порошковую лекарственную форму для ингаляции, содержащую дозу GLP-1 в количестве 1,5 мг, измеренная в различные моменты времени после ингаляции, в сравнении с субъектами, получившими дозу GLP-1 внутривенно в количестве 50 мкг, и субъектами, получившими дозу GLP-1 подкожно.
На Фиг. 3 показана средняя концентрация в плазме C-пептида у субъектов, получивших сухую порошковую лекарственную форму для ингаляции, содержащую дозу GLP-1 в количестве 1,5 мг, измеренная в различные моменты времени после ингаляции.
На Фиг. 4 показана средняя концентрация глюкозы в плазме субъектов, получивших сухую порошковую лекарственную форму для ингаляции, содержащую дозы GLP-1 в количестве 0,05 мг, 0,45 мг, 0,75 мг, 1,05 мг и 1,5 мг, измеренная в различные моменты времени после ингаляции.
На Фиг. 5 показаны средние концентрации инсулина в плазме пациентов, получивших сухую порошковую лекарственную форму для ингаляции, содержащую дозы GLP-1 в количестве 0,05 мг, 0,45 мг, 0,75 мг, 1,05 мг и 1,5 мг. Данные показывают, что секреция инсулина в ответ на пульмональное введение GLP-1 является дозозависимой.
На Фиг. 6 показаны средние концентрации глюкагона в плазме пациентов, получивших сухую порошковую лекарственную форму для ингаляции, содержащую дозы GLP-1 в количестве 0,05 мг, 0,45 мг, 0,75 мг, 1,05 мг и 1,5 мг.
На Фиг. 7 показаны средние концентрации эксендина в плазме у самцов крыс линии Zucker Diabetic Fat (ZDF), получавших эксендин-4/FDKP (фумарилдикетопиперазин) в форме порошка путем пульмональной инсуффляции, в сравнении с подкожно (п/к) введенным эксендином-4. Закрашенные квадраты обозначают ответ после пульмональной инсуффляции порошка эксендина-4/FDKP. Белые квадраты обозначают ответ после п/к введения эксендина-4. Данные представлены как средние ±SD.
На Фиг. 8 показаны изменения в концентрации глюкозы в крови от базовой линии в самцах крыс линии ZDF, получающих контрольный воздух, либо порошок эксендина-4/FDKP, либо порошок GLP-1/FDKP путем пульмональной инсуффляции, в сравнении с подкожно вводимым эксендином-4. На графике также показан комбинированный эксперимент, в котором крысам путем пульмональной инсуффляции вводили порошок для ингаляции, включающий GLP-1/FDKP, с последующим введением порошка для ингаляции, включающего эксендин-4/FDKP. На графике ромбы обозначают ответ после пульмональной инсуффляции порошка эксендина-4/FDKP. Круги обозначают ответ после подкожного введения эксендина-4. Треугольники обозначают ответ после введения порошка GLP-1/FDKP. Квадраты обозначают ответ после пульмональной инсуффляции чистого воздуха. Звездочки обозначают ответ, полученный при введении инсуффляцией 2 мг GLP-1/FDKP крысам, с последующим введением 2 мг порошка эксендина-4/FDKP, который также вводили инсуффляцией.
На Фиг. 9A показаны средние концентрации оксинтомодулина в плазме самцов крыс линии ZDF, получающих оксинтомодулин/FDKP в форме порошка путем пульмональной инсуффляции, в сравнении с внутривенным (в/в) введением оксинтомодулина. Квадраты обозначают ответ после в/в введения одного оксинтомодулина. Треугольники обозначают ответ после пульмональной инсуффляции 5% порошка оксинтомодулина/FDKP (0,15 мг оксинтомодулина). Круги обозначают ответ после пульмональной инсуффляции 15% порошка оксинтомодулина/FDKP (0,45 мг оксинтомодулина). Треугольники, перевернутые вершиной вниз, обозначают ответ после пульмональной инсуффляции 30% порошка оксинтомодулина/FDKP (0,9 мг оксинтомодулина). Данные представлены как средние ±SD.
На Фиг. 9B показано совокупное потребление пищи у самцов крыс линии ZDF, получавших 30% порошок оксинтомодулина/FDKP (0,9 мг оксинтомодулина) путем пульмональной инсуффляции (1); один оксинтомодулин (1 мг оксинтомодулина) путем в/в инъекции (2); или воздух в качестве контроля (3).
На Фиг. 10A показаны средние концентрации оксинтомодулина в плазме самцов крыс линии ZDF, получавших порошок оксинтомодулина/FDKP путем пульмональной инсуффляции, в сравнении с воздухом в качестве контроля. Квадраты обозначают ответ после введения контрольного воздуха. Круги обозначают ответ после пульмональной инсуффляции порошка оксинтомодулина/FDKP (0,15 мг оксинтомодулина). Треугольники обозначают ответ после пульмональной инсуффляции порошка оксинтомодулина/FDKP (0,45 мг оксинтомодулина). Треугольники, перевернутые вершиной вниз, обозначают ответ после пульмональной инсуффляции порошка оксинтомодулина/FDKP (0,9 мг оксинтомодулина). Данные представлены как средние ±SD.
На Фиг. 10B показаны данные экспериментов, отражающие совокупное потребление пищи у самцов крыс линии ZDF, получающих 30% порошок оксинтомодулина/FDKP в различных дозах, включающих 0,15 мг оксинтомодулина (1), 0,45 мг оксинтомодулина (2) или 0,9 мг оксинтомодулина (3) путем пульмональной инсуффляции, в сравнении с контрольным воздухом (4). Данные представлены как средние ±SD. Звездочка (*) обозначает статистическую значимость.
На Фиг. 11 показаны значения глюкозы, полученные у шести воздерживавшихся от приема пищи пациентов с диабетом II типа после введения разовой дозы сухой порошковой лекарственной формы для ингаляции, содержащей GLP-1, в различные моменты времени.
На Фиг. 12 показаны средние значения глюкозы в группе из шести воздерживавшихся от приема пищи пациентов с диабетом II типа (Фиг. 11), выраженные как изменение уровней глюкозы с нулевого момента (введение дозы) для всех шести пациентов.
На Фиг. 13 показаны данные, полученные из экспериментов, в которых крысам линии ZDF вводили эксендин-4 в лекарственной форме, включающей дикетопиперазин или соль дикетопиперазина, где эксендин-4 вводили различными путями введения (инстилляцией жидкости (LIS), SC, пульмональной инсуффляцией (INS)) в тесте на толерантность к глюкозе при внутрибрюшинном введении (IPGTT). В одной группе крысы получали эксендин-4 в комбинации с GLP-1, вводимые пульмональной инсуффляцией.
На Фиг. 14 показано совокупное потребление пищи у самцов крыс линии ZDF, получающих в качестве контроля воздух путем пульмональной инсуффляции, только белок YY (3-36) (PYY) в/в инъекцией, только PYY пульмональной инстилляцией, 10% порошок PYY/FDKP (0,3 мг PYY) пульмональной инсуффляцией, 20% порошок PYY/FDKP (0,6 мг PYY) пульмональной инсуффляцией. В каждой группе потребление пищи измеряли через 30 минут после введения дозы, через 1 час после введения дозы, через 2 часа после введения дозы и через 4 часа после введения дозы. Данные представлены как средние ±SD.
На Фиг. 15 показана концентрация глюкозы в крови у самок крыс линии ZDF, которым вводили порошок PYY/FDKP путем пульмональной инсуффляции, в сравнении с внутривенным введением PYY, в различные моменты времени после введения дозы.
На Фиг. 16 показаны средние концентрации PYY в плазме самок крыс линии ZDF, получавших порошок PYY/FDKP путем пульмональной инсуффляции, в сравнении с внутривенно введенным PYY. Квадраты обозначают ответ после внутривенного введения одного PYY (0,6 мг). Круги обозначают ответ после инстилляции только жидкого PYY (1 мг). Треугольники, перевернутые вершиной вниз, обозначают ответ после пульмональной инсуффляции 20% порошка PYY/FDKP (0,6 мг PYY). Треугольники обозначают ответ после пульмональной инсуффляции 10% порошка PYY/FDKP (0,3 мг PYY). Треугольники, повернутые вершиной влево, обозначают ответ после пульмональной инсуффляции только воздуха. Данные представлены как ±SD.
На Фиг. 17 показано относительное воздействие препарата и относительный биоэффект существующих лекарственных форм, вводимых путем пульмональной ингаляции и содержащих инсулин, эксендин, оксинтомодулин или PYY, в сравнении с подкожным и внутривенным введением.
На Фиг. 18 показаны средние уровни GLP-1 в плазме у пациентов, которым вводили различные ингаляционные формы GLP-1 и контрольные лекарственные формы.
На Фиг. 19 показаны уровни инсулина в плазме у пациентов, которым вводили различные ингаляционные формы GLP-1 и контрольные лекарственные формы.
На Фиг. 20 показана эвакуация желудочного содержимого в ответ на вдыхание ингаляционной формы GLP-1 у пациентов, которым вводили различные ингаляционные формы GLP-1 и контрольные лекарственные формы.
Определение терминов
Перед изложением изобретения может быть целесообразным обеспечить понимание определенных терминов, которые будут применяться в дальнейшем:
Активные вещества: Используемое в настоящей заявке "активное вещество" относится к лекарственным средствам, фармацевтическим веществам и биологически активным соединениям. Активные вещества могут представлять собой органические макромолекулы, включая нуклеиновые кислоты, синтетические органические соединения, полипептиды, пептиды, белки, полисахариды и другие сахара, а также липиды. Пептиды, белки и полипептиды являются цепями аминокислот, связанных пептидными связями. Пептиды, как обычно считают, состоят менее чем из 40 аминокислотных остатков, но могут включать и больше. Белки представляют собой полимеры, которые могут содержать более 40 аминокислотных остатков. Термин "полипептид", известный в уровне техники и используемый в настоящей заявке, может относиться к пептиду, белку или любой другой цепи аминокислот любой длины, содержащей множественные пептидные связи, хотя обычно содержащей, по меньшей мере, 10 аминокислот. Активные вещества могут относиться к различным классам биологически активных веществ, таким как вазоактивные средства, нейроактивные средства, гормоны, антикоагулянты, иммуномодулирующие средства, цитотоксические средства, антибиотики, противовирусные средства, антигены и антитела. Более конкретно активные вещества могут включать, в неограничивающем порядке, инсулин и его аналоги, гормон роста, паратиреоидный гормон (PTH), грелин, гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМКСФ), глюкагоноподобный пептид 1 (GLP-1) и аналоги подобных пептидов, Техасский красный, алкины, циклоспорины, клопидогрел и PPACK (D-фенилаланил-L-пролил-L-аргинин хлорметилкетон), антитела и их фрагменты, включая, помимо прочего, гуманизированные или химерные антитела; F(ab), F(ab)2 или одноцепочечное антитело, по отдельности или слитое с другими полипептидами; терапевтические или диагностические моноклональные антитела к раковым антигенам, цитокинам, возбудителям инфекций, медиаторам воспаления, гормонам и поверхностным антигенам клеток. В некоторых случаях термины "лекарственное средство" и "активное вещество" используются попеременно.
Дикетопиперазин: Используемый в настоящей заявке "дикетопиперазин" или "DKP" включает дикетопиперазины, а также их соли, производные, аналоги и модификации, охватываемые общей Формулой 1, в которой атомы кольца E1 и E2 в положениях 1 и 4 являются либо O, либо N, и, по меньшей мере, одна из боковых цепей, R1 и R2, расположенных в положениях 3 и 6, соответственно, содержит карбоксильную (карбоксилатную) группу. Соединения Формулы 1 включают, помимо прочих, дикетопиперазины, дикетоморфолины и дикетодиоксаны, а также их замещенные аналоги.
Формула 1
Дикетопиперазины в дополнение к созданию аэродинамически подходящих микрочастиц также облегчают доставку лекарственных соединений, быстро растворяясь при физиологическом pH с высвобождением, в результате, активного вещества и ускорением его абсорбции в кровоток. Дикетопиперазины могут быть сформированы в частицы, которые включают лекарственное средство, или частицы, на которых может адсорбироваться лекарственное соединение. Комбинация препарата и дикетопиперазина может придавать лекарственному средству повышенную стабильность. Указанные частицы можно вводить различными путями введения. В виде сухих порошков указанные частицы можно доставлять посредством ингаляции в определенные области дыхательной системы, в зависимости от размера частицы. Кроме того, могут быть приготовлены частицы, имеющие достаточно малый размер для включения в суспензионную лекарственную форму для внутривенного введения. Пероральная доставка также возможна в случае частиц, включенных в суспензию, таблетки или капсулы.
В одном варианте осуществления дикетопиперазином является 3,6-ди(фумарил-4-аминобутил)-2,5-дикетопиперазин (фумарил-дикетопиперазин, FDKP). FDKP может образовывать микрочастицы в своей кислотной форме или в форме солей, которые могут быть введены в форме аэрозоля или суспензии.
В другом варианте осуществления DKP является производным 3,6-ди(4-аминобутил)-2,5-дикетопиперазина, которое может быть получено путем (термической) конденсации аминокислоты лизина. Примеры производных включают 3,6-ди(сукцинил-4-аминобутил)-, 3,6-ди(малеил-4-аминобутил)-, 3,6-ди(глутарил-4-аминобутил)-, 3,6-ди(малонил-4-аминобутил)-, 3,6-ди(оксалил-4-аминобутил)- и 3,6-ди(фумарил-4-аминобутил)-2,5-дикетопиперазин. Применение различных DKP для доставки лекарственных средств известно в уровне техники (см., например, патенты США 5352461, 5503852, 6071497 и 6331318, которые включены в настоящую заявку путем отсылки в отношении всего, что касается дикетопиперазинов и дикетопиперазин-опосредованной доставки лекарственных средств). Применение солей DKP описано в одновременно находящейся на рассмотрении заявке на патент США 11/210710, поданной 23 августа 2005 года, которая настоящим включена путем отсылки в отношении всего, что касается солей дикетопиперазинов. Пульмональная доставка лекарственных средств с применением микрочастиц DKP раскрыта в патенте США 6428771, который настоящим полностью включен путем отсылки. Дополнительные детали, связанные с адсорбцией активных веществ на кристаллических частицах DKP, можно найти в одновременно находящихся на рассмотрении заявках на патент США 11/532063 и 11/532065, которые настоящим полностью включены путем отсылки.
Система доставки лекарственного средства: Используемая в настоящей заявке "система доставки лекарственного средства" относится к системе для доставки одного или нескольких активных веществ.
Сухой порошок: Используемый в настоящей заявке "сухой порошок" относится к композиции из тонкодисперсных частиц, которая не суспендирована или растворена в пропелленте, носителе или другой жидкости. Это не означает, что обязательно подразумевается полное отсутствие всех молекул воды.
Ранняя фаза: Используемая в настоящей заявке "ранняя фаза" относится к быстрому повышению концентрации инсулина в крови, индуцированному в ответ на прием пищи. Указанное раннее повышение инсулина в ответ на прием пищи иногда называют первой фазой. В более поздних источниках первую фазу иногда используют для обозначения более быстрого повышения концентрации инсулина в крови кинетического профиля, достигаемого при болюсной в/в инъекции глюкозы, в отличие от ответа, связанного с приемом пищи.
Эндокринное заболевание: Эндокринная система является информационной сигнальной системой, которая выделяет гормоны из желез, обеспечивая специфических химических посредников, которые регулируют многие и различные функции организма, например настроение, рост и развитие, функцию ткани и метаболизм, а также посылку сигналов и ответное действие на них. Болезни эндокринной системы включают, помимо прочих, сахарный диабет, заболевание щитовидной железы и ожирение. Эндокринное заболевание характеризуется нарушением выработки гормонов (продуктивная аденома гипофиза), неадекватной реакцией на сигналы (гипотиреоз), недостаточностью или разрушением железы (сахарный диабет I типа, дефицитный эритропоэз при хронической почечной недостаточности), пониженной восприимчивостью к сигналам (резистентность к инсулину при сахарном диабете II типа) или структурной гипертрофией в критическом участке, например в шее (токсический многоузловой зоб). Гипофункция эндокринных желез может развиться в результате снижения резерва, пониженной секреции, агенеза, атрофии или активного разрушения. Гиперфункция может развиться в результате гиперсекреции, снижения супрессии, гиперпластического или неопластического перерождения, или гиперстимуляции. Термин "эндокринное нарушение" охватывает метаболические нарушения.
Отклонение: Используемое в настоящей заявке "отклонение" может относиться к концентрациям глюкозы в крови, которые повышаются или падают относительно базовой линии до приема пищи или другой исходной точки. Отклонения обычно выражают как площадь под кривой (AUC) на графике уровня глюкозы в крови с течением времени. AUC может быть выражен разнообразными способами. В некоторых случаях присутствует как падение ниже, так и превышение относительно базовой линии, создающие положительную и отрицательную область. Некоторые вычисления вычитают отрицательную AUC из положительной, тогда как другие прибавляют их абсолютные значения. Положительную и отрицательную AUC также можно учитывать отдельно. Также могут использоваться более сложные статистические анализы. В некоторых случаях это также может относиться к концентрациям глюкозы в крови, которые повышаются или падают, выходя за пределы нормального диапазона. Нормальная концентрация глюкозы в крови обычно составляет 70 - 110 мг/дл у человека, длительное время не принимавшего пищу, менее чем 120 мг/дл через два часа после приема пищи и менее чем 180 мг/дл после приема пищи. Хотя отклонение описано в настоящей заявке применительно к глюкозе в крови, в других контекстах данный термин может аналогичным образом применяться к другим аналитам.
Скорость выведения глюкозы: Используемая в настоящей заявке "скорость выведения глюкозы" представляет собой скорость, с которой глюкоза уходит из крови. Обычно она определяется количеством глюкозы, вводимым при инфузии, которое требуется для поддержания устойчивого уровня глюкозы крови, обычно приблизительно 120 мг/дл в ходе исследования. Указанная скорость выведения глюкозы равна скорости инфузии глюкозы (сокращенно GIR).
Гипергликемия: Используемая в настоящей заявке "гипергликемия" является превышением нормальной концентрации глюкозы в крови, взятой натощак, обычно 126 мг/дл или выше. В некоторых исследованиях приступы гипергликемии определяли как концентрации глюкозы в крови, превышающие 280 мг/дл (15,6 мМ).
Гипогликемия: Используемая в настоящей заявке "гипогликемия" является снижением относительно нормальной концентрации глюкозы в крови, обычно менее 63 мг/дл (3,5 мМ). Клинически значимую гипогликемию определяют как концентрацию глюкозы в крови ниже 63 мг/дл или проявление у пациента таких симптомов, как гипотония, внезапное покраснение лица и слабость, которые являются признанными симптомами гипогликемии и которые исчезают при достаточном потреблении калорий. Тяжелую гипогликемию определяют как приступ гипогликемии, который требует инъекции глюкагона, вливания глюкозы или помощи каким-либо иным путем.
В близости: Используемый в настоящей заявке термин "в близости", применительно к пищи, относится к периоду, близкому к моменту начала потребления пищи или легкой закуски.
Микрочастицы: Используемый в настоящей заявке термин "микрочастицы" обычно включает частицы диаметром 0,5-100 микронов, и в особенности частицы диаметром менее 10 микронов. Различные варианты осуществления включают более конкретные диапазоны размеров. Микрочастицы могут представлять собой агрегаты кристаллических пластинок с неровными поверхностями и внутренними пустотами, что является обычным для частиц, получаемых путем pH-регулируемого осаждения DKP кислот. В таких вариантах осуществления активные вещества могут включаться в частицы в процессе осаждения или абсорбироваться на поверхности кристаллических микрочастиц. Микрочастицы также могут являться пустотелыми сферами или сжатыми пустотелыми сферами, состоящими из солей DKP и активного вещества, распределенного в них. Обычно такие частицы могут быть получены путем сушки при распылении раствора, содержащего DKP и активное вещество. Соль DKP в таких частицах может быть аморфной. Приведенные выше описания следует рассматривать как примеры. Данный термин предусматривает и охватывает также другие формы микрочастиц.
Ожирение: является патологическим состоянием, при котором в организме накапливается излишний жир до такой степени, что это может отрицательно повлиять на здоровье. Ожирение обычно оценивают по значению BMI (индекс массы тела), которое превышает 30 кг/м2.
Периферическая ткань: Используемая в настоящей заявке "периферическая ткань" относится к любой соединительной или промежуточной ткани, которая связана с органом или сосудом.
Перипрандиальный: Используемый в настоящей заявке "перипрандиальный" относится к промежутку времени, который начинается незадолго до, и заканчивается вскоре после потребления пищи или легкой закуски.
Постпрандиальный: Используемый в настоящей заявке "постпрандиальный" относится к промежутку времени после потребления пищи или легкой закуски. Используемый в настоящей заявке поздний постпрандиальный относится к промежутку времени через 3, 4 часа или более после потребления пищи или легкой закуски.
Потенцирование: В целом потенцирование относится к состоянию или действию, которое повышает эффективность или активность некоторого агента выше уровня, которого агент мог бы достичь в иных условиях. Аналогично он может относиться непосредственно к повышенному эффекту или активности. Используемое в настоящей заявке "потенцирование", в частности, относится к способности повышенных концентраций инсулина в крови повышать эффективность последующих уровней инсулина, например, при повышении скорости выведения глюкозы.
Прандиальный: Используемый в настоящей заявке "прандиальный" относится к потреблению пищи или закуски.
Препрандиальный: Используемый в настоящей заявке "препрандиальный" относится к промежутку времени перед потреблением пищи или закуски.
Пульмональная ингаляция: Используемая в настоящей заявке "пульмональная ингаляция" относится к введению фармацевтических препаратов посредством ингаляции, при которой они достигают легких и в конкретных вариантах осуществления альвеолярных областей легкого. Обычно ингаляцию выполняют через рот, однако в альтернативных вариантах осуществления она может включать ингаляцию через нос.
ПОДРОБНОЕ ОПИСАНИЕ
Раскрыт способ лечения заболевания или нарушения с применением системы доставки лекарственного средства, которая обеспечивает эффективную доставку активного вещества в легочное кровообращение, при этом активное вещество попадает в легочное кровообращение и может доставляться в терапевтическом количестве в место (места) действия. Способы лечения заболевания или нарушений включают введение пациенту, испытывающему потребность в лечении, лекарственной формы, которая обеспечивает доставку активного вещества непосредственно в легочное кровообращение и таким образом в артериальное кровообращение, и может избегать деградации активного вещества, такого как пептиды, при воздействии ферментов или других механизмов в локальных периферических и/или сосудистых тканях легких. В одном варианте осуществления способ включает эффективную терапевтическую доставку активных веществ с помощью системы доставки лекарственного средства, которая обеспечивает очень быструю абсорбцию активного вещества в легочное кровообращение и повышает его эффективную биодоступность. В данном варианте осуществления с помощью указанного способа введения можно доставлять более низкие дозы активного вещества. В подобных вариантах осуществления можно достичь эффективных доз, которые невозможно было достичь другими способами введения.
В вариантах осуществления в настоящей заявке описан способ лечения заболевания, включая эндокринные заболевания, такие как диабет, гипергликемию и ожирение. Авторы настоящего изобретения определили потребность в доставке лекарственных средств непосредственно в системный кровоток, в частности артериальное русло, неинвазивным способом, чтобы лекарственное средство достигало целевого органа (органов) до возврата через венозную систему. Данный подход, как это ни парадоксально, может приводить к более высокому пиковому воздействию активных веществ на целевой орган, чем воздействие, обеспечиваемое при сопоставимом введении внутривенным, подкожным или другим парентеральным путем. Подобное преимущество может быть получено и в сравнении с пероральным введением даже в случае лекарственных форм, обеспечивающих защиту от расщепления в пищеварительном тракте, поскольку после абсорбции активное вещество попадает в венозное кровообращение.
В одном варианте осуществления система доставки лекарственного средства может применяться с любым типом активного вещества, которое быстро метаболизируется и/или расщепляется при непосредственном контакте с локальными деструктивными ферментами или воздействии других деструктивных механизмов, например окисления, фосфорилирования или любой модификации белка или пептида, в периферической или сосудистой венозной ткани, которые встречаются при других путях введения, таких как пероральное, внутривенное, трансдермальное и подкожное введение. В данном варианте осуществления способ может включать стадию идентификации и отбора активного вещества, активность которого теряется вследствие метаболизации или расщепления при пероральном, подкожном или внутривенном введении. Например, из-за неустойчивости подкожная инъекция GLP-1 не приводит к накоплению эффективных уровней GLP-1 в крови. Это отличается от пептидов, таких как инсулин, который можно эффективно доставлять такими способами введения.
В определенных вариантах осуществления способ лечения заболевания или нарушения включает стадию подбора подходящего носителя для ингаляции и доставки активного вещества в альвеолы легких. В данном варианте осуществления носитель может быть связан с одним или несколькими активными веществами с формированием комплекса лекарственного соединения/носителя, который можно вводить в форме композиции, которая не подвергается быстрой деградации активного вещества в периферической и сосудистой венозной ткани легкого. В одном варианте осуществления носителем является дикетопиперазин.
Способ, описанный в настоящей заявке, может применяться для доставки многих типов активных веществ, включая биологические препараты. В конкретных вариантах осуществления в способе применяется система доставки лекарственного средства, которая эффективно и быстро доставляет терапевтическое количество активного вещества, включая пептидные гормоны, в артериальное русло. В одном варианте осуществления одно или более активных веществ включают, помимо прочих, пептиды, такие как глюкагоноподобный пептид 1 (GLP-1), белки, липокины, низкомолекулярные фармацевтические препараты, нуклеиновые кислоты и т.п., котор