Частицы антагониста crth2
Иллюстрации
Показать всеИзобретение относится к новым кристаллическим формам I, II и аморфной форме {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты. Изобретение также относится к фармацевтической композиции, содержащей кристаллическую форму I соединения, и к применению кристаллической формы I для лечения, профилактики или облегчения одного или более симптомов заболевания, опосредованного CRTH2, связанного с эозинофилами, базофилами, где заболевание выбрано из астмы, аллергической астмы, астмы, индуцированной физическими нагрузками, аллергического ринита, круглогодичного аллергического ринита, сезонного аллергического ринита, атопического дерматита, контактной гиперчувствительности. 7 н. и 9 з.п. ф-лы, 11 ил., 8 табл., 11 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
В настоящем изобретении рассматривают частицы {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты в аморфной и кристаллической формах, способы получения и их фармацевтические композиции. Также предоставлены способы их применения для лечения, профилактики или облегчения одного или более симптомов расстройства или заболевания, опосредованных CRTH2.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
CRTH2 представляет собой хемоаттрактантный рецептор, связанный с G белками, экспрессируемый на Th2 клетках, эозинофилах и базофилах (Nagata et al., J. Immunol. 1999, 162, 1278-1286; Hirai et al., J. Exp. Med. 2001, 193, 255-261). Простагландин D2 (PGD2), основной медиатор воспаления, продуцируемый тучными клетками, является естественным лигандом CRTH2. В последнее время было показано, что активация CRTH2 PGD2 вызывает миграцию и активацию Th2 клеток и эозинофилов, предполагая, что CRTH2 может играть провоспалительную роль в аллергических заболеваниях (Hirai et al., J. Exp. Med. 2001, 193, 255-261; Gervais et al., J. Allergy Clin. Immunol. 2001, 108, 982-988). Также было показано, что у пациентов с атопическим дерматитом существует повышение циркулирующих Т клеток, экспрессирующих CRTH2, которое коррелирует с тяжестью заболевания (Cosmi et al., Eur. J. Immunol. 2000, 30, 2972-2979; Iwazaki et al., J. Investigative Dermatology 2002, 119, 609-616). Роль PGD2 в развитии и поддержании аллергического воспаления дополнительно была продемонстрирована в модели астмы на мышах, показывая, что избыточная продукция PGD2 PGD2-синтазой in vivo усиливает воспаление дыхательных путей (Fujitani et al., J. Immunol. 2002, 168, 443-449). Следовательно, антагонисты CRTH2 являются потенциально применимыми для лечения расстройств или заболеваний, опосредованных CRTH2, таких как аллергический ринит, аллергическая астма, бронхоконстрикция, атопический дерматит или системные воспалительные заболевания.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
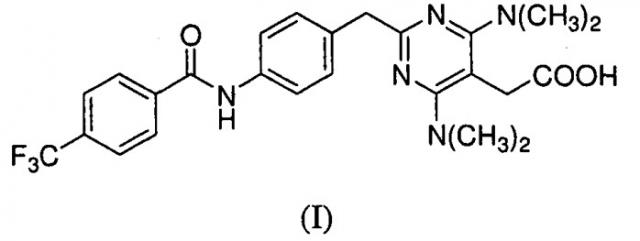
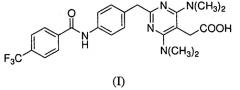
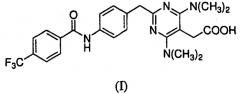
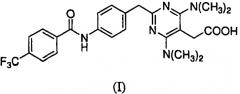
Предоставлены частицы {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты, которая имеет формулу I:
в аморфной форме или кристаллической форме I или II. Соединение формулы I было идентифицировано как антагонист CRTH2 (WO 2004/0022218).
В одном варианте осуществления изобретения частицы {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты имеют форму I, которая имеет дифрактограмму рентгеновского излучения на порошке, по существу как показано на фиг.1, или термограмму дифференциальной сканирующей калориметрии, по существу как показано на фиг.2.
В другом варианте осуществления изобретения частицы {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты имеют форму II, которая имеет дифрактограмму рентгеновского излучения на порошке, по существу как показано на фиг.6.
В еще одном варианте осуществления изобретения частицы {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты являются аморфными.
Также предоставлена фармацевтическая композиция, содержащая частицы {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты в аморфной форме, кристаллической форме I или II или их смеси, и один или более фармацевтически приемлемых носителей или вспомогательных веществ.
Дополнительно предоставлен способ для лечения, профилактики или облегчения одного или более симптомов расстройства или заболевания, опосредованных CRTH2, который включает введение частиц {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты в аморфной форме, кристаллической форме I или II или их смеси.
Кроме того, предоставлен способ для получения частиц {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты в аморфной форме или кристаллической форме I или II.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 изображена дифрактограмма рентгеновского излучения на порошке частиц {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты в кристаллической форме I.
На фиг.2 изображена термограмма дифференциальной сканирующей калориметрии (DSC) частиц кислоты формулы I в форме I.
На фиг.3 изображена термогравиметрическая (TG) термограмма частиц кислоты формулы I в форме I.
На фиг.4 изображены фотографии сканирующей электронной микроскопии (SEM) частиц кислоты формулы I в форме I при увеличении 2500 (А), 5000 (В) и 10000 (С).
На фиг.5 изображен график распределения по размеру частиц кислоты формулы I в форме I.
На фиг.6 изображена XRP дифрактограмма частиц кислоты формулы I в форме II.
На фиг.7 изображены SEM фотографии частиц кислоты формулы I в форме II при увеличении 370 (А), 2000 (В), 5500 (С) и 10000 (D).
На фиг.8 изображена XRP дифрактограмма частиц кислоты формулы I, полученных посредством фазы установления равновесия между частицами в форме I и форме II.
На фиг.9 изображена XRP дифрактограмма кислоты формулы I в аморфной форме.
На фиг.10 изображена кривая доза-ответ для {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты формулы I в анализе конкурентного связывания радиолиганда с использованием клеток, трансфицированных CRTH2.
На фиг.11 изображена кривая доза-ответ для {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты формулы I (▲), вместе с селективным антагонистом DP1 BWA 868C (■), в анализе конкурентного связывания радиолиганда с использованием клеток, трансфицированных DP1.
ПОДРОБНОЕ ОПИСАНИЕ
Для облечения понимания описания, представленного ниже, ряд терминов определен ниже.
Как используется в настоящем описании, формы единственного числа могут относиться к формам множественного числа, если особым образом не указано иначе. Обычно номенклатура, используемая в настоящем описании и лабораторных методиках в органической химии, медицинской химии и фармакологии, описанная в настоящем описании, является таковой, хорошо известной и обычно используемой в области техники. Если не указано иначе, все технические и научные термины, используемые в настоящем описании, обычно имеют такие же значения, которые, как правило, понимает обычный специалист в области техники, к которой принадлежит это описание. В случае, когда существует множество определений для термина, превалируют определения, представленные в настоящем разделе, если не указано иначе.
Термин «антирастворитель» относится к жидкости, которую добавляют к растворителю для уменьшения растворимости соединения в таком растворителе, приводя к осаждению соединения.
Термин «пациент» относится к животному, включая, но не ограничиваясь перечисленными, примата (например, человека), корову, овцу, козу, лошадь, собаку, кошку, кролика, крысу или мышь. Обычно термины «субъект» и «пациент» используются в настоящем описании взаимозаменяемо в отношении, например, субъекта млекопитающего, особенно пациента человека.
Термины «лечить», «лечение» и «процесс лечения» предназначены для включения облегчения или устранения расстройства или заболевания или одного или более симптомов, ассоциированных с расстройством или заболеванием; или облегчения или устранения причин(ы) расстройства или заболевания как такового.
Термины «предотвращать», «предотвращение» и «профилактика» относятся к способу замедления или предотвращения развития заболевания и/или его сопутствующих симптомов, предохраняя пациента от развития заболевания или уменьшения риска развития заболевания у пациента.
Термин «терапевтически эффективное количество» относится к количеству соединения, которое при введении достаточно для профилактики развития или в некоторой степени облегчения одного или больше симптомов состояния или расстройства, подвергаемого лечению. Термин «терапевтически эффективное количество» также относится к количеству соединения, которое усиливает биологический или медицинский ответ ткани, системы, животного или человека, который ищет исследователь, ветеринар, врач или клиницист.
Термин «фармацевтически приемлемый носитель», «фармацевтически приемлемое вспомогательное вещество», «физиологически приемлемый носитель» или «физиологически приемлемое вспомогательное вещество» относится к фармацевтически приемлемому материалу, композиции или носителю, такому как жидкий или твердый наполнитель, разбавитель, растворитель или инкапсулирующий материал. Каждый компонент должен быть «фармацевтически приемлемым» в смысле совместимости с другими ингредиентами фармацевтической композиции. Он также должен быть подходящим для использования в контакте с тканями или органами людей и животных без чрезмерной токсичности, раздражения, аллергического ответа, иммуногенности или других проблем или осложнений, соответствуя приемлемому соотношению польза/риск.
Термин «естественного происхождения» или «нативный» при использовании в связи с биологическими материалами, такими как молекулы нуклеиновой кислоты, полипептиды, клетки-носители и подобные, относится к материалам, которые обнаруживаются в природе и не созданы человеком. Сходным образом, «не-естественного происхождения» или «не-нативный» относятся к материалу, который не обнаруживается в природе или который был структурно модифицирован или синтезирован человеком.
Термин «CRTH2» относится к белку рецептору CRTH2 или его варианту, который способен опосредовать клеточный ответ на PGD2 in vitro или in vivo. Варианты CRTH2 включают белки, по существу гомологичные нативному CRTH2, т.е. белки, имеющие одну или больше естественных или неестественных делеций, вставок или замен аминокислот (например, производные, гомологи и фрагменты CRTH2) по сравнению с последовательностью аминокислот естественного CRTH2. Последовательность аминокислот варианта CRTH2 является на, по меньшей мере, около 80% идентичной, по меньшей мере, около 90% идентичной или, по меньшей мере, около 95% идентичной нативному CRTH2.
Термин «другой рецептор PGD2» относится к белку простаноидного рецептора, отличному от CRTH2, или его варианту, который способен опосредовать клеточный ответ на PGD2 in vivo или in vitro. «Другой рецептор PGD2» может быть селективным для PGD2, например, DP или любого одного или более другого простаноида. Варианты «другого рецептора PGD2» включают белки, по существу гомологичные соответствующим нативным простаноидным рецепторам, отличным от CRTH2, т.е. белки, имеющие одну или более естественную или неестественную делецию, вставку или замену аминокислот (например, производные, гомологи и фрагменты нативного простаноидного рецептора, отличного от CRTH2). Последовательность аминокислот нативного варианта «другого рецептора PGD2» является на, по меньшей мере, около 80% идентичной, по меньшей мере, около 90% идентичной или, по меньшей мере, около 95% идентичной соответствующему «другому рецептору PGD2».
Термин «антагонист CRTH2» относится к соединению, которое, например, частично или полностью блокирует, снижает, предотвращает, ингибирует или подавляет активность CRTH2 и/или активность одного или более других рецепторов PGD2. Термин «антагонист CRTH2» также относится к соединению, которое связывается с, замедляет активацию, инактивирует или десенсибилизирует CRTH2 или один или более других рецепторов PGD2. Антагонист CRTH2 может действовать, вмешиваясь во взаимодействие PGD2 с CRTH2 или одним или более другими рецепторами PGD2.
Термин «расстройство или заболевание, опосредованное CRTH2» и «состояние, расстройство или заболевание, опосредованное CRTH2» относится к состоянию, расстройству или заболеванию, характеризуемым несоответствующей, например, меньшей чем или большей чем нормальная активность CRTH2. Несоответствующая функциональная активность CRTH2 может возникать в результате экспрессии CRTH2 в клетках, которые обычно не экспрессируют CRTH2, увеличенной экспрессии CRTH2 или степени внутриклеточной активации, приводящей к, например, воспалительным или иммуно-связанным расстройствам или заболеваниям; или сниженной экспрессии CRTH2. Состояние, расстройство или заболевание, опосредованные CRTH2, могут быть полностью или частично опосредованы несоответствующей активностью CRTH2. В частности, состояние, расстройство или заболевание, опосредованное CRTH2, является таким, при котором модуляция CRTH2 или одного или больше рецепторов PGD2 приводит в некоторой степени к фоновому состоянию или расстройству, например, антагонист или агонист CRTH2 приводят к некоторому улучшению у, по меньшей мере, некоторых пациентов, получающих лечение.
Термин «насыпная масса после уплотнения» относится к насыпной плотности в тесно наполненном состоянии с помощью отвода жидкости, такого как сброс из контейнера, наполненного образцом заранее определенной высоты повторно для получения небольшого давления на дно контейнера. Насыпная масса после уплотнения может быть определена с использованием, например, Powder Tester PT-D (Hosokawa Micron Corporation, Osaka, Japan).
Термин «коэффициент однородности» относится к параметру, который показывает степень однородности распределения частиц по размеру и его определяют как значение, полученное делением размера частиц 60 процентиля на размер частиц 10 процентиля, которые получают из кривой распределения частиц. Когда распределение частиц по размеру становится более однородным, коэффициент однородности приближается к 1.
Частицы
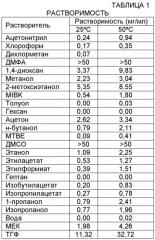
В настоящем описании предоставлены частицы {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты в аморфной форме или кристаллической форме I или II. Частицы кислоты формулы I могут быть охарактеризованы с использованием ряда способов, известных специалисту в области техники, включая монокристаллическую рентгеновскую дифракцию, дифракцию рентгеновского излучения на порошке (XRPD), микроскопию (например, сканирующую электронную микроскопию (SEM)), термический анализ (например, дифференциальная сканирующая калориметрия (DSC), термический гравиметрический анализ (TGA) и микроскопия с нагревательным столиком) и спектроскопию (например, инфракрасную, Рамана, ядерный магнитный резонанс твердой фазы). Размер частиц и распределение по размеру могут быть определены обычными методами, такими как методика рассеяния лазерного излучения. Чистота частиц кислоты формулы I может быть определена стандартными аналитическими методами, такими как тонкослойная хроматография (ТЖХ), гель-электрофорез, газовая хроматография, высокоэффективная жидкостная хроматография (ВЭЖХ) и масс-спектрометрия (МС).
В одном варианте осуществления изобретения частицы {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты находятся в кристаллической форме I. В одном варианте осуществления изобретения частицы формы I имеют дифрактограмму рентгеновского излучения на порошке, по существу как показано на фиг.1. В другом варианте осуществления изобретения частицы формы I имеют характерные пики XRP дифракции при двойном угле сближения приблизительно 9,8, 13,1, 22,0 и 26,4º. В еще одном варианте осуществления изобретения частицы формы I имеют характерный пик XRP дифракции при двойном угле сближения приблизительно 9,8, 13,1, 22,0 и 26,4º. В еще одном варианте осуществления изобретения частицы формы I имеют характерный пик XRP дифракции при двойном угле сближения приблизительно 22,0º. В еще одном варианте осуществления изобретения частицы формы I имеют термограмму дифференциальной сканирующей калориметрии, по существу как показано на фиг.2. В еще одном варианте осуществления изобретения частицы формы I имеют DSC термограмму с эндотермой при пиковой температуре около 224ºС и температуре начала разложения около 220ºС. В еще одном варианте осуществления изобретения форма кристалла частиц формы I является по существу игольчатой (фиг.4). В еще одном варианте осуществления изобретения частицы формы I имеют растворимость в воде около 3 мкг/мл при комнатной температуре.
В одном варианте осуществления изобретения частицы формы I могут иметь средний размер частиц, варьирующийся от около 0,1 до около 150 мкм, от около 0,5 до около 100 мкм, от около 1 до около 50 мкм, от около 1 до около 25 мкм, от около 1 до около 20 мкм, от около 1 до около 10 мкм, от около 2 до около 10 мкм или от около 2 до около 7,5 мкм. В другом варианте осуществления изобретения частицы формы I могут иметь однородное распределение частиц по размеру, что оценивают по коэффициенту однородности, варьирующемуся от около 1 до около 20, от около 1 до около 10, от около 2 до около 5 или от около 3 до около 4. В еще одном варианте осуществления изобретения твердые частицы формы I могут иметь насыпную массу после уплотнения, варьирующуюся от около 0,1 до около 1,0, от около 0,15 до около 0,8, от около 0,2 до около 0,6, от около 0,25 до около 0,5 или от около 0,3 до около 0,4 г/мл.
Частицы с такими свойствами частиц могут быть получены непосредственно способом получения, описанным в настоящем описании. Альтернативно, частицы таких размеров могут также быть получены с использованием любого обычного способа получения частиц, такого как измельчение, микронизация или гранулирование. Частицы формы I, представленные в настоящем описании, подходят для непосредственного получения кислоты формулы I в качестве терапевтических продуктов, таким образом, упрощая процесс производства и устраняя риски, ассоциированные с обычными способами получения частиц, такие как нежелательная конверсия вещества, кристаллизующегося в различных формах.
В определенных вариантах осуществления изобретения частицы кислоты формулы I в форме I могут содержать не менее около 95%, не менее около 97%, не менее около 98%, не менее около 99% или не менее около 99,5% по массе кислоты формулы I. Частицы также могут содержать не менее около 90%, не менее около 95%, не менее около 98%, не менее около 99% или не менее около 99,5% по массе твердых частиц в форме I.
В определенных вариантах осуществления изобретения частицы кислоты формулы I в форме I могут иметь остаточное содержание органического растворителя не более около 5%, не более около 2%, не более около 1%, не более около 0,9%, не более около 0,8%, не более около 0,7%, не более около 0,6%, не более около 0,5, не более около 0,4%, не более около 0,3%, не более около 0,2%, не более около 0,1%, не более около 0,05% или не более около 0,01% по массе.
В определенных вариантах осуществления изобретения частицы кислоты формулы I в форме I могут иметь остаточное содержание метанола не более около 100000 ч./млн, не более около 10000 ч./млн, не более около 5000 ч./млн, не более около 4000 ч./млн, не более около 3000 ч./млн, не более около 2000 ч./млн, не более около 1000 ч./млн, не более около 500 ч./млн или не более около 100 ч./млн.
В другом варианте осуществления изобретения частицы {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты находятся в кристаллической форме II. Частицы формы II имеют дифрактограмму рентгеновского излучения на порошке, по существу как показано на фиг.6. Частицы формы I имеют характерный пик XRP дифракции при двойном угле сближения приблизительно 31,7º.
В одном варианте осуществления изобретения частицы формы II могут иметь средний размер частиц, варьирующийся от около 0,1 до около 150 мкм, от около 0,5 до около 100 мкм, от около 1 до около 50 мкм, от около 1 до около 25 мкм, от около 1 до около 20 мкм, от около 1 до около 10 мкм, от около 1 до около 5 мкм или от около 2 до около 5 мкм. В другом варианте осуществления изобретения частицы формы II могут иметь однородное распределение частиц по размеру, что оценивают по коэффициенту однородности, варьирующемуся от около 1 до около 20, от около 1 до около 10, от около 2 до около 5 или от около 3 до около 4. В еще одном варианте осуществления изобретения частицы формы II могут иметь насыпную массу при уплотнении, варьирующуюся от около 0,1 до около 1,0, от около 0,15 до около 0,8, от около 0,2 до около 0,6, от около 0,25 до около 0,5 или от около 0,3 до около 0,4 г/мл.
Частицы с указанными свойствами частиц могут быть получены непосредственно способом получения, описанным в настоящем описании. Альтернативно, частицы таких размеров также могут быть получены с использованием любых обычных способов, таких как измельчение, микронизация или гранулирование.
В определенных вариантах осуществления изобретения частицы кислоты формулы I в форме II могут содержать не менее около 95%, не менее около 97%, не менее около 98%, не менее около 99% или не менее около 99,5% по массе кислоты формулы I. Частицы также могут содержать не менее около 90%, не менее около 95%, не менее около 98%, не менее около 99% или не менее около 99,5% по массе частиц в форме II.
В определенных вариантах осуществления изобретения частицы кислоты формулы I в форме II могут иметь остаточное содержание органического растворителя не более около 5%, не более около 2%, не более около 1%, не более около 0,9%, не более около 0,8%, не более около 0,7%, не более около 0,6%, не более около 0,5%, не более около 0,4%, не более около 0,3%, не более около 0,2%, не более около 0,1%, не более около 0,05% или не более около 0,01% по массе.
В еще одном варианте осуществления изобретения частицы {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты являются аморфными. Аморфные частицы имеют дифрактограмму рентгеновского излучения на порошке, по существу как показано на фиг.9, которая не имеет характерных пиков XRP дифракции для частиц формы I и/или формы II. В одном варианте осуществления изобретения аморфные частицы могут содержать не менее около 95%, не менее около 97%, не менее около 98%, не менее около 99% или не менее около 99,5% по массе кислоты формулы I. В другом варианте осуществления изобретения частицы могут также содержать не менее около 90%, не менее около 95%, не менее около 98%, не менее около 99% или не менее около 99,5% по массе аморфных твердых частиц.
В определенных вариантах осуществления изобретения аморфные частицы кислоты формулы I могут иметь остаточное содержание органического растворителя не более около 5%, не более около 2%, не более около 1%, не более около 0,9%, не более около 0,8%, не более около 0,7%, не более около 0,6%, не более около 0,5%, не более около 0,4%, не более около 0,3%, не более около 0,2%, не более около 0,1%, не более около 0,05% или не более около 0,01% по массе.
Необходимо понимать, что численные значения пиков дифрактограмм рентгеновского излучения на порошке могут немного варьироваться от одного прибора к другому или от одного образца к другому, и поэтому указанные значения должны рассматриваться не как абсолютные, а с доступной вариабельностью, такой как 0,1º, которая рекомендована в Фармакопее Соединенных Штатов (страницы 387-389, 2007).
Способ получения
Также предоставлены способы для получения частиц кислоты формулы I в аморфной форме или кристаллической форме I или II. Способы включают стадию контакта кислоты формулы I с растворителем, в котором частицы кислоты формулы I в аморфной форме или кристаллической форме I или II могут быть образованы из раствора или преобразованы из одной твердой формы в другую. Способ может дополнительно включать стадию выделения, на которой частицы могут быть выделены обычным способом, таким как фильтрация и центрифугирование, с последующей промывкой растворителем и затем сушкой (например, сушка в вакуумной печи, сушка на воздухе или сушка десикантом).
Подходящие растворители для использования в получении твердых частиц в аморфной форме или кристаллической форме I или II включают, но не ограничиваются перечисленными, углеводороды, включая петролейный эфир, пентан, гексан(ы), гептан, октан, изооктан, циклопентан, циклогексан, метилциклогексан, бензол, толуол, ксилол, тетралин и кумен; хлорированные углеводороды, включая дихлорметан (ДХМ), 1,2-дихлорэтан, 1,1-дихлорэтен, 1,2-дихлорэтен, хлороформ, трихлорэтан, трихлорэтен, тетрахлорид углерода, хлорбензол и трифторметилбензол; спирты, включая метанол, этанол, изопропанол (IPA), 1-пропанол, 1-бутанол, 2-бутанол, трет-бутанол, 3-метил-1-бутанол, 1-пентанол, 2-метоксиэтанол, 2-этоксиэтанол и этиленгликоль; простые эфиры, включая диэтиловый эфир, диизопропиловый эфир, метил трет-бутиловый эфир (MTBE), дифениловый эфир, 1,2-диметоксиэтан, би(2-метоксиэтиловый)эфир, 1,1-диметоксиметан, 2,2-диметоксипропан и анизол; кетоны, включая ацетон, бутанон, метилэтилкетон (MEK), метилизопропилкетон, метилбутилкетон и метилизобутилкетон (MIBK); сложные эфиры, включая метилацетат, этилформиат, этилацетат, пропилацетат, изопропилацетат, изобутилацетат и бутилацетат; карбонаты, включая этиленкарбонат и пропиленкарбонат; амиды, включая формамид, N,N-диметилформамид (ДМФА) и N,N-диметилацетамид; нитрилы, включая ацетонитрил (ACN); сульфоксиды, такие как диметилсульфоксид (ДМСО); сульфоны, также как сульфолан; нитросоединения, такие как нитрометан и нитробензол; гетероциклы, такие как N-метилпирролидон, 2-метилтетрагидрофуран, тетрагидрофуран (ТГФ), диоксан и пиридин; карбоновые кислоты, такие как уксусная кислота, трихлоруксусная кислота и трифторуксусная кислота; фосфорамиды, такие как гексаметилфосфорамид; сульфид углерода; вода и их смеси.
Твердые частицы кислоты формулы I в кристаллической форме I могут быть получены из раствора или густой суспензии кислоты формулы I в растворителе с использованием обычных методов, включая, но не ограничиваясь перечисленными, охлаждение, замораживание, выпаривание растворителя или добавление антирастворителя.
В одном варианте осуществления изобретения способ для получения частиц формы I включает стадии (а) получения раствора кислоты формулы I в растворителе при первой температуре и (b) создания частиц формы I при второй температуре. Для ускорения образования частиц формы I способ также может включать стадию посева путем затравливания раствора кристаллами формы I перед или во время стадии (b). Способ может дополнительно включать стадию выделения, как описано в настоящем описании.
Раствор может быть получен из любых форм кислоты формулы I, включая, но не ограничиваясь перечисленными, масла, полутвердые вещества, твердые вещества (такие как аморфная форма или форма I или II) или их смеси. Раствор по стадии (а) может быть получен как насыщенный или почти насыщенный раствор при первой температуре. Насыщенный или почти насыщенный раствор может быть получен растворением достаточного количества кислоты формулы I в растворителе при температуре, которая выше, чем первая температура, так что, когда раствору позволяют остыть до первой температуры, получают насыщенный или почти насыщенный раствор. Достаточное количество кислоты формулы I может быть оценено на основании растворимости частиц формы I в растворителе при первой температуре, которая может быть определена с использованием способа, известного специалисту в области техники.
Первая температура может варьироваться от комнатной до температуры около температуры кипения растворителя, например, от около 20 до около 200ºС, от около 20 до около 150ºС или от около 20 до около 100ºС. Вторая температура может варьироваться от -100 до 100ºС, от около -50 до около 50ºС, от около -10 до около 30ºС, от около 20 до около 200ºС, от около 20 до около 150ºС или от около 20 до около 100ºС. Первая температура может быть выше или ниже или такой же, как вторая температура. Для максимального увеличения выхода и эффективности способа вторую температуру обычно устанавливают ниже, чем первая температура.
В одном варианте осуществления изобретения частицы формы I образуются путем выпаривания растворителя из раствора при второй температуре. Выпаривание растворителя может быть облегчено применением к раствору тепла и/или вакуума. В одном варианте осуществления изобретения растворителем является ацетонитрил, дихлорметан, ДМФА, 1,4-диоксан, метанол, 2-метоксиэтанол, MIBK, ацетон, 1-бутанол, MTBE, ДМСО, этанол, этилацетат, изобутилацетат, изопропилацетат, 1-пропанол, IPA, MEK, ТГФ или их смесь.
В другом варианте осуществления изобретения частицы формы I образуются путем охлаждения раствора до второй температуры. В таком случае вторую температуру устанавливают ниже, чем первая температура. В одном варианте осуществления изобретения растворителем является ДМФА, 1,4-диоксан, метанол, 2-метоксиэтанол, 1-бутанол, 1-пропанол, IPA, MEK, ТГФ или их смесь.
В еще одном варианте осуществления изобретения частицы формы I образуются путем добавления антирастворителя к растворителю при второй температуре.
Подходящие антирастворители включают, но не ограничиваются перечисленными, углеводороды, включая петролейный эфир, пентан, гексан(ы), гептан, октан, изооктан, циклопентан, циклогексан, метилциклогексан, бензол, толуол, ксилол, тетралин и кумен; хлорированные углеводороды, включая дихлорметан (ДХМ), 1,2-дихлорэтан, 1,1-дихлорэтен, 1,2-дихлорэтен, хлороформ, трихлорэтан, трихлорэтен, тетрахлорид углерода, хлорбензол и трифторметилбензол; спирты, включая изопропанол (IPA), 1-пропанол, 1-бутанол, 2-бутанол, трет-бутанол, 3-метил-1-бутанол, 1-пентанол, 2-этоксиэтанол и этиленгликоль; простые эфиры, включая диэтиловый эфир, диизопропиловый эфир, метил трет-бутиловый эфир (MTBE), дифениловый эфир, 1,2-диметоксиэтан, би(2-метоксиэтил)эфир, 1,1-диметоксиметан, 2,2-диметоксипропан и анизол; кетоны, включая бутанон, метилизопропилкетон, метилбутилкетон и метилизобутилкетон (MIBK); сложные эфиры, включая метилацетат, этилформиат, этилацетат, пропилацетат, изопропилацетат, изобутилацетат и бутилацетат; карбонаты, включая этиленкарбонат и пропиленкарбонат; нитросоединения, включая нитрометан и нитробензол; гетероциклы; сульфид углерода; вода и их смеси.
Когда в качестве пары растворитель/антирастворитель используют два растворителя, кислота формулы I имеет более высокую растворимость в растворителе, чем в антирастворителе. Необязательно, растворитель и антирастворитель в паре растворитель/антирастворитель являются, по меньшей мере, частично смешиваемыми. В одном варианте осуществления изобретения растворителем является ТГФ, метоксиэтанол, ДМСО, ДМФА или их смесь; и антирастворителем является гексан(ы), MTBE, толуол, вода или их смесь. В другом варианте осуществления изобретения парой растворитель/антирастворитель является ТГФ/гексан, ТГФ/вода, ДМФА/MTBE или ДМФА/вода.
В еще одном варианте осуществления изобретения частицы формы I получают путем добавления растворителя к антирастворителю при второй температуре. В одном варианте осуществления изобретения растворителем является ТГФ, метоксиэтанол, ДМСО, ДМФА или их смесь; и антирастворителем является гексан(ы), MTBE, толуол, изопропилацетат, вода или их смесь. В другом варианте осуществления изобретения парой растворитель/антирастворитель являются ТГФ/гексан, ТГФ/вода, 2-метоксиэтанол/гексан, ДМСО/вода или ДМФА/вода.
В другом варианте осуществления изобретения способ для получения частиц формы I включает стадии (а) получения густой суспензии кислоты формулы I в растворителе при первой температуре и (b) получение частиц формы I путем воздействия на густую суспензию второй температуры. Густая суспензия может быть получена из любых форм кислоты формулы I, включая, но не ограничиваясь перечисленными, масла, полутвердые вещества, твердые вещества (такие как аморфная форма или форма I или II) или их смеси. Способ может дополнительно включать стадию посева и/или стадию выделения, как описано в настоящем описании.
Первая и вторая температуры и растворитель являются такими, как определено в настоящем описании. В одном варианте осуществления изобретения растворителем является ацетонитрил, хлороформ, дихлорметан, ДМФА, 1,4-диоксан, метанол, 2-метоксиэтанол, MIBK, толуол, гексан(ы), ацетон, 1-бутанол, MTBE, ДМСО, этанол, этилацетат, этилформиат, гептан, изобутилацетат, изопропилацетат, 1-пропанол, IPA, MEK, ТГФ или их смесь.
В еще одном варианте осуществления изобретения способ для получения частиц формы I включает стадии (а) получения раствора кислоты формулы I в растворителе при первой температуре (b) образования густой суспензии путем охлаждения раствора до второй температуры; и (с) создания твердых частиц формы I путем воздействия на густую суспензию одного или более циклов нагревания и охлаждения. Способ может дополнительно включать стадию посева и/или стадию выделения, как описано в настоящем описании.
Первая и вторая температуры и растворитель являются такими, как определено в настоящем описании. В одном варианте осуществления изобретения растворителем является ацетонитрил, 1,4-диоксан, 2-метоксиэтанол, MIBK, ацетон, 1-бутанол, этанол, 1-пропанол, IPA, MEK, ТГФ, вода/ТГФ (3:7, об/об) или их смесь. Циклы нагревания и охлаждении могут проводиться в диапазоне температур от около -50 до около 120ºС, от около -50 до около 100ºС, от около -20 до около 80ºС, от около 0 до около 80ºС, от около 10 до около 80ºС, от около 20 до около 80ºС, от около 20 до около 60ºС или от около 20 до около 50ºС.
Частицы кислоты формулы I в кристаллической форме II могут быть получены из раствора или густой суспензии кислоты формулы I в растворителе с использованием обычных методов, включая, но не ограничиваясь перечисленными, охлаждение, замораживание, выпаривание растворителя или добавление антирастворителя.
В одном варианте осуществления изобретения способ для получения частиц формы II включает стадии (а) получения раствора кислоты формулы I в растворителе при первой температуре и (b) получения частиц формы II при второй температуре. Для ускорения образования частиц формы II способ также может включать стадию посева путем затравливания раствора кристаллами формы II перед или во время стадии (b). Способ может дополнительно включать стадию выделения, как описано в настоящем описании.
Раствор может быть получен из любых форм кислоты формулы I, включая, но не ограничиваясь перечисленными, масла, полутвердые вещества, твердые вещества (такие как аморфная форма или форма I или II) или их смеси. Раствор по стадии (а) может быть получен как насыщенный или почти насыщенный раствор при первой температуре. Насыщенный или почти насыщенный раствор может быть получен путем растворения достаточного количества кислоты формулы I в растворителе при температуре, которая выше, чем первая температура, так что, когда раствору позволяют остыть до первой температуры, получают насыщенный или почти насыщенный раствор. Достаточное количество кислоты формулы I может быть оценено на основании растворимости частиц формы II в растворителе при первой температуре, которая может быть определена с использованием метода, известного специалисту в области техники.
В одном варианте осуществления изобретения частицы формы II образуются путем выпаривания растворителя из раствора при второй температуре. Выпаривание растворителя может быть облегчено применением к раствору нагревания и/или вакуума. В одном варианте осуществления изобретения растворителем является ДМФА, 1,4-диоксан, метанол, 2-метоксиэтанол, 1-бутанол, 1-пропанол, IPA, MEK, ТГФ или их смесь.
В другом варианте осуществления изобретения частицы формы II образуются путем охлаждения раствора до второй температуры.
В еще одном варианте осуществления изобретения частицы формы II образуются путем добавления антирастворителя к растворителю при второй температуре. В одном варианте осуществления изобретения растворителем является ТГФ, метоксиэтанол, ДМСО, ДМФА или их смесь и антирастворителем является гексан(ы), MTBE, толуол, вода или их смесь.
В еще одном варианте осуществления изобретения частицы формы II образуются путем добавления раствора к антирастворителю при второй температуре. В одном варианте осуществления изобретения растворителем является ТГФ, метоксиэтанол, ДМСО, ДМФА и их смеси и антирастворителем является гексан(ы), MTBE, толуол, вода и их смеси. В другом варианте осуществления изобретения парой растворитель/антирастворитель является ДМФА/MTBE.
В другом варианте осуществления изобретения способ для получения частиц формы II включает стадии (а) получения густой суспензии кислоты формулы I в растворителе при первой температуре и (b) создания твердых частиц формы II путем воздействия на суспензию второй температуры. Густая суспензия может быть получена из любых форм кислоты формулы I, включая, но не ограничиваясь перечисленными, масла, полутвердые вещества, твердые вещества (такие как аморфная форма, или форма I или II), или их смеси. Способ может дополнительно включать стадию посева и/или стадию в