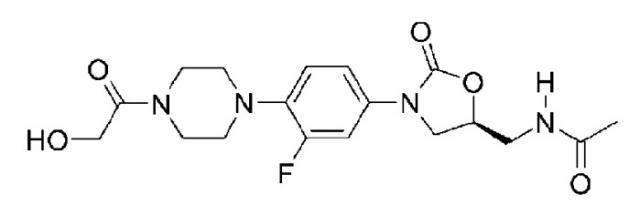
Новые производные оксазолидинона с циклическим амидоксимом или циклическим амидразоном и содержащие их фармацевтические композиции
Иллюстрации
Показать всеОписывается производное оксазолидинона общей формулы
где значения радикалов приведены в формуле изобретения, и фармацевтическая антибиотическая композиция, включающая в качестве активного ингредиента новое производное оксазолидинона, его гидрат, сольват, изомер или фармацевтически приемлемую соль. Данные соединения характеризуются широким антибактериальным спектром и высокой антибактериальной активностью против грам-положительных и грам-отрицательных резистентных бактерий, низкой токсичностью и могут применяться в качестве антибиотика. 2 н. и 5 з.п. ф-лы, 3 табл., 106 пр.
Реферат
Область техники, к которой относится изобретение
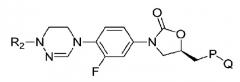
Настоящее изобретение относится к новым производным оксазолидинона, представленным химической формулой 1, в частности к новым производным оксазолидинона, содержащим группу циклического амидоксима или циклического амидразона.
[Химическая формула 1]
Настоящее изобретение также относится к фармацевтическим антибиотическим композициям, включающим в качестве эффективного ингредиента новые производные оксазолидинона, представленные химической формулой 1, их пролекарства, гидраты, сольваты, изомеры или фармацевтически приемлемые соли.
Уровень техники
Со времени открытия пенициллина фармацевтическими компаниями во всем мире были разработаны многочисленные антибиотики, включая β-лактамные антибиотики против бактериальных инфекций, сульфонамиды, тетрациклины, аминогликозиды, макролиды, хинолоны, гликопептиды, и другие подобные препараты. И, кроме того, в результате неправильного применения или применения антибиотиков непрерывно появляются новые резистентные к действию антибиотиков бактерии или полирезистентные бактерии. Вследствие этого во всем мире растет озабоченность по поводу этих проблем. Международное микробиологическое сообщество выражает обеспокоенность тем, что по мере развития резистентности к антибиотикам в ближайшем будущем может наблюдаться широкое распространение новых резистентных бактерий, на которые не оказывают действия любые применяемые в настоящее время антибиотики.
В целом, бактериальные патогены могут быть подразделены на грамположительные или грамотрицательные бактерии. В частности, очень важными являются грамположительные бактерии, например, Staphylococcus, Enterococcus, Streptococcus, и кислотоустойчивые бактерии. Это связано с тем, что, после того как они появляются в больничной среде, их трудно уничтожить и они имеют тенденцию превращаться в неподдающиеся лечению резистентные бактерии. Такие резистентные бактерии включают метициллин-резистентные Streptococcus (MRSA), метициллин-резистентные коагулаза-отрицательные Streptococcus (MRCNS), пенициллин-резистентные Streptococcus pneumoniae, полирезистентные Enterococcus faecium, или другие подобные бактерии.
Для эффективного клинического лечения грамположительных бактерий часто применяют гликопептидный антибиотик ванкомицин. Однако ванкомицин проявляет различные виды токсичности и, с момента появления ванкомицин-резистентных Enterococcus (VRE) в 1990 годах, постоянно появляются бактерии, резистентные к ванкомицину и другим антибиотикам на основе гликопептидов.
И в отношении таких антибиотиков, как β-лактамы, хинолоны и макролиды, применяемых для лечения инфекций верхних дыхательных путей, вызываемых специфическими грам-негативными бактериями, включающими Haemophilus influenzae (H. influenzae) и Moraxella catarrhalis (M. catarrhalis), появляются резистентные бактерии, такие как хинолон-резистентные Staphylococcus aureus (QRSA). Поэтому в настоящее время проводятся исследования по созданию новых антибиотиков.
Соответственно, для того чтобы коренным образом решить проблему резистентности к антибиотикам, крайне необходимо создать антибиотики с новой химической структурой и новым механизмом уничтожения микробов. В связи с этим, с тех пор как в 1984 году впервые было сообщено фирмой DuPont об антибиотике с новой химической структурой на основе оксазолидинона (European Paten Publication No. 127902), многие фармацевтические компании разработали и синтезировали ряд производных оксазолидинона.
Эти производные оксазолидинона являются новыми синтетическими антибиотиками и могут вводиться перорально. Антибиотики на основе оксазолидинона имеют полностью отличающуюся от классических антибиотиков химическую основу. Так как они ингибируют начальную стадию белкового синтеза, они проявляют исключительную противобактериальную активность против бактерий, резистентных к действию антибиотиков, в частности грамположительных бактерий, таких как метицилин-резистентные Staphylococcus aureus (MRSA), метицилин-резистентные Staphylococcus epidermidis (MRSE), хинолон-резистентные Staphylococcus aureus (QRSA), ванкомицин-резистентные Enterococcus (VRE) и полирезистентные Mycobacterium tuberculosis (MDRTB).
В качестве примеров соединений оксазолидинона, включающих оксазолидиноновое кольцо, в патентных документах US Patent Nos. 4948801, 4461773, 4340606, 4476136, 4250318 и 4128654 описаны производные 3-фенил-2-оксазолидинона, имеющие один или два заместителя (заместителей), и в патентном документе EP 0312000, публикациях J. Med. Chem. 32, 1673(1989), J. Med. Chem. 33, 2569 (1990), Tetrahedron Lett. 45,123(1989) и других подобных публикациях описаны производные 3-[(монозамещенный)фенил]-2-оксазолидинона, представленные химической формулой A.
[Химическая формула A]
И производные оксазолидинона, представленные химической формулой B и химической формулой C, были синтезированы фирмой Pharmacia & Upjohn (патентные документы WO 93/23384, WO 95/14684 и WO 95/07271). Соединение химической формулы B, "линезолид", является первым антибиотиком на основе оксазолидинона, одобренным Управлением по контролю качества продовольствия и медикаментов США (FDA), и он продается на рынке под торговым названием "зивокс" для перорального введения и инъекций. Однако большинство синтетических соединений оксазолидинона характеризуются рядом недостатков, ограничивающих их применение, таких как токсичность, низкая эффективность in vivo и низкая растворимость. Что касается линезолида, то его растворимость в воде составляет только около 3 мг/мл, что ограничивает его применение для инъекций.
[Химическая формула B]
[Химическая формула C]
В патентном документе WO 93/09103 раскрыты фенильные производные оксазолидинона, имеющие гетероциклическое кольцо, включая пиридин, тиазол, индол, оксазол, хинол и так далее, в 4-положении фенильной группы. Но заместителями гетероциклического кольца являются только простая алкильная группа или аминогруппа, и активность этих производных является отнюдь невысокой.
Для решения этих проблем в патентном документе WO 01/94342 раскрыты фенилпроизводные оксазолидинона, имеющие различные производные пиридина или фенила в 4-положении фенильной группы. Синтетические соединения имеют широкий спектр антибактериального действия и высокую антибактериальную активность. Несмотря на то, что соединения оксазолидинона, имеющие различные производные пиридина в 4-положении фенильной группы оксазолидинона, обладают более широким спектром антибактериального действия и высокой антибактериальной активностью по сравнению с линезолидом, тем не менее большинство из них имеют растворимость в воде 30 мкг/мл или менее, и поэтому они имеют ограниченное применение при приготовлении инъекционных препаратов.
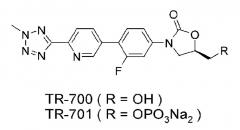
TR-700 и TR-701, представленные химической формулой D, разработаны фирмой Dong-A Pharmaceutical и лицензия на них недавно продана фирме Trius Therapeutics. TR-701 является пролекарством TR-700, и это средство находится сейчас на II стадии клинических испытаний. Проблема растворимости в случае TR-700 решается путем образования из него пролекарства TR-701, и TR-700 обладает антибактериальной активностью, превосходящей антибактериальную активность линезолида. Однако соединение проявляет более высокую токсичность (цитотоксичность, свойства по отношению к моноаминоксидазе, миелосупрессия, и так далее), чем линезолид, и поэтому ожидается, что оно будет иметь много ограничений для применения.
[Химическая формула D]
На основании вышеизложенного, можно сделать вывод, что еще не найдено соединение, которое имеет значительно более высокую антибактериальную активность, удовлетворительную растворимость и более низкую токсичность.
Описание изобретения
Задача, решаемая изобретением
Авторы настоящего изобретения синтезировали новые производные оксазолидинона с целью получения антибиотиков, имеющих значительно более высокую антибактериальную активность по сравнению с существующими антибиотиками, и имеющие более высокую растворимость для более простого приготовления из них пероральных и инъекционных препаратов. Было подтверждено, что новые производные оксазолидинона согласно настоящему изобретению обладают значительно более высокой антибактериальной активностью и значительно улучшенным спектром антибактериального действия.
В частности, соединение циклического амидоксима или циклического амидразона, представляемое настоящим изобретением, еще не было исследовано. В то время как циклический амидоксим или амидразон являются относительно хорошо известными соединениями, соединение циклического амидоксима или циклического амидразона, раскрываемые в настоящем изобретении, практически неизвестны. Введение циклической формы дает в результате значительно улучшенную абсорбционную способность и позволяет получать соль, имеющую соответствующую основность, в результате чего сильно повышается растворимость в воде. Повышенная растворимость в воде позволяет изготавливать инъекционные препараты без использования пролекарства и с низкой токсичностью.
Соответственно, задачей настоящего изобретения является разработка новых производных оксазолидинона, в частности новых соединений оксазолидинона с группой циклического амидоксима или группой циклического амидразона, с тем, чтобы повысить их растворимость, и разработка способов их получения.
Другой задачей настоящего изобретения является разработка фармацевтических антибиотических композиций, включающих в качестве активного ингредиента новые производные оксазолидинона, их пролекарства, гидраты, сольваты, изомеры или фармацевтически приемлемые соли.
Новые производные оксазолидинона согласно настоящему изобретению могут быть использованы для лечения внутрибольничной пневмонии, внебольничной пневмонии, осложненных инфекций кожи и структуры кожи, неосложненных инфекций кожи и структуры кожи, или инфекций, вызванных бактериями, резистентными к действию антибиотиков, в частности септицемии, вызванной ванкомицин-резистентными Enterococcus faecium (VRE) или линезолид-резистентными Enterococcus faecalis, или для комбинированной терапии заболеваний, связанных с грамм-отрицательными бактериями.
Решение задачи
Далее будут подробно описаны варианты осуществления настоящего изобретения.
Настоящее изобретение относится к новым производным оксазолидинона, представленным химической формулой 1, в частности новым соединениям оксазолидинона с группой циклического амидоксима или группой циклического амидразона. Настоящее изобретение также относится к фармацевтическим антибиотическим композициям, включающим в качестве активного ингредиента новое производное оксазолидинона, представленное химической формулой 1, его пролекарство, гидрат, сольват, изомер или фармацевтически приемлемую соль.
[Химическая формула 1]
в химической формуле 1,
R1 представляет водород, (C1-C6)алкил или (C3-C6)циклоалкил;
Y представляет -O- или -N(R2)-;
R2 представляет водород, циано, (C1-C6)алкил, (C3-C6)-циклоалкил, -(CH2)mOC(=O)R11, -(CH2)mC(=O)R12, -(CH2)mC(=S)R12, или -SO2R13, где алкил в R2 может быть дополнительно замещен с помощью одного или более заместителя (заместителей), выбранного из группы, состоящей из (C2-C6)алкенила, (C2-C6)алкинила, галогена, галоген(C1-C6)алкила, (C1-C6)алкил(C2-C6)алкинила, гидроксила, (C3-C6)циклоалкила и циано;
R11-R13 независимо представляют водород, (C1-C6)алкил, (C1-C6)алкокси, амино, (C3-C6)циклоалкил, (C2-C6)алкенил, (C2-C6)-алкинил или (C1-C6)алкилкарбонил, где алкил, алкокси, или амино в R11-R13 могут быть дополнительно замещены с помощью одного или более заместителя (заместителей), выбранного из галогена, амино, гидроксила, циано, (C1-C6)алкила, (C1-C6)-алкилкарбонилокси и гидрокси(C1-C6)алкила;
m представляет целое число от 0 до 2;
X1 и X2 независимо представляют водород или фтор;
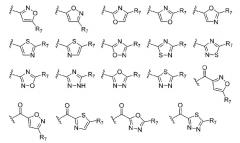
P представляет -O-, -NH-, или пятичленный ароматический гетероцикл со следующей структурой
Q представляет водород, -C(=O)R3, -C(=S)R4, -C(=O)NR5R6, -C(=S)NR5R6, или пятичленный ароматический гетероцикл со структурой, выбранной из следующих структур:
R3 и R4 независимо представляют водород, (C1-C6)алкил, (C1-C6)алкокси, (C3-C6)циклоалкил, (C2-C6)алкенил или (C2-C6)-алкинил;
R5 и R6 независимо представляют водород, (C1-C6)алкил, (C3-C6)циклоалкил или (C2-C6)алкенил;
R7 представляет водород, галоген, (C1-C6)алкил или (C3-C6)-циклоалкил; и
алкил в R3-R7 может быть дополнительно замещен с помощью одного или более заместителя (заместителей), выбранного из группы, состоящей из гидроксила, циано, галогена, (C1-C6)-алкилкарбонилокси и амино.
Используемый здесь термин "алкил" включает линейные и разветвленные структуры. Например, термин "(C1-C6)алкил" включает все возможные позиционные и геометрические изомеры, такие как метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, гексил и другие подобные алкилы.
Термин "(C3-C6)циклоалкил" включает все возможные позиционные и геометрические изомеры, такие как циклопропил, циклобутил, циклопентил, циклогексил, циклопропилметил, и другие подобные циклоалкилы.
Термин "(C2-C6)алкенил" включает все возможные позиционные и геометрические изомеры, такие как винил, пропенил, 1- и 2-бутенил, пентенил, и другие подобные алкенилы.
Термин "(C2-C6)алкинил" включает все возможные позиционные и геометрические изомеры, такие как ацетиленил, пропаргил, 1-пропинил, 2-пентинил, и другие подобные алкинилы.
Производные оксазолидинона согласно настоящему изобретению могут быть представлены химической формулой 2 или 3:
[Химическая формула 2]
[Химическая формула 3]
В химических формулах 2 и 3, R2, X1, X2, P и Q являются такими же, как в химической формуле 1.
Более предпочтительно, чтобы производные оксазолидинона согласно настоящему изобретению включали соединения, представленные химическими формулами 4-9:
[Химическая формула 4]
[Химическая формула 5]
[Химическая формула 6]
[Химическая формула 7]
[Химическая формула 8]
[Химическая формула 9]
В химических формулах 4-9,
R2 представляет водород, циано, (C1-C6)алкил, (C3-C6)-циклоалкил,
-(CH2)mOC(=O)R11, -(CH2)mC(=O)R12, -(CH2)mC(=S)R12 или -SO2R13, где алкил в R2 может быть дополнительно замещен с помощью одного или более заместителя (заместителей), выбранного из группы, состоящей из (C2-C6)алкенила, (C2-C6)алкинила, галогена, галоген(C1-C6)алкила, (C1-C6)алкил(C2-C6)алкинила, гидроксила, (C3-C6)циклоалкила и циано;
R11-R13 независимо представляют водород, (C1-C6)алкил, (C1-C6)алкокси, амино, (C3-C6)циклоалкил, или (C1-C6)-алкилкарбонил, где алкил, алкокси или амино в R11-R13 могут быть дополнительно замещены с помощью одного или более заместителя (заместителей), выбранного из галогена, амино, гидроксила, циано, (C1-C6)алкила, (C1-C6)алкилкарбонилокси и гидрокси(C1-C6)алкила;
m представляет целое число от 0 до 2;
P представляет -O-, -NH- или пятичленный ароматический гетероцикл со следующей структурой
Q представляет водород, -C(=O)R3, -C(=S)R4, -C(=O)NR5R6, -C(=S)NR5R6, или пятичленный ароматический гетероцикл со структурой, выбранной из следующих структур
R3 и R4 независимо представляют водород, (C1-C6)алкил или (C1-C6)алкокси;
R5 и R6 независимо представляют водород или (C1-C6)алкил; и
алкил в R3-R6 может быть дополнительно замещен с помощью одного или более заместителя (заместителей), выбранного из группы, состоящей из гидроксила, циано, галогена, (C1-C6)-алкилкарбонилокси и амино.
Примеры новых производных оксазолидинона согласно настоящему изобретению включают следующие соединения, но объем настоящего изобретения ими не ограничивается:
Новые производные оксазолидинона согласно настоящему изобретению имеют группу циклического амидоксима или группу циклического амидразона и могут быть приготовлены в виде пролекарств, гидратов, сольватов, изомеров или фармацевтически приемлемых солей, для того чтобы улучшить абсорбцию в организме или повысить растворимость. Поэтому пролекарства, гидраты, сольваты, изомеры или фармацевтически приемлемые соли также входят в объем настоящего изобретения.
Новые производные оксазолидинона согласно настоящему изобретению могут быть превращены в фармацевтически приемлемые соли. Термин "фармацевтически приемлемые соли" относится к "солям присоединения кислоты", подходящих для введения соединений этого изобретения, и они включают метансульфонат, этансульфонат, фумарат, сукцинат, гидрохлорид, цитрат, малат, тартрат и (менее предпочтительно) гидробромид, фосфат, сульфат и другие подобные соли. Кроме того, соответствующая основная соль включает, например, соль щелочного металла (например, натриевую соль) или соль щелочноземельного металла (например, соль кальция или магния), соль органического амина (например, триэтиламина, морфолина, N-метилпиперидина, N-этилпиперидина, дибензиламина, N,N-дибензилэтиламина и трис-(2-гидроксиэтил)амина), или аминокислоты (например, N-метил-d-глутамина и лизина). Соли могут включать один или более катион (катионов) или анион (анионов) в зависимости от числа заряженных группы (групп) и валентности соответствующего катиона (катионов) или аниона (анионов). Предпочтительной фармацевтически приемлемой основной солью является натриевая соль. Однако для того чтобы облегчить выделение соли во время ее приготовления, предпочтительной может являться соль, менее растворимая в выбранном растворителе.
Производное оксазолидинона настоящего изобретения может присутствовать либо в форме сольвата, например в виде гидрата, либо не в сольватированной форме. Сольваты производных оксазолидинона согласно настоящему изобретению включают все фармацевтически активные сольватированные формы.
Производные оксазолидинона настоящего изобретения могут быть введены в форме пролекарства, которое трансформируется в организме человека или животного с образованием активного ингредиента настоящего изобретения. Пролекарство может быть образовано путем введения соответствующей группы или заместителя, способных модифицировать или улучшать физические и/или фармакологические свойства исходного соединения. Примеры пролекарства включают эфиры соединений настоящего изобретения и их фармацевтически приемлемые соли, которые могут подвергаться гидролизу in vivo.
В данной области техники известны различные типы форм пролекарств. Например, смотрите следующие публикации:
a) Design of Prodrugs, edited by H. Bundgaard, (Elsevier, 1985) и Methods in Enzymology, Vol. 42, p.309-396, edited by K. Widder, et al. (Academic press, 1985);
b) A Textbook of Drug Design и Development, edited by Krogsgaard-Larsen и H. Bundgaard, Chapter 5 "Design and Application of Prodrugs ", by H. Bundgaard p. 113-191 (1991);
c) H. Bundgaard, Advanced Drug Delivery Reviews, 8, 1-38 (1992);
d) H. Bundgaard, et al., Journal of Pharmaceutical Sciences, 77, 285 (1988); и
e) N. Kakeya, et al., Chem. Pharm. Bull., 32, 692 (1984).
Примеры пролекарства согласно настоящему изобретению включают следующие соединения.
Как показано в приведенных выше примерах, фосфонатная или ацетильная группа может быть присоединена по гидроксильной группе, так что после введения пролекарство трансформируется в активную форму. В качестве варианта, может быть присоединена аминокислота или может быть образована карбонатная форма. Форму пролекарства используют главным образом в случаях относительно низкой растворимости или низкой абсорбционной способности. Использование пролекарства помимо повышения растворимости и абсорбционной способности может приводить к улучшению абсорбции, распределения, метаболизма и экскреции (ADME) и PK профиля.
Соединение настоящего изобретения имеет хиральный центр в позиции C-5 кольца оксазолидинона. Предпочтительный диастереомер производного оксазолидинона согласно настоящему изобретению представлен химической формулой 1. По сравнению с эпимером, представленным химической формулой 1b, он проявляет улучшенные свойства в отношении моноаминоксидазы.
[Химическая формула 1b]
В случае использования смеси эпимеров относительно хирального центра оксазолидинона, для того чтобы достигать сопоставимого фармакологического эффекта по сравнению со случаем, когда используют только один зеркальный изомер, можно регулировать ее количество с учетом доли энантиомеров (или диастереомеров).
Кроме того, некоторые соединения настоящего изобретения в зависимости от их заместителя (заместителей) могут иметь другой хиральный центр. Все оптические изомеры, диастереомеры и смеси, имеющие антибактериальную активность, входят в объем настоящего изобретения. Метод получения оптически активных форм (например, перекристаллизация, хиральный синтез, ферментативное разделение, биотрансформация или разделение смесей с помощью хроматографии) и метод измерения антибактериальной активности являются известными в этой области техники.
Так как соединения, представленные химической формулой 1, или их соли могут таутомеризироваться, и даже если только один из возможных таутомеров приведен в химических формулах или схемах реакций в описании заявки, то настоящее изобретение охватывает все таутомеры, имеющие антибактериальную активность, и не ограничивается таутомерной формой, приведенной в химических формулах или схемах реакций.
Кроме того, соединение настоящего изобретения может проявлять полиморфизм. Поэтому все полиморфные соединения, имеющие антибактериальную активность, входят в объем настоящего изобретения.
Новые производные оксазолидинона согласно настоящему изобретению могут быть получены с помощью альтернативных способов в зависимости от того, какие они имеют заместители. Например, они могут быть получены согласно способам, приведенным в качестве примеров на схемах 1-6. Способы получения, приведенные на схемах 1-6, являются только примерами, и они могут быть легко модифицированы специалистами в этой области в зависимости от конкретных заместителей. Соответственно, примеры способов в схемах 1-6 не ограничивают способ получения соединений оксазолидинона настоящего изобретения. Если не указано иначе, то определения для заместителей в схемах реакций являются такими же, как в химической формуле 1.
Производные оксазолидинона химической формулы 1 согласно настоящему изобретению могут быть синтезированы с помощью различных методик синтеза, в зависимости от X1, X2, Y, P и Q. Характерные методы синтеза в случаях, когда X1 является атомом фтора (F), и X2 является атомом водорода (H), приведены в качестве примеров в схемах 1-5. И случай, когда оба, и X1 и X2, являются H или F, приведен в качестве примера на схеме 6.
Синтезы соединений циклического амидразона, когда Y является атомом азота (N-R2), методы синтеза в случае, когда P является NH, приводятся в качестве примеров на схемах 1 и 2, метод синтеза в случае, когда P является ароматическим гетероциклом (например, триазолом), приводится в качестве примера на схеме 3, и случай, когда P является атомом кислорода (O), приводится в качестве примера на схеме 4. Кроме того, метод синтеза соединений циклического амидоксима, когда Y является O, приводится в качестве примера на схеме 5.
Согласно схеме 1, 3,4-дифторнитробензол взаимодействует с этаноламином с получением соединения I. После защиты спиртовой и аминной групп последовательно с помощью трет-бутилдиметилсилила (TBS) и трет-бутилоксикарбонила (boc) (соединение II), нитрогруппу восстанавливают до амина с использованием Pd/C (соединение III). Присоединяют бензилоксикарбонильную группу (cbz) с использованием бензилхлорформиата (Cbz-Cl) с получением соединения IV. Соединение IV взаимодействует с (R)-глицидил бутиратом и н-бутиллитием (n-BuLi) с образованием хирального соединения V. Соединение V реагирует с метансульфонилхлоридом (Ms-Cl) (соединение VI), и затем с азидом натрия (NaN3) (соединение VII). После превращения азидной группы в амин с использованием Pd/C в атмосфере газообразного водорода, присоединяют группу cbz с использованием Cbz-Cl с образованием соединения VIII. Соединение VIII обрабатывают с помощью хлористоводородной кислоты для удаления защитных групп (boc и tbs) с получением соединения IX, которое взаимодействует с метансульфонилхлоридом (Ms-Cl) с образованием соединения X. Взаимодействие соединения X с гидразином и затем взаимодействие с триметилортоформиатом дает соединение циклического амидразона XII. После удаления группы cbz из соединения XII (соединение XIII), в него может быть введен целый ряд групп Q. Кроме того, после удаления формильной группы может быть введен целый ряд групп R2. Конкретные примеры описаны при получении соединений.
[Схема 1]
Согласно схеме 2, в случае, когда Q является ароматическим гетероциклом, не содержащим карбонильную группу, в соединение VI сначала вводят группы P и Q. Реакция с аминоизоксазолом приведена в качестве примера на схеме 2. Соединение VI взаимодействует с аминоизоксазолом с аминогруппой, защищенной группой boc, с образованием соединения XIV. Удаление boc и tbs групп с помощью хлористоводородной кислоты дает соединение XV, последующее мезилирование и затем реакция с гидразином приводили к образованию соединения XVII, которое взаимодействовало с триметилортоформиатом с образованием соединения циклического амидразона. После удаления формильной группы, вводили различные R2 группы. Конкретные примеры описаны при получении соединений.
[Схема 2]
Согласно схеме 3, случай, когда P является ароматическим гетероциклом, подразделяется на 1) когда Q является H и 2) когда Q является заместителем, отличным от H. Сначала, для соединения, в котором Q является H, азидное соединение (соединение VII) взаимодействует с 2,5-норборнадиеном с образованием триазольного соединения (соединение XVIII). Удаление boc и tbs групп с помощью хлористоводородной кислоты дает соединение XIX. Мезилирование (соединение XX), обработка с помощью гидразина и затем с помощью триметилортоформиата дает соединение циклического амидразона. Соединения, в которых Q является заместителем, отличным от H, может быть получено следующим образом; соединение XXI дихлортозилгидразона получают, как показано, путем реакции тозилгидразида и хлорангидрида. Взаимодействие амина XIII и тозилгидразона XXI дает промежуточное соединение циклического амидразона, которое после удаления формильной группы получают с различными R2 группами. Конкретные примеры описаны при получении соединений.
[Схема 3]
Случай, когда P является атомом кислорода (O), и Q является H, приведен в качестве примера на схеме 4. Соединение, в котором P является O, и Q является ароматическим гетероциклом, может быть синтезировано по схеме 2. Для соединения, в котором Q является H, осуществление защиты спиртовой группы соединения V с помощью бензоила дает соединение XXII. Удаление boc и tbs защитных групп с помощью хлористоводородной кислоты (соединение XXIII) и мезилирование дает соединение XXIV, которое взаимодействует с гидразином с образованием соединения XXV. Во время реакции с гидразином обнаружено, что бензоильная группа удаляется. Соединение гидразина реагирует с триметилортоформиатом с образованием соединения циклического амидразона. После удаления формильной группы вводят различные R2 группы. Конкретные примеры описаны при получении соединений.
[Схемы 4]
Метод синтеза соединения циклического амидоксима, в котором Y является O, приводится в качестве примера на схеме 5. В зависимости от того, P-Q является ли OH, или не является, случаи подразделяются на 1) и 2).
1) Если P-Q на является OH, P и Q группы вводят в соединение VI в соответствии со схемами 1-4 с образованием соединения XXVI, которое обрабатывают с помощью хлористоводородной кислоты для удаления boc и tbs групп, получая соединение XXVII. Соединение XXVII подвергают реакции Мицунобу с гидроксифталимидом с получением соединения XXVIII. Удаление фталимида с помощью гидразина и затем взаимодействие с триметилортоформиатом дает соединение циклического амидоксима.
2) Когда P-Q является OH, спиртовая группа оксазолидиноновой части должна быть защищена с помощью бензоильной группы (соединение XXIII). Реакция Мицунобу с гидроксифталимидом дает соединение XXIX. Удаление фталимида с помощью гидразина и затем реакция с триметилортоформиатом дает соединение циклического амидоксима. И опять, бензольную группу удаляют во время реакции с гидразином. Соединение циклического амидоксима может также быть получено путем реакции с триметилортоформиатом.
[Схема 5]
Случаи, когда X1 является F, и X2 является H, были описаны на схемах 1-5. Согласно схеме 6, соединение, в котором оба, и X1 и X2, являются H или F, может быть синтезировано таким же образом, как в схемах 1-5, с той только разницей, что в качестве исходного материала используют 4-фторнитробензол или 3,4,5-три-фторнитробензол.
*[Схема 6]
Композиции настоящего изобретения могут находиться в соответствующей форме для перорального введения (например, в форме таблетки, пастилки, твердой или мягкой капсулы, водной или масляной суспензии, эмульсии, диспергируемого порошка или гранулы, сиропа или эликсира), в соответствующей форме для топического применения (например, в форме крема, мази, геля, водного или масляного раствора или суспензии), в соответствующей форме для окулярного введения, в соответствующей форме для введения путем ингаляции (например, в форме тонкоизмельченного порошка или жидкого аэрозоля), в соответствующей форме для введения путем инсуффляции (например, в форме тонкоизмельченного порошка), или в соответствующей форме для парентерального введения (например, в форме водного или масляного стерильного раствора для внутривенной, подкожной, сублингвальной или внутримышечной инъекции, или ректального суппозитория).
Помимо соединений настоящего изобретения, фармацевтические композиции настоящего изобретения могут дополнительно включать (то есть могут быть приготовлены в виде лекарственной формы вместе с) один или более известный препарат(ы), выбранный из применяемых в медицине антибактериальных средств (например, из β-лактама, макролида, хинолона или аминогликозида) и противовоспалительных средств (например, из противогрибкового триазола или амфотерицина), или могут быть введены в комбинации с одним или более известным лекарственным средством (средствами). Для усиления терапевтического эффекта композиции могут дополнительно содержать карбапенем, например меропенем или имипенем. Кроме того, соединения настоящего изобретения могут быть введены в комбинации или приготовлены в виде лекарственной формы вместе с бактерицидным увеличивающим проницаемость белком (BPI) или ингибитором выкачивающего насоса, для того чтобы повысить активность против грамотрицательных бактерий и бактерий, резистентных к антибиотикам.
Соединения настоящего изобретения могут быть введены в комбинации или приготовлены в виде лекарственной формы вместе с витамином, например, витамином B, таким как витамин B2, витамин B6 или витамин B12, и фолиевая кислота. Кроме того, соединения настоящего изобретения могут быть введены в комбинации или приготовлены в виде лекарственной формы вместе с ингибитором циклооксигеназы (COX), в частности, ингибитором COX-2. Кроме того, соединения настоящего изобретения могут быть введены в комбинации или приготовлены в виде лекарственной формы вместе с антибактериальным средством, активным против грамположительных бактерий или грамотрицательных бактерий.
Композиции настоящего изобретения могут быть приготовлены с помощью широко используемого известного фармацевтического вспомогательного средства. Соответственно, композиция, предназначенная для перорального введения, может включать, например, одно или более окрашивающее вещество, подсластитель, ароматизатор и/или антисептик. Предпочтительно, чтобы фармацевтическая композиция для внутривенного введения могла включать (например, для того чтобы повысить стабильность) соответствующий бактерицид, антиоксидант, восстановитель, или вещество, усиливающее экскрецию.
Композиция для перорального введения может находиться в форме твердой желатиновой капсулы, приготовленной путем смешения активного ингредиента с инертным твердым разбавителем, например, карбонатам кальция, фосфатом кальция или каолином, или в форме мягкой желатиновой капсулы, приготовленной путем смешения активного ингредиента с водой или маслом, например, арахисовым маслом, жидким парафином или оливковым маслом.
Водная суспензия обычно включает одно или более суспендирующее средство (средства), например, натрий карбоксиметилцеллюлозу, метилцеллюлозу, гидроксипропилметилцеллюлозу, альгинат натрия, поливинилпирролидон, трагакантовую камедь или гуммиарабик, или диспергирующее или смачивающее средство (средства), например, лецитин, продукт конденсации оксида алкилена с жирной кислотой (например, полиоксиэтиленстеарат), продукт конденсации оксида этилена с длинноцепочечным алифатическим спиртом, например, гептадекаэтиленоксицетанол, продукт конденсации оксида этилена с неполным эфиром, полученным из жирной кислоты и гексита, например, моноолеат полиоксиэтиленсорбита, продукт конденсации оксида этилена с неполным эфиром, полученным из жирной кислоты и ангидрида гексита, например, моноолеат полиэтиленсорбита, помимо активного ингредиента в форме тонкоизмельченного порошка. Водная суспензия может дополнительно включать один или более антисептик (антисептиков) (например, этил или пропил п-гидроксибензоат), антиоксидант (антиоксидантов) (например, аскорбиновую кислоту), окрашивающее средство (средства), ароматизатор (ароматизаторы), и/или подсластитель (подсластители) (например,