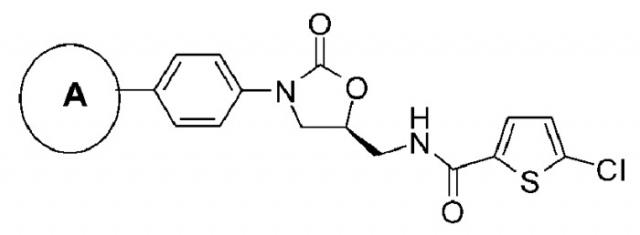
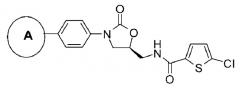
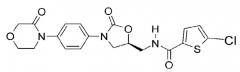
Ингибиторы fxa с циклическим амидоксимом или циклическим амидразоном в качестве p4 субъединицы, способы их получения и их фармацевтические композиции и производные
Иллюстрации
Показать всеИзобретение относится к соединениям формулы 1, обладающим свойствами ингибитора фактора Ха, их фармацевтически приемлемым солям и фармацевтическим композициям на их основе. В формуле 1
[Формула 1]
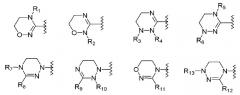
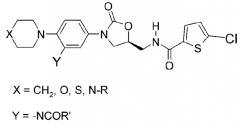
цикл А обозначает остаток, выбранный из группы, включающей следующие структуры:
R1-R2 независимо представляют собой Н, (С1-С7) алкил или (С3-С7) циклоалкил, R3 и R4 образуют цикл посредством соединения с (С3-C5) алкиленом, атом углерода алкилена может быть замещен карбонилом; R13 означает Н, (С1-С7)алкил или формил. 5 н. и 3 з.п. ф-лы, 1 ил., 3 табл., 22 пр.
Реферат
Область техники
Настоящее изобретение относится к новым оксазолидиноновым производным с циклической амидоксимной или циклической амидразоновой группой, представленных формулой I, их фармацевтически приемлемым солям, способам их получения и содержащим их фармацевтическим композициям.
[Формула I]
где цикл А представляет собой остаток, выбранный из группы, включающей следующие структуры:
Антитромботический и антикоагулянтный эффект новых оксазолидиноновых производных по настоящему изобретению с циклической амидоксимной или циклической амидразоновой группой, представленных формулой I, приписывают ингибированию активной коагулирующей протеазы, известной как фактор Xa, или других активных сериновых протеаз, таких как фактор VIIa, фактор IXa или тромбин.
Уровень техники
Факторы свертывания крови распределены в плазме, притом что различные типы факторов, от 1-го фактора свертывания до 13-го фактора свертывания, работают по каскадному типу, обеспечивая в результате свертывание крови. Механизм, по которому индивидуальные факторы свертывания крови участвуют в свертывании крови, показан на фиг. 1.
Как показано на фигуре 1, свертывание крови происходит в результате ряда сложных реакций. В целом, инактивированные предшественники активируются специфическими активными факторами свертывания крови (указаны индексом "a", прибавленным после номера фактора коагуляции). Затем активируются следующие факторы свертывания крови. Большинство из этих активированных факторов свертывания крови представляют собой ферменты семейства сериновых протеаз. Они прилипают к поверхности активированного тромбоцита на месте раны, постепенно активируют факторы свертывания крови и, в конце концов, продуцируют фибриновый сгусток, приводя к остановке кровотечения.
Тромбин является многофункциональным фактором коагуляции, который вовлечен в конечные стадии коагуляционного каскада. Протромбин, предшественник тромбина, активируется комплексом протромбиназы, состоящим из фактора Va, фактора Xa, Ca++ и фосфолипидов (PL), получая тромбин, который преобразует фибриноген в фибрин. Генерированные фибрины покрывают агрегированный тромбоцит, индуцируя свертывание крови. В заключение фибрины сшиваются фактором XIIIa, продуцируя стабильный фибриновый сгусток.
Для образования комплекса протромбиназы фактор X активируется в фактор Xa, что опосредовано, главным образом, комплексом Хазы. Фактор VIIIa, фактор IXa, Ca++ и фосфолипиды (PL), генерируемые по внутреннему пути, или фактор VIIa, фактор ткани (TF) и Ca++, генерируемые по внешнему пути, работают как комплекс Хазы.
Тромбин также активирует фактор V и фактор VIII. Если происходит перепроизводство тромбина, сам кровеносный сосуд может забиться. Чтобы избежать закупоривания, тромбин запускает действие по ингибированию свертывания крови. То есть, тромбин связывается с тромбомодулином, активируя протеин C. Активированный протеин C (APC) образует комплекс с протеином S, инактивирует фактор Va и фактор VIIIa.
Фактически фактор Xa сам по себе является сериновой протеазой и включен в сложный процесс свертывания крови. Фактор Xa, как существенный член комплекса протромбиназы, действует как катализатор для преобразования протромбина в тромбин. Тромбин преобразует фибриноген в фибриновые мономеры, и генерированные таким образом фибриновые мономеры включаются в образование и стабилизацию тромба. Таким образом, в результате чрезмерного или несоответствующего продуцирования тромбина может происходить тромбоэмболия. Следовательно, ингибирование самого тромбина или генерации тромбина может приводить к снижению образования фибрина, вовлеченного в образование тромба, и предупреждению тромбоэмболии.
Вкратце, ингибирование фактора Xa приводит к ингибированию образования тромбина, посредством чего можно предупредить или ослабить тромбоэмболию. Соединение, представленное в настоящем изобретении формулой I, и его фармацевтически приемлемая соль могут ингибировать фактор Xa, что в конечном счете согласно изложенной выше логике ведет к предупреждению тромбоэмболических заболеваний (MI, удара, PE и др.).
Среди соединений, известных в качестве ингибиторов фактора Xa, типичными примерами ингибиторов белка являются антистазин (ATS) и клещевой антикоагулянтный пептид (TAP). ATS (состоящий из 119 аминокислот) представляет собой природный пептид, выделяемый из пиявок, имеющий значение Ki 0,05 нМ относительно фактора Xa. TAP также представляет собой пептид, выделяемый из клещей, который составлен из 60 аминокислот и имеет значение Ki 0,5 нМ относительно фактора Xa. Однако эти ингибиторы имеют ограниченное клиническое применение; только гепарин или его сульфатированные полисахаридные аналоги имеют клиническое применение с некоторым ограничением.
В качестве ингибитора свертывания крови, в частности ингибитора фактора Xa, разработано низкомолекулярное соединение, которое описано в W095291S9. Между тем, в WO9933800 описан ингибитор фактора Xa, имеющий индольные фрагменты. Кроме того, различные ингибиторы фактора Xa раскрыты и в процессе разработки. Например, гетероциклическое соединение, содержащее атом азота (WO2004058743), имидазольные производные (WO2004050636), пиразольные производные (WO2004056815), индол-2-карбоксамидные производные (WO2003044014), оксибензамидные производные (WO200205I831), гуанидин/амидиновые производные (WO2002046159), амино-бициклические пиразинон/пиридиноновые производные (WO2004002405) и др.
Чтобы быть клинически пригодными в качестве ингибиторов FXa, эти молекулы должны обладать высоким антитромботическим эффектом, высокой стабильностью в плазме и печени, подходящей селективностью в отношении других родственных сериновых протеаз (тромбин, трипсин, катепсин G и др.), низкой токсичностью и удовлетворительной биодоступностью.
Наиболее прогрессивным соединением, содержащим оксазолидинон, аналогично соединению по настоящему изобретению, является ривароксабан (формула A), который в настоящее время находится в фазе III клинической оценки. Некоторые оксазолидиноновые производные, представленные формулой 2, описаны в WO 01/47917. Однако сообщается, что некоторые из этих соединений имеют ограниченную растворимость; конкретный пример данной проблемы представляет ривароксабан. Растворимость ривароксабана составляет только 8 мг/л. В результате слабой растворимости может возникать множество практических ограничений, включая вариабельность и медленное разложение. Эти проблемы можно обойти, вводя высокорастворимый фрагмент.
[Формула A]
[Формула B]
В WO 2004/83174 описано применение пиразольных производных, включая апиксабан. Некоторые из этих ингибиторов являются циклическими амидиновыми и сульфониламидиновыми производными, представленными формулой C.
Однако не имеется прецедентов, аналогичных настоящему изобретению, которые описывают специфическое введение циклического амидоксима или циклического амидразона в оксазолидиноновый каркас с целью получения ингибиторов фактора Xa. Фактически, мало что известно в отношении обоснования присутствия циклического амидоксима или циклического амидразона в конструкции лекарства.
[Формула C]
Главной тенденцией последних исследований FXa и ингибитора тромбина является реализиция амидиновых функций. Предполагается, что амидиновая функция, так называемая группа P1, связывает Asp189, расположенный на дне кармана S1. И FXa, и тромбин распознают аргининовый остаток в природном субстрате как сайт P1. Амидиновая группа (в том числе гуанидиновые производные), замещающая гуанидин в аргинине, является высокогидрофильной. Таким образом, ингибиторы с амидиновой функцией обычно не очень хорошо абсорбируются, и даже если они абсорбируются, то очень быстро выводятся вследствие присущей им высокой полярности амидина (Drugs of the Future, 1999, 24(7), 771).
Сам амидин характеризуется сильной основностью (PKa: примерно 12,5). Из-за формально положительного заряда в физиологических условиях амидиновый ингибитор обычно демонстрирует слабую абсорбцию. Следовательно, необходимо произвести изменения в направлении менее основных альтернатив. Типичными примерами таких веществ являются пиридиновое производное, амидразон, циклический амин, алкиламинное производное, аминобензизоксазол и др. (US 6958356). Имеются также фундаментально отличные подходы к преодолению этих проблем, включающие использование амидоксимов. Амидоксим легко синтезируют, добавляя гидроксильную группу к амидиновой структуре, которая представляет собой пролекарство, основываясь на том, что слабая связь N-O легко восстанавливается in vivo до амидина. Этот подход выгодно использует тот факт, что PKa амидоксима заметно ниже (8-9), чем соответствующее значение для амидина. Другим примером пролекарства такого же типа является ксимелагатран. Эта тенденция видна не только при исследовании FXa-ингибитора, но также при исследовании ингибитора тромбина. Однако большинство этих попыток оказываются не такими хорошими, как ожидалось. В качестве попытки третьего типа вводят нейтральные группы P1. В отличие от лекарств другого класса FXa и ингибиторы тромбина имеют тенденцию демонстрировать хорошую эффективность, если они присутствуют в крови при высоких концентрациях. Кроме того, очень важна концентрация в крови свободного лекарственного средства, не связанного с белками сыворотки. В случае ингибитора с нейтральной группой P1 существует тенденция высокого связывания белка, в результате чего эффективность является меньшей, чем ожидалось.
Для преодоления этих проблем авторы настоящего изобретения вводят относительно полярную группу в положения, отличные от сайта P1, при фиксированном положении нейтральной группы на сайте P1. Параллельно с этой логикой включаются некоторые другие важные факторы для улучшения фармацевтического эффекта, которые приведены далее: 1) существенное повышение растворимости в воде; 2) низкое связывание белка плазмы; если концентрация свободного лекарственного средства является высокой, эффективность в PT-исследовании также повышается, даже если FXa-связывающая афинность отчасти снижается.
Сайт, выбранный для введения полярной группы, в данном изобретении является подсайтом P4 ингибитора, и логика выбора является следующей. Сайт S4 от FXa имеет U-образный сайт связывания, окруженный с трех сторон Tyr99, Phe174 и Trp215. Сайт связывания составлен только из боковых цепей ароматических аминокислот, в отличие от тромбина, окруженного Leu99, Ile174 и Trp215. Различие используют в конструкции лекарства.
S4 карман от FXa является подходящим при взаимодействии с катионным остатком, которое обычно называют "π-катионным взаимодействием". Фактически, некоторые ингибиторы конструируют и синтезируют таким образом, чтобы они имели положительный заряд на сайтах P4. В данном изобретении циклический амидоксим или амидразон вводят в сайт P4 для улучшения растворимости в воде и повышения эффекта лекарственного средства по снижению связывания белка, как упоминается выше. Причина выбора циклической формы заключается в том, что авторы полагают, что абсорбцию можно улучшить, снижая количество NH связей, которые обычно оказывают отрицательное влияние на абсорбцию. Согласно последним исследованиям для лекарства более предпочтительно иметь меньше доноров водородных связей (HBD), чем акцепторов водородной связи (HBA). Согласно правилу Липински можно допустить наличие до 10 HBA, а количество HBD ограничено только 5 (Adv. Drug Deliveiy Rev., 2001, 46, 3-26), и, в частности, в случае нового лекарства среднее количество HBD составляет примерно 2, предполагая, что число HBD ограничено более строго (J. Med. Chem. 2004, 47, 6338-48). Амидоксимная или амидразоновая группа сама по себе имеет основный характер, что делает возможным более легкое разделение-очистку-хранение в виде соли и, как результат, ожидается повышенная растворимость в воде.
Вкратце, авторы вводят амидоксим или амидразон в сайт P4. Для снижения числа HBD авторы используют циклическую форму функции, получая ингибиторы, более похожие на лекарство.
Фактически, установлено, что соединения формулы I по настоящему изобретению имеют указанные выше преимущества. Представлена растворимость в воде и уровень связывания белка вместе со значениями 2× PT и Ki.
Раскрытие изобретения
Техническая задача
Авторы настоящего изобретения синтезировали новые оксазолидиноновые производные с циклической амидоксимной или циклической амидразоновой группой, имеющей подходящие свойства, которые можно применять для приготовления фармацевтических препаратов. В частности, оксазолидиноновые производные с циклической амидоксимной или циклической амидразоновой группой демонстрируют FXa ингибирующее действие, так что их можно применять для лечения или профилактики тромбоза, инфаркта миокарда, артериосклероза, воспаления, апоплексии, стенокардии, рецидивирующей стриктуры после ангиопластики и тромбоэмболии, например перемежающейся хромоты. Кроме того, оксазолидиноновые производные с циклическим амидоксимом или циклическим амидразоном по настоящему изобретению могут служить в качестве ингибитора в отношении фактора VIIa, фактора IXa и тромбина, которые представляют собой факторы коагуляции в каскаде свертывания крови.
Целью настоящего изобретения является обеспечение новых оксазолидиноновых производных с циклической амидоксимной или циклической амидразоновой группой, демонстрирующих свойство ингибирования фактора Xa, или их фармацевтически приемлемых солей.
Другой целью настоящего изобретения является обеспечение фармацевтической композиции для противодействия коагуляции, содержащей в качестве активного ингредиента оксазолидиноновые производные с циклической амидоксимной или циклической амидразоновой группой или их фармацевтически приемлемые соли.
Также целью настоящего изобретения является обеспечение фармацевтической композиции, содержащей в качестве активного ингредиента оксазолидиноновые производные с циклической амидоксимной или циклической амидразоновой группой или их фармацевтически приемлемые соли, для лечения или профилактики тромбоза, инфаркта миокарда, артериосклероза, воспаления, удара, стенокардии, рестеноза, перемежающейся хромоты, флеботромбоза, легочной эмболии, артериального тромбоза, ишемии миокарда или тромбоэмболии.
Кроме того, целью настоящего изобретения является обеспечение фармацевтической композиции для лечения или профилактического лечения заболевания коронарной артерии, заболевания церебральных артерий и заболевания периферических артерий, характеристически подвергаемых совместному лечению оксазолидиноновыми производными с циклической амидоксимной или циклической амидразоновой группой или их фармацевтически приемлемыми солями и тромболитическим агентом.
Также целью настоящего изобретения является обеспечение применения оксазолидиноновых производных с циклической амидоксимной или циклической амидразоновой группой или их фармацевтически приемлемых солей в качестве антикоагулянта для in vitro консервации крови, плазмы или продуктов крови.
Техническое решение
Настоящее изобретение относится к новым оксазолидиноновым производным с циклической амидоксимной или циклической амидразоновой группой, представленным формулой I, или их фармацевтически приемлемым солям, способам их получения и содержащим их фармацевтическим композициям.
[Формула I]
где цикл А представляет собой остаток, выбранный из группы, включающей следующие структуры;
R1-R12 независимо представляют собой H, (C1-C7)алкил, (C3-C7)циклоалкил, (C6-C12)арил или (C4-C12)гетероарил, содержащий от одного до четырех гетероатомов, выбранных из группы, состоящей из O, S и N, R3 и R4 образуют цикл посредством соединения с (C3-C5)алкиленом, атом углерода алкилена может быть замещен карбонилом, и алкил, циклоалкил, арил или гетероарил от R1-R12 может быть замещен одним заместителем, выбранным из группы, состоящей из (C1-C7)алкила, галоген(C1-C7)алкила, (C1-C7)алкокси и галогена;
R13 означает H, (C1-C7)алкил, (C1-C7)циклоалкил, формил, (C1-C7)алкилкарбонил, (C1-C7)алкоксикарбонил или (C6-C12)арил.
Термин "арил" в этом изобретении означает органический радикал, получаемый из ароматического углеводорода, отщеплением одного H, в котором каждый цикл моноциклической системы или конденсированной циклической системы содержит 6-12, предпочтительно 6-10, циклических атомов. Конкретно, термин включает фенил, нафтил, бифенил и инденил, но не всегда ограничен ими.
Термин "гетероарил" в этом изобретении означает арильную группу, которая содержит 1-4 гетероатома, выбранных из группы, состоящей из N, O и S, в качестве атомов, составляющих структуру ароматического цикла, и остальные атомы, составляющие структуру ароматического цикла, являются атомами C, которая проиллюстрирована (5-6)-членным моноциклическим гетероарилом и полициклическим гетероарилом, конденсированным с одним или большим количеством бензольных колец, которые могут быть частично насыщенными.
Оксазолидиноновые производные по настоящему изобретению с циклической амидоксимной или циклической амидразоновой группой выбраны из соединений следующих далее формул II-XI.
[Формула II]
[Формула III]
[Формула IV]
[Формула V]
[Формула VI]
[Формула VII]
[Формула VIII]
[Формула IX]
[Формула X]
[Формула XI]
где R1-R12 независимо представляют собой H, (C1-C7)алкил или (C3-C7)циклоалкил; R13 означает H, (C1-C7)алкил, (C3-C7)циклоалкил, формил или (C1-C7)алкилкарбонил; и m равно целому числу от 1 до 3.
В качестве примера оксазолидиноновых производных по настоящему изобретению с циклической амидоксимной или циклической амидразоновой группой в приведенных выше формулах II-XI R1-R12 независимо представляют собой H, метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, циклопропил, циклобутил, циклопентил или циклогексил; R13 означает H, метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, циклопропил, циклобутил, циклопентил, циклогексил, формил или ацетил; и m равно целому числу 1.
Оксазолидиноновые производные по настоящему изобретению с циклической амидоксимной или циклической амидразоновой группой можно проиллюстрировать следующими соединениями, но не всегда ограничиваясь ими:
В этом изобретении способы получения оксазолидиноновых производных с циклической амидоксимной или циклической амидразоновой группой, представленных формулой I, проиллюстрированы при помощи реакционных схем с 1 по 5. Однако приведенный далее способ не может ограничивать способы получения оксазолидиноновых производных по настоящему изобретению с циклической амидоксимной или циклической амидразоновой группой, представленных формулой I, и специалистам в данной области хорошо известно, что модификация приведенного ниже способа дозволена и также включена в признаки настоящего изобретения. Если указано иного, заместители на реакционных схемах такие, как определено для формулы I.
Как показано на реакционных схемах 1-5, способ получения оксазолидиноновых производных с циклической амидоксимной или циклической амидразоновой группой, представленных формулой I, модифицируют в соответствии со структурой циклического соединения A в формуле I. Сначала синтезируют циклические амидоксимные соединения, такие как соединения B1 и B2 на реакционной схеме 1 и соединение E на реакционной схеме 4. Также синтезируют циклические амидразоновые соединения, такие как соединения C1 и C2 на реакционной схеме 1, соединение D1 на реакционной схеме 2 и соединение F на реакционной схеме 5.
[Реакционная схема 1]
Как показано на реакционной схеме 1, синтез циклических амидоксимных соединений B1 и B2 формулы I и циклических амидразоновых соединений C1 и C2 осуществляют, проводя взаимодействие 4-цианоанилина (1) и 2-(((S)-оксиран-2-нил)метил)трет-бутилоксикарбонила (2) с получением соединения 3. Затем синтезируют оксазолидиноновое циклическое соединение 4, используя 1,1-карбонилдиимидазол и DMAP, и реакционную смесь обрабатывают HCl для удаления защитной группы boc. Проводят конденсацию с 5-хлортиофен-2-карбоновой кислотой с последующей обработкой HCl. В заключение проводят взаимодействие реагента с диаминным соединением, получая циклические амидоксимные соединения B1 и B2 формулы I и циклические амидразоновые соединения C1 и C2.
В синтезе соединения 3 можно получить аминное соединение, защищенное фталимидом, используя 2-(((S)-оксиран-2-ил)метил)изоиндолин-1,3-дион (9) из реакционной схемы 2 вместо 2-(((S)-оксиран-2-нил)метил)трет-бутилоксикарбонила (2), аналогично способу по реакционной схеме 2. На реакционной схеме 1 описан способ с использованием 2-(((S)-оксиран-2-нил)метил)трет-бутилоксикарбонила (2), и на реакционной схеме 2 описан способ с использованием 2-(((S)-оксиран-2-ил)метил)изоиндолин-1,3-диона (9).
Циклические амидразоновые соединения D1 и D2 формулы I можно различить по расположению двойной связи, и их синтезируют по реакционной схеме 2 и реакционной схеме 3.
[Реакционная схема 2]
Сначала 4-нитроанилин (6) защищают при помощи группы boc, а затем гидрируют, используя палладиевый катализатор. Затем синтезируют аминоспиртовое соединение 10, используя 2-(((S)-оксиран-2-ил)метил)изоиндолин-1,3-дион (9). Оксазолидиноновый цикл получают, используя карбонилдиимидазол, с получением соединения 11. Используя гидразин, удаляют фталимидную защитную группу, а затем проводят конденсацию с 5-хлортиофен-2-карбоновой кислотой, получая соединение 13. Соединение 13 обрабатывают HCl для удаления защитной группы boc, далее проводят взаимодействие с boc-защищенным аминалом, получая соединение 14. Вводят нитрозогруппу, используя NaNO2, а за тем проводят восстановление посредством Zn, получая гидразиновое соединение 15. Проводят взаимодействие соединения 15 с ортоформиатом, получая циклическое амидразоновое соединение D1.
Другое циклическое амидразоновое соединение D2 синтезируют по реакционной схеме 3.
[Реакционная схема 3]
Из соединения 14, показанного на реакционной схеме 2, синтезируют соединение 14a, где R7 означает H, в которое вводят аминогруппу (15a) и затем постепенно вводят алкильную группу (16). Индуцируют циклизацию, используя ортоформиат и получая циклическое амидразоновое соединение D2.
Циклическое амидоксимное соединение E формулы I синтезируют по реакционной схеме 4.
[Реакционная схема 4]
Проводят взаимодействие соединения 17, полученного из 4-фторнитробензола, с метансульфонил хлоридом, получая соединение 18, затем проводят взаимодействие с гидроксифталимидом, получая соединение 19. Фталимидную защитную группу удаляют при помощи гидразина, а вместо нее используют для защиты группу boc, получая в результате соединение 21. Нитрогруппу соединения 21 восстанавливают, используя Zn и получая соединение 22, затем проводят взаимодействие с 2-(((S)-оксиран-2-ил)метил)изоиндолин-1,3-дионом (9) способом, показанным на реакционной схеме 2, с получением соединения 26. Соединение 26 обрабатывают HCl, затем проводят взаимодействие с ортоэфиром, получая соединение E.
Циклическое амидразоновое соединение F формулы I синтезируют по реакционной схеме 5.
[Реакционная схема 5]
Вводят защиту соединения 17, полученного из 4-фторнитробензола, посредством группы tbs (трет-бутилдиметилсилил) и затем вводят защиту аминной области посредством boc, получая в результате соединение 27. Используя палладиевый катализатор, получают амин, который подвергают взаимодействию с Cbz-Cl, получая соединение 28. Проводят взаимодействие соединения 28 с глицидилбутилатом, получая соединение 29. Спиртовую группу заменяют амином с получением соединения 30. Проводят взаимодействие этого соединения с хлортиофенкарбоновой кислотой, получая соединение 31, затем проводят взаимодействие с метансульфонилхлоридом. Реагент обрабатывают гидразином с получением соединения 33. Проводят взаимодействие соединения 33 с ортоэфиром, получая соединение F.
Оксазолидиноновые производные по настоящему изобретению с циклической амидоксимной или циклической амидразоновой группой, представленные формулой I, можно применять в медицине в качестве фармацевтически активного ингредиента, в частности, для профилактики и лечения тромбоза, инфаркта миокарда, артериосклероза, воспаления, апоплексии, стенокардии, рецидивирующей стриктуры после ангиопластики, перемежающейся хромоты, флеботромбоза, легочной эмболии, артериального тромбоза, ишемии миокарда, нестабильной стенокардии на базе тромбоза и тромбоэмболии, например криза.
Оксазолидиноновые производные по настоящему изобретению с циклической амидоксимной или циклической амидразоновой группой, представленные формулой I, или их фармацевтически приемлемые соли можно использовать для профилактики или лечения атеросклеротического заболевания, в том числе заболевания коронарной артерии, заболевания церебральных артерий или заболевания периферических артерий. Для лечения инфаркта миокарда оксазолидиноновые производные с циклической амидоксимной или циклической амидразоновой группой можно применять совместно с тромболитическим агентом (например, альтеплазой, тенектеплазой и др.). Указанные соединения также можно использовать для профилактики реокклюзии после тромболизиса, чрескожной транслюминальной коронарной ангиопластики (PTCA) и обходного шунтирования коронарной артерии.
Оксазолидиноновые производные по настоящему изобретению с циклической амидоксимной или циклической амидразоновой группой, представленные формулой I, или их фармацевтически приемлемые соли можно использовать для профилактики постоперативного повторного образования тромбов. Их также можно использовать в качестве антикоагулянта в отношении искусственного органа или гемодиализа. Указанное соединение можно использовать для промывки катетера и медицинского вспомогательного устройства, применяемого in vivo. Кроме того, их также можно использовать в качестве антикоагулянтной композиции для ex vivo хранения крови, плазмы и продуктов крови других типов. Указанные соединения по настоящему изобретению также эффективны при лечении заболевания, связанного со свертыванием крови, или заболевания, вызванного вторичным поражением, например рака (в том числе, метастатического рака), воспалительного заболевания, в том числе артрита и диабета.
Оксазолидиноновые производные по настоящему изобретению с циклической амидоксимной или циклической амидразоновой группой, представленные формулой I, можно использовать в виде фармацевтически приемлемых солей. Что касается фармацевтически приемлемых солей, предпочтительны аддитивные соли кислот, получаемые с использованием фармацевтически приемлемой свободной кислоты. Свободную кислоту (неорганическая или органическая кислота) можно использовать, если она является фармацевтически приемлемой. Примеры неорганической свободной кислоты включают соляную кислоту, бромистоводородную кислоту, серную кислоту и фосфорную кислоту. Примерами доступных органических свободных кислот являются лимонная кислота, уксусная кислота, молочная кислота, малеиновая кислота, фумаровая кислота, глюконовая кислота, метансульфоновая кислота, гликолевая кислота, янтарная кислота, 4-толуолсульфоновая кислота, трифторуксусная кислота, галактуроновая кислота, эмбоновая кислота, глютаминовая кислота и аспарагиновая кислота. Оксазолидиноновые производные по настоящему изобретению могут включать гидрат соли, в частности, если указанная соль является гигроскопичной, ее предпочтительно использовать в виде кристаллогидрата.
Оксазолидиноновые производные по настоящему изобретению с циклической амидоксимной или циклической амидразоновой группой, представленные формулой I, можно получить как пролекарство, предназначенное для повышения in vivo абсорбционной способности или растворимости, и можно применять в виде гидрата или сольвата. Например, как объясняется ниже, присоединяют группу, которую можно легко отделить после in vivo абсорбции, или получают соединение в виде соли, а именно в виде одного или большего количества гидратов или сольватов. Пролекарство и гидрат или сольват соли также включены в признаки настоящего изобретения.
Для получения эффекта от лечения можно определить эффективную дозу оксазолидиноновых производных, представленных формулой I, их гидратов, их сольватов или их фармацевтически приемлемых солей, принимая во внимание конкретные используемые соединения, способ введения, целевой субъект, целевое заболевание и др., но предпочтительной является доза 0,1-20 мг/кг (массы тела) в день оксазолидинонового производного соединения, представленного формулой 1. Дневную дозу можно вводить один раз в день (одновременно) или несколько раз в день, поделив дневную эффективную дозу должным образом. В соответствии с препаратом можно допустить пероральное введение, парентеральное введение (инъекцию) или локальное введение. Фармацевтическую композицию по настоящему изобретению для перорального введения можно приготовить, например, в виде таблеток, порошков, сухих сиропов, жевательных таблеток, гранул, капсул, мягких капсул, пилюль, напитков, подъязычных препаратов и др. Композицию по изобретению, приготовленную в виде таблеток, можно вводить субъекту любым способом или путем, который доставляет эффективную дозу таблетки с биодоступностью, которую может обеспечить пероральный путь. Также можно определить способ или путь введения в соответствии с характеристиками, стадиями целевого заболевания и другими условиями. Если композицию по изобретению формуют в виде таблеток, то она может дополнительно включать фармацевтически приемлемые наполнители. Содержание и характеристики наполнителя можно определить по растворимости и химическим свойствам выбранной таблетки, пути введения и исходя из стандартной фармацевтической практики.
Краткое описание фигур
Указанные выше и другие цели, отличительные признаки и преимущества настоящего изобретения станут ясны из следующего описания предпочтительных вариантов, данных в сопряжении с фиг. 1, где приведена диаграмма, демонстрирующая механизм свертывания крови.
Способ по изобретению
Фактические и предпочтительные в настоящее время варианты настоящего изобретения являются иллюстративными, как показано в следующих примерах.
Однако понятно, что специалисты в данной области при обсуждении данного раскрытия могут производить модификации и исправления в рамках духа и области настоящего изобретения.
Пример получения 1: получение соединения 5
<1-1> Получение соединения 3
4-Аминобензонитрил(1) (5 г, 42,30 ммоль) и 2-(((S)-оксиран-2-нил)метил)трет-бутилоксикарбонил (2) (8,79 г, 50,78 ммоль) добавляют к 2-изопропиловому спирту (20 мл) с последующим кипячением с обратным холодильником при перемешивании в течение 12 часов. Реакционную смесь концентрируют при пониженном давлении и затем отправляют на колонку, получая указанное в заголовке соединение 3 в виде белого твердого вещества (7,30 г, 25,1 ммоль, 59%).
1H ЯМР (400 МГц, хлороформ-d1) δ 7,41 (д, J=8,4 Гц, 4H), 6,59 (д, J=8,4 Гц, 1H), 4,95 (широкий с, 1H), 4,80 (широкий с, 1H), 3,97-3,93 (м, 1H), 3,31-3,15 (м, 5H), 1,46 (c,9H).
<1-2> Получение соединения 4
Полученное выше соединение 3 (7,30 г, 25,05 ммоль), 1,1-карбонилдиимидазол (4,87 г, 30,06 ммоль) и диметиламинопиридин (1,53 г, 12,52 ммоль) постепенно добавляют к тетрагидрофурану (70 мл) с последующим кипячением с обратным холодильником при перемешивании в течение 12 часов. Реакционную смесь концентрируют при пониженном давлении, затем растворяют в этилацетате (300 мл). После последовательного промывания 1н. раствором HCl (50 мл) и раствором бикарбоната натрия (50 мл) реакционную смесь сушат над сульфатом натрия, а затем концентрируют при пониженном давлении. Реакционную смесь промывают диэтиловым эфиром (100 мл) с получением соединения 4 в виде белого твердого вещества (6,60 г, 20,8 ммоль, 83%).
1H ЯМР (400 МГц, хлороформ-d1) δ 7,67 (c, 4H), 4,95 (широкий с, 1H), 4,82-4,79 (м, 1H), 4,07 (дд, J=8,8, 8,8 Гц, 1H), 3,94 (дд, J=8,8, 6,8 Гц, 1H), 3,56-3,54 (м, 2H), 1,38 (c, 9H).
<1-3> Получение соединения 5
Полученное выше соединение 4 (6 г, 18,90 ммоль) добавляют к этилацетату (10 мл), реакционную смесь добавляют к 4н. HCl, растворенному в 1,4-диоксане (60 мл), с последующим перемешиванием при комнатной температуре в течение одного часа. Полученное твердое вещество отфильтровывают при пониженном давлении и затем последовательно промывают этилацетатом (20 мл) и диэтиловым эфиром (30 мл). В результате получают гидрохлорид аминного соединения с удаленными boc-группами в виде белого твердого вещества (4,60 г, 18,1 ммоль, 95,9%).
1H ЯМР (400 МГц, хлороформ-d1) δ 8,36 (широкий с, 3H), 7,90 (д, J=8,8 Гц, 2H), 7,73 (д, J=8,8 Гц, 2H), 5,03-4,96 (м, H), 4,25 (дд, J=9,2, 9,2 Гц, 1H), 3,92 (дд, J=9,2, 6,4 Гц, 1H), 3,28-3,25 (м, 2H).
Аминное соединение (4,60 г, 18,13 ммоль), HOBt (2,75 г, 19,94 ммоль), EDC (4,17 г, 21,75 ммоль), 5-хлортиофен-2-карбоновую кислоту (3,20 г, 19,04 ммоль) и триэтиламин (5,70 мл, 39,88 ммоль) постепенно добавляют к N,N'-диметилформамиду (50 мл) с последующим перемешиванием при комнатной температуре в течение 12 часов. Реакционную смесь медленно добавляют к дистиллированной воде (800 мл) и полученное твердое вещество отфильтровывают при пониженном давлении. Реакционную смесь промывают диэтиловым эфиром (100 мл) с получением соединения 5 в виде белого твердого вещества (5,70 г, 15,8 ммоль, 87%).
1H ЯМР (400 МГц, ДМСО-d6) δ 8,93 (т, J=5,2 Гц, 1H), 7,81 (д, J=9,2 Гц, 2H), 7,69 (д, J=9,2 Гц, 2H), 7,63 (д, J=4,0 Гц, 1H), 7,15 (д, J=4,0 Гц, 1H), 4,86-4,8l (м, 1H), 4,17 (дд, J=9,2, 9,2 Гц, 1H), 3,83 (дд, J=9,2, 5,2 Гц, 1H), 3,57 (дд, J=5,2, 5,2 Гц, 2H); ЖХМС: 362(M+H+) для C16H12ClN3O3S.
Пример получения 2: получение соединения 13
<2-1> Получение соединения 7
4-Нитроанилин (20 г, 145 ммоль) растворяют в ацетонитриле (200 мл), к смеси добавляют ди-трет-бутилдикарбонат (63,2 г, 290 ммоль) и 4-диметиламинопиридин (3,54 г, 29 ммоль) с последующим кипячением с обратным холодильником при перемешивании в течение 16 часов. Реакционный раствор охлаждают до комнатной температуры с последующим концентрированием при пониженном давлении, получая коричневое твердое соединение, имеющее две группы boc (49 г, 145 ммоль, 100%).
1H ЯМР (600 МГц, CDCl3) δ 8,25 (д, J=9 Гц, 2H), 7,36 (д, J=9 Гц, 2H), 1,45 (c, 18H).
Полученное соединение (49 г, 145 ммоль) растворяют в метаноле (200 мл), добавляют к раствору карбонат калия (60 г, 434 ммоль), затем кипятят с обратным холодильником при перемешивании в течение 16 часов. Реакционный раствор охлаждают при комнатной температуре, с последующим концентрир