Ингибиторы теломеразы и способ их получения
Иллюстрации
Показать всеИзобретение относится к новым координационным соединениям производным имидазол-4-она, ингибирующим теломеразу, общей формулы
где заместитель А выбран из группы, включающей арильные заместители, конденсированные арильные заместители, циклопентил, циклогексил, алифатические заместители, алифатические заместители с двойной связью, алифатические заместители с тройной связью, метиламиновый заместитель CH3NH-, карбэтокси-группу C2H5O(O)С-, пятичленные гетероциклические заместители с одним атомом азота, пятичленные гетероциклические заместители с двумя атомами азота, шестичленные гетероциклические заместители, заместитель В отсутствует или является алифатическим заместителем, заместитель С представляет собой гетероарильный заместитель, присоединяемый к производному имидазол-4-она через атом углерода и выбранный из группы, включающей 5-членные ненасыщенные моноциклические гетероарильные заместители с 1, 2, 3 гетероатомами в цикле, выбранными из группы, включающей N, О и S, 6-членные ненасыщенные моноциклические гетероарильные заместители с 1, 2, 3 гетероатомами в цикле, выбранными из группы, включающей N, О и S, 8-, 9- и 10-членные ненасыщенные бициклические гетероарильные заместители с 1, 2, 3 гетероатомами в цикле, выбранными из группы, включающей N, О и S, Х, представляет собой хлорид Cl или нитрат NO3. Также предложен способ их получения. Изобретение позволяет получить новые производные имидазол-4-она, способные ингибировать теломеразу. 2 н. и 6 з.п. ф-лы, 5 ил., 2 табл., 24 пр.
Реферат
Область техники
Изобретение относится к области органической и медицинской химии, молекулярной биологии и касается способа получения нового класса соединений, ингибирующих теломеразу, которые могут быть использованы для изучения теломераз и каталитических субъединиц теломераз, обратных транскриптаз, для изучения и лечения опухолевых и вирусных заболеваний.
Уровень техники
Теломераза - это фермент, необходимый для компенсации укорочения длины теломер в клетках эукариот. Теломеры состоят из характерных тандемных повторов (например TTAGGG у человека), найденных на концах большинства эукариотических хромосом (Blackburn, "Structure and Function of Telomeres,"Nature, 350: 569-573, 1991). Количество повторов определяет длину теломер. Пролиферативный потенциал клетки связывают с длиной теломер, так как стабильность и целостность эукариотических хромосом зависят от динамической структурной организации теломер (Baird DM. "Mechanisms of telomeric instability", Cytogenet Genome Res. 2008; 122(3-4): 308-14, 2009), при их укорочении меньше критической длины стабильность нарушается, затем клетка гибнет. Теломеры играют важную роль в контроле разделения хромосом и вовлечены в регулирование клеточного цикла. С каждым клеточным делением у соматической клетки теряются приблизительно 60-100 оснований с концов хромосом. Теломеры сокращаются, клетка, в конечном счете, достигает кризиса, и в клетке запускается апоптоз. В организме существуют клетки с неограниченным потенциалом деления. Именно в них (в половых, стволовых клетках, а так же в клетках опухоли) существует процесс компенсации укорочения теломер. За этот процесс отвечает фермент-теломераза. Теломераза активна в таких клетках и поддерживает длину теломер выше кризисного уровня. Теломераза - это специализированная обратная транскриптаза (для человека hTERT), работающая в комплексе с собственной рибонуклеиновой кислотой (РНК). Эта РНК называется теломеразной (для человека hTERC) и содержит участок для синтеза теломерных повторов ДНК (матричный участок). Другими словами, для приобретения способности к неограниченному делению клетка должна активировать механизм, поддерживающий длину теломер выше критического уровня, а именно теломеразу. Так, существенный уровень теломеразной активности был обнаружен в более чем 85% опухолей (Kim et al., "Specific Association of Human Telomerase Activity with Immortal Cells and Cancer," Science, 266: 2011-2015, 1994). Теломеразная активность также присутствует в стволовых сумках нормальных тканей, но на более низком уровне (Morin, "Is Telomerase a Universal Cancer Target?", J. Natl. Cancer Inst, 87: 859-861, 1995). Таким образом, присутствие активной теломеразы в опухоли обеспечивает наличие мишени, дающей потенциально хорошую селективность к опухолевым клеткам по отношению к здоровой ткани. Ингибирование теломеразы было предложено в качестве нового подхода к терапии рака (первые работы Morin, "Is Telomerase a Universal Cancer Target?", J. Natl. Cancer Inst., 87: 859-861, 1995; Parkinson, "Do Telomerase Antagonists Represent a Novel Anti-Cancer Strategy?" Brit. J. Cancer, 73: 1-4, 1996; Raymond et al., "Agents that target telomerase and telomeres," Curr Opinion Biotech., 7: 583-591, 1996, более современное состояние в обзоре Shay JW, Wright WE. Telomerase therapeutics for cancer: challenges and new directions. Nat Rev Drug Discov. 5(7): 577-84, 2006).
Третичная структура белка каталитической субъединицы теломеразы человека остается на настоящий момент неразрешенной, но на основе анализа первичной структуры показано, что этот белок сходен с другими обратными транскриптазами (Lingner et al., "Reverse Transcriptase Motifs in the Catalytic Subunit of Telomerase," Sci., 276: 561-567, 1997), поэтому ее активность подавляется при использовании ингибиторов обратных транскриптаз, например: AZT (Strahl and Blackburn, "Effects of Reverse Transcriptase Inhibitors on Telomere Length and Telomerase Activity in Two Immortalized Human Cell Lines, "Mol. Cell. Biol., 16; 53-65, 1996) и других нуклеозидов (Fletcher et al., "Human Telomerase Inhibition by 7-Deaza 2'-deoxypurine Nucleoside Triphosphates," Biochem, 35: 15611-15617, 1996). Также была показана возможность ингибирования любой теломеразной активности при использовании антисмысловой последовательности к матричному участку теломеразной РНК, например нуклеиновых кислот, слитых с пептидом (Norton et al., "Inhibition of Human Telomerase Activity by Peptide Nucleic Acids," Nature Biotechnol., 14: 615-619, 1996) и фосфотиоатных олигонуклеотидов (Mata et al., "A Hexameric Phosphorothioate Oligonucleotide Telomerase Inhibitor Arrests Growth of Burkitt's Lymphoma Cells in Vitro and in Vivo, "Toxicol Appl. Pharmacol., 144: 189-197, 1997). Антисмысловый дезоксирибонуклеотид, содержащий 185 нуклеотидов hTERC, был в состоянии сократить теломеры в клетках HeLa за 23-26 клеточных делений до критического уровня и вызвал апоптоз. Другой дезоксирибонуклеотид, содержащий 2'-5'-аденилат (2-5А) с тем, чтобы не только связать, но и расщепить hTERC, вызвал апоптоз в глиоме, раке простаты, раке шейки матки, мочевого пузыря и яичников в течение 4-5 дней. Чтобы увеличить сродство к hTERC-последовательности и стабильность олигонуклеотида были использованы 2'-O-метил-РНК-олигонуклеотиды. Самым эффективным оказался олигонуклеотид GRN163 (Asai et al. A novel telomerase template antagonist (GRN163) as a potential anticancer agent. Cancer Research, 63: 3931-3939, 2003). Клетки, культивируемые с этим соединением, гибли в течение 100 дней, GRN163 ингибировал теломеразную активность при очень низких, по сравнению с другими олигонуклеотидами, концентрациях, GRN163L является первым ингибитором теломеразы, который вошел в клиническую практику. Доклинические исследования показали безопасность и эффективность такого ингибирования. Безопасность и определение дозы для пациентов, невосприимчивых к другой терапии, находятся в стадии изучения. Эти исследования не закончены (США, ClinicalTrials.gov, NCT00310895), однако уже показанная эффективность GRN163L -однозначное подтверждение того, что ингибирование теломеразы - это основа антираковой терапии.
Из WO 99/01560 от 14.01.1999 (RU 2000102361, дата приоритета 01.07.1998) также известны ингибиторы теломеразной активности олигонуклеотидной природы.
Известны примеры использования координационных соединений железа (III), цинка (II), никеля (II), марганца (III) и платины (II) (Monchaud et al., "A hitchhiker's guide to G-quadruplex ligands", Org. Biomol. Chem., 6, 627, 2008). Большинство координационных соединений содержит производные порфирина или конденсированные пиридиновые системы. Ингибирование теломеразы наблюдается при значениях IC50-TRAP (IC50 - концентрация ингибитора, при которой активность фермента подавляется на 50%) от 0,12 до 30 мкМ.
Наиболее близким аналогом изобретения является ингибитор теломеразы, который представляет собой координационное соединение меди (II), содержащее лиганд на основе производного порфирина [S.Е.Evans, M.A.Mendez, К.В.Turner, L.R.Keating, R.Т.Grimes, S.Melchoir and V.A.Szalai, J. Biol. Inorg. Chem., 2007, 12(8), 1235-1249]. Это соединение селективно взаимодействует с квадруплексом ДНК, значение IC50-ТRАР в экспериментах по ингибированию теломеразы составляет 26 мкМ. К недостаткам этого ингибитора теломеразы следует отнести сложность синтеза органического лиганда и координационного соединения, а также низкое значение IC50.
Указанные недостатки известных ингибиторов теломеразы могут быть преодолены при использовании координационных соединений производных имидазол-4-она, более подробно описанных далее со ссылками на прилагаемые иллюстративные материалы.
Описание иллюстративных материалов
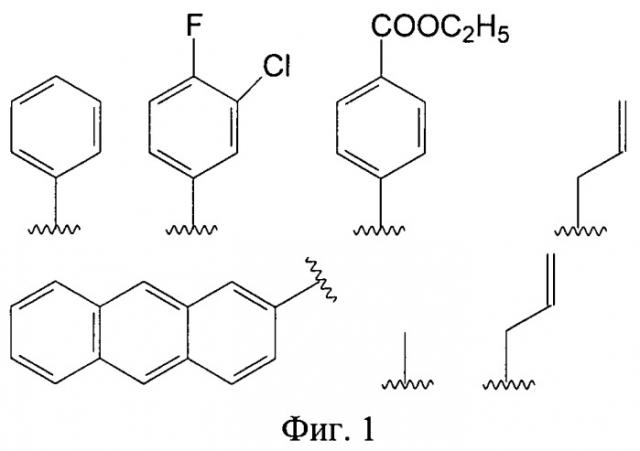
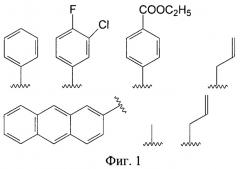
Фиг.1. Структурные формулы заместителей А в заявленных производных имидазол-4-она.
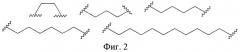
Фиг.2. Структурные формулы заместителей В в заявленных производных имидазол-4-она.
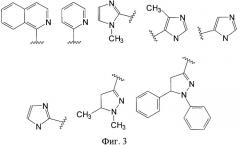
Фиг.3. Структурные формулы заместителей С в заявленных производных имидазол-4-она.
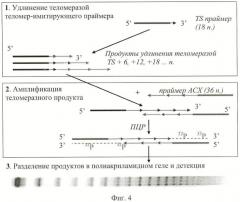
Фиг.4. Метод амплификации теломерных повторов (TRAP-анализ).
Фиг.5. Тестирование теломеразной активности для различных концентраций комплекса (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-аллил-3,5-дигидро-4Н-имидазол-4-она) с хлоридом меди.
Раскрытие изобретения
В качестве ингибиторов теломеразы согласно изобретению могут быть использованы координационные соединения производных имидазол-4-она общей формулы
где заместитель А выбран из группы, включающей арильные заместители, конденсированные арильные заместители, циклопентил, циклогексил, алифатические заместители, алифатические заместители с двойной связью, алифатические заместители с тройной связью, метиламиновый заместитель CH3NH-, карбэтокси-группу C2H5O(O)C-, пятичленные гетероциклические заместители с одним атомом азота, пятичленные гетероциклические заместители с двумя атомами азота, шестичленные гетероциклические заместители, заместитель В отсутствует или является алифатическим заместителем, заместитель С представляет собой гетероарильный заместитель, присоединяемый к производному имидазол-4-она через атом углерода и выбран из группы, включающей 5-членные ненасыщенные моноциклические гетероарильные заместители с 1, 2, 3 гетероатомами в цикле, выбранными из группы, включающей N, О и S, 6-членные ненасыщенные моноциклические гетероарильные заместители с 1, 2, 3 гетероатомами в цикле, выбранными из группы, включающей N, О и S, 8-, 9- и 10-членные ненасыщенные бициклические гетероарильные заместители с 1, 2, 3 гетероатомами в цикле, выбранными из группы, включающей N, О и S, X представляет собой хлорид Cl или нитрат NO3.
В предпочтительном варианте выполнения изобретения заместитель А является незамещенным или монозамещенным, или дизамещенным арильным заместителем, при этом заместители R в арильной группе выбраны из группы, включающей галогены и алкильные заместители.
В предпочтительном варианте выполнения изобретения заместитель А является незамещенным или монозамещенным, или дизамещенным конденсированным арильным заместителем, при этом заместители R в конденсированной арильной группе выбраны из группы, включающей галогены и алкильные заместители.
В предпочтительном варианте выполнения заместитель А выбран из группы, включающей фенил С6Н5-, 3-хлор-4-фторфенил 3-Cl-4-F-С6Н3-, 4-карбэтоксифенил 4-C2H5O(O)СС6Н4-, метил СН3-, аллил СН2=СНСН2-, 2-антрил, пропил С3Н7- (фиг.1).
В предпочтительном варианте выполнения заместитель В выбран из группы, включающей 1,2-этандиил -(СН2)2-, 1,3-пропандиил -(CH2)3-, 1,4-бутандиил -(СН2)4-, 1,6-гександиил -(СН2)6-, 1,10-декандиил -(СН2)10- (фиг.2).
В предпочтительном варианте выполнения заместитель С выбран из группы, включающей 2-хинолил, 2-пиридил, 1-метил-2-имидазолил, 4-метил-5-имидазолил, 5-имидазолил, 2-имидазолил, 1,5-диметил-3-пиразолинил, 1,5-дифенил-3-пиразолинил (фиг.3).
В способе получения координационных соединений производных имидазол-4-она согласно изобретению осуществляют следующие стадии: смешивают раствор производного имидазол-4-она в дихлорметане с метанолом, медленно приливают к смеси раствор соли меди в метаноле или ацетонитриле, реакционную смесь выдерживают до выпадения осадка координационного соединения производного имидазол-4-она.
В качестве соли меди могут быть использованы хлорид меди и нитрат меди.
В качестве производных имидазол-4-она могут быть использованы соединения общей формулы
где заместитель А выбран из группы, включающей арильные заместители, конденсированные арильные заместители, циклопентил, циклогексил, алифатические заместители, алифатические заместители с двойной связью, алифатические заместители с тройной связью, метиламиновый заместитель CH3NH-, карбэтокси-группу C2H5O(O)С-, пятичленные гетероциклические заместители с одним атомом азота, пятичленные гетероциклические заместители с двумя атомами азота, шестичленные гетероциклические заместители, заместитель В отсутствует или является алифатическим заместителем, заместитель С представляет собой гетероарильный заместитель, присоединяемый к производному имидазол-4-она через атом углерода и выбран из группы, включающей 5-членные ненасыщенные моноциклические гетероарильные заместители с 1, 2, 3 гетероатомами в цикле, выбранными из группы, включающей N, О и S, 6-членные ненасыщенные моноциклические гетероарильные заместители с 1, 2, 3 гетероатомами в цикле, выбранными из группы, включающей N, О и S, 8-, 9- и 10-членные ненасыщенные бициклические гетероарильные заместители с 1, 2, 3 гетероатомами в цикле, выбранными из группы, включающей N, О и S.
В предпочтительном варианте выполнения изобретения заместитель А является незамещенным или монозамещенным, или дизамещенным арильным заместителем, при этом заместители R в арильной группе выбраны из группы, включающей галогены и алкильные заместители.
В предпочтительном варианте выполнения изобретения заместитель А является незамещенным или монозамещенным, или дизамещенным конденсированным арильным заместителем, при этом заместители R в конденсированной арильной группе выбраны из группы, включающей галогены и алкильные заместители.
В предпочтительном варианте выполнения заместитель А выбран из группы, включающей фенил С6Н5-, 3-хлор-4-фторфенил 3-Cl-4-F-С6Н3-, 4-карбэтоксифенил 4-C2H5O(O)СС6Н4-, метил СН3-, аллил СН2=СНСН2-, 2-антрил, пропил С3Н7- (фиг.1).
В предпочтительном варианте выполнения заместитель В выбран из группы, включающей 1,2-этандиил -(СН2)2-, 1,3-пропандиил -(CH2)3-, 1,4-бутандиил -(CH2)4-, 1,6-гександиил -(СН2)6-, 1,10-декандиил -(СН2)10- (фиг.2).
В предпочтительном варианте выполнения заместитель С выбран из группы, включающей 2-хинолил, 2-пиридил, 1-метил-2-имидазолил, 4-метил-5-имидазолил, 5-имидазолил, 2-имидазолил, 1,5-диметил-3-пиразолинил, 1,5-дифенил-3-пиразолинил (фиг.3).
Заявленные производные имидазол-4-она могут быть получены алкилированием замещенных в 3-положении 2-тиогидантоинов α,ω-дибромалканами. Для этого к смеси производных 2-тиогидантоинов (2 эквивалента) и сухого К2СО3 (3 эквивалента) в диметилформамиде при температуре 0°С при перемешивании добавляют α,ω-дибромалкан (1 эквивалент). Реакционную смесь перемешивают в течение двух часов при температуре 0°С, а затем 2 часа при комнатной температуре. После этого к смеси добавляют 50 мл воды. Образовавшийся осадок отфильтровывают и промывают водой, а затем диэтиловым эфиром.
Изобретение иллюстрируется примерами альтернативных вариантов его выполнения.
Пример 1. Синтез (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-метил-3,5-дигидро-4Н-имидазол-4-она)
Из 0,5 г (0,0025 моль) 2-тиоксо-3-метил-5((Z)-2-пиридилметилен)-тетрагидро-4Н-имидазол-4-она и 0,21 г (0,0013 моль) 1,2-дибромэтана получено 0,40 г (76%) (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-метил-3,5-дигидро-4Н-имидазол-4-она). Тпл=215°С.
Спектр ЯМР 1Н (400 МГц, CDCl3, δ, м.д.): 8,82 (д, 1Н, Нα-Ру, J=7,9 Гц), 8,59 (д, 1Н, Нβ'-Ру, J=4,0 Гц), 7,71 (тд, 1Н, Нβ-Ру, J1=7,3 Гц, J2=2,3 Гц), 7,23 (с, 1Н, СН=), 7,13 (дд, 1Н, Нγ-Ру, J1=7,5 Гц, J2=0,9 Гц), 3,41 (т, 2Н, S-CH2, J=7,5 Гц), 3,08 (с, 3Н, N-СН3).
ИК-спектр (см-1): 1710 (С=O), 1670 (C=N), 1640 (C=C).
Элементный анализ: C22H20N6O2S2 вычислено С 56,88% Н 4,34% N 18,09%; найдено С 56,74% Н 4,27% N 17,82%.
Пример 2. Синтез (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-пропил-3,5-дигидро-4Н-имидазол-4-она)
Из 0,5 г (0,002 моль) 2-тиоксо-3-пропил-5((Z)-2-пиридилметилен)-тетрагидро-4Н-имидазол-4-она и 0,19 г (0,001 моль) 1,2-дибромэтана получено 0,43 г (82%) (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-пропил-3,5-дигидро-4Н-имидазол-4-она). Тпл=152°С.
Спектр ЯМР 1Н (400 МГц, CDCl3, δ, м.д.): 8,69 (д, J=8,0 Гц, 1Н, Нα-Ру,), 8,65 (д, J=4,7 Гц, 1Н, Нβ'-Ру,), 7,63 (тд, J1=7,4 Гц, J2=2,0 Гц, 1Н, Нβ-Ру,), 7,19 (дд, J1=7,5 Гц, J2=0,9 Гц, 1Н, Нγ-Ру,), 7,12 (с, 1Н, СН=), 7,12 (с, 1Н, СН=), 3,93 (с, 2Н, S-CH2), 3,60 (т, J=7,5 Гц, 2Н, CH2N), 1,72 (м, 2Н, CH2), 0,96 (т, J=7,5, 3H, СН3).
ИК-спектр (см-1): 1705 (С=O), 1675 (C=N), 1640 (C=C).
Элементный анализ: C26H28N6O2S2 вычислено С 59,98% Н 5,42% N 16,14%; найдено С 59,34% Н 5,17% N 15,88%.
Пример 3. Синтез (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-аллил-3,5-дигидро-4Н-имидазол-4-она)
Из 0,5 г (0,002 моль) 2-тиоксо-3-аллил-5((Z)-2-пиридилметилен)-тетрагидро-4Н-имидазол-4-она и 0,19 г (0,001 моль) 1,2-дибромэтана получено 0,46 г (92%) (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-аллил-3,5-дигидро-4Н-имидазол-4-она). Тпл=187°C.
Спектр ЯМР 1Н (400 МГц, CDCl3, δ, м.д.): 8,65 (м, 2Н, Нα-Ру+Нβ'-Ру,), 7,62 (т, J=7,5 Гц, 1Н, Нβ-Ру,), 7,19 (м, 1Н, Нγ-Ру,), 7,14 (с, 1Н, СН=), 7,12 (с, 1Н, СН=), 5,82 (м, 1Н, СН=), 5,23 (м., 2Н, СН2=), 4,23 (м, 2Н, CH2N) 3,89 (с, 2Н, S-CH2).
ИК-спектр (см-1): 1720 (С=O), 1680 (С=N), 1640 (С=С).
Элементный анализ: C26H26N6O2S2 вычислено С 60,44% Н 4,68% N 16,27%; найдено С 60,14% Н 4,48% N 16,03%.
Пример 4. Синтез (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-фенил-3,5-дигидро-4Н-имидазол-4-она)
Из 0,3 г (0,001 моль) 2-тиоксо-3-фенил-5((Z)-2-пиридилметилен)-тетрагидро-4Н-имидазол-4-она и 0,1 г (0,0005 моль) 1,2-дибромэтана получено 0,23 г (73%) (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-фенил-3,5-дигидро-4Н-имидазол-4-она). Тпл=259°С.
Спектр ЯМР 1Н (400 МГц, CDCl3, δ, м.д.): 8,75 (д, 2Н, Нα-Ру, J=7,9 Гц), 8,66 (д, 2Н, Нβ'-Ру, J=4,0 Гц), 7,81 (тд, 2Н, Нβ-Ру, J1=7,3 Гц, J2=2,3 Гц), 7,42 (м, 6Н, H-Ph), 7,29 (м, 4Н, H-Ph), 7,11 (тд, 2Н, Нγ-Ру, J1=7,5 Гц, J2=1,0 Гц), 7,18 (с, 2Н, СН=), 3,11 (т, 4Н, S-CH2-, J=7,5 Гц).
ИК-спектр (см-1): 1710 (С=O), 1670 (C=N), 1640 (C=C).
Элементный анализ: C32H24N6S2O2 вычислено С% 65,31, Н% 4,08, N% 14,29; найдено С% 65,28, Н% 4,10, N% 14,11.
Пример 5. Синтез (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-(1-нафтил)-3,5-дигидро-4Н-имидазол-4-она)
Из 0,3 г (0,001 моль) 2-тиоксо-3-(1-нафтил)-5((Z)-2-пиридилметилен)-тетрагидро-4Н-имидазол-4-она и 0,1 г (0,0005 моль) 1,2-дибромэтана получено 0,19 г (68%) (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-(1-нафтил)-3,5-дигидро-4Н-имидазол-4-она). Тпл=267°С.
Спектр ЯМР 1Н (400 МГц, CDCl3, δ, м.д.): 9,12 (д, J=8,8 Гц, 1Н, HetAr), 8,30 (д, J=8,7 Гц, 1Н, HetAr), 8,20 (д, J=8,3 Гц, 1Н, HetAr), 8,15 (д, J=8,3 Гц, 1Н, Ar), 7,95 (м, 1Н, Ar), 7,78 (д, J=8,1 Гц, 1Н, HetAr), 7,69 (т, J=7,1 Гц, 1Н, HetAr), 7,61 (м, 1Н, Ar), 7,53 (м, 6Н, HetAr+СН=+Ar), 6,91 (с, 2Н, СН=), 3,76 (с, 4Н, CH2-S).
ИК-спектр (см-1): 1710 (С=O), 1670 (C=N), 1640 (C=C).
Пример 6. Синтез (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-(2-антрил)-3,5-дигидро-4Н-имидазол-4-она)
Из 0,4 г (0,001 моль) 2-тиоксо-3-(2-антрил)-5((Z)-2-пиридилметилен)-тетрагидро-4Н-имидазол-4-она и 0,1 г (0,0005 моль) 1,2-дибромэтана получено 0,21 г (81%) (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-(2-антрил)-3,5-дигидро-4Н-имидазол-4-она). Тпл=249°C.
Спектр ЯМР 1Н (400 МГц, CDCl3, δ, м.д.): 8,73 (д, J=7,9 Гц, 2Н, Ar), 8,69 (д, J=5,1 Гц, 1Н, Нα'-Ру), 8,45 (м, 4Н, Ar), 8,13 (д, J=8,8 Гц, 2Н, Нβ-Ру), 8,01 (м, 3Н, Ar), 7,76 (т, J=7,6 Гц, 1Н, Нβ'-Ру), 7,51 (м, 4Н, Ar), 7,47 (дд, J1=6,8 Гц, J2=1,4 Гц, 2Н, Нγ-Ру)), 7,25 (м, 2Н, Ar), 6,94 (с, 2Н, СН=), 3,83 (с, 4Н, CH2-S).
ИК-спектр (см-1): 1730 (С=O), 1680 (C=N), 1620 (C=C).
Элементный анализ: C48H32N6O2S2 вычислено С 73,08% Н 4,09% N 10,65%; найдено С 73,35% Н 4,82% N 10,13%.
Пример 7. Синтез (5Z,5'Z)-2,2'-(бутан-1,4-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-аллил-3,5-дигидро-4Н-имидазол-4-она)
Из 0,5 г (0,002 моль) 2-тиоксо-3-аллил-5((Z)-2-пиридилметилен)-тетрагидро-4Н-имидазол-4-она и 0,22 г (0,001 моль) 1,4-дибромбутана получено 0,40 г (76%) (5Z,5'Z)-2,2'-(бутан-1,4-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-аллил-3,5-дигидро-4Н-имидазол-4-она). Тпл=198°С.
Спектр ЯМР 1Н (400 МГц, CDCl3, δ, м.д.): 8,72 (д, J=8,1 Гц, 2Н, Нα'-Ру), 8,65 (д, J=3,8 Гц, 2Н, Нβ-Ру), 7,63 (тд, J1=8,3 Гц, J2=4,6 Гц, 2Н, Нγ-Ру), 7,05 (дд, J1=4,7 Гц, J2=1,2 Гц, 2Н, Нβ'-Ру,), 7,12 (с, 2Н, СН=), 5,80 (м, 2Н, =СН-) 5,25 (м, 4Н, СН2=), 4,22 (д, J=7,1 Гц, 4Н, -CH2-N), 3,45 (т, J=6,7 Гц, 4Н, -CH2-S), 2,07 (м, 4Н, -СН2-).
ИК-спектр (см-1): 1710 (С=O), 1670 (C=N), 1640 (C=C).
Элементный анализ: C28H28N6O2S2 вычислено С 61,74% Н 5,18% N 15,43%; найдено С 61,74% Н 5,18% N 15,43%.
Пример 8. Синтез (5Z,5'Z)-2,2'-(бутан-1,4-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-фенил-3,5-дигидро-4Н-имидазол-4-она
Из 0,3 г (0,001 моль) 2-тиоксо-3-фенил-5((Z)-2-пиридилметилен)-тетрагидро-4Н-имидазол-4-она и 0,12 г (0,0005 моль) 1,4-дибромбутана получено 0,18 г (78%) (5Z,5'Z)-2,2'-(бутан-1,4-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-фенил-3,5-дигидро-4Н-имидазол-4-она). Тпл=249°С.
Спектр ЯМР 1Н (400 МГц, CDCl3, δ, м.д.): 8,75 (д, J=7,9 Гц, 2Н, Нα-Ру), 8,66 (д, J=4,0 Гц, 1Н, Нβ'-Ру), 7,81 (тд, J1=7,3 Гц, J2=2,3 Гц, 2Н, Нβ-Ру), 7,42 (м, 6Н, H-Ph), 7,29 (м, 4Н, H-Ph), 7,11 (тд, J1=7,5 Гц, J2=1,0 Гц, 2Н, Нγ-Ру), 7,18 (с, 2Н, СН=), 3,11 (т, J=7,5 Гц, 4Н, S-CH2-), 1,86 (кв, J=7,6 Гц, 4Н, -СН2-).
ИК-спектр (см-1): 1720 (С=O), 1670 (C=N), 1640 (C=C).
Элементный анализ: C34H28N6O2S2 вычислено С 66,21% Н 4,58% N 13,63%; найдено С 66,12% Н 4,76% N 13,20%.
Пример 9. Синтез (5Z,5'Z)-2,2'-(гексан-1,6-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-аллил-3,5-дигидро-4Н-имидазол-4-она)
Из 0,5 г (0,002 моль) 2-тиоксо-3-аллил-5((Z)-2-пиридилметилен)-тетрагидро-4Н-имидазол-4-она и 0,22 г (0,001 моль) 1,6-дибромгексана получено 0,40 г (81%) (5Z,5'Z)-2,2'-(гексан-1,6-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-аллил-3,5-дигидро-4Н-имидазол-4-она). Тпл=171°С.
Спектр ЯМР 1Н (400 МГц, CDCl3, δ, м.д.): 8,75 (д, J=8,2 Гц, 2Н, Нα'-Ру), 8,67 (д, J=4,1 Гц, 2Н, Нβ-Ру), 7,68 (т, J=7,8 Гц, 21Н, Нγ-Ру), 7,16 (м, 2Н, Нβ'-Ру), 7,13 (с, 2Н, СН=), 5,83 (м, 2Н, -СН=), 5,25 (м, 4Н, СН2=), 4,15 (д, J=5,9, 4Н, -CH2-N), 3,38 (т, J=7,0 Гц, 4Н, CH2-S), 1,91 (м, 4Н, -СН2-), 1,60 (м, 4Н, -СН2-).
ИК-спектр (см-1): 1710 (С=O), 1670 (C=N), 1640 (C=C).
Элементный анализ: C30H32N6O2S2 вычислено С 62,91% Н 5,63% N 14,67%; найдено С 62,91% Н 5,63% N 14,67%.
Пример 10. Синтез (5Z,5'Z)-2,2'-(гексан-1,6-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-фенил-3,5-дигидро-4Н-имидазол-4-она)
Из 0,3 г (0,001 моль) 2-тиоксо-3-фенил-5((Z)-2-пиридилметилен)-тетрагидро-4Н-имидазол-4-она и 0,13 г (0,0005 моль) 1,6-дибромгексана получают 0,19 г (64%) (5Z,5'Z)-2,2'-(гексан-1,6-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-фенил-3,5-дигидро-4Н-имидазол-4-она). Тпл=240°С.
Спектр ЯМР 1Н (400 МГц, CDCl3, δ, м.д.): 8,77 (д, J=7,9 Гц, 2Н, Нα-Ру,), 8,66 (д, J=3,9 Гц, 1Н, Нβ'-Ру), 7,75 (тд, J1=7,3 Гц, J2=2,3 Гц, 2Н, Нβ-Ру), 7,45 (м, 6Н, H-Ph), 7,30 (м, 4Н, H-Ph), 7,17 (с, 2Н, СН=), 7,13 (дд, J1=7,5 Гц, J2=0,9 Гц, 2Н, Нγ-Ру), 3,32 (т-, J=7,5 Гц, 4Н, S-CH2), 1,86 (м, 4Н, -СН2-), 1,54 (м, 4Н, -СН2-).
ИК-спектр (см-1): 1700 (C=O), 1670 (C=N), 1630 (C=C).
Элементный анализ: C36H32N6S2O2 вычислено С% 67,06, Н% 5,00, N% 13,03; найдено С% 66,71, Н% 5,04, N% 12,65.
Пример 11. Синтез (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-хинолилметилен)-3-пропил-3,5-дигидро-4Н-имидазол-4-она)
Из 0,5 г (0,0015 моль) 2-тиоксо-3-пропил-5((Z)-2-хинолилметилен)-тетрагидро-4Н-имидазол-4-она и 0,15 г (0,0008 моль) 1,2-дибромэтана получено 0,75 г (81%) (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-хинолилметилен)-3-пропил-3,5-дигидро-4Н-имидазол-4-она). Тпл=140°С.
Спектр ЯМР 1Н (400 МГц, CDCl3, δ, м.д.): 8,82 (д, J=9,1 Гц, 2Н, HetAr), 8,05 (м, 4Н, HetAr), 7,72 (м, 4Н, HetAr), 7,53 (м, 2Н, HetAr), 7,29 (с, 2Н, СН=), 4,00 (с, 4Н, -СН2-S), 3,64 (т, J=7,4 Гц, 4Н, CH2-N), 1,75 (м, 4Н, СН2), 1,01 (т, J=7,3, СН3-).
ИК-спектр (см-1): 1715 (С=O), 1670 (C=N), 1640 (C=C).
Пример 12. Синтез (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-хинолилметилен)-3-аллил-3,5-дигидро-4Н-имидазол-4-она)
Из 0,5 г (0,0015 моль) 2-тиоксо-3-аллил-5((Z)-2-хинолилметилен)-тетрагидро-4Н-имидазол-4-она и 0,15 г (0,0008 моль) 1,2-дибромэтана получено 0,70 г (78%) (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-хинолилметилен)-3-аллил-3,5-дигидро-4Н-имидазол-4-она). Тпл=180°С.
Спектр ЯМР 1Н (400 МГц, CDCl3, δ, м.д.): 8,82 (д, J=9,0 Гц, 2Н, HetAr), 8,05 (м, 4Н, HetAr), 7,73 (м, 4Н, HetAr), 7,57 (м, 2Н, HetAr), 7,32 (с, 2Н, СН=), 5,88 (м, 2Н, СН=), 5,30 (м, 4Н, СН2=), 4,30 (д, J=5,6 Гц, 4Н, -CH2-N), 3,97 (с, 4Н, CH2-S).
ИК-спектр (см-1): 1710 (С=O), 1670 (C=N), 1640 (C=C).
Пример 13. Синтез (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-хинолилметилен)-3-фенил-3,5-дигидро-4Н-имидазол-4-она)
Из 0,5 г (0,0015 моль) 2-тиоксо-3-фенил-5((Z)-2-хинолилметилен)-тетрагидро-4Н-имидазол-4-она и 0,14 г (0,0007 моль) 1,2-дибромэтана получено 0,41 г (81%) (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-хинолилметилен)-3-фенил-3,5-дигидро-4Н-имидазол-4-она). Тпл=239°С.
Спектр ЯМР 1Н (400 МГц, CDCl3, δ, м.д.): 8,84 (д, J=8,6 Гц, 2Н, HetAr), 8,05 (д, J=8,8 Гц, 2Н, HetAr), 7,97 (д, J=8,3 Гц, 2Н, HetAr), 7,73 (м, 4Н, HetAr), 7,45 (м, 14Н, Ar+СН=+HetAr), 3,93 (с, 4Н, -CH2-S).
ИК-спектр (см-1): 1710 (С=O), 1670 (C-N), 1640 (C=C).
Пример 14. Синтез (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-циклопентил-3,5-дигидро-4Н-имидазол-4-она)
Из 0,5 г (0,0018 моль) 2-тиоксо-3-циклопентил-5((Z)-2-пиридилметилен)-тетрагидро-4Н-имидазол-4-она и 0,17 г (0,0009 моль) 1,2-дибромэтана получено 0,42 г (81%) (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-циклопентил-3,5-дигидро-4Н-имидазол-4-она).
Элементный анализ: C30H32N6O2S2 вычислено С 62,91% Н 5,63% N 14,67%; найдено С 62,76% Н 5,57% N 14,53%.
Пример 15. Синтез (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-циклогексил-3,5-дигидро-4Н-имидазол-4-она)
Из 0,5 г (0,0017 моль) 2-тиоксо-3-циклогексил-5((Z)-2-пиридилметилен)-тетрагидро-4Н-имидазол-4-она и 0,17 г (0,0009 моль) 1,2-дибромэтана получено 0,45 г (86%) (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-циклогексил-3,5-дигидро-4Н-имидазол-4-она).
Элементный анализ: C32H36N6O2S2 вычислено С 63,97% Н 6,04% N 13,99%; найдено С 63,78% Н 5,97% N 13,81%.
Пример 16. Синтез (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-(бут-2-инил)-3,5-дигидро-4Н-имидазол-4-она)
Из 0,5 г (0,0019 моль) 2-тиоксо-3-(бут-2-инил)-5((Z)-2-пиридилметилен)-тетрагидро-4Н-имидазол-4-она и 0,18 г (0,0010 моль) 1,2-дибромэтана получено 0,36 г (69%) (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-(бут-2-инил)-3,5-дигидро-4Н-имидазол-4-она).
Элементный анализ: C28H24N6O2S2 вычислено С 62,20% Н 4,47% N 15,54%; найдено С 62,07% Н 4,43% N 15,40%.
Пример 17. Синтез (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-метиламино-3,5-дигидро-4Н-имидазол-4-она)
Из 0,5 г (0,0021 моль) 2-тиоксо-3-метиламино-5((Z)-2-пиридилметилен)-тетрагидро-4Н-имидазол-4-она и 0,20 г (0,0011 моль) 1,2-дибромэтана получено 0,38 г (72%) (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-метиламино-3,5-дигидро-4Н-имидазол-4-она).
Элементный анализ: C22H22N8O2S2 вычислено С 53,42% Н 4,48% N 22,66%; найдено С 53,25% Н 4,42% N 22,50%.
Пример 18. Синтез (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-карбэтокси-3,5-дигидро-4Н-имидазол-4-она)
Из 0,5 г (0,0018 моль) 2-тиоксо-3-карбэтокси-5((Z)-2-пиридилметилен)-тетрагидро-4Н-имидазол-4-она и 0,17 г (0,0009 моль) 1,2-дибромэтана получено 0,41 г (78%) (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-карбэтокси-3,5-дигидро-4Н-имидазол-4-она).
Элементный анализ: C26H24N6O6S2 вычислено С 53,78% Н 4,17% N 14,47%; найдено С 53,62% Н 4,11% N 14,32%.
Пример 19. Синтез (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-(2-оксопирролидин-3-ил)-3,5-дигидро-4Н-имидазол-4-она)
Из 0,5 г (0,0017 моль) 2-тиоксо-3-(2-оксопирролидин-3-ил)-5((Z)-2-пиридилметилен)-тетрагидро-4Н-имидазол-4-она и 0,16 г (0,0009 моль) 1,2-дибром-этана получено 0,38 г (73%) (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-(2-оксопирролидин-3-ил)-3,5-дигидро-4Н-имидазол-4-она).
Элементный анализ: C28H26N8O4S2 вычислено С 55,80% Н 4,35% N 18,59%; найдено С 55,68% Н 4,31% N 18,46%.
Пример 20. Синтез (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-(1-метил-1Н-имидазол-2-ил)-3,5-дигидро-4Н-имидазол-4-она)
Из 0,5 г (0,0018 моль) 2-тиоксо-3-(1-метил-1Н-имидазол-2-ил)-5((Z)-2-пиридилметилен)-тетрагидро-4Н-имидазол-4-она и 0,16 г (0,0009 моль) 1,2-дибром-этана получено 0,39 г (75%) (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-(1-метил-1Н-имидазол-2-ил)-3,5-дигидро-4Н-имидазол-4-она).
Элементный анализ: C28H24N10O2S2 вычислено С 56,36% Н 4,05% N 23,47%; найдено С 56,19% Н 4,00% N 23,33%.
Пример 21. Синтез (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-(2-пиридил)-3,5-дигидро-4Н-имидазол-4-она)
Из 0,5 г (0,0018 моль) 2-тиоксо-3-(2-пиридил)-5((Z)-2-пиридилметилен)-тетрагидро-4Н-имидазол-4-она и 0,17 г (0,0009 моль) 1,2-дибром-этана получено 0,38 г (73%) (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-(2-пиридил)-3,5-дигидро-4Н-имидазол-4-она).
Элементный анализ: C30H22N8O2S2 вычислено С 61,00% Н 3,75% N 18,97%; найдено С 60,86% Н 3,69% N 18,79%.
Пример 22. Синтез (5Z,5'Z)-2,2'-дисульфанилбис(5-(2-пиридилметилен)-3-метил-3,5-дигидро-4Н-имидазол-4-она)
К 0,5 г (0,0023 моль) 2-тиоксо-3-метил-5((Z)-2-пиридилметилен)-тетрагидро-4Н-имидазол-4-она при температуре 0°С при перемешивании добавили 5 мл 30%-ного раствора пероксида водорода. Реакционную смесь перемешивали в течение двух часов при температуре 0°С, после этого к смеси добавили 50 мл воды. Образовавшийся осадок отфильтровали и промыли водой, а затем диэтиловым эфиром. Получено 0,34 г (68%) (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-(2-пиридил)-3,5-дигидро-4Н-имидазол-4-она).
Элементный анализ: C20H16N6O2S2 вычислено С 55,03% Н 3,69% N 19,25%; найдено С 54,84% Н 3,61% N 19,07%.
Пример 23. Синтез (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(1-метил-1Н-имидазол-2-илметилен)-3-метил-3,5-дигидро-4Н-имидазол-4-она)
Из 0,5 г (0,0022 моль) 2-тиоксо-3-метил-5((Z)-1-метил-1Н-имидазол-2-илметилен)-тетрагидро-4Н-имидазол-4-она и 0,21 г (0,0011 моль) 1,2-дибромэтана получено 0,41 г (77%) (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(1-метил-1Н-имидазол-2-илметилен)-3-метил-3,5-дигидро-4Н-имидазол-4-она).
Элементный анализ: C20H22N8O2S2 вычислено С 51,05% Н 4,71% N 23,81%; найдено С 50,91% Н 4,65% N 23,68%.
Пример 24. Получение координационных соединений производных имидазол-4-она
К раствору 0,0001 моль алкилированных производных 2-тиогидантоина (производных имидазол-4-она) в 2-3 мл хлористого метилена добавляют 2 мл метанола для достижения расслоения. Затем медленно, по каплям, в течение не менее чем 2 минут приливают раствор 0,0002 моль соли меди в 2-3 мл метанола. Реакционную смесь плотно закрывают и оставляют до выпадения осадка.
В случае получения комплексов (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-аллил-3,5-дигидро-4Н-имидазол-4-она) и (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-метил-3,5-дигидро-4Н-имидазол-4-она) с нитратом меди в качестве растворителя соли используют ацетонитрил, при этом реакционную смесь закрывают от света и оставляют до выпадения осадка.
Получение комплекса (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-метил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2·2Н2О
Из 0,05 г (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-метил-3,5-дигидро-4Н-имидазол-4-она) и 0,03 г CuCl2·2Н2О получают 0,04 г (54%) комплекса коричневого цвета.
Элементный анализ: C22H20N6O2S2*CuCl2*CuCl С 37,86% Н 2,89% N 12,04%; найдено С 37,04% Н 2,57% N 12,22%.
Получение комплекса (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-пропил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2·2Н2О
Из 0,05 г (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-пропил-3,5-дигидро-4Н-имидазол-4-она) и 0,03 г CuCl2·2Н2О получают 0,03 г (45%) комплекса коричневого цвета.
Элементный анализ: C26H28N6O2S2*CuCl2*CuCl вычислено С 41,41% Н 3,74% N 11,14%; найдено С 41,63% Н 3,87% N 11,86%.
Получение комплекса (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-аллил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2·2Н2О
Из 0,05 г (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-аллил-3,5-дигидро-4Н-имидазол-4-она) и 0,03 г CuCl2·2Н2О получают 0,03 г (40%) комплекса коричневого цвета.
Элементный анализ: C26H24N6O2S2*CuCl2*CuCl вычислено С 41,63% Н 3,23% N 11,15%; найдено С 41,36% Н 3,23% N 11,85%.
Получение комплекса (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-фенил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2·2Н2О
Из 0,05 г (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-фенил-3,5-дигидро-4Н-имидазол-4-она) и 0,03 г CuCl2·2Н2О получают 0,03 г (55%) комплекса коричневого цвета.
Элементный анализ: C32H24N6O2S2*CuCl2*CuCl вычислено С 46,75% Н 2,94% N 10,22%; найдено С 46,67% Н 2,14% N 10,77%.
Получение комплекса (5Z,5'Z)-2,2'-(бутан-1,4-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-аллил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2·2Н2О
Из 0,05 г (5Z,5'Z)-2,2'-(бутан-1,4-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-аллил-3,5-дигидро-4Н-имидазол-4-она) и 0,03 г CuCl2·2Н2О получают 0,04 г (59%) комплекса коричневого цвета.
Элементный анализ: C28H28N6O2S2*CuCl2*CuCl вычислено С 43,22% Н 3,63% N 10,80%; найдено С 43,45% Н 3,33% N 10,30%.
Получение комплекса (5Z,5'Z)-2,2'-(бутан-1,4-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-фенил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2·2Н2О
Из 0,05 г (5Z,5'Z)-2,2'-(бутан-1,4-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-фенил-3,5-дигидро-4Н-имидазол-4-она) и 0,03 г CuCl2·2Н2О получают 0,03 г (49%) комплекса коричневого цвета.
Элементный анализ: C34H28N6O2S2*CuCl2*CuCl вычислено С 48,03% Н 3,32% N 9,88%; найдено С 48,49% Н 2,60% N 9,10%.
Получение комплекса (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-циклопентил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2·2Н2О
Из 0,05 г (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-циклопентил-3,5-дигидро-4Н-имидазол-4-она) и 0,03 г CuCl2·2Н2О получают 0,03 г (43%) комплекса коричневого цвета.
Элементный анализ: C30H32N6O2S2*CuCl2*CuCl вычислено С 44,69% Н 4,00% N 10,42%; найдено С 44,46% Н 3,88% N 10,16%.
Получение комплекса (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-циклогексил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2·2Н2О
Из 0,05 г (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-циклогексил-3,5-дигидро-4Н-имидазол-4-она) и 0,03 г CuCl2·2Н2О получают 0,04 г (58%) комплекса коричневого цвета.
Элементный анализ: C32H36N6O2S2*CuCl2*CuCl вычислено С 46,07% Н 4,35% N 10,07%; найдено С 45,89% Н 4,27% N 9,93%.
Получение комплекса (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-(бут-2-инил)-3,5-дигидро-4Н-имидазол-4-она) с CuCl2·2Н2О
Из 0,05 г (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-(бут-2-инил)-3,5-дигидро-4Н-имидазол-4-она) и 0,03 г CuCl2·2Н2О получают 0,04 г (56%) комплекса коричневого цвета.
Элементный анализ: C28H24N6O2S2*CuCl2*CuCl вычислено С 43,44% Н 3,12% N 10,86%; найдено С 43,23% Н 3,01% N 10,62%.
Получение комплекса (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-метиламино-3,5-дигидро-4Н-имидазол-4-она) с CuCl2·2Н2О
Из 0,05 г (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-метиламино-3,5-дигидро-4Н-имидазол-4-она) и 0,03 г CuCl2·2Н2О получают 0,04 г (54%) комплекса коричневого цвета.
Элементный анализ: C22H22N8O2S2*CuCl2*CuCl вычислено С 36,29% Н 3,05% N 15,39%; найдено С 36,12% Н 2,96% N 15,20%.
Получение комплекса (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-карбэтокси-3,5-дигидро-4Н-имидазол-4-она) с CuCl2·2Н2О
Из 0,05 г (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-карбэтокси-3,5-дигидро-4Н-имидазол-4-она) и 0,03 г CuCl2·2Н2О получают 0,04 г (57%) комплекса коричневого цвета.
Элементный анализ: C26H24N6O6S2*CuCl2*CuCl вычислено С 38,36% Н 2,97% N 10,32%; найдено С 38,23% Н 2,92% N 10,19%.
Получение комплекса (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-(2-оксопирролидин-3-ил)-3,5-дигидро-4Н-имидазол-4-она) с CuCl2·2Н2О
Из 0,05 г (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-(2-оксопирролидин-3-ил)-3,5-дигидро-4Н-имидазол-4-она) и 0,03 г CuCl2·2Н2О получают 0,04 г (58%) комплекса коричневого цвета.
Элементный анализ: C28H26N8O4S2*CuCl2*CuCl вычислено С 40,22% Н 3,13% N 13,40%; найдено С 40,04% Н 3,02% N 13,23%.
Получение комплекса (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметипен)-3-(1-метил-1Н-имидазол-2-ил)-3,5-дигидро-4Н-имидазол-4-она) с CuCl2·2Н2О
Из 0,05 г (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-(1-метил-1Н-имидазол-2-ил)-3,5-дигидро-4Н-имидазол-4-она) и 0,03 г CuCl2·2Н2О получают 0,03 г (43%) комплекса коричневого цвета.
Элементный анализ: C28H24N10O2S2*CuCl2*CuCl вычислено С 40,51% Н 2,91% N 16,87%; найдено С 40,29% Н 2,81% N 16,68%.
Получение комплекса (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-(2-пиридил)-3,5-дигидро-4Н-имидазол-4-она) с CuCl2·2Н2О
Из 0,05 г (5Z,5'Z)-2,2'-(этан-1,2-диилдисульфанилдиил)бис(5-(2-пиридилметилен)-3-(2-пиридил)-3,5-дигидро-4Н-имидазол-4-она) и 0,03 г CuCl2·2Н2О получают 0,04 г (57%) комплекса коричневого цвета.
Элементный анализ: C30H22N8O2S2*CuCl2*CuCl вычислено С 43,72% Н 2,69% N 13,60%; найдено С 43,56% Н 2,62% N 13,46%.
Получение комплекса (5Z,5'Z)-2,2'-дисулъфанилбис(5-(2-пиридилметилен)-3-метил-3,5-дигидро-4Н-имидазол-4-она) с CuCl2·2Н2О
Из 0,05 г (5Z,5'Z)-2,2'-дисульфанилбис(5-(2-пиридилметилен)-3-метил-3,5-дигидро-4Н-имидазол-4-она) и 0,03 г CuCl2·2Н2О получают 0,04 г (52%) комплекса коричневого цвета.
Элементный анализ: C20H16N6O2S2*CuCl2*CuCl вычислено С 35,85% Н 2,4