Сопряженный с g-белком рецептор, имеющий измененное сродство к лигандам, и его применение
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к исследованию рецептору, сопряженному с G-белком, и может быть использовано в медицине. Получен белковый комплекс, обладающий сродством GPCRα1L к лиганду, включающий GPCRα1L и полипептид с последовательностью аминокислот SEQ ID NO:1. Связывание указанного рецептора, сопряженного с G-белком, с полипептидом изменяет сродство к лиганду рецептора. Также предложены методы скрининга агонистов или антагонистов рецептора, сопряженного с G-белком, с использованием трансформанта, в котором экспрессируется указанный измененный рецептор, сопряженный с G-белком. Заявленное изобретение обеспечивает проведение анализа функции многих предполагаемых рецепторов, сопряженных с G-белком, структура которых еще не известна. 8 н. и 4 з.п. ф-лы, 3 ил., 2 табл., 4 пр.
Реферат
Область техники
Настоящее изобретение относится к рецепторам, сопряженным с G-белком (GPCRs), которые характеризуются измененным сродством к лигандам, и применению указанных рецепторов. В частности, настоящее изобретение относится к GPCRs, сродство к лигандам которых изменено в результате образования комплекса с определенным белком, и их применению.
Уровень техники
Многие реакции в живых организмах вызваны проникновением в клетку внеклеточной информации и распространению информации по клетке. Мембранные рецепторы служат медиаторами, через которые внеклеточная информация передается в клетки. Хорошо известно, что GPCRs, имеющие 7 трансмембранных доменов, являются одним из основных типов связанных с мембраной рецепторов.
Когда лиганд (например, аминокислота, пептид или амид) связывается с GPCR, GPCR передает информацию в клетку через тримерный G-белок. G-белки, сопряженные с GPCRs, подразделяют на Gs, Gi, Gq и другие, которые активируют/инактивируют различные эффекторные пути (например, сигнальный путь цАМФ, сигнальный путь цГМФ и сигнальный путь фосфолипазы С), соответственно. Например, α1-адренэргический рецептор главным образом сопряжен с Gq-белком для активации системы фосфолипазы С, что приводит к образованию диацилглицерола и инозитолтрифосфата, таким образом повышая внутриклеточную концентрацию Са2+. α2-адренергический рецептор главным образом сопряжен с Gi-белком для подавления аденилатциклазной системы, что, таким образом, снижает уровень цАМФ. Кроме того, β-адренергический рецептор главным образом сопряжен с Gs-белком для активации аденилатциклазной системы, что, таким образом, приводит к повышению уровня цАМФ.
GPCRs повсеместно встречаются и функционируют в нашем организме. Например, α1-адренэргические рецепторы представлены в периферических кровеносных сосудах, предстательной железе и обеспечивают сокращения. Также известно, что α1-адренэргические рецепторы функционируют в центральной нервной системе, β-адренергические рецепторы в сердце и жировой ткани играют важную роль для регуляции частоты сердечных сокращений и расщепления жиров.
Известно, что GPCRs и зависимые от них системы передачи сигналов не только контролируют физиологический гомеостаз в нашем теле, но и определяют патофизиологическое состояние при различных заболеваниях. Поэтому для того, чтобы лечить такие заболевания, очень важно определить конкретные GPCRs, связанные с определенными заболеваниями, и затем разработать специфичные в отношении GPCRs лекарственные средства (например, агонисты или антагонисты).
Не патентная литература 1
Muramatsu, I. et al. Br. J. Pharmacol., 99: 197 (1990)
He патентная литература 2
Muramatsu, I. et al. Pharmacol. Commun., 6: 23 (1995)
He патентная литература 3
Morishima, S. et al. J. Urol. 177: 377-381 (2007)
He патентная литература 4
Molenaar, P. and Parsonage, W.A.Trends Pharmacol. Sci., 26: 368-375 (2005)
Не патентная литература 5
Samaha, A.N. et al., J. Neurosci. 27: 2979-2986 (2007)
Краткое описание изобретения
В изучении GPCR произошел значительный прогресс, в результате чего было обнаружено большое количество GPCR. Однако все еще существуют несколько предполагаемых GPCRs, для которых определены фенотипы, но структура которых пока неизвестна. Например, α1-адренергические рецепторы разделяют на три подтипа (α1A, α1B и α1D) на основе кодирующих их различных генов. Однако было выдвинуто предположение о существовании в дополнение к классическим α1-адренергическим рецепторам, дополнительного подтипа (α1L) рецепторов, отличающихся по фармакологическому профилю (фенотипу) от классических подтипов. Рецепторы подтипа α1L обладают существенно сниженным сродством к типичному блокатору α1- рецепторов (празозину) по сравнению с α1A-, α1B- и α1D-подтипами. α1L-подтип обнаруживается только в интактных полосках или сегментах нативных тканей, но не обнаруживается в гомогенатах тканей (см. Не патентная литература 1-3). Дополнительно, известно, что подтипы β1 адреналинового рецептора (β1H и β1L), отличающиеся по фенотипу, кодированы одними и теми же генами (см. Не патентная литература 4). Для этого подтипа известен только фенотип, но не его сущность. Подобное можно также отметить для допаминовых рецепторов, мускариновых рецепторов или эндотелиновых рецепторов (см. Не патентная литература 5 и т.п.). Однако механизмы формирование разных фенотипов продуктами одного и того же гена до сих пор не известны.
Настоящее изобретение было создано с учетом этой проблемы, и целью настоящего изобретения является обеспечить способ анализа функции рецептора, сопряженного с G-белком, структура которого не известна.
Белковый комплекс согласно настоящему изобретению характеризуется связыванием GPCR с: (1) полипептидом, который имеет последовательность аминокислот SEQ ID NO:1; (2) полипептидом (i), который имеет последовательность аминокислот SEQ ID NO:1 с делецией, вставкой, заменой или добавлением одной или нескольких аминокислот, и (ii) способен изменять сродство к лиганду GPCR, с которым указанный полипептид образовал комплекс; (3) полипептидом, кодируемым полинуклеотидом, который имеет последовательность нуклеотидов SEQ ID NO:2; (4) полипептидом (i), кодируемым полинуклеотидом, который имеет последовательность нуклеотидов SEQ ID NO:2 с делецией, вставкой, заменой или добавлением одной или нескольких нуклеотидов, и (ii) способен изменять сродство к лиганду GPCR, с которым указанный полипептид образовал комплекс; (5) полипептидом (i), кодируемым полинуклеотидом, которой способен гибридизоваться в жестких условиях гибридизации с полинуклеотидом, который имеет последовательность, комплементарную последовательности нуклеотидов SEQ ID NO:2, и (ii) способен изменять сродство к лиганду GPCR, с которым указанный полипептид образовал комплекс; или (6) полипептидом (i), кодируемым полинуклеотидом, последовательность которого на 70% и более идентична последовательности полинуклеотида, который имеет последовательность нуклеотидов SEQ ID NO:2, и (ii) способен изменять сродство к лиганду GPCR, с которым указанный полипептид образовал комплекс.
Способ получения белкового комплекса согласно настоящему изобретению характеризуется наличием стадии осуществления совместного присутствия GPCR и белка на липидной мембране, при этом указанный полипептид представляет собой: (1) полипептид, который имеет последовательность аминокислот SEQ ID NO:1; (2) полипептид (i), который имеет последовательность аминокислот SEQ ID NO:1 с делецией, вставкой, заменой или добавлением одной или нескольких аминокислот, и (ii) способен изменять сродство к лиганду GPCR, с которым указанный полипептид образовал комплекс; (3) полипептид, кодируемый полинуклеотидом, который имеет последовательность нуклеотидов SEQ ID NO:2; (4) полипептид (i), кодируемый полинуклеотидом, который имеет последовательность нуклеотидов SEQ ID NO:2 с делецией, вставкой, заменой или добавлением одной или нескольких аминокислот, и (ii) способен изменять сродство к лиганду GPCR, с которым указанный полипептид образовал комплекс; (5) полипептид (i), кодируемый полинуклеотидом, который способен гибридизоваться при жестких условиях гибридизации с полинуклеотидом, который имеет последовательность нуклеотидов, комплементарную последовательности нуклеотидов SEQ ID NO:2, и (ii) способен изменять сродство к лиганду GPCR, с которым указанный полипептид образовал комплекс; или (6) полипептид (i), кодируемый полинуклеотидом, последовательность которого на 70% и более идентична последовательности полинуклеотида, который имеет последовательность нуклеотидов SEQ ID NO:2, и (ii) способен изменять сродство к лиганду GPCR, с которым указанный полипептид образовал комплекс.
Благодаря указанным признакам, настоящее изобретение может изменять сродство GPCR к лиганду. Другими словами, способ получения белкового комплекса согласно настоящему изобретению также может представлять собой способ изменения сродства GPCR к его лигандам.
Липидная мембрана согласно настоящему изобретению характеризуется содержанием белкового комплекса. Способ получения липидной мембраны согласно настоящему изобретению характеризуется стадией осуществления совместного присутствия GPCR и белка на липидной мембране, при этом указанный полипептид представляет собой: (1) полипептид, который имеет последовательность аминокислот SEQ ID NO:1; (2) полипептид (i), который имеет последовательность аминокислот SEQ ID NO:1 с делецией, вставкой, заменой или добавлением одной или нескольких аминокислот, и (ii) способен изменять сродство к лиганду рецептора, сопряженного с G-белком, с которым указанный полипептид образовал комплекс; (3) полипептид, кодируемый полинуклеотидом, который имеет последовательность нуклеотидов SEQ ID NO:2; (4) полипептид (i), кодируемый полинуклеотидом, который имеет последовательность нуклеотидов SEQ ID NO:2 с делецией, вставкой, заменой или добавлением одного или нескольких нуклеотидов, и (ii) способен изменять сродство к лиганду GPCR, с которым указанный полипептид образовал комплекс; (5) полипептид (i), кодируемый полинуклеотидом, способным гибридизоваться при жестких условиях гибридизации с полинуклеотидом, который имеет последовательность, комплементарную последовательности нуклеотидов SEQ ID NO:2, и (ii) способен изменять сродство к лиганду GPCR, с которым указанный полипептид образовал комплекс; или (6) полипептид (i), кодируемый полинуклеотидом, последовательность которого на 70% и более идентична последовательности полинуклеотида, который имеет последовательность нуклеотидов SEQ ID NO:2, и (ii) способен изменять сродство к лиганду GPCR, с которым указанный полипептид образовал комплекс.
Дополнительно, трансформант (трансформированная клетка или организм) согласно настоящему изобретению характеризуется тем, что он содержит белковый комплекс. Способ получения трансформанта согласно настоящему изобретению характеризуется стадией экспрессии указанного белкового комплекса и предпочтительно включает стадию введения в клетку гена, кодирующего GPCR, и гена, кодирующего полипептид.
Благодаря указанным признакам, настоящее изобретение облегчает анализ функции GPCR с измененным сродством к лиганду.
Способ скрининга агонистов или антагонистов GPCR с измененным сродством к лиганду согласно настоящему изобретению характеризуется присутствием стадий: [1] получения белкового комплекса посредством обеспечения совместного присутствия GPCR и полипептида на липидной мембране; и [11] инкубирования указанного белкового комплекса совместно с исследуемым веществом (потенциальным агонистом или антагонистом), при этом указанный полипептид представляет собой: (1) полипептид, который имеет последовательность аминокислот SEQ ID NO:1; (2) полипептид (i), который имеет последовательность аминокислот SEQ ID NO:1 с делецией, вставкой, заменой или добавлением одной или нескольких аминокислот, и (ii) способен изменять сродство к лиганду рецептора, сопряженного с G-белком, с которым указанный полипептид образовал комплекс; (3) полипептид, кодируемый полинуклеотидом, который имеет последовательность нуклеотидов SEQ ID NO:2; (4) полипептид (i), кодируемый полинуклеотидом, который имеет последовательность нуклеотидов SEQ ID NO:2 с делецией, вставкой, заменой или добавлением одного или нескольких нуклеотидов, и (ii) способен изменять сродство к лиганду GPCR, с которым указанный полипептид образовал комплекс; (5) полипептид (i), кодируемый полинуклеотидом, способным гибридизоваться при жестких условиях гибридизации с полинуклеотидом, который имеет последовательность, комплементарную последовательности нуклеотидов SEQ ID NO:2, и (ii) способен изменять сродство к лиганду GPCR, с которым указанный полипептид образовал комплекс; или (6) полипептид (i), кодируемый полинуклеотидом, последовательность которого на 70% и более идентична последовательности полинуклеотида, который имеет последовательность нуклеотидов SEQ ID NO:2, и (ii) способен изменять сродство к лиганду GPCR, с которым указанный полипептид образовал комплекс.
Способ получения трансформанта, экспрессирующего GPCR с измененным сродством к лиганду, согласно настоящему изобретению характеризуется присутствием стадии ингибирования экспрессии полипептида в клетке, в которой имеет место экспрессия GPCR, при этом указанный полипептид представляет собой: (1) полипептид, который имеет последовательность аминокислот SEQ ID NO:1; (2) полипептид (i), который имеет последовательность аминокислот SEQ ID NO:1 с делецией, вставкой, заменой или добавлением одной или нескольких аминокислот, и (ii) способен изменять сродство к лиганду рецептора, сопряженного с G-белком, с которым указанный полипептид образовал комплекс; (3) полипептид, кодируемый полинуклеотидом, который имеет последовательность нуклеотидов SEQ ID NO:2; (4) полипептид (i), кодируемый полинуклеотидом, который имеет последовательность нуклеотидов SEQ ID NO:2 с делецией, вставкой, заменой или добавлением одного или нескольких нуклеотидов, и (ii) способен изменять сродство к лиганду GPCR, с которым указанный полипептид образовал комплекс; (5) полипептид (i), кодируемый полинуклеотидом, способным при жестких условиях гибридизации гибридизоваться с полинуклеотидом, который имеет последовательность, комплементарную последовательности нуклеотидов SEQ ID NO:2, и (ii) способен изменять сродство к лиганду GPCR, с которым указанный полипептид образовал комплекс; или (6) полипептид (i), кодируемый полинуклеотидом, последовательность которого на 70% и более идентична последовательности полинуклеотида, который имеет последовательность нуклеотидов SEQ ID NO:2, и (ii) способен изменять сродство к лиганду GPCR, с которым указанный полипептид образовал комплекс.
Благодаря указанным признакам, настоящее изобретение облегчает анализ функции GPCR с измененным сродством к лиганду и обеспечивает возможность изменения сродства GPCR к лиганду. Таким образом, настоящее изобретение также может рассматриваться как способ изменения сродства GPCR к его лигандам.
Способ получения согласно настоящему изобретению предпочтительно является таким, что полипептид представляет собой эндогенный белок, и стадию подавления экспрессии полипептида осуществляют способом РНК интерференции. Также, указанная клетка может представлять собой трансформант, экспрессирующий экзогенный белок GPCR.
Способ скрининга агонистов или антагонистов GPCR с измененным сродством к лиганду согласно настоящему изобретению характеризуется присутствием стадий: [1] подавления экспрессии полипептида в клетке, в которой экспрессируется GPCR; и [11] инкубирования клетки совместно с исследуемым веществом (потенциальным агонистом или антагонистом), при этом полипептид представляет собой (1) полипептид, который имеет последовательность аминокислот SEQ ID NO:1; (2) полипептид (i), который имеет последовательность аминокислот SEQ ID NO:1 с делецией, вставкой, заменой или добавлением одной или нескольких аминокислот, и (ii) способен изменять сродство к лиганду рецептора, сопряженного с G-белком, с которым указанный полипептид образовал комплекс; (3) полипептид, кодируемый полинуклеотидом, который имеет последовательность нуклеотидов SEQ ID NO:2; (4) полипептид (i), кодируемый полинуклеотидом, который имеет последовательность нуклеотидов SEQ ID NO:2 с делецией, вставкой, заменой или добавлением одного или нескольких нуклеотидов, и (ii) способен изменять сродство к лиганду GPCR, с которым полипептид образовал комплекс; (5) полипептид (i), кодируемый полинуклеотидом, способным гибридизоваться при жестких условиях гибридизации с полинуклеотидом, который имеет последовательность, комплементарную последовательности нуклеотидов SEQ ID NO:2, и (ii) способен изменять сродство к лиганду GPCR, с которым указанный полипептид образовал комплекс; или (6) полипептид (i), кодируемый полинуклеотидом, последовательность которого на 70% и более идентична последовательности полинуклеотида, который имеет последовательность нуклеотидов SEQ ID NO:2, и (ii) способен изменять сродство к лиганду GPCR, с которым указанный полипептид образовал комплекс.
Предпочтительно, способ скрининга согласно настоящему изобретению дополнительно включает стадию измерения внутриклеточной концентрации Са2+ или стадию измерения метаболизма внутриклеточного инозитолфосфата.
Согласно настоящему изобретению GPCR, который входит в состав белкового комплекса, предпочтительно представляет собой адренергический рецептор, допаминовый рецептор, мускариновый рецептор или рецептор эндотелина, а указанный адренергический рецептор может представлять собой α-рецептор или β-рецептор. Дополнительно, указанный допаминовый рецептор предпочтительно являлся D2 рецептором. Предпочтительно, α-рецептор представляет собой α1-рецептор, и более предпочтительно, α1-рецептор представляет собой α1A-подтип указанного рецептора. В предпочтительном варианте реализации настоящего изобретения, белковый комплекс согласно настоящему изобретению представляет собой адренергический рецептор α1L-подтипа или β1L-подтипа.
Для более полного понимания сущности и преимуществ настоящего изобретения следует ссылаться на следующее ниже подробное описание изобретения совместно с прилагаемыми рисунками.
Краткое описание фигур
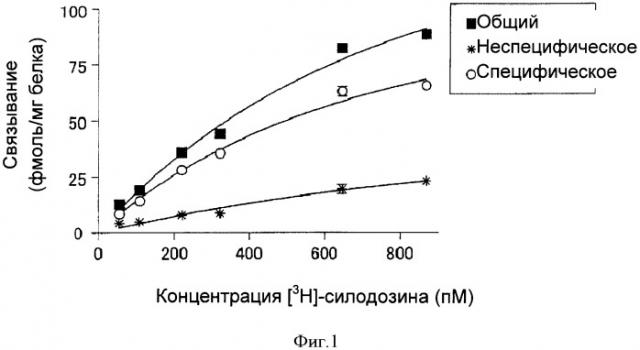
Фигура 1
На фигуре 1 показаны кривые насыщения связывания [3Н]-силодозина в клетках α1L (эксперимент по связыванию целыми клетками).
Фигура 2
На фигуре 2(а) приведены кривые конкурентного связывания празозина в клетках α1L и α1A (эксперимент по связыванию целыми клетками). На фигуре 2(b) показаны кривые конкурентного связывания празозина в гомогенатах клеток α1L и α1A. Пунктирная линия с закрашенными квадратами: кривая конкурентного связывания празозина в целых клетках α1L была описана для сравнения с кривыми в гомогенатах.
Описания вариантов реализации изобретения
1. Белковый комплекс.
Настоящее изобретение обеспечивает белковый комплекс GPCR и определенного полипептида. В описании настоящего изобретения термин «комплекс» означает находящуюся в виде единого целого комбинацию множества веществ и «образование комплекса» и «объединение» взаимозаменяемы. Следует отметить, что необходимо только, чтобы множество веществ, образующих комплекс, взаимодействовали друг с другом в непосредственной близости, при этом указанные вещества могут связываться или не связываться друг с другом. В предпочтительном варианте реализации настоящего изобретения белковый комплекс согласно настоящему изобретению представляет собой GPCR и определенный полипептид, которые взаимодействуют друг с другом в непосредственной близости, и в итоге указанный белковый комплекс функционирует как GPCR с измененным сродством к лиганду.
Данное описание описывает настоящее изобретение на примере адренэргического рецептора (в частности α1A-подтипа) в качестве GPCR, сродство к лиганду которого изменено посредством взаимодействия с определенным полипептидом. Однако специалисту в данной области, который прочел настоящее описание, будет ясно, что GPCR, согласно настоящему изобретению, не ограничивается адренергическим рецептором. Кроме того, специалист в данной области сможет с легкостью получить информацию о последовательности GPCR, согласно настоящему изобретению.
Хорошо известно, что адренергические рецепторы опосредуют работу автономной нервной системы (симпатической нервной системы). Связывание адреналина, норадреналина и т.п. с адренергическим рецептором вызывает различные физиологические ответы, например сокращение гладкой мускулатуры сосудов, повышение кровяного давления и частоты сердечных сокращений, расширение зрачка и повышение уровня глюкозы в крови.
Прогресс в исследовании и развитие новых вариантов лекарственных средств позволили четко понять, что существуют различные типы адренергических рецепторов. Ранее, адренергические рецепторы подразделяли на α-рецепторы и β-рецепторы согласно их различиям в реакционной способности к изопротеренолу и фентоламину, и дополнительно классифицировали по фармакологическим подгруппам (α1-рецептор, α2-рецептор и β-рецептор). Известно, что эти рецепторы по-разному распределены в тканях и выполняют различные функции. Например, известно, что α1-адренэргические рецепторы выполняют функцию важных медиаторов, которые вызывают сокращения гладкой мускулатуры сосудов, предстательной железы и т.п., и также известно, что они участвуют в управлении сознанием и эмоциями в центральной нервной системе.
В настоящий момент, когда закончено картирование генома человека, можно определить структуру и функции многих белков на генетическом уровне. В случае α1-адренэргических рецепторов выделили три подтипа (α1A, α1B и α1D), на основании различных генов, которые их кодируют. Известно, что эти классические подтипы хорошо совпадают с фармакологическими подтипами. В этом отношении можно считать, что один подтип рецепторов в основном происходит от одного отдельного гена.
Однако давно показано, что в некоторых тканях нашего организма встречается и функционирует уникальный α1-адренэргический рецептор. Из-за его низкого сродства к типичному блокатору α1 (празозину), этот уникальный подтип был назван «α1L-подтипом», несмотря на то, что соответствующий ген пока не был клонирован.
В таблице 1 приведена классификация и избирательность к лекарственным средствам α1-адренэргических рецепторов.
| [Таблица 1] | |||||
| Классификация и селективность лекарственных средств в отношении α1-адренэргических рецепторов | |||||
| подтип | сродство (pKb) | ||||
| Силодозин1,3,4,5 | Тамсулозин1,3,4 | Празозин1,2,3,4,5 | RS-170532,4 | BMY 73784,5 | |
| α1А | 10.7-9.5 | 10.4-9.9 | 10.6-9.3 | 9.1-8.4 | 6.9-5.6 |
| α1L | 10.7-9.5 | 10.4-9.9 | 8.3-7.6 | 6.3 | 6.9-5.6 |
| α1В | 8.1 | 9.3 | 10.6-10.1 | 7.8 | 7.4 |
| α1D | 8.6 | 9.9 | 10.1-9.9 | 7.8 | 9.1 |
Данные для соединений, приведенных в таблице 1, основаны на приведенных ниже публикациях:
1. Muramatsu, I. et al. Pharmacol. Commun., 6: 23 (1995)
2. Ford, АР. et al. Mol. Pharmacol., 49: 209 (1996)
3. Murata, S. et al. J. Urol., 164: 578 (2000)
4. Hiraizumi-Hiraoka, Y. et al. J. Pharmacol. Exp. Ther., 310: 995 (2004)
5. Murata, S. et al. Br. J. Pharmacol., 127: 19 (1999)
В биологических исследованиях было показано, что α1L-подтип является функциональным рецептором в нижних отделах мочеполовой системы человека и других млекопитающих. Также обнаружили α1L-подтип в интактных сегментах нативных тканей (например, предстательная железа человека). Однако α1L-подтип не обнаруживали с помощью традиционных экспериментов связывания, проводившихся на гомогенизированных тканях. Тот факт, что α1L-подтип не определяли в гомогенизированной ткани, означает, что очень трудно выделить α1L-подтип из ткани. Если неизвестна природа α1L-подтипа, то будет очень трудно исследовать функцию α1L-адренэргического рецептора, в частности, для разработки α1L-селективных лекарственных средств (например, агонистов или антагонистов).
Авторы настоящего изобретения предположили, что α1L-подтип, сущность которого неизвестна, образуется при связывании некой вспомогательной молекулы с уже известным подтипом (возможно, α1A-подтипом). То есть, авторы предположили, что взаимодействие между молекулой рецептора определенного подтипа и ее вспомогательной молекулой, которые совместно составляют α1L-подтип, разрушается при гомогенизации ткани, и в результате α1L-подтип меняет свои свойства на свойства α1A-подтипа. В результате, было обнаружено, что при гомогенизации ткани фармакологический профиль α1L-подтипа превратился в профиль α1A-подтипа. Более того, в результате кропотливых исследований авторы настоящего изобретения подтвердили, что определенный белок связывается с α1A-подтипом, и совместная экспрессия указанного белка с α1A-подтипом в культуре клеток приводит к экспрессии фенотипа α1L-подтипа. То есть, было обнаружено, что α1L-подтип состоит из белкового комплекса, был определен белок, входящий в состав данного комплекса, и таким образом осуществлено настоящее изобретение.
В одном варианте реализации настоящее изобретение обеспечивает комплекс, который образует α1L-подтип адренэргического рецептора. То есть, белковый комплекс согласно данному варианту реализации настоящего изобретения представляет собой α1L-подтип адренэргического рецептора. Данный вариант реализации изобретения позволяет обеспечить лечение любого заболевания, связанного с α1L-подтипом, сущность которого была определена.
Полипептид, составляющий белковый комплекс согласно настоящему изобретению, известен как CRELD (обогащенный цистеином с EGF-подобными доменами) 1а белок, миссенс мутация которого считается связанной с дефектом атриовентрикулярной перегородки (Gene 293: 47-57 (2002), Am. J. Hum. Genet. 72: 1047-1052 (2003)). Информация о последовательности полипептида может быть получена по номеру доступа NCBI: NM_015513 и в настоящем описании, представлена через SEQ ID NO:1 (последовательность аминокислот) и SEQ ID NO:2 (последовательность нуклеотидов). То есть, полипептид, составляющий белковый комплекс согласно одному из вариантов реализации настоящего изобретения, может представлять собой полипептид, который имеет последовательность аминокислот SEQ ID NO:1, или может являться полипептидом, кодируемым полинуклеотидом, который имеет последовательность нуклеотидов SEQ ID NO:2.
Полипептид, который входит в состав белкового комплекса согласно данному варианту реализации настоящего изобретения не ограничивается полипептидом, который имеет последовательность аминокислот SEQ ID NO:1, и может представлять собой мутантный полипептид, сохраняющий активность исходного полипептида. Примером такого мутантного полипептида является полипептид, который: (i) имеет последовательность аминокислот SEQ ID NO:1 с делецией, вставкой, добавлением одной или нескольких аминокислот, и (ii) обладает способностью образовывать комплекс с GPCR и изменять сродство указанного GPCR к лиганду.
С помощью общих методических принципов, известных в данной области, специалист может легко получить мутантный полипептид, из аминокислотной последовательности конкретного полипептида посредстовм делеции, вставки, замены или добавления одной или нескольких аминокислот. Кроме того, на основе информации, содержащейся в настоящем описании изобретения и общих методических принципов, специалист в данной области может легко определить, сохраняет ли мутантный полипептид ту же активность, что и первоначальный полипептид.
Кроме того, полинуклеотид, кодирующий полипептид, входящий в состав белкового комплекса согласно настоящему изобретению, не ограничивается полинуклеотидом, который имеет последовательность нуклеотидов SEQ ID NO:2, и также может представлять собой мутантный полинуклеотид, кодирующий полипептид, сохраняющий способность изменять сродство к лиганду GPCR, с которым указанный полипептид образовал комплекс. Примером такого мутантного полинуклеотида является, но не ограничен им: (1) полинуклеотид, который имеет последовательность нуклеотидов SEQ ID NO:2 с делецией, вставкой, заменой или добавлением одного или нескольких нуклеотидов, (2) полинуклеотид, который способен гибридизоваться в жестких условиях гибридизации с полинуклеотидом, который имеет последовательность, комплементарную последовательности нуклеотидов SEQ ID NO:2, или (3) полинуклеотид, последовательность которого на 70% или более, предпочтительно 80% или более, или более предпочтительно 85% или более, гомологична полинуклеотиду, который имеет последовательность нуклеотидов SEQ ID NO:2.
С помощью общих методических подходов, известных в данной области, специалист может легко получить: мутантный полипептид из аминокислотной последовательности конкретного полинуклеотида посредством делеции, вставки, замены или добавления одной или нескольких аминокислот; мутантный полинуклеотид, способный при жестких условиях гибридизации гибридизоваться с определенным полинуклеотидом; или мутантный полинуклеотид, последовательность которого на 70% или более идентична последовательности определенного полинуклеотида. Далее, на основе описания настоящего изобретения и общих методических принципов специалист в данной области может легко определить, сохраняет ли полипептид, кодируемый указанным мутантным полинуклеотидом, ту же активность, что и полипептид, кодируемый исходным полинуклеотидом.
Применительно к настоящему описанию, термин «жесткие условия гибридизации» означает инкубацию в течение ночи при 42°С в растворе для гибридизиации (содержащем 50% формамид, 5 х SSC [150 мМ NaCl, 15 мМ тринатриевого цитрата], 50 мМ фосфат натрия (рН=7.6), 5 х раствор Денгардса, 10% декстран сульфат и 20 мкг/мл денатурированной спермы лосося), с последующей промывкой фильтра при 65°С в 0.1 х SSC.
Необходимо только провести процедуру специфичной гибридизации по способу, хорошо известному в данной области (например, по способу, описанному в "Molecular Cloning: A Laboratory Manual, 3rd ed., J. Sambrook and D.W.Russell ed., Cold Spring Harbor Laboratory, NY (2001)", который включен посредством ссылки на настоящее описание).
Настоящее изобретение описано выше с использованием адренэргических рецепторов в качестве примера GPCR, составляющих белковый комплекс согласно настоящему изобретению. Однако достаточно, чтобы белковый комплекс согласно настоящему изобретению представлял собой комплекс GPCR и (1) полипептида, который имеет последовательность аминокислот SEQ ID NO:1; (2) полипептида (i), который имеет последовательность аминокислот SEQ ID NO:1 с делецией, вставкой, заменой или добавлением одной или нескольких аминокислот, и (ii) способен изменять сродство к лиганду GPCR, с которым указанный полипептид образовал комплекс; (3) полипептида, кодируемого полинуклеотидом, который имеет последовательность нуклеотидов SEQ ID NO:2; (4) полипептида (i), кодируемого полинуклеотидом, который имеет последовательность нуклеотидов SEQ ID NO:2 с делецией, вставкой, заменой или добавлением одной или нескольких нуклеотидов, и (ii) способен изменять сродство к лиганду GPCR, с которым указанный полипептид образовал комплекс; (5) полипептида (i), кодируемого полинуклеотидом, который способен в жестких условиях гибридизации гибридизоваться с полинуклеотидом, который имеет последовательность, комплементарную последовательности нуклеотидов SEQ ID NO:2 и (ii) способен изменять сродство к лиганду GPCR, с которым указанный полипептид образовал комплекс; или (6) полипептида (i), кодируемого полинуклеотидом, последовательность которого на 70% или более идентична последовательности полинуклеотида, который имеет последовательность нуклеотидов SEQ ID NO:2, и (ii) способен изменять сродство к лиганду GPCR, с которым указанный полипептид образовал комплекс. То есть, GPCR, входящий в состав указанного белкового комплекса, не ограничен адренергическим рецептором, но также может представлять собой допаминовый рецептор, мускариновый рецептор или эндотелиновый рецептор. Кроме того, специалист в данной области может легко получить, из общедоступных баз данных, информацию о последовательности GPCR, к которому относится настоящее изобретение, и поэтому может легко получить желаемый белковый комплекс, на основе информации из описания настоящего изобретения и известных общих методических принципов.
2. Липидная мембрана, содержащая белковый комплекс.
Настоящее изобретение также обеспечивает способ получения белкового комплекса GPCR и определенного полипептида. Способ получения белкового комплекса GPCR и определенного полипептида согласно настоящему изобретению характеризуется стадией осуществления совместного присутствия GPCR и определенного белка на липидной мембране. Таким образом, настоящее изобретение обеспечивает липидную мембрану, содержащую белковый комплекс, и способ ее получения.
Липидная мембрана согласно настоящему изобретению характеризуется содержанием белкового комплекса, описанного выше. Липидная мембрана согласно настоящему изобретению может представлять собой природную липидную мембрану или искусственной липидной мембраной. В тех случаях, когда мембрана представляет собой природную липидную мембрану, подразумевается, что мембрана является биологической мембраной. В тех случаях, когда мембрана представляет собой искусственную липидную мембрану, подразумевается, что мембрана представляет собой плоскую липидную мембрану или липосому.
В одном аспекте настоящего изобретения, липидная мембрана может представлять собой биологическую мембрану трансформанта, в который включен полинуклеотид, кодирующий полипептид, входящий в состав белкового комплекса согласно настоящему изобретению. Такой трансформант можно получить посредством введения в живой организм вектора экспрессии, содержащего полинуклеотид, таким образом, что полипептид экспрессируется в виде биологической мембраны. Следует отметить, что живой организм, который используют в качестве трансформанта, может представлять собой прокариотный или эукариотный организм.
В другом аспекте настоящего изобретения, липидная мембрана может представлять собой липидный бислой, содержащий полипептид, который входит в состав белкового комплекса согласно настоящему изобретению. Липидный бислой представляет собой мембранную структуру, состоящую из двух слоев полярных липидов (в частности, фосфолипидов). Структура липидного бислоя стабилизирована в виде двумерной структуры, если она принимает вид сферы, но она может являться плоской структурой, если ее концы изолированы от молекул воды. При использовании в настоящем описании термином «липосома» обозначается сферический липидный бислой, созданный искусственно, и термин «липидная плоская мембрана» означает плоский липидный бислой, созданный искусственно. В данной области искусственный липидный бислой используют при измерениях активности мембранных белков in vitro (например, белков каналов). Т.о., специалист в данной области может легко получить липидную плоскую мембрану и сделать так, чтобы указанная плоская липидная мембрана удерживала интересующий белок (полипептид). Дополнительно, липосома представляет собой искусственную липидную мембрану, которую также обозначают термином «везикула», и ее можно получить посредством взбивания суспензии липидов (например, фосфолипидов) и последующей обработки их ультразвуком. В этой области, широко известны работы с липосомами в качестве моделей клеточных мембран и способов доставки лекарств (DDS). Таким образом, специалист в данной области может легко получить липосому и заставить липосому удерживать интересующий белок (полипептид).
В одном варианте реализации, настоящее изобретение обеспечивает липидную мембрану, содержащую α1L-подтип адренэргического рецептора. Как описано выше, α1L-подтип адренэргического рецептора представляет собой белковый комплекс молекулы α1A-подтипа и белка CRELD1α. Как α1A-подтип адренэргического рецептора, так и CRELD1α оба являются мембранно связанными белками и, как описано выше, их взаимодействие друг с другом нарушается при гомогенизации (разрушении мембраны). То есть, их взаимодействие друг с другом выражается в размещении и сохранении их обоих на липидной мембране.
В тех случаях, когда липидная мембрана согласно данному варианту реализации настоящего изобретения является биологической мембраной, способ получения липидной мембраны согласно такому варианту реализации может также представлять собой способ получения трансформанта, экспрессирющего α1L-подтип адренэргического рецептора, и который необходимо только дополнить стадией совместной экспрессии белка α1A-адренэргического рецептора и белка CRELD1α. Информация о последовательности α1A-подтипа адренэргического рецептора доступна через номер доступа NCBI - No. U03866 или NM_000680 и, в настоящем описании, представлена как SEQ ID NO:3 (последовательность аминокислот) и SEQ ID NO; 4 (последовательность нуклеотидов). То есть, необходимо только, чтобы способ получения белкового комплекса согласно настоящему варианту реализации включал стадию трансформации хозяина вектором, содержащим полинуклеотид, который имеет последовательность нуклеотидов SEQ ID NO:2, и вектором, с